INTRODUCCIÓN
El Vaquero Brilloso Molothrus bonariensis (Gmelin, 1789) se distribuye en el Caribe y Sudamérica y se está expandiendo por el norte de Florida (EUA) y al sur de Argentina (Post et al. 1993, Fraga c2018). En Ecuador esta especie es común por debajo de los 1500 m y presenta registros dispersos hasta los 2400 m, pero estaría expandiendo su ámbito de distribución siguiendo la alteración antrópica de los hábitats (Freile y Restall 2018), lo que concuerda con varios registros recientes sobre los 2400 m en el país (eBird c2012, Crespo-Pérez et al. 2016).
Uno de los métodos más utilizados para entender la dinámica de la distribución de especies es mediante modelamientos de nicho ecológico, los cuales predicen la idoneidad relativa de hábitat para la especie, empleando datos de ocurrencia conjuntamente con variables ambientales y espaciales (Warrent y Seifert 2011). Específicamente, los modelos de máxima entropía son las herramientas más usadas (West et al. 2016), y han sido ampliamente aplicadas para estudiar especies invasoras (Descombes et al. 2016, Barbet-Massin et al. 2018, Schliep et al. 2018) y los posibles efectos del cambio climático en la distribución de las especies (Kovach et al. 2017).
Molothrus bonariensis es una especie invasora (Post et al. 1993, Fraga c2018), pero además, es un parásito obligado de nidos, no construye nidos y en su lugar deja el cuidado de sus huevos y crías a otras especies (Mason 1986). Además, no tiene mayor discriminación en las especies que parasita, registrándose hasta el momento 270 especies hospederas a lo largo de su distribución (Lowther c2018). Sin embargo esta lista puede estar sesgada por falta de publicación de estos eventos, por ejemplo, en Ecuador únicamente hay registros formales de parasitación de trece especies (Marchant 1960, Oppel et al. 2003, 2004, Greeney et al. 2004, Ingels 2007, Solano-Ugalde et al. 2007, Crespo-Pérez et al. 2016, Greeney 2018), la mayoría de estos reportes son observaciones puntuales, en unas se identificó el huevo de M. bonariensis en el nido de la especie parasitada, sin evidencia posterior de cría del parásito, lo que según Lowther (c2018) define como víctima a la especie parasitada; y en otros casos sí se evidenció crianza, es decir, la especie parasitada fue hospedero (op. cit.). Únicamente dos trabajos dan un seguimiento más detallado de la especie parasitada (Oppel et al. 2003, 2004).
En consecuencia, nuestro objetivo es analizar la dinámica espacial y temporal de la distribución de M. bonariensis, predecir su nicho ecológico bajo escenarios de cambio climático y aportar al conocimiento de las especies que parasita en Ecuador.
MATERIALES Y MÉTODOS
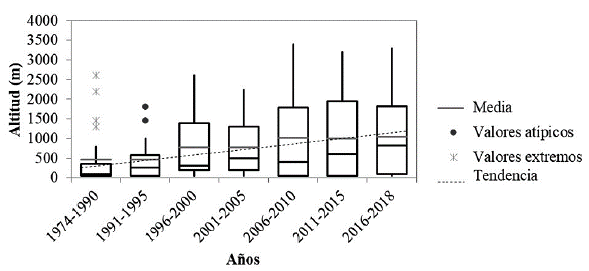
Para los análisis de distribución de M. bonariensis en Ecuador empleamos datos de eBird (c2012), plataforma en línea de ciencia ciudadana, que permite a los observadores de aves incorporar sus registros, mismos que son revisados por experimentados observadores locales (Sullivan et al. 2009). Trabajamos con los registros de eBird que datan desde 1974 hasta 2018, los clasificamos en períodos de cinco años, a excepción del primer grupo, que debido a la reducida cantidad de datos, incluimos registros desde 1974 hasta 1990, y del último grupo en el que incluimos registros desde 2016 hasta 2018. Excluimos datos duplicados, utilizando un tamaño de celda de 1 km2, dejando solo un registro en cada celda, posteriormente con los datos ya filtrados comparamos las variaciones altitudinales entre los periodos, empleando diagramas de caja para visualizar su distribución.
Para los análisis de idoneidad de hábitat, realizamos modelamientos de máxima entropía en MaxEnt 3.4.1 (Phillips et al. 2006), usando 19 variables climáticas con resolución de 1 km2 obtenidas de WorlClim (Hijmans et al. 2005). Filtramos estas variables para trabajar con las más importantes y menos correlacionadas, para lo cual, seleccionamos las de mayor contribución mediante análisis de la prueba de Jackknife de un modelo previo ejecutado en MaxEnt, y eliminamos las variables altamente correlacionadas (>0,8), mediante una matriz de correlación de Pearson, para evitar multicolinearidad de los datos (Merow et al. 2013).
Obtuvimos seis variables climáticas no correlacionadas y de mayor contribución: Precipitación en el trimestre más seco (Bio17), la variable de mayor porcentaje de contribución para el modelo (32,1 %); seguida de Estacionalidad de la precipitación (Bio15) (coeficiente de variación) (23,3 %); Temperatura promedio del trimestre más frío (Bio11) (18,8 %); Estacionalidad de la temperatura (Bio4) (DE *100) (11,2 %); Precipitación en el trimestre más caluroso (Bio18) (9,4 %), y Rango medio diurno (Bio2) (Promedio mensual: temp max - temp min) (5,2 %).
Con las variables filtradas corrimos 100 réplicas con el método de remuestreo de Bootstrap, utilizando el 30 % de los registros para validación y el restante 70 % para la generación de los modelos de idoneidad de hábitat para condiciones actuales de clima y futuras con escenarios de cambio climático. Para el modelamiento futuro con condiciones de cambio climático utilizamos variables proyectadas para el año 2050 (promedio entre 2041 y 2060, Hijmans et al. 2005). El modelo de circulación general (GCM) utilizado fue HadGEM2-ES (Martin et al. 2011), debido a que es considerado estable, realista y se desempeña bien en los trópicos (Martin et al. 2010, Collins et al. 2011, Jones et al. 2011).
Con respecto a escenarios de cambio climático, el Panel de Intergubernamental de Cambio Climático (IPCC) define cuatro Vías de Concentración Representativa o RCP (2,6; 4,5; 6 y 8,5), que son proyecciones que integran varios escenarios de cambio climático, incorporando diferentes aspectos socioeconómicos y políticas de mitigación para cada RCP (IPCC 2013, Qin et al. 2016). Para contrastar condiciones optimistas versus condiciones extremas de cambio climático, trabajamos con RCP 2,6 y RCP 8,5; el primero es el escenario más optimista y de menor cambio climático, en el que se han desarrollado políticas de mitigación, y las emisiones de gases de efecto invernadero y CO2 son reducidas (Butler et al. 2012, Varela et al. 2015); mientras que RCP 8,5 es un escenario de cambio climático extremo, en el que existe alta densidad poblacional, alta demanda de energía, las emisiones de gases de efecto invernadero y CO2 siguen incrementándose a lo largo del siglo XXI, y no hay políticas climáticas (Varela et al. 2015, Ruosteenoja et al. 2016, Castillo et al. 2017). El ajuste de los modelos fue evaluado utilizando el valor de AUC (Área bajo la curva).
Calculamos el área de distribución del modelo actual y de los dos modelos futuros (RCP 2,6 y RCP 8,5) para comparar variaciones entre los tres escenarios. Además, analizamos cómo se relaciona la distribución de esta especie con la transformación de hábitat, utilizando el programa Quantum GIS (Quantum GIS Development Team c2018) en el que, sobreponiendo el mapa de distribución potencial actual de la especie con la capa de uso de suelo (MAE-MAGAP 2015), determinamos la cantidad de área de distribución que se encuentra en cada categoría de suelo.
Finalmente, compilamos los registros de parasitación a nidos por parte de M. bonariensis, a través de las redes sociales de los colectivos AvesQuito y Pajareando Ando Ecuador. Estos colectivos promocionan activamente la observación de aves como una actividad recreativa, efectuando excursiones, talleres, ferias y censos. Varios miembros de estos colectivos remitieron información de eventos de parasitación, los autores confirmamos las identificaciones por fotografías y cuando fue posible dimos seguimiento in situ a los eventos. Seguimos la taxonomía y la nomenclatura del Comité de Clasificación de América del Sur (Remsen et al. c2018).
RESULTADOS
Dinámica de distribución
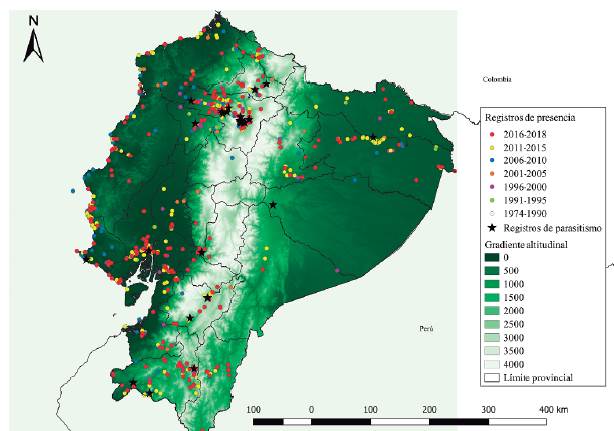
Obtuvimos 451 registros filtrados de M. bonariensis y mediante el análisis de distribución temporal, evidenciamos que su presencia en Ecuador se ha incrementado altitudinalmente 580 m, pues la altitud media registrada del primer período (1974-1990) fue 460 m y del último período (2016-2018) fue 1040 m. Por su parte, los registros más altos de cada período también ascienden de 800 m en el primero a 3300 m en el último (Fig. 1). Finalmente es notorio que los registros en la región interandina del Ecuador corresponden principalmente al último período (Fig. 2).
Modelamiento de nicho ecológico actual y en condiciones de cambio climático
El valor de AUC del modelo fue 0,904, lo que indica un buen ajuste de los datos. El mapa de distribución potencial actual (Fig. 3a) muestra que la zona con mayor idoneidad de hábitat para M. bonariensis se localiza en la región centro occidental del Ecuador. La provincia de Pichincha presenta las condiciones más favorables para su ocurrencia; además, aunque en Cotopaxi y Chimborazo se ubican únicamente seis registros, las condiciones climáticas actuales también son favorables para su presencia.
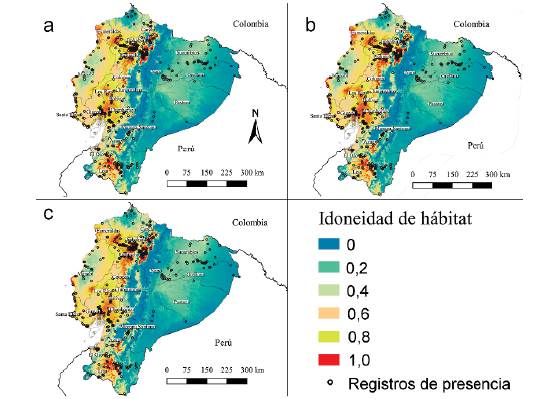
Figura 3 Modelos de distribución potencial de Molothrus bonariensis: a. Modelo de distribución potencial actual, b. Modelo de distribución potencial con escenario RCP 2,6 y c. Modelo de distribución potencial con escenario RCP 8,5.
Las áreas de distribución potencial actual (78 619,16 km2) y futuras con cambio climático (RCP 2,6: 78 148,35 km2; RCP 8,5: 77 743 km2) no presentaron mayor variación. Sin embargo, considerando únicamente las áreas de mayor idoneidad de hábitat (>0,8) (zonas marcadas en rojo, Fig. 3) constatamos que la distribución para M. bonariensis aumentaría en condiciones de cambio climático. El modelo de distribución potencial actual abarcó un área de 25 914 km2, y los modelos futuros alcanzaron: RCP 2,6: 28 199km2 y RCP 8,5: 27 001 km2.
Encontramos también que bajo las condiciones actuales de clima, las áreas más idóneas para la ocurrencia de M. bonariensis se encuentran en zonas dedicadas a actividades agropecuarias (48 286,84 km2; 61,4%), seguidas de bosque (19 051,55; 24,2%), vegetación arbustiva y herbácea, (6 418,39; 8,2%), zonas antrópicas (2 754,11; 4%), cercanías a cuerpos de agua (650,37; 0,8%) y otras áreas (afloramientos rocosos, zonas glaciares o nivales, pantanos, turberas y tierras desnudas/degradadas) (1 457,9; 1,85%).
Registros de parasitación
Documentamos 21 especies parasitadas por M. bonariensis en Ecuador (Tabla 1), trece de las cuales tienen evidencia que son hospederas (Fig. 4), mientras que las siete restantes, solo hay evidencia que son víctimas, según las definiciones de Lowther (c2018). De las 21 especies parasitadas en Ecuador, doce (Thamnophilus bernardi Lesson, 1844, Muscigralla brevicauda d'Orbigny and Lafresnaye, 1837, Furnarius leucopus Swainson, 1838, Vireo olivaceus (Linnaeus, 1766), Cantorchilus superciliaris (Lawrence, 1869), Mimus longicaudatus Tschudi, 1844, Conothraupis speculigera (Gould, 1855), Ramphocelus flammigerus (Jardine y Selby, 1833), Arremon abeillei Lesson, 1844, Geothlypis semiflava Lesson, 1832, Icterus graceannae Cassin, 1867 e I. mesomelas Wagler, 1829) se distribuyen en áreas bajas occidentales; Campylorhynchus turdinus (Wied, 1821) y Paroaria gularis (Linnaeus, 1766) están en áreas bajas orientales; Sturnella militaris (Linnaeus, 1758) en ambas regiones; Pheucticus chrysogaster (Lesson, 1832) en áreas bajas orientales y en la región andina; Zonotrichia capensis (Müller, 1776), Atlapetes latinuchus (Gisignies, 1855), A. leucopterus (Jardine, 1856) y A. palli-diceps (Sharpe, 1900) en la región andina, con esta última endémica de Azuay y finalmente Tyrannus melancholicus Vieillot, 1819 que se distribuye en todo el Ecuador.
Tabla 1 Especies par asitadas por Molo thrus bonariensis en Ecuador . *= se reporta únicamen t e como víctima, es decir un hue v o de M. bonariensis en el nido de la especie, en otros casos ha y evidencia de crianza. E n la última columna se especifica de acuerdo al listado de Lowther (c2018): N= no listado en ese trabajo, H= hospeder o, V= Listado únicamente como víctima.
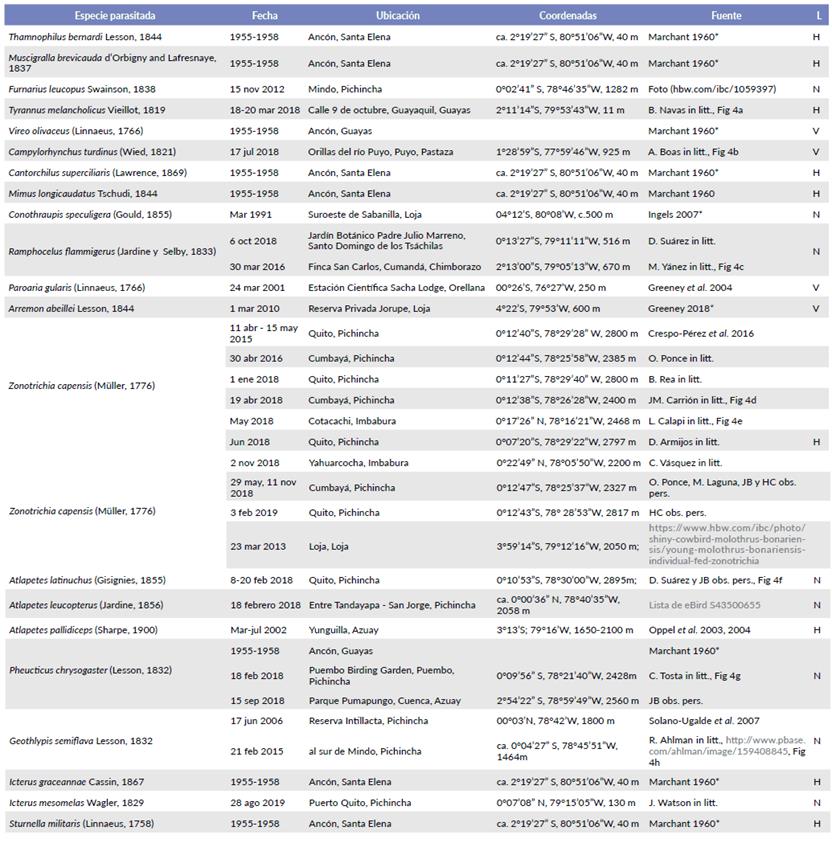

Figura 4 Registros de Molothrus bonariensis juveniles en Ecuador, alimentados por los hospederos: a. Tyrannus melancholicus, 18 mar 2018, Guayaquil, Guayas (B. Navas); b. Campylorhynchus turdinus, 17 jul 2018, Puyo, Pastaza (A. Boas); c. Ramphocelus flammigerus, 30 mar 2016, Cumandá, Chimbo-razo (M. Yánez); d. Zonotrichia capensis 19 abr 2018, Cumbayá, Pichincha (JM. Carrión); e. Z. capensis, may 2018, Cotacachi, Imbabura (L. Calapi); f. Atlapetes latinuchus 8 feb 2018, Quito, Pichincha (JB); g. Pheucticus chrysogaster 18 feb 2018, Quito (C. Tosta); h. Geothlypis semiflava 21 feb 2015, Mindo, Pichincha (R. Ahlman).
Es necesario aclarar que en la Tabla 1 no consideramos la referencia de Marchant (1958), pues solo menciona probables especies parasitadas por M. bonariensis; tampoco consideramos las referencias de Friedmann (1963) y Friedmann et al. (1977), porque la primera hace alusión a Marchant (1958 y 1960) citando como hospedero de M. bonariensis a Vireo flavoviridis (Cassin, 1851), mientras que en Friedmann et al. (1977) cita como Vireo olivaceus; pero estas referencias citan a Marchant (1958, 1960), quién hace alusión como hospedero de M. bonariensis a Vireo virescens, lo que se conoce actualmente como Vireo olivaceus.
DISCUSIÓN
Nuestros análisis de distribución (Figs. 1 y 2), los modelos futuros (Fig. 3), la relación de distribución potencial actual con el uso de suelo y los ocho eventos de parasitación sobre los 2400 m (Fig. 4 y Tabla 1), límite superior de ámbito conocido para M. bonariensis en Ecuador (Freile y Restall 2018), respaldan una expansión y establecimiento de esta ave en la región andina y además, que esta colonización continuará, asociada a la perturbación de hábitats.
La distribución de M. bonariensis en Ecuador se ha incrementado con el paso del tiempo, mostrando una tendencia a colonizar zonas cada vez más altas (Fig. 1). Podrían influir las variaciones de esfuerzo de muestreo en los periodos analizados y en las zonas comparadas; sin embargo, los modelos de idoneidad de hábitat muestran que Cotopaxi y Chimborazo, provincias localizadas en las zonas más altas de Ecuador y con apenas seis registros, son áreas potencialmente habitables para esta especie.
Los autores hemos evidenciado que M. bonariensis ya tiene poblaciones establecidas en dos ciudades de altura: Cuenca, Azuay (2500 m) y Puembo, Pichincha (2400 m), en estas localidades hay evidencia anecdótica hace aproximadamente cinco años, M. bonariensis no estaba presente o al menos, no en números considerables como en la actualidad (M. Ríos y M. Rivadeneira com. pers.); esto coincide con nuestros análisis (Fig. 2) e incluso con los registros de parasitación en esas ciudades (Tabla 1). Por otra parte, aún no hemos evidenciado poblaciones establecidas de M. bonariensis en las ciudades de altura de las provincias de Coto-paxi y Chimborazo, sin embargo, con base en nuestros modelos, nuestras observaciones en campo y a los registros en eBird de individuos en estas provincias, asumimos que en los próximos años se evidencien poblaciones establecidas de M. bonariensis en más ciudades sobre los 2400 m.
De acuerdo con la contribución de las variables en los modelos a futuro, la distribución de M. bonariensis está ligada a la temperatura y pluviosidad, además, analizando las áreas de mayor idoneidad de hábitat (>0,8), se evidencia que condiciones de cambio climático, sean estas menores (RCP 2,6), o extremas (RCP 8,5), incrementarían el área de distribución potencial para M. bonariensis. Estos hallazgos sugieren que el cambio climático desempeñaría un rol importante en el proceso de colonización de nuevas áreas para M. bonariensis, similar a lo ya evidenciado para Mimus gilvus (Vieillot, 1808) también en Ecuador (Aguilar et al. 2016) y a otras especies alrededor del mundo (e.g., Graham et al. 2011).
Eventos de expansión de M. bonariensis ya han sido reportados en otras zonas, por ejemplo, en las islas del Caribe y Norte América se ha evidenciado una colonización gradual de M. bonariensis, la cual ha sido asociada con la modificación antrópica de los hábitats (Post y Wiley 1977, Post et al. 1993, Cruz et al. 1995), mismo factor relacionado a la ampliación de ámbito de distribución de otras especies (Walther et al. 2002).
Por su parte, la cobertura del suelo también está relacionada con la parasitación de nidos, varios estudios han reportado que cuando los nidos están más ocultos, es decir en zonas con mayor cobertura de bosque, son parasitados en menor frecuencia que los nidos que se encuentran en áreas más expuestas (e.g., Sharp y Kus 2006, Saunders et al. 2003). También se conoce que los nidos localizados en áreas de bosque disperso, son parasitados antes que los nidos de zonas con mayor cobertura (Fiorini et al. 2012). Entonces, las especies de aves que habitan en zonas donde los bosques han sido degradados, serían más vulnerables a ser parasitadas por M. bonariensis y eventos como la deforestación y el crecimiento de la frontera agrícola favorecerían el espectro de potenciales hospederos, ya que, M. bonariensis puede expandir su nicho ecológico, es decir, sí puede parasitar nuevas especies (Mason 1986).
Nuestros análisis indican que la mayor parte de la distribución potencial actual de esta ave se ubica en zonas dedicadas a actividades agropecuarias (61,4 %), entendiéndose a estas áreas como propicias para la parasitación de nidos. Esto, sumado a los resultados de los modelamientos con escenarios de cambio climático, sugieren que la distribución de M. bonariensis está asociada a presiones antrópicas, y a su vez, supone que las poblaciones de otras especies de aves sean afectadas, no solo por la transformación de los hábitats en sí, sino también por la colonización de M. bonariensis.
Las especies o poblaciones que no han coevolucionado con parásitos de nidos son propensas a mantener una desventaja en su reproducción porque no han desarrollado mecanismos de adaptación (Cruz et al. 1995). En el sur de Ecuador ya se evidenció a M. bonariensis como una amenaza para la conservación de Atlapetes pallidiceps (Oppel et al. 2003, 2004), y en nuestros resultados tenemos evidencias que otras tres especies de aves con exclusiva distribución en la región andina, ya han sido parasitadas (Zonotrichia capensis, Atlapetes latinuchus, A. leucopterus). También a lo largo de la distribución global de M. bonariensis se han documentado otros casos de afectación a la conservación de las especies parasitadas (Azpiroz 2015, Miller et al. 2016).
En el argot popular de la costa ecuatoriana se conoce a M. bonariensis como Negro Vago, haciendo alusión a que no crían a sus polluelos y los mismos son criados por varias especies; es evidente que nuestro listado de especies víctimas y hospederos de M. bonariensis en Ecuador (Tabla 1) es aún incompleto, sin embargo, presentamos nuevos registros, no considerados en el listado de Lowther (c2018) y el presente puede servir para que se motiven a publicar más observaciones puntuales sobre la historia natural de M. bonariensis.
De igual forma es importante que se desarrollen trabajos de monitoreo de M. bonariensis y de las aves que parasita, esto permitirá obtener información sobre dinámica poblacional y cómo las interacciones de parasitismo podrían estar afectando a las poblaciones de especies vulnerables. En este contexto, para que se obtengan datos de nuevas especies parasitadas, es sustancial continuar estudiando y publicando sobre la biología reproductiva de M. bonariensis, más aún, porque la coloración de los huevos es muy variable entre sus poblaciones (Fraga c2018), e incluso dentro de una misma población, haciendo poco certera la discriminación entre huevos de M. bonariensis con respecto a los huevos de la especie parasitada (Oppel et al. 2004). En Ecuador, el conocimiento de la biología reproductiva de las aves requiere mucha atención, pues no se tiene una descripción formal de los huevos de muchas especies que pueden ser o llegar a ser víctimas u hospederas de M. bonariensis.