INTRODUCCIÓN
La familia Rallidae está entre las más cosmopolitas de las aves; sus 147 especies están dispersas por todos los continentes además de muchas islas oceánicas. Son aves acuáticas que forrajean caminando o nadando en espejos de agua y zonas de vegetación densa. En general los miembros de este grupo vuelan poco dentro de sus hábitats, aunque varias especies hacen migraciones largas y parecen tener una tendencia de desviarse a lugares lejos de sus rutas normales (Taylor 1996). La limitación en las capacidades de movimiento de algunos Rallidae no se limita a los varios taxones endémicos de islas dentro de la familia como la Gallinula chloropus sandvicensis Mathews, 1927, endémica de Hawaii (DesRochers et al. 2010), Gallirallus australis Sparrmn, 1786, endémica de Nueva Zelanda (Beauchamp 1998), algunas descritas recientemente como Rallus rovianae Diamond, 1991 y Gallirallus calayanensis Allen, Oliveros, Española, Broad & Gonzalez, 2004; varias especies continentales tienen distribuciones muy limitadas, representando taxones diferenciados en subespecies o hasta especies distintas. Por sus poblaciones de distribuciones muy limitadas y a menudo pequeñas, estas especies son potencialmente vulnerables a la extinción, especialmente como resultado de la intervención humana, alteraciones de sus hábitats, introducción de especies exóticas, o cacería (Renjifo et al. 2016).
Un 25 % de las especies de la familia está en riesgo de extinción (Taylor 1996). Esta situación de amenaza ha despertado el interés de conservación de estas especies a nivel mundial, generando estudios de diversos aspectos, pues es a partir de conocimientos detallados de los requisitos de hábitat y los ciclos de vida de tales especies que se pueden aplicar medidas de conservación efectivas. Algunos ejemplos de estos trabajos intensivos sobre algunas pocas especies de preocupación para la conservación, especialmente de islas, incluyen a Gallinula chloropus sandvicensis Streets, 1877 de Hawaii (DesRochers et al. 2010), Gallirallus owstoni Rothschild, 1895, de la isla de Guam (Jenkins 1979) y Gallirallus okinawae Yamashina y Mano, 1981 de la isla de Okinawa (Ozaki 2009).
Por otro lado, los conocimientos sobre ecología y reproducción de la familia se basan históricamente en estudios intensivos de las especies que anidan en latitudes templadas de Eurasia y Norteamérica (Meanley 1969, Garnett 1980, Kaufmann 1987, Eddleman et al. 1988, McRae 1996, Jenkins 1999, Post y Seals 2000). En Suramérica, la información disponible para la mayoría de las especies es insuficiente para medidas efectivas de conservación (Taylor 1996). Un ejemplo de este problema es la subespecie endémica y aislada Porphyriops melanops bogotensis Chapman, 1914 en Colombia, con una distribución limitada al altiplano de la cordillera Oriental en los departamentos de Cundinamarca y Boyacá. Los hábitats de esta subespecie se han reducido drásticamente, especialmente en las últimas décadas (Rosselli et al. 2016), llevándola a tener serios problemas de conservación, con el descenso pronunciado de sus números en las últimas décadas (Stiles et al. 2017). Medidas para su conservación son urgentes para prevenir su extinción, pero hace falta un conocimiento más detallado de su biología para poder elaborar un plan de manejo efectivo. La poca información sobre la especie se limita a algunos registros geográficos (Lopes et al. 2012, Salvador 2014) y detalles de la alimentación (Olguín et al. 2013) para las subespecies presentes en el sur del continente. Para P. m. bogotensis, se conoce que se encuentra en espejos de agua y zonas con vegetación flotante pequeña; hay descripciones de eventos reproductivos y nidos (Becerra Galindo et al. 2005, Rosselli et al. 2016) pero no hay seguimiento de nidadas ni información sobre el desarrollo de los pollos, tanto en plumaje como sobre sus medidas. El objetivo de este estudio es obtener información sobre la biología reproductiva especialmente anidación y desarrollo de los pollos, de P. m. bogotensis, para contribuir a la implementación de medidas de conservación que eviten la extinción de esta subespecie.
Describimos detalladamente el comportamiento reproductivo de P. m. bogotensis y las tasas de crecimiento de los polluelos, haciendo observaciones de nidos durante tres años y siguiendo su desarrollo desde el momento del nacimiento con doce individuos de origen silvestre y criados en cautiverio. Esta última información permitirá calcular apropiadamente la edad en estudios posteriores, así como la distinción entre machos y hembras. Entregamos así una de las descripciones más completas del crecimiento y secuencia de plumaje hasta la fecha de una especie de Rallidae para Colombia y la región.
MATERIALES Y MÉTODOS
Área de estudio
El estudio se hizo en el parque Jaime Duque (4°56' Norte, 73°57' Oeste) ubicado en un altiplano conocido como Sabana de Bogotá, a 2585 m en los Andes orientales de Colombia. La precipitación promedio anual está entre 600 y 700 mm y la temperatura promedio es de 13,5 °C (Guhl 1981, CAR 2006). Las lluvias tienen un régimen bimodal con dos picos en abril-mayo y octubre-noviembre y la mayor temporada seca en enero-marzo. El parque tiene una extensión total de 200 ha que incluyen 40 ha de uso recreativo destinado al turismo con un área de 6,4 ha de cuerpos de agua donde habitan tanto aves silvestres, incluyendo a P. m. bogotensis, como domésticas, entre ellos cisnes, gansos y patos. En esta zona, los lagos están desprovistos de vegetación acuática a excepción de pequeñas porciones con papiro (Cyperus papyrus L.), y pequeñas áreas con vegetación flotante, especialmente Eichhornia crassipes (Mart.) Solms, y vegetación emergente dominada por Bidens laevis (L.) Britton, Sterns & Poggenb. Además de la zona recreativa, el estudio se hizo en otra sección de restauración ecológica sin acceso al público de 70 ha conocida como Ecoparque Sabana, siete de las cuales son humedales y canales. El parque está rodeado principalmente por industria, y en menor proporción áreas verdes, además de carreteras y autopistas; 2 km al norte se encuentra el río Bogotá y sus humedales asociados. El área de uso turístico cuenta con un aviario de 2600 m2 provisto con vegetación arbórea y de porte bajo, además de cuerpos de agua en donde se albergan aves nativas para ser exhibidas a los visitantes.
Porphyriops melanops
Porphyriops melanops es una gallineta suramericana, con un peso adulto aproximado entre 154 y 225 g. La coloración de los adultos es gris en la parte inferior, cuello y cabeza; la cara y frente son negruzcas y los flancos marrones con manchas blancas, las alas y la espalda castaño, abdomen y coberteras infracaudales blancas. Las patas son verdosas, el pico es verde claro llamativo, los ojos rojos. Se distribuye desde los Andes orientales colombianos hasta el sur de Suramérica (Taylor 1996). Se encuentran en humedales naturales y artificiales en donde se alimentan de vegetación y pequeños invertebrados. Las poblaciones colombianas constituyen una subespecie endémica (P. m. bogotensis), aislada cerca de 3000 km de las más cercanas que se encuentran en Bolivia y Brasil (Taylor 1996). En Colombia, en donde se reproduce a lo largo de todo el año (Rosselli et al. 2016), P. m. bogotensis se restringe a los humedales del altiplano Cundiboyacense entre los 2500 y 3100 m; estos ecosistemas han disminuido en más del 97 % y están altamente transformados, lo que ha llevado a que la subespecie colombiana se encuentre amenazada y categorizada En Peligro (Renjifo et al. 2016).
Anidación
Con el fin de encontrar nidos de P. m. bogotensis se realizaron entre marzo de 2016 y mayo de 2019 caminatas semanales en el área de estudio y consultas a los trabajadores quienes permanecen en campo. Se consideró que un nido era activo si se encontraba en etapa de incubación o postura y se tomó como mes de anidación aquel en que se hizo la postura. Esta fecha de postura se calculó o porque efectivamente estaban poniendo, o de acuerdo con la etapa de incubación de los huevos determinada mediante ovos-copia. Mediante el uso de Google Earth Pro (version 7.3.2) se midió el área de cada uno de los cuerpos de agua en que se encontraron nidos. Dado el constante seguimiento de las aves acuáticas y del área de estudio por parte de FCV y del personal del Parque Jaime Duque, consideramos que la mayor parte de los nidos de P. m. bogotensis fueron encontrados. Adicionalmente los autores estaban haciendo simultáneamente una investigación asociada en la que se contaba con 18 individuos anillados individualmente y equipados con equipos de telemetría (transmisores VHF -ATM A2480 y receptores ATM R410) lo cual permitió el reconocimiento de sexos e individuos. La notoria diferencia entre el tamaño de machos y hembras encontrada en este trabajo también permite distinguir los sexos en campo. En cada nido redondo se tomaron medidas de diámetro y profundidad (desde la base hasta la parte más alta) con una regla de 1 mm de precisión y notas sobre los materiales de construcción, número de huevos y largo y ancho de estos con un calibrador con una décima de milímetro de precisión. Los promedios de estas y las otras medidas en este trabajo se dan ± la desviación estándar. Se obtuvieron 832 minutos de grabación 626 diurnos (6:00 a 17:59) y 206 nocturnos (18:00 a 5:59), con una cámara trampa Bushnell - 119876 puesta entre el 22 y el 28 de septiembre de 2018 para observar el comportamiento de incubación en uno de los nidos de dos individuos anillados y equipados con transmisores. Se pudo hacer el seguimiento de dos nidos silvestres desde el momento de su construcción hasta la eclosión de todos los huevos con lo que se obtuvo el tiempo de incubación natural. Uno de los individuos nacidos en el medio natural fue anillado y seguido con telemetría lo cual permitió registrar la edad de la primera reproducción. Una pareja criada y mantenida en cautiverio anidó exitosamente lo cual permitió tener otro dato de la primera edad de reproducción.
Incubación y cría artificial
Entre el primero de marzo de 2016 y el 28 de julio de 2018 se recolectaron doce huevos de ocho nidos. Para aquellos nidos con cuatro huevos o menos se recolectó uno, mientras que nidos con cinco huevos o más se recolectaron dos. Todos los huevos recolectados se encontraban en el primer tercio de incubación determinado en campo por medio de ovoscopia, posteriormente se llevaron a incubación artificial (Incubadora Grumbach Modelo 8414) a 37,4 °C y 60 % de humedad relativa (HR), de acuerdo con los protocolos de cría del Avian Rearing Resource para Rallidae, especialmente Crex crex Linneo, 1758 (Graham 2007) y el zoológico de San Diego (Kuehler y Good 1990). La remoción de huevos de los nidos no tuvo ningún efecto perceptible en la viabilidad de los nidos. Posterior a la ruptura de la cámara de aire en el huevo, estos se trasladaron a una nacedora (RcomMax 20) a 37,0 °C y 80 % HR. Pasadas 24 horas de la eclosión los polluelos fueron alimentados con concentrado para aves de corral en crecimiento Solla Master Pollito 24 % proteína, verduras, suplemento vitamínico, insectos, y agua a voluntad. Los primeros diez días de vida se mantuvieron en una criadora a 30 °C, y la temperatura se redujo paulatinamente hasta llegar a los 25 °C en el día 20 de vida. Alrededor del día 30 se mantuvieron a temperatura ambiente (18 °C). En el día 60 se trasladaron al aviario donde finalizó su desarrollo. Dos polluelos silvestres de diez días que quedaron huérfanos fueron trasladados a cuidado en cautiverio, y sus mediciones de desarrollo fueron sumadas a las doce iniciales.
Desarrollo
Antes de alimentarlas las catorce aves criadas artificialmente (ocho hembras y seis machos incluyendo los pollue-los silvestres rescatados) se pesaron diariamente en una báscula digital de precisión 0,1 g serie BBG 5050921; el pesaje se realizó, cuando fue posible, desde el primer día hasta el día 59, cuando alcanzaron el peso definitivo. Solo se lograron datos completos de peso de siete individuos (cinco hembras y dos machos) dadas las dificultades para capturarlos en el aviario en donde se mantuvieron cuando se iban haciendo mayores. Se calculó la tasa porcentual de aumento de peso diaria dividiendo el peso ganado en un día por el peso del día anterior. Para las otras medidas (culmen, tarso, ala y cola) el número de individuos incluidos en las mediciones de seguimiento de desarrollo tuvo variaciones por dificultades que se presentaron a lo largo del trabajo incluyendo dificultad en la captura y manejo de las aves. Las medidas de culmen, tarso y ala se tomaron semanalmente con un calibrador digital Discover de 0,1 mm de precisión, desde el primer día hasta que las curvas se estabilizaron (día 53 para culmen y tarso, día 60 para ala). Adicionalmente se capturaron once individuos silvestres que ya habían alcanzado el tamaño y plumaje de adulto (cinco hembras, seis machos) cuyas medidas de peso y dimensiones se incluyeron en las comparaciones de los individuos de tamaño definitivo. No todos estos once individuos adicionales se incluyeron en todas las mediciones por factores varios tales como estar en muda o porque se fugaron durante la manipulación.
Para hacer el seguimiento del cambio de coloración de los polluelos desde su nacimiento hasta adquirir el plumaje de adulto, semanalmente se tomaron fotografías y anotaciones. Los colores se describen usando la guía de color para naturalistas de Smithe (1975).
Las diferentes medidas entre machos y hembras de P. m. bogotensis se compararon usando análisis de t de student con el programa PAST (Hammer et al. 2001).
RESULTADOS
Anidación
A lo largo de los tres años de observaciones se encontraron 19 nidos activos durante todos los meses del año exceptuando junio, octubre y diciembre (Fig. 1). Los meses de abril (época de lluvias) y agosto (época de lluvias bajas) presentaron la mayor cantidad de nidos (cinco en abril (1,25 nidos/meses de observación) y cuatro en agosto (1,33 nidos/meses de observación); Fig. 1).
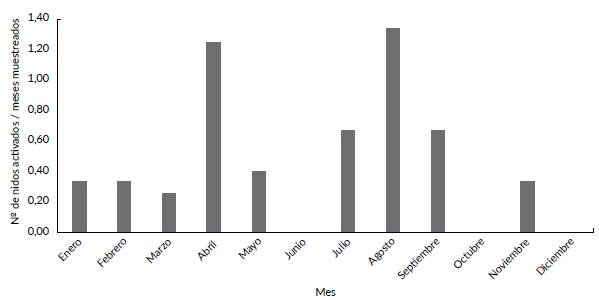
Figura 1 Número de nidos activos de P. melanops bogotensis registrados en el momento de la postura entre marzo del 2016 y mayo del 2019 en el Parque Jaime Duque, Sabana de Bogotá, Cordillera Oriental Colombiana. El número de nidos está corregido por el número de veces que el mes correspondiente fue muestreado.
Los nidos fueron construidos por macho y hembra quienes también intervinieron en la incubación y cría de los polluelos. Los nidos se construyeron ocultos entre vegetación, principalmente acuática con plantas como Cyperus papyrus, Schoenoplectus californicus (C.A. Mey.) Soják, Polygonum hydropiperoides Michx. y Pennisetum clandestinum Hochst. ex Chiov. Tres de los nidos se construyeron sobre el agua, y los otros 16 a una distancia máxima de 50 cm del cuerpo de agua (Fig. 2). Solo se encontró un nido a la vez por cada cuerpo de agua, aunque la misma pareja con frecuencia ubicó nidos sucesivos en la misma área separados alrededor de 50 m. Los cuerpos de agua en los cuales encontramos nidos fluctuaron entre 0,1 y 3,4 ha (Promedio 0,91±1,17). La distancia entre los nidos encontrados de diferentes parejas fue de 200 - 400 m. Los nidos son redondeados (Diámetro medio = 16 ± 2,5 cm, n = 19 nidos) con una profundidad de 5,3 ± 2,3 cm (n = 19 nidos), construidos con material vegetal diverso del área, incluidas hojas frescas y secas de plantas terrestres y acuáticas, pequeñas ramas y, ocasionalmente, plumas de P. m bogotensis yArdea alba Linneo, 1758 (Fig. 2).

Figura 2 Nidos y huevos de P. melanops bogotensis hallados en el área de estudio. Se muestran diferentes tipos de materiales: a. nido construido con Pennisetum clandestinum entre Polygonum hydropiperoides, b. nido construido con diversos tipos de material vegetal entre Cyperus papyrus, c nido sobre el agua construido con hojas de Syzygium paniculatum entre Schoenoplectus californicus.
El número de huevos por nido varió entre tres y seis (Media = 4,4 huevos ± 0,9, n = 19). Los huevos tienen forma ovalada (Largo: 40,7 ± 1,5 mm; n = 62, ancho: 28,7 ± 1,5 mm n = 62). La coloración fue variable, entre crema y marrón claro, con manchas marrón oscuro más densas hacia el polo más ancho del huevo (Fig. 2).
Según las grabaciones hechas con la cámara trampa durante el día, el macho pasó una mayor cantidad de tiempo incubando que la hembra (57,8 % vs 42,2 %). Además, solo se registró incubación nocturna por parte del macho, quien permaneció toda la noche en el nido. Durante el día, los turnos del padre y madre variaron entre 8 y 335 minutos (Promedio = 100,5 min ± 67,0), sin encontrarse diferencia significativa entre la duración de los turnos de incubación entre los dos sexos (t = 0,26 P = 0,79). Previo a los relevos ambos sexos emiten vocalizaciones como cacareo "kakakaka", y después del intercambio, ocasionalmente emiten vocalizaciones adicionales de contacto. La incubación tanto en laboratorio (10 huevos) como en ambiente natural (2 Nidos/8 huevos) duró de 18 a 20 días y la tasa de eclosión en laboratorio fue del 85 %.
Una vez nacidos, los polluelos pueden nadar y bucear a las pocas horas según vimos en ocho ocasiones tanto en individuos silvestres (tres) como en cautiverio (cinco). Los polluelos son alimentados y protegidos por los dos padres hasta por lo menos los 50 días de edad según observaciones en dos nidos silvestres.
Desarrollo
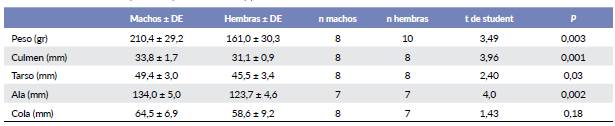
No hubo diferencias significativas entre el peso de los machos y hembras al nacer (machos 11,76 ± 1,23 g, n = 5 vs hembras 12,44 ± 0,58 g, n = 7; t = 1,30 P = 0,22). Los individuos criados artificialmente alcanzaron su peso definitivo alrededor del día 55 (Fig. 3). El peso final de los machos criados en cautiverio a los 55 días fue mayor que el de las hembras criadas en cautiverio (189,0 ± 1.4 g, n = 2, vs 136,9 ± 12,6 g, n = 5) aunque los datos no fueron suficientes para aplicar una prueba estadística (Fig. 3). La longitud del tarso y culmen se estabilizaron cerca del día 45 de vida, mientras que la del ala cerca del día 60 (Fig. 4). El aumento de peso porcentual diario máximo se dio en el día siete para machos (19 %) y diez para hembras (21 %).
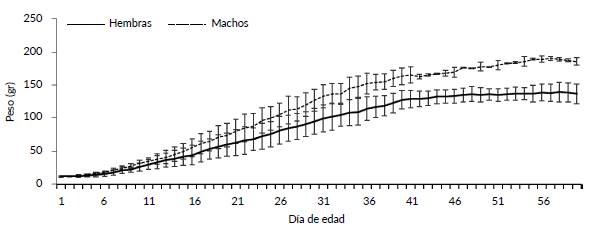
Figura 3 Peso (gr ± DE) de machos y hembras de P. melanops bogotensis criados artificialmente hasta el día 59 de vida.
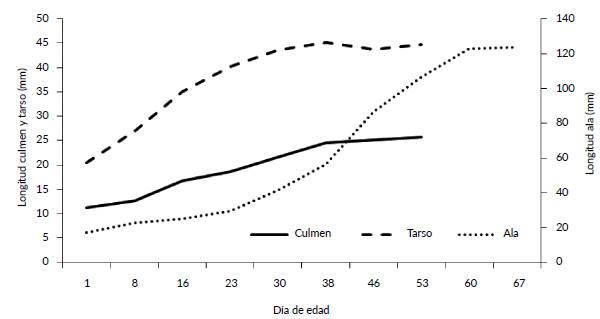
Figura 4 Longitud media (mm) de culmen y tarso del día 1 al 53 y de ala del día 1 al 67 de P. melanops bogotensis
La diferencia de peso entre machos y hembras de tamaño definitivo incluyendo silvestres y criados en cautiverio, lo mismo que la longitud del culmen, tarso y ala fue significativa. No hubo diferencia significativa en la longitud de la cola (Tabla 1). El peso de las hembras criadas en cautiverio fue menor que el de las silvestres (Promedio 136,9 ± 12,6 g, n = 5 vs. 185,0 ± 21,5 g, n = 5, t = 4,3, P = 0,003) y los machos tienen la misma tendencia, aunque no hubo datos suficientes para hacer una prueba (Promedio ind. cautiverio 189,0 ± 1,4 g, n = 2, vs Ind. silvestres 217,5 ± 30,8, n = 6).
Coloración del pico
El pico de P. m. bogotensis sufre un cambio de coloración desde ser rosado (7 Pink) al nacimiento hasta llegar al verde (158 Chartreuse) definitivo a los 75 días de edad. En el primer día de vida, la sección proximal del pico es roja -rosada con algunas partes negras y la punta blanca, la cual corresponde al diente de huevo que permanece hasta el día 20 (Figs. 5a, b). Hacia el día 28 la coloración rosada ha desaparecido casi en su totalidad y el negro se expande a casi todo el pico (Fig. 5c). A partir del día 41 empieza a aparecer el color verdoso, mientras que el negro comienza a desaparecer; hacia el día 75 se torna completamente verde (Figs. 5d-f). A partir del día 54 empieza a aparecer la coloración negra en las plumas que rodean el pico (Figs. 5e, f).
Coloración del iris
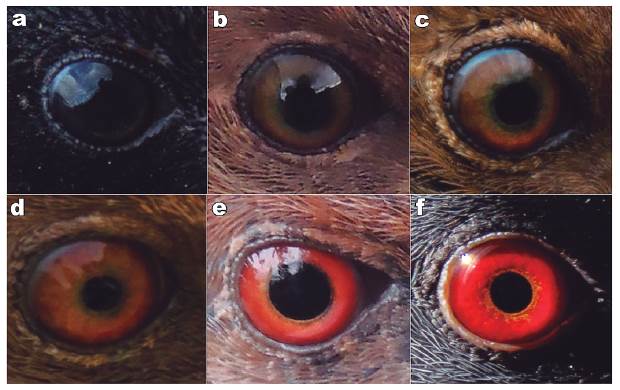
El iris también presentó una transformación notable desde un marrón oscuro (119B Dark Drab) al nacer (Fig. 6a) hasta el rojo encendido (210 Pratt's Ruby) de los adultos (Fig. 6f). Alrededor del día 30, el marrón se aclara (223C Sayal Brown) y se va tornando rojizo (40 Cinnamon-Rufous) (Figs. 6b-e) hasta llegar al rojo definitivo alrededor de los 150 días de edad (Fig. 6f).
Plumaje
El plumaje hace una transición desde el plumón negro al nacer hasta alcanzar el patrón típico del adulto (Figs. 7, 8). Los polluelos nacen cubiertos de plumón negro con una zona desnuda rosácea en la coronilla (Fig. 7a), y permanecen sin mayores cambios hasta el día 20, cuando empiezan a aparecer plumas castaño (32 Chestnut) en varias zonas del cuerpo, incluyendo la zona auricular (Fig. 7b); en este momento todavía no han crecido las plumas de vuelo (Fig. 8a). De ahí en adelante, aparece coloración blanca en los muslos y el color castaño se vuelve generalizado, incluyendo la parte inferior del cuerpo; las manchas blancas en los flancos son evidentes en el día 42 (Figs. 7c-e, Figs. 8d-f). A partir del día 28 empiezan a crecer las plumas de vuelo, que alcanzan su desarrollo casi completo en el día 55 (Figs. 8b, c). A partir de esta edad se empieza a notar un color gris (88 Pratt's Payne's Gray) en el cuello, para llegar al patrón adulto cerca del día 165 (Figs. 7e, f); a esta misma edad (aproximadamente cinco meses) observamos el primer evento reproductivo con anidación tanto en individuos en cautiverio (dos) como silvestres (uno).

Figura 7 Cambios en el plumaje de P. melanops bogotensis desde el nacimiento hasta el patrón adulto. a. día 15; b. día 20; c. día 28; d. día 54; e. día 75; f. día 165.

Figura 8 Desarrollo del plumaje de P. melanops bogotensis desde el día 20 de edad hasta el 42. a. ala sin plumas de vuelo (20 días); b. primeras plumas de vuelo emergiendo en ala (28d); c. plumas del vuelo en crecimiento (42 d); d. presencia de plumas blancas en muslos (20 d); e. abundante plumaje en pecho y muslos exceptuando zona de la quilla (28 d); f. presencia de manchas blancas en flancos y abundante plumaje en la región inferior incluyendo la quilla (42 d).
DISCUSIÓN
La descripción detallada que proveemos sobre la reproducción y desarrollo de P. m. bogotensis coincide con lo descrito en términos generales para la familia Rallidae, con algunas variaciones atribuibles a su tamaño y distribución tropical, y concuerda con los pocos datos anteriores para la subespecie P. m. bogotensis (Taylor 1996, Rosselli et al. 2016).
El tamaño de la nidada registrado fue menor que lo reportado para la especie, ya que en el sur del continente hay casos de hasta ocho huevos (Johnson 1965), y también inferior a especies cercanas como Porzana carolina (Linneo, 1758) que tiene una nidada de 11,5 huevos en promedio (Lor y Malecki 2006), y Gallinula galeata (Lichtenstein, 1818) en Norteamérica, con promedios de nidadas entre 7,1 y 12,5 (Fredrickson 1971). Esta tendencia a aumentar el número de huevos con la latitud es bien conocida en aves, y se ha atribuido una mayor competencia inter e intraespecífica en climas tropicales, más estables, que consume tiempo y energía de la especie (Cody 1966).
En los rálidos, al igual que en la mayoría de aves (Ehrlich et al. 1988), la incubación generalmente la hacen ambos sexos (Gullion 1954, Meanley 1969, Jenkins 1979, Legare y Eddleman 2001), y en muchas especies el macho incuba de día y la hembra de noche (Taylor 1996). En nuestro caso, encontramos que macho y hembra incuban durante el día, sin embargo, durante la noche solo se registró al macho en esta actividad, lo cual, por lo menos para la pareja observada, representa una diferencia. Este tipo de incubación fue llamado patrón de carpintero por Skutch (1976) dado que ocurre en esas aves; en rálidos se registra a veces en Fulica americana (Skutch 1976). Aún se sabe poco sobre los factores que explican la distribución de la tarea de la incubación, aunque seguramente influyen el clima, la oferta de alimento y la presión de depredación (Ehrlich et al. 1988).
La anidación de P. m. bogotensis ocurre durante todo el año, como se había registrado en estudios anteriores (Rosselli et al. 2016) y no parece haber relación con los periodos de lluvia, como también encontraron Sánchez et al. (2016), aunque para otros rálidos tropicales se sugiere anidación durante la época lluviosa o al final de esta (Taylor 1996).
Los patrones de crecimiento observados en P. m. bogotensis se asemejan a los de Gallinula galeata (Fredrickson, 1971) en donde el tamaño del culmen y del tarso se estabilizan después de la sexta semana. En Gallirallus owstoni, de mayor tamaño que P. melanops, estas estructuras alcanzan el tamaño adulto a las siete semanas (Jenkins 1979); el crecimiento es más rápido en Porzana carolina, especie relacionada con P. melanops, pero de menor tamaño, que alcanza el tamaño adulto de tarso cerca de las tres semanas (Kaufmann 1987). La diferencia en el tamaño entre sexos que encontramos en P. m. bogotensis es una novedad pues además de que no se da en la mayoría de Rallidae (Taylor y van Perlo 1998), el único otro estudio que incluye el peso de esta especie (Salvador 2014) no contó con suficientes datos para sacar una conclusión en este aspecto.
La edad de la primera reproducción que encontramos en P. m. bogotensis está dentro de lo hallado en otros rálidos que abarca un intervalo que va desde las 16 semanas hasta el año (Taylor 1996, Taylor y van Perlo 1998).
La coloración del pico, con patrones llamativos en los polluelos como la encontrada en P. m. bogotensis, es común en especies que anidan ocultas entre la vegetación, y posiblemente tiene la función de ayudar a los padres a dirigir la comida hacia el pico de los polluelos (Taylor 1996). Por otro lado, la coloración rosada oscura de la cabeza de los polluelos recién nacidos como la encontrada en P. m. bogotensis ha sido interpretada en Fulica atra (Linneo, 1758) como una señal de apaciguamiento, dado el comportamiento agresivo de esta especie, u otra señal asociada a la alimentación o competencia con los hermanos durante las primeras semanas, cuando son completamente dependientes de los padres (Fjeldsá 1973, Krebs y Putland 2004). Según nuestras observaciones, aunque P. m. bogotensis es una subespecie territorial que agrede a otros individuos invasores, no vimos agresiones contra sus propios juveniles, los cuales son dependientes de los padres hasta las tres semanas de vida aproximadamente, después de lo cual se alejan de ellos según nuestras limitadas observaciones.
El plumaje natal negro observado en P. m. bogotensis es típico de la familia Rallidae en general (Taylor 1996, Livezey 1998, Krebs y Putland 2004). Tal como describe Kaufmann (1987) para Porzana carolina, P. m. bogotensis empezó a desarrollar su plumaje juvenil alrededor del día 20, para adquirir el plumaje castaño el día 28, tal como encontraron Sánchez et al. (2016), quienes lo llaman plumaje subadulto. Sánchez et al. (2016) narran que a P. m. bogotensis le tomó 63 días adquirir el plumaje de adulto, mientras que en nuestro caso el plumaje de adulto se alcanzó después de 160 días, más cercano a lo descrito para P. carolina (Kaufmann 1987) aunque un poco más tarde (4 vs 5,5 meses). Estas diferencias se pueden deber a que Sánchez et al. (2016) no hicieron seguimiento individual a animales marcados.
Con los datos que aportamos se puede calcular la edad de individuos silvestres. Esto serviría para evaluar en detalle la estructura poblacional en diferentes humedales determinando la importancia de los mismos, así como para confirmar eventos reproductivos en cuerpos de agua de diferentes tipos y tamaños en donde se puedan encontrar. Esta subespecie se ha registrado en estanques artificiales desde pocos cientos de metros cuadrados de área en cultivos de flores (ABO c2010), campus universitarios (Sánchez et al. 2016), y áreas rurales en general (Rodríguez-Grisales 2007) pero no están confirmados eventos reproductivos ni presencia de individuos de diferentes edades en la mayoría de casos. El poder determinar la edad de individuos en actividades de monitoreo permite hacer seguimiento a la efectividad de medidas de conservación para la especie como la restauración y creación de humedales artificiales; adicionalmente conociendo la edad de los individuos presentes en un cuerpo de agua se pueden hacer estudios sobre etapas de mortalidad y vulnerabilidad que permitan mejorar la supervivencia. El no poder determinar una edad precisa mediante el aspecto del plumaje también limita el seguimiento de las tasas de crecimiento (DesRochers et al. 2010). Adicionalmente, el conocimiento de la crianza de esta especie en cautiverio es de gran valor como una eventual medida de conservación con la suplementación de poblaciones naturales o la reintroducción de la subespecie en localidades con hábitat disponible de donde haya desaparecido.
Con este trabajo se aumenta el conocimiento sobre la biología reproductiva de P. m. bogotensis en cautiverio y vida silvestre. Esta información es importante para el manejo de sus poblaciones y posteriores estudios en pro de su conservación (Elphick et al. 2007). Esperamos que estos aportes contribuyan a la preservación de esta subespecie para la cual todavía no hay acciones específicas y efectivas para su conservación.