INTRODUCCIÓN
En un análisis fitogeográfico anterior basado en la distribución de las macroalgas marinas, se constató que Cuba pertenece a la región Antillana, que incluye a Bahamas y llega hasta Bermudas (zona de transición) (Suárez 1989). Como resultado del mismo se llegó a la conclusión de que en el caso de macroalgas marinas no se puede hablar de endemismo por países, pues la distribución de las especies es a nivel regional, del Caribe y golfo de México; así mismo los análisis de similitud determinaron tres grandes zonas: 1- Continental Norte, desde Carolina del Norte hasta Yucatán con una zona transicional de Carolina del Norte a Jacksonville; 2- el archipiélago de las Antillas, que incluye Islas Vírgenes, Bahamas y Bermudas, que llega hasta una segunda zona transicional en Bermudas; 3- Continental Sur, desde Yucatán a Recife, Brasil, con una zona transicional en las islas del Caribe sur (Antillas Holandesas y Trinidad-Tobago) y la zona del delta del Orinoco (Fig. 1) (Suárez 1989).
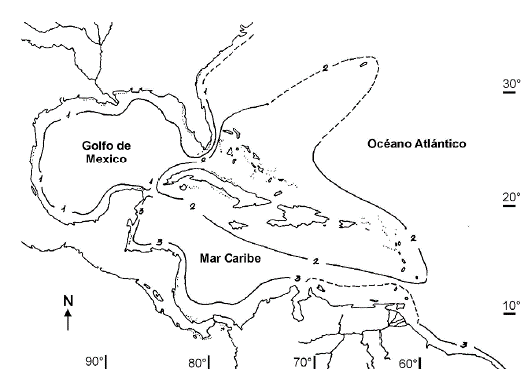
Figura 1 Regionalización fitogeográfica del Mediterráneo Americano según Suárez (1989). 1- Continental Norte, desde Carolina del Norte hasta Yucatán; 2- el archipiélago de las Antillas, que llega hasta Bermudas; 3- Continental Sur, desde Yucatán a Recife, Brasil. Las líneas punteadas señalan zonas de transición en la distribución de especies.
Veinte años después de la regionalización fitogeográfica de Suárez (1989) se realizó un nuevo análisis sobre el estado del conocimiento de la distribución de las macroalgas en la América Latina y el Caribe, incluyendo el Pacífico hasta México y la zona templada del Atlántico Sur (citado en Suárez et al. 2015), de donde se obtuvieron nuevos resultados para Cuba, el Caribe Occidental y el Golfo de México. En ese momento ya se habían publicado nuevas listas y libros, tanto generales (Littler y Littler 2000, Wynne 2005) como de zonas particulares del Atlántico de México (Ortega et al. 2001, Garduño-S et al. 2005, González-Gándara et al. 2007), Colombia (Díaz-Pulido y Díaz-Ruíz 2003) y Cuba (Suárez 2005). En esa ocasión, el resultado principal fue una similitud mayor del 70 % entre Cuba, el Caribe Occidental (México caribeño, Centroamérica y Colombia) y el suroeste del Golfo de México; la similitud con Florida fue baja y el norte del Golfo de México se separaba sustancialmente La ficoflora del Pacífico (Ecuador, Centroamérica y México) y de Suramérica (Uruguay, Argentina, Chile, Perú y el Pacífico colombiano) formaron dos grupos separados con similitudes muy bajas, de alrededor del 20 %, con el Atlántico Occidental Tropical y Subtropical (Suárez et al. 2015). Estos grupos coincidían en parte con los dominios (realms), provincias (provinces) y ecorregiones (ecoregions) definidas por Spalding et al. (2007). Estos autores consideran como una provincia al Atlántico Tropical Noroccidental con varias ecorregiones, y separan el norte del Golfo de México y las Carolinas, incluyendo el norte de la Florida, como una provincia cálido-templada. Hacia el sur, el Atlántico Tropical Noroccidental llega hasta la desembocadura del Orinoco, seguida por la provincia del Norte de Brasil, que incluye la Guayana y la Amazonia. El resto del Brasil forma parte de la provincia del Atlántico Tropical Suroccidental.
En los últimos años se han publicado nuevas listas del Atlántico Occidental Tropical y Subtropical (Wynne 2011, 2017), estudios de grupos taxonómicos (Won et al. 2009, Mamoozadeh y Freshwater 2011) y regionales, fundamentalmente de Cuba (Suárez et al. 2015), México (Cetz-Navarro et al. 2008, Mendoza-Gonzalez et al. 2009, Mateo-Cid et al. 2012), América Central (Bernecker 2009, Bernecker y Wehrtmann 2009), Colombia (Albis-Salas y Gavio 2011, Ortiz y Gavio 2012), Florida (Dawes y Mathieson 2008, Littler et al. 2008), golfo de México (Fredericq et al. 2009) y Venezuela (Web Ficoflora Venezuela c2016). Por ello, se trazó como objetivo hacer un nuevo análisis de las zonas fitogeográficas que habían sido analizadas anteriormente (Suárez 1989, Suárez et al. 2015).
MATERIALES Y MÉTODOS
Para comparar la flora de macroalgas marinas entre zonas del Atlántico Occidental Tropical y Subtropical, se dividió la región en 17 zonas: Carolina del Norte + Carolina del Sur + Georgia (CAG), Bermuda (BER), Bahamas + Turks y Caicos (BH), Florida (FLA), costa norte del golfo de México (NG), costa mexicana del golfo de México (MG), costa mexicana del Caribe (MC), Centroamérica (CA), Colombia (CO), Venezuela y Guayanas (VEN), Cuba (CU), Española (ES), Puerto Rico (PR), Jamaica + Islas Caimán (JA), Antillas Holandesas + Trinidad-Tobago (AHTT), Antillas Menores + Islas Vírgenes (AMV) y Brasil (BRA). Estas zonas fueron seleccionadas teniendo en cuenta las ecorregiones propuestas por Spalding et al. (2007), de modo general, aunque en ocasiones se unen varias de ellas debido a que muchas de las listas se refieren a un país, sin especificar la zona estudiada.
Los datos de presencia de taxones infragenéricos en las diferentes zonas del AOTS se obtuvieron de la literatura científica y bases de datos, en especial la monografía de Taylor (1960) y las listas de Wynne (1986, 1998, 2005, 2011, 2017), así como la base de datos en línea Algaebase (Guiry y Guiry c2018); los artículos más recientes, después del 2008 a los que se ha hecho referencia aparecen en las listas de Wynne y en Algaebase (Bernecker 2009, Bernecker y Wehrtmann 2009, Fredericq et al. 2009, Mendoza-Gonzalez et al. 2009, Won et al. 2009, Albis-Salas y Gavio 2011, Mamoozadeh y Freshwater 2011, Mateo-Cid et al. 2012, Ortiz y Gavio 2012, Suárez et al. 2015, Web Ficoflora Venezuela c2016). Los nombres específicos aceptados en la actualidad fueron actualizados según Algaebase. Se excluyeron 35 nombres de especies cuyas localidades no fue posible precisar. Los registros se ordenaron en una hoja de cálculo en Microsoft Office Excel 2010 por phylum y por zonas.
Para conocer las semejanzas entre las zonas se hizo una matriz de similitud con el índice binario de Sorensen (Sorensen 1948). Con esta matriz se realizó un análisis de agrupamiento (CLUSTER) con el método de ligamiento por promedio de grupos (UPGMA) y se aplicó la prueba de significación SIMPROF. Esta prueba busca evidencia estadísticamente significativa de la similitud entre muestras y grupos (Clarke y Gorley 2006). También se realizó un escalado multidimensional no métrico (MDS). Estos cálculos se hicieron para el total de especies de macroalgas, así como para cada phylum, con el programa Primer 6.1.6 (Primer-E, Ltd.) (Clarke y Warwick 2001).
RESULTADOS
Se obtuvo una lista con 1615 taxones infragenéricos (Anexo 1 en material suplementario). De ellos, 368 pertenecen al phylum Chlorophyta, 1050 a Rhodophyta y 197 a la clase Phaeophyceae del phylum Ochrophyta; solo 65 se encontraron en todas las zonas (Tabla 1), 136 en al menos el 94 % de estas (16 y 17 zonas), mientras que 516 fueron registradas en una sola.
Tabla 1 Lista de taxones infragenéricos de macroalgas comunes para las 17 zonas en que se dividió el Atlántico Occidental Tropical y Subtropical.
El mayor número de taxones se encontró en Brasil (890) y representa más del doble de las zonas menos ricas (registrados en Jamaica + Islas Caimán, la Española y Antillas Holandesas + Trinidad-Tobago) (Tabla 2). En todos los casos, el phylum Rhodophyta fue más rico en taxones y Ochrophyta, menos. La similitud entre las zonas estudiadas varió entre 36,1 y 76 % (Tabla 3).
Tabla 2 Cantidad de taxones infragenéricos por phylum y total encontrados en las zonas en que se dividió el Atlántico occidental tropical y subtropical.
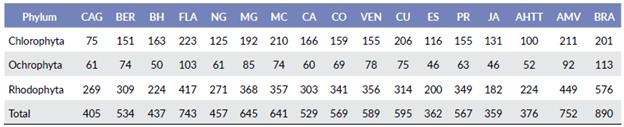
CAG: Carolina del Norte + Carolina del Sur + Georgia; BER: Bermuda; BH: Bahamas + Turks & Caicos; FLA: Florida; NG: costa norte del golfo de México; MG: costa mexicana del golfo de México; MC: costa mexicana del Caribe; CA: Centroamérica; CO: Colombia; VEN: Venezuela + Guayanas; CU: Cuba; ES: Española; PR: Puerto Rico; JA: Jamaica + Islas Caimán; AHTT: Antillas Holandesas + Trinidad-Tobago; AMV: Antillas Menores + Islas Vírgenes; BRA: Brasil. Holandesas + Trinidad-Tobago; AMV: Antillas Menores + Islas Vírgenes; BRA: Brasil.
Tabla 3 Similitud (%) según el índice de Sorensen entre las zonas en que se dividió el Atlántico Occidental tropical y Subtropical.
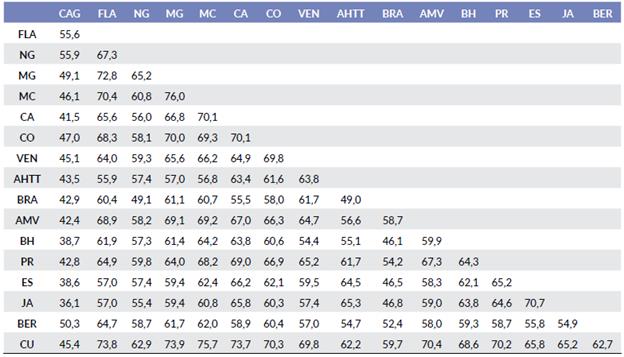
CAG: Carolina del Norte + Carolina del Sur + Georgia; FLA: Florida; NG: costa norte del Golfo de México; MG: costa mexicana del golfo de México; MC: costa mexicana del Caribe; CA: Centroamérica; CO: Colombia; VEN: Venezuela + Guyanas; AHTT: Antillas Holandesas + Trinidad-Tobago; BRA: Brasil; AMV: Antillas Menores + Islas Vírgenes; BH: Bahamas + Turks & Caicos; PR: Puerto Rico; ES: Española; JA: Jamaica + Islas Caimán; BER: Bermuda; CU: Cuba.
La prueba de significación SIMPROF del análisis de agrupamiento CLUSTER con todos los taxones mostró que no hubo diferencias significativas (P > 0,05) entre Cuba y las costas de México cercanas al golfo homónimo y al Caribe, así como entre la Española y Jamaica. Las demás zonas presentaron diferencias significativas (P < 0,05) (Fig. 2a). Cuando se realiza este análisis con el phylum Chlorophyta solamente, se aprecia semejanza de la fico-flora entre Florida y México Golfo, Cuba y México Caribe, Colombia y Centroamérica, Puerto Rico y Jamaica, así como entre Venezuela, el Norte del Golfo de México y Bermudas (P > 0,05) (Fig. 2b). En el análisis realizado con el phylum Ochrophyta, las mayores similitudes están entre Venezuela y Colombia, Cuba, Centroamérica y Puerto Rico, México Golfo y México Caribe, Antillas Holandesas + Trinidad Tobago y Jamaica, así como entre Florida y el Norte del Golfo (P > 0,05) (Fig. 2c). En el phylum Rhodo-phyta, fueron similares Florida y Cuba, México Golfo y México Caribe, Colombia y Venezuela, así como la Española y Jamaica (P > 0,05) (Fig. 2d). En los cuatro análisis de agrupamiento, Carolina del Norte + Carolina del Sur + Georgia es la zona que tiene menor similitud con el resto.
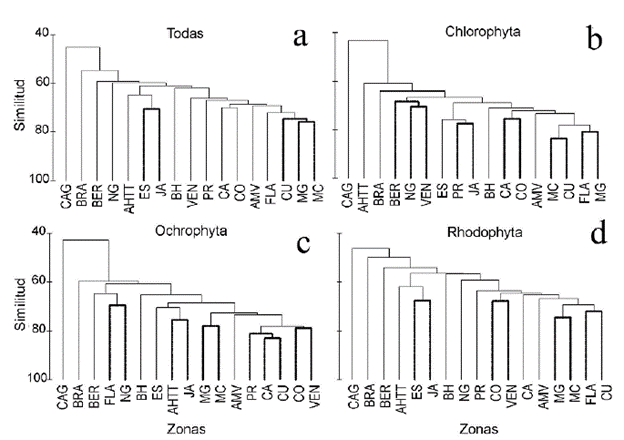
Figura 2 Agrupamiento formado a partir del análisis de conglomerados de las zonas en que se dividió el Atlántico Occidental tropical y Subtropical, con todas las especies de macroalgas y por phylum. Las líneas gruesas muestran aquellas que no presentaron diferencias significativas, según la prueba SIMPROF (P > 0,05). CAG: Carolina del Norte + Carolina del Sur + Georgia; FLA: Florida; NG: costa norte del golfo de México; MG: costa mexicana del golfo de México; MC: costa mexicana del Caribe; CA: Centroamérica; CO: Colombia; VEN: Venezuela + Guayanas; AH^: Antillas Holandesas + Trinidad-Tobago; BRA: Brasil; AMV: Antillas Menores + Islas Vírgenes; BH: Bahamas + Turks & Caicos; PR: Puerto Rico; ES: Española; JA: Jamaica + Islas Caimán; BER: Bermuda; CU: Cuba.
El escalado multidimensional no métrico corroboró la separación de Carolina del Norte + Carolina del Sur + Georgia de las demás zonas con todas las especies (Fig. 3a) y por Phylum (Fig. 3b-d). La similitud de las Chlorophyta (Fig. 3b) y las Ochrophyta (Fig. 3c) en las restantes zonas es mayor, con excepción de Brasil con menos del 60 % de similitud. Las Rhodophyta presentan menor grado de similitud entre las zonas, quedando más alejadas Bermudas, el Norte del golfo, Bahamas y Brasil de forma individual, mientras que Jamaica, la Española y Antillas Holandesas + Trinidad Tobago forman un solo grupo que se separa del resto (Fig. 3d).
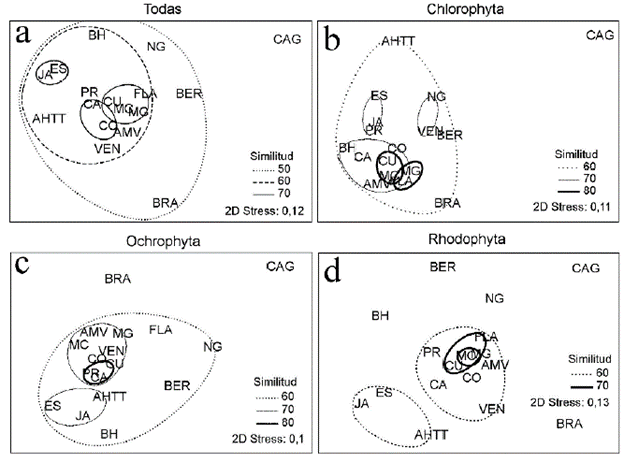
Figura 3 Escalado multidimensional no métrico con las zonas en que se dividió el Atlántico Occidental tropical y Subtropical con todas las especies de macroalgas y por phylum. Las distintas líneas muestran la similitud obtenida con el índice de Sorensen. CAG: Carolina del Norte + Carolina del Sur + Georgia; FLA: Florida; NG: costa norte del golfo de México; MG: costa mexicana del golfo de México; MC: costa mexicana del Caribe; CA: Centroamérica; CO: Colombia; VEN: Venezuela + Guayanas; AHTT: Antillas Holandesas + Trinidad-Tobago; BRA: Brasil; AMV: Antillas Menores + Islas Vírgenes; BH: Bahamas + Turks & Caicos; PR: Puerto Rico; ES: Española; JA: Jamaica + Islas Caimán; BER: Bermuda; CU: Cuba.
DISCUSIÓN
La acusada diferencia en el número de especies entre las zonas puede deberse a la variedad de ambientes en las zonas de mayor extensión, como las Antillas Mayores y las zonas continentales. Pero también pudiera indicar que no todos los inventarios tuvieron el mismo esfuerzo de mues-treo, como los casos de Jamaica, la Española y Antillas Holandesas + Trinidad Tobago, donde pudiera esperarse un mayor número de especies, fundamentalmente de Rhodo-phyta. Esto pudiera incidir en la alta semejanza entre estas zonas (Fig. 4) por la cantidad de ausencias comunes en la matriz de datos (Anexo 1 en material suplementario).
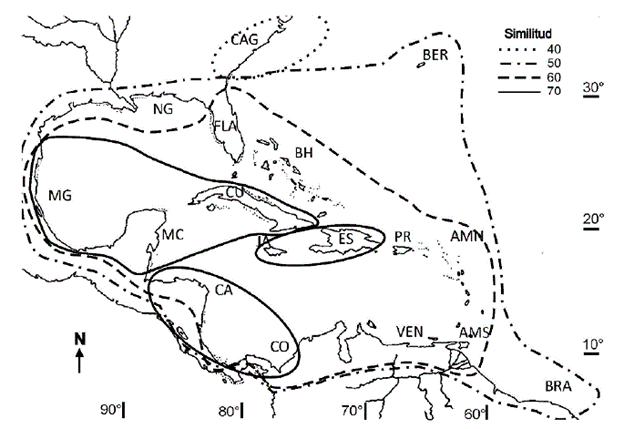
Figura 4 Representación geográfica de la similitud entre las zonas en que se dividió el Atlántico occidental tropical y subtropical con todas las especies de macroalgas marinas. CAG: Carolina del Norte + Carolina del Sur + Georgia; FLA: Florida; NG: costa norte del golfo de México; MG: costa mexicana del golfo de México; MC: costa mexicana del Caribe; CA: Centroamérica; CO: Colombia; VEN: Venezuela + Guayanas; AHTT: Antillas Holandesas + Trinidad-Tobago; BRA: Brasil; AMV: Antillas Menores + Islas Vírgenes; BH: Bahamas + Turks & Caicos; PR: Puerto Rico; ES: Española; JA: Jamaica + Islas Caimán; BER: Bermuda; CU: Cuba.
Los índices de similitud se emplean para identificar biorregiones y patrones de beta biodiversidad y se basan en los números de especies compartidas entre las localidades, pero no tienen en cuenta la proximidad espacial o ambiental. Esto puede deberse a muestreo insuficiente, a que sean especies con distribuciones limitadas, difíciles de observar, o difíciles de identificar, lo que conllevaría a falsas ausencias (Barbosa 2015). Por ello, se eligió el índice de Sorensen o Dice, que duplica la importancia de los atributos compartidos por lo que es útil para lograr comparaciones más efectivas entre colecciones ricas y pobres en condiciones de gran heterogeneidad de la matriz de datos cualitativos (Herrera 2000).
Otro problema es la correcta determinación de las especies. Los métodos de filogenia molecular están dando lugar a nuevas especies y combinaciones en muchos taxones. Como ejemplos tenemos el complejo Laurencia (i.e. Machín-S et al. 2014, Sentíes et al. 2015, Fujii et al. 2016), la especie conocida como Lobophora variegata (J.V. Lamouroux) que ha dado lugar a varias especies (Schultz et al. 2015) y lo mismo sucede con Hypnea musciformis (Wulfen) J.V. Lamouroux (Nauer et al. 2015). Otro caso es el de Centroceras clavulatum (C. Agardh) Montagne, cuya distribución está restringida al Océano Pacífico (Won et al. 2009) y son otras las especies que se encuentran en el Océano Atlántico (Barros-Barreto et al. 2006, Won et al. 2009, Ramos-Romero y Suárez 2016). Por estos problemas, sería necesario completar estos estudios que permitan unificar los criterios taxonómicos en la región, lo que disminuiría la cantidad de falsas ausencias.
A pesar de lo descrito anteriormente, se observó una similitud de más del 60 % de toda la zona tropical y la separación de la zona subtropical Carolina del Norte + Carolina del Sur + Georgia con menos del 40 % de similitud. Brasil, Bermudas y el Norte del golfo tienen una similitud del 50 % con las demás zonas tropicales (Fig. 4). Esta separación se hace más evidente en las Rhodophyta.
Los resultados del presente trabajo coinciden en general con lo planteado por Spalding et al. (2007), al obtener una mayor similitud entre las ecorregiones de la provincia Atlántico Noroccidental Tropical, aunque Bermuda queda un tanto separada del resto (Bahamas, el Mar Caribe, el sur del golfo de México y la Florida). Las dos ecorregiones que integran la provincia Atlántico Occidental Templado Cálido, de acuerdo con estos autores (Golfo de México y las Carolinas) aunque están más próximas según el MDS, poseen una similitud menor del 50 %. Para la costa de las Guayanas-Brasil; estos autores la separan en dos provincias, Plataforma Norte de Brasil y el Atlántico Suroccidental Tropical, pero en el presente trabajo se unieron los inventarios de Brasil, mientras que las Guayanas se unieron a Venezuela. Por otro lado, la ecorregión Virginia es colocada por Spalding et al. (2007) en la provincia Atlántico Occidental Templado Frío.
No obstante, Cuba que forma parte de la ecorregión denominada Antillas Mayores por estos autores, mostró una similitud de su ficoflora mayor al 70 % con algunas de las ecorregiones de la provincia del Atlántico Tropical Noroccidental, como son la Florida, el Sur del golfo de México, el Caribe Occidental y el Caribe Suroccidental. Esto ha de deberse a la ubicación de Cuba en el centro de la región analizada.
Al comparar los resultados con Suárez (1989) y Suárez et al. (2015), se evidencia, de modo general, que a medida que aumentan los inventarios, va cambiando el panorama de similitudes entre las distintas ecorregiones. Esto pudiera deberse al aumento de información sobre las especies de macroalgas en las diferentes zonas, pero también pudiera haber cambios en la ficoflora regional debido a la dispersión de diásporas dentro de una misma provincia fitogeográfica, gracias a la conectividad de las aguas oceánicas o por causas antrópicas como tráfico naval y acuarios.
También pudiera presentarse cambios en la composición ficoflorística de algunas zonas debido a los efectos del cambio climático (Díaz-Pulido et al. 2007). El alto número de taxones (516) que aparecen en una sola zona, pudiera deberse en parte a nombres de especies mal aplicados o a la segregación de nuevos taxones que aún no se han encontrado en otras zonas.
De acuerdo con los datos compilados, el Atlántico occidental tropical y subtropical tiene en general una alta similitud en la composición de macroalgas si se toma como límite el 50 % (Fig. 4), ya que este límite sólo excluye Carolina del Norte + Carolina del Sur + Georgia, considerada también por Spalding et al. (2007) como cálido templada; sin embargo la similitud del 60 % lo forma un núcleo central que incluye todo el Caribe, el sur del golfo de México y la Florida y profundizando en este dato, vemos que también queda fuera Brasil. Según el análisis que había hecho Suárez (1989) las características oceanográficas de la región muestran que la Corriente Ecuatorial en su paso por las Antillas Menores separa a Brasil del núcleo central mencionado y la zona de transición del sur, se debe a la disminución de la salinidad en la desembocadura del Orinoco, que actúa como una barrera a la dispersión; en el caso de las dos zonas de transición posibles en el norte se debe a la temperatura, ya que el paso de la Corriente del Golfo hacia el norte, después de pasar por el estrecho de la Florida, sigue llevando aguas de temperaturas cálidas y con ellas diásporas del fitobentos que pueden alejarse y llegar con estas aguas hasta Carolina del Norte y Bermudas y seguir hasta la costa atlántica europea, penetrando algunas en el Mediterráneo.














