INTRODUCCIÓN
Los ríos y arroyos de Latinoamérica y el Caribe albergan valiosos recursos acuáticos y suministran importantes servicios ecosistémicos para las poblaciones humanas (Ramírez et al. 2008). Los ríos de montaña contienen una gran diversidad de hábitats, los cuales se caracterizan por presentar perturbaciones y cambios temporales en los factores ambientales (Vitt et al. 1986) y pueden ser particularmente sensibles a las consecuencias del calentamiento global (McGregor et al. 1995). Por lo tanto, los organismos que allí se establecen deben presentar adaptaciones a un ambiente de alta energía y a fluctuaciones en la disponibilidad hídrica por cambios temporales en los niveles de humedad (Vitt et al. 1986).
A diferencia de las plantas acuáticas vasculares, los briófitos acuáticos son más resistentes a la desecación y a las corrientes fuertes (Fritz et al. 2009) tolerando bajos niveles de luz y temperatura (Stream Bryophyte Group 1999), siendo en muchas ocasiones, las plantas acuáticas más abundantes en los ríos de cabecera de tierras altas (Glime 1987) y los productores primarios más importantes en estos ecosistemas (Stream Bryophyte Group 1999, Strayer y Dudgeon 2010). Por otra parte, los briófitos influencian de manera importante las dinámicas de nutrientes de los ríos, contribuyen a la estabilización de los márgenes de los cursos de agua y a la colonización por parte de perifiton e invertebrados acuáticos, pues incrementan la heterogeneidad del hábitat (Suren 1996, Stream Bryophyte Group 1999, Strayer y Dudgeon 2010).
Vitt y Glime (1984) clasifican a los briófitos acuáticos a partir de dos gradientes ambientales principales; según la fluctuación en los niveles de agua, se denominan acuáticos obligados a los que se desarrollan en ambientes completamente sumergidos, y acuáticos facultativos a aquellos que, aunque se desarrollan en ambientes sumergidos, pueden soportar temporadas de sequía. Por otra parte, según la corriente del agua, y acogiendo los términos utilizados por Hustedt (1938), los briofitos se clasifican en limnófilos, o que se establecen en ecosistemas con aguas estancadas, y en reófilos, aquellos que crecen en aguas corrientes. van Stennis (1981, 1987) define a los reófilos como las especies que se establecen dentro de la columna de agua de hábitats ribereños, donde las plantas están influenciadas por inundaciones estacionales. Para establecerse en estos ecosistemas, los briófitos requieren importantes adaptaciones morfológicas y fisiológicas, que incluyen la tolerancia a largos periodos de inundación, el soporte del movimiento del agua a grandes velocidades y de varios niveles de desecación cuando la columna de agua se reduce en volumen (Shevock et al. 2017).
El establecimiento y distribución de los briófitos dentro de los ecosistemas acuáticos se ven influenciados por diversas variables, a escala macro, se encuentran variables como el clima y la altitud, que dictan a su vez el comportamiento de variables de mesoescala como el régimen hidrológico de la corriente y variables microescala como el tamaño del sustrato, la estabilidad del lecho, velocidad de la corriente y pendiente del arroyo (Suren 1996, Stream Bryophyte Group 1999). Según Luis et al. (2015), la riqueza y composición de briofitos acuáticos, están influenciadas por factores ambientales, como variables geomorfológicas, hidrológicas y fisicoquímicas, así como la temperatura del curso del agua. Slack y Glime (1985) describen la altitud como uno de los factores más fiables para evaluar la segregación de nichos en briófitos acuáticos.
En Suramérica son pocos los trabajos sobre briófitos reófilos, el estudio más reciente es el realizado por Vásquez et al. (2019) en Ecuador, en donde evalúan los cambios en la diversidad y su relación con los usos del suelo y los análisis físico-químicos para evaluar la calidad del agua; al igual que en los trabajos realizados en Colombia por Bolaños (2012) y Romero (2017). Los trabajos de Linares-C y Churchill (1997) y Lagos et al. (2008) se enfocan al estudio de la diversidad de las comunidades de briófitos reófilos. Para este trabajo se plantearon los siguientes interrogantes: ¿Cuál es la diversidad de briófitos acuáticos del río Teatinos? y ¿Cuál es la relación entre los factores ambientales de pH, conductividad, temperatura, profundidad, pendiente y ancho del cauce con la diversidad y estructura de los briófitos acuáticos en el gradiente altitudinal en que se encuentra el río?
MATERIALES Y MÉTODOS
Sitio de muestreo
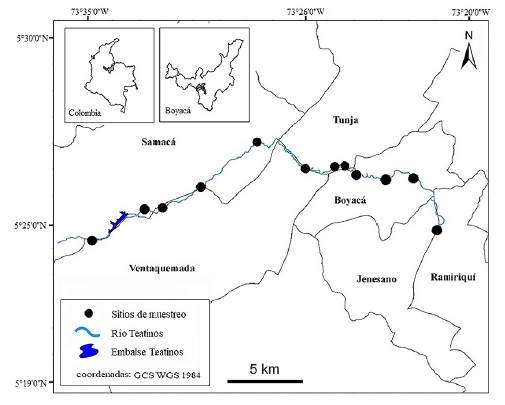
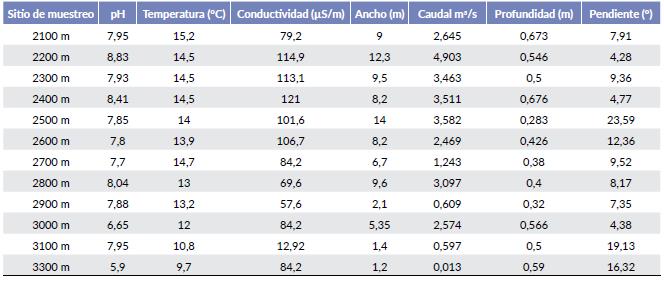
El estudio se realizó en el río Teatinos que es un afluente de alta montaña localizado en el departamento de Boyacá, hace parte de la cuenca alta del río Garagoa y de la cuenca del río Orinoco. Nace hacia el sector suroriental del municipio de Samacá en el alto del Santuario a 05°24'26'' Norte y 73°33'54'' Oeste, por la unión de las quebradas las Juntas y Yerbabuena en el páramo de Rabanal (Samacá) a los 3400 m. Pasa por los municipios de Ventaquemada, Tunja, Boyacá, Ramiriquí y desemboca en el río Jenesano a 05°24'50'' Norte y 073°21'7" Oeste sobre 2100 m. Tiene una longitud aproximada de 19,65 km. En su parte alta circula por ecosistemas de páramo. A los 3250 m forma el embalse de Teatinos que provee agua a la ciudad de Tunja, con una capacidad de ocho millones de m3 (Márquez y Suárez 2005) (Fig. 1). Después del embalse, la microcuenca se encuentra dentro de la formación vegetal denominada Bosque Altoandino (IAvH et al. 2008).
Muestreo de material vegetal
El muestreo se realizó cada 100 m de altitud, desde los 2100 hasta los 3300 m; comprendiendo desde la desembocadura en el río Jenesano hasta el nacimiento en el páramo de Rabanal para un total de doce sitios de muestreo. En cada sitio se ubicó una parcela de 1m por el ancho del cauce y se tomó el área de cobertura de cada briófito utilizando un acetato de 20 x 20 cm. Se calcó el contorno de cada una de las especies con un lápiz de cera. El área ocupada se obtuvo en cm2 a partir de los contornos mediante el programa ImageJ 1.50i (Rasband c2016).
Para la determinación del material recolectado se utilizaron las claves para musgos de Churchill y Linares (1995), para hepáticas, Bischler et al. (2005), Costa (2008), Gradstein (2016a, b) y para antocerotes, Gradstein (2018).
Factores ambientales
En cada sitio de muestreo se registró la conductividad del agua (µS/m) con un conductímetro HANNA modelo Hi 9835 y la temperatura (°C) y el valor de pH con un pH-metro HANNA modelo Hi 98129. Se midió la profundidad del río con una vara de dos metros previamente demarcada en centímetros según Dawson (2002) y el ancho utilizando un decámetro. La velocidad de la corriente se calculó registrando el tiempo en que una pelota de poliestireno expandido se demoró en recorrer una distancia de 1 m. Con los valores de la velocidad de la corriente, y el ancho y la profundidad del cauce se determinó el caudal en m3/s (Goyenola 2007). Se determinó la pendiente de cada sitio de muestreo a partir de un modelo de elevación digital Aster DEM (15 X 15 m) en ArcGis 10.5 (ESRI c2017).
Análisis de datos
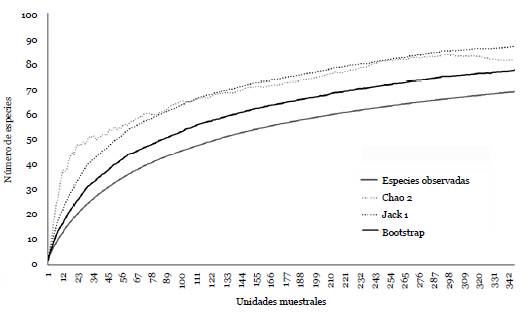
Para conocer la suficiencia del esfuerzo de muestreo se construyó una curva de acumulación de especies con los estimadores no paramétricos Jackknife 1, Chao 2 y Bootstrap (Moreno 2001, Villarreal et al. 2004). La diversidad alfa de cada sitio de muestreo se evaluó a partir de la estimación de la riqueza específica y de los índices de diversidad de Simpson, dominancia de Berger-Parker y equitatividad de Pielou (Magurran 1988, Moreno 2001, Villarreal et al. 2004). La relación entre las variables ambientales cuantificadas y la riqueza específica se analizaron con un Modelo Lineal Generalizado (GLM) con distribución de errores Poisson y función de vínculo logarítmica (Zuur et al. 2007, Guerra et al. 2020). Para la diversidad beta, se aplicó el índice de similitud de Jaccard y se utilizó el método Wards para generar el dendrograma correspondiente, mediante el software Past 3.08 (Hammer et al. 2001). Para analizar la relación entre la composición de briófitos y las variables ambientales se realizó un escalamiento multidimensional no métrico (NMDS) con la función metaMDS, utilizando la distancia Bray-Curtis para calcular la matriz de semejanza. Los valores de la abundancia relativa de especies y las variables ambientales se ajustaron a los primeros dos ejes de la ordenación NMDS. Los coeficientes de correlación (R2) y los valores de P se calcularon con la función envfit y 999 permutaciones; estos análisis fueron realizados con el paquete vegan (Oksanen et al. c2013) en el programa estadístico R (R Development Core Team c2011).
RESULTADOS Y DISCUSIÓN
Curva de acumulación de especies
Al comparar el número de especies observadas (70), con las generadas por los estimadores utilizados, se evidencian que el muestreo es significativo. Bootstrap estima la presencia de 77 especies, Chao 2 un total de 82 especies y Jackknife 1 un total de 87 (Fig. 2).
Diversidad alfa
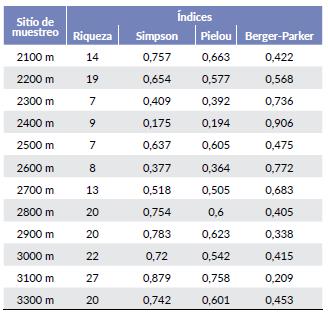
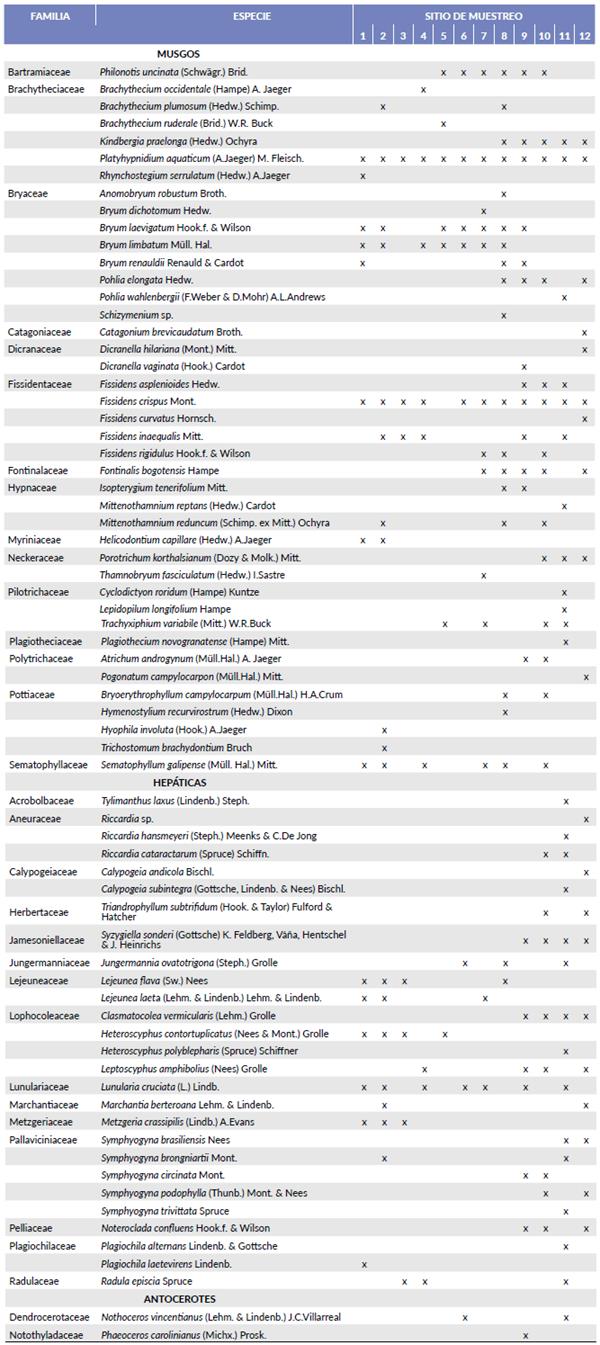
Se registraron 70 especies de briófitos para el área de estudio, pertenecientes a 49 géneros y 33 familias. Los musgos son el grupo más diverso con 41 especies, en 30 géneros y 16 familias, seguido de las hepáticas, con 27 especies en 17 géneros y 15 familias y antocerotes, con dos especies, pertenecientes a los géneros Nothoceros (Dendrocerotaceae) y Phaeoceros (Notothyladaceae) (Tabla 1). Esta investigación presenta el mayor número de especies registradas para briófitos acuáticos en Colombia con relación a los trabajos realizados por Griffin III (1978), Cleef (1981), Linares-C y Churchill (1997), Lagos et al. (2008), Bolaños (2012) y Romero (2017).
Tabla 1 Lista de familias y especies de briófitos acuáticos presentes en cada sitio de muestreo dentro del río Teatinos
La mayor riqueza se presentó a los 3100 m (27 especies) y a los 2300 y 2500 m se registraron los valores más bajos con siete especies cada uno. La mayor diversidad y equitatividad, según los índices de Simpson y Pielou respectivamente, se presenta a los 3100 m; mientras que, los menores valores de dichos índices fueron registrados a los 2400 m. Comportamiento que concuerda con lo reportado por Stream Bryophyte Group (1999), Demars y Thiébaut (2008) y Ah-Peng et al. (2012).
El sitio de muestreo ubicado a los 3100 m. se encuentra inmerso dentro del bosque, donde se generan condiciones de sombrío por flora nativa, no se evidencian actividades agrícolas en la ronda del río y se presenta una mayor distancia entre el río y los asentamientos urbanos y viviendas rurales, con respecto a los demás sitios muestreados, resultado que concuerda con los reportes de Allan y Castillo (2007), quienes indican que los puntos más altos del río presentan una menor intervención antrópica, que generalmente pueden modificar las dinámicas naturales del agua y el movimiento de sedimentos, afectando las comunidades acuáticas y ribereñas (Wohl 2016). Según Stream Bryophyte Group (1999) y Tessler et al. (2014) los briófitos reófilos prefieren ambientes oligotróficos, alto sombrío, bajas temperaturas y poca sedimentación.
La dominancia, medida a partir del índice de Berger-Parker, reporta su mayor valor a 2400 m y el valor más bajo a 3100 m (Tabla 2). Resultado que se relaciona con las condiciones de bajas altitudes pues ellas permiten el establecimiento de unas pocas especies, haciendo que las más tolerantes alcancen grandes coberturas. En las partes altas del río, las condiciones son propicias para que se establezca una mayor cantidad de especies disminuyendo la dominancia. La especie Platyhypnidium aquaticum (A.Jaeger) M.Fleisch., es un ejemplo de esta situación, pues es dominante en las partes bajas del río, pero disminuye su cobertura en las partes más altas.
Diversidad beta
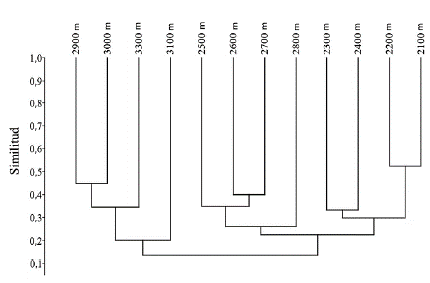
El índice de Jaccard revela una baja similitud entre los sitios de muestreo (<0,5) y muestra una clara organización en dos grupos separados altitudinalmente. El primero entre los 2900 y los 3300 m y el segundo entre los 2100 y los 2800 m (Fig. 3). La agrupación de mayor altitud se define por la presencia de las especies Syzygiella sonderi (Gottsche) K. Feldberg, Váña, Hentschel & J. Heinrichs y Clasmatocolea vermicularis (Lehm.) Grolle. En este grupo, los sitios ubicados a los 2900 y 3000 m. muestran el mayor valor de similitud (0,44). El segundo grupo está definido por la presencia de la especie Bryum limbatum Müll. Hal. y está configurado a su vez por dos agrupaciones, dadas por los sitios que se encuentran entre los 2500 y los 2800 m y entre los 2100 y 2400 m, soportadas por las especies Lejeunea flava (Sw.) Nees, Heteroscyphus contortuplicatus (Nees & Mont.) Grolle y Metzgeria crassipilis (Lindb.) A.Evans.
Relación entre los factores ambientales y la riqueza
Como es de esperarse, la temperatura del agua, el caudal y el ancho del río son menores a mayores altitudes (Tabla 3). La conductividad sigue esta misma tendencia, mientras que el pH, la profundidad y la pendiente, varían independientemente de la altitud (Tabla 3).
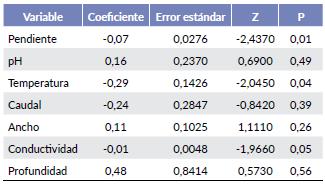
El Modelo Lineal Generalizado (GLM) evidencia una correlación negativa entre la riqueza específica y la conductividad, la temperatura y la pendiente del río (Tabla 4). En estudios como los de Arts (1990), Ceschin et al. (2012) y Gecheva et al. (2013), se ha reportado que las especies de briofitos prefieren colonizar aquellos tramos que presentan bajos niveles de conductividad, los cuales por lo general se presentan en ambientes poco perturbados (Luis et al. 2015) y que muchas veces se encuentran en las partes altas de los ríos (Suren 1996). Dicha relación sugiere que la distribución de las especies de briófitos dentro del río Teatinos se presenta a partir de un gradiente de contaminación que se hace evidente por la presencia de sales minerales disueltas que aumentan la conductividad eléctrica del agua; condición que deberá ser comprobada a partir de un estudio enfocado en la medición de la calidad del agua. La temperatura se correlaciona de manera inversa con la riqueza debido a que la baja temperatura del agua favorece la fotorespiración de los briófitos (Dilks y Proctor 1975, Glime y Acton 1979), los cuales presentan valores óptimos de temperatura menores que los briófitos terrestres (Glime y Vitt 1984). En relación a la pendiente, la presencia de un mayor número de especies en partes del río con menor declive puede estar relacionada con la robustez estructural de las especies, pues según Martínez y Núñez (1991), las especies más delicadas pueden evitar establecerse en sustratos muy inclinados, donde recibirían un embate más fuerte del agua. Esta condición genera abrasión en los tejidos de los briófitos, pérdida de biomasa y de órganos reproductivos generada por las corrientes demasiado fuertes; situación que condiciona la supervivencia de las especies a la capacidad de formar tejidos nuevos de manera rápida y de su reproducción de manera asexual (Lewis 1973a, b, Stream Bryophyte Group 1999).
Relación entre los factores ambientales y la composición de las especies
El NMDS establece dos grupos claramente diferenciados: el primero, entre los 2100 y los 2700 m y el segundo, entre los 2800 y los 3100 (Fig. 4), en concordancia con el índice de Jaccard. Donde la temperatura es la variable que explica los mayores cambios en la composición de especies con un 83 % de varianza entre los sitios de muestreo, seguida del ancho del río con el 73 % (Tabla 5). Según Martínez y Núñez (1991), el intervalo térmico de las especies determina la distribución geográfica de los briófitos acuáticos, por la correlación que presenta la temperatura con la altitud. Correlación también existente con el ancho del río, el cual aumenta a medida que la altitud disminuye, por la llegada de diversos afluentes que aumentan el cauce. En el río teatinos la composición de especies de los sitios entre los 2100 y los 2700 m se ven influenciadas por una alta temperatura y un mayor ancho del río. Donde se establecen especies como Bryum limbatum, Lejeuneaflava, Lejeunea laeta (Lehm. & Lindenb.) Lehm. & Lindenb y Heteroscyphus contortuplicatus. Mientras que las especies presentes en los sitios ubicados entre los 2800 y los 3100 m están relacionadas con una menor temperatura y un menor ancho del cauce. Este intervalo altitudinal alberga especies como Clasmatocolea vermicularis, Kindbergiapraelonga (Hedw.) Ochyra, Noteroclada confluens Hook.f. & Wilson, Porotrichum korthalsianum (Dozy & Molk.) Mitt, Pohlia elongata Hedw., Symphyogyna brasiliensis Nees, Symphyogyna podophylla (Thunb.) Mont. & Nees y Triandrophyllum subtrifidum (Hook. & Taylor) Fulford & Hatcher
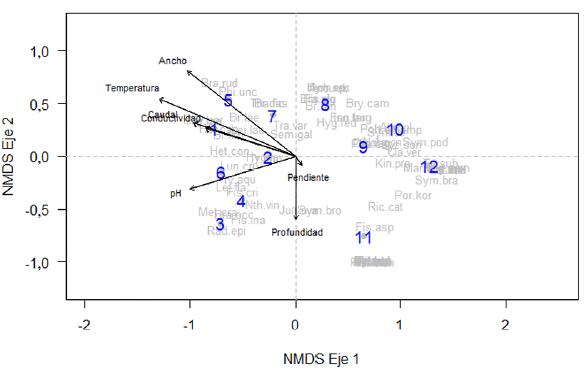
Figura 4 Análisis de escalamiento multidimensional (NMDS) entre las variables ambientales y la composición de especies de briófitos acuáticos del río Teatinos. Los números corresponden a las estaciones de muestreo y las especies son indicadas mediante sus nombres abreviados.
Tabla 5 Correlaciones entre las variables ambientales y los dos primeros ejes ajustados del NMDS, aplicado a las comunidades de briófitos acuáticos del río Teatinos.
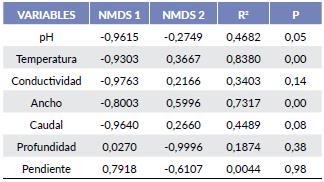
Comparando la composición de especies en cada sitio de muestreo y los valores de cada factor ambiental, se observa que el pH presenta una relación directa con la especie Lejeunea flava, la cual se considera como basófila al encontrarse en aguas alcalinas (con pH de 7,7 a 8,83) y una relación negativa con las especies Symphyogyna podophylla y Triandrophyllum subtrifidum, consideradas especies acidófilas al establecerse en aguas ácidas (con pH de 5,9 a 6,65). La especie Philonotis uncinata (Schwagr.) Brid muestra mayor presencia en sitios con mayor profundidad y la especie Sematophyllum galipense (Müll. Hal.) Mitt. en sitios con menor inclinación. La especie Platyhypnidium aquaticum se establece en sitios con altos niveles de conductividad, mientas que Fissidens asplenioides Hedw y Kindbergia praelonga abundan ambientes con bajos contenidos minerales. Las especies Clasmatocolea vermicularis, Kindbergia praelonga, Porotrichum korthalsianum, Symphyogyna brasiliensis y Syzygiella sonderi se encontraron en aguas con caudales bajos y Heteroscyphus contortuplicatus se registró en sitios con caudales fuertes.
Se concluye que la comunidad de briófitos acuáticos del río Teatinos se compone de dos grupos principales, ordenados de manera altitudinal, donde la riqueza y diversidad aumentan de manera gradual con el incremento en la elevación. La temperatura del agua y el ancho del cauce son las variables más importantes en la distribución de las especies. Además de relacionarse con estos dos factores, la riqueza se relaciona con la conductividad, variable que se modifica por la presencia de sales minerales. Relación que sugiere que la riqueza de briófitos acuáticos puede estar afectada por la contaminación del agua del río.