INTRODUCCIÓN
La familia Aphididae contiene 5291 especies aproximadamente (Favret c2020). De acuerdo con varios investigadores principalmente colombianos (Gallego 1967, Bustillo 1976, Bustillo y Sánchez 1977, Smith y Cermeli 1979, Bustillo y Posada 1986, Posada 1989, Madrigal 2003, David Giraldo et al. 2009, Kondo y Simbaqueba 2014, Rodas et al. 2015, Simbaqueba et al. 2015, 2016) se conocen 55 especies para Colombia. Las primeras listas de áfidos de Colombia indican la presencia de 65 especies (Gallego 1967, Posada 1989). Por su parte, Bustillo y Sánchez (1977) llevaron a cabo el primer estudio mayor sobre el reconocimiento de la diversidad de los áfidos que afectan los cultivos de importancia económica en el país, reportando 49 especies, recolectadas sobre 112 especies vegetales en 74 municipios de 17 departamentos. En el mismo trabajo, se rectifican varias identificaciones, se aclaran sinonimias, se generan herramientas taxonómicas para la identificación de las especies y se presenta el listado de las plantas hospedantes. En dicho estudio, se hace énfasis en negar para el país la presencia de nueve especies - entre ellas Aphis pomi De Geer, 1173 - al no encontrar ningún espécimen en las colecciones de los museos entomológicos, ni en el campo. Simbaqueba et al. (2014) ofrecen diagnosis e ilustraciones para 15 especies comunes en Colombia: Aphis nerii Boyer de Fonscolombe, 1841; A. gossypii Glover, 1877; A. craccivora Koch, 1854; Brevicoryne brassicae (Linnaeus, 1758); Greenidea ficicola Takahashi, 1921; Macrosiphum euphorbiae (Tomas, 1878); Myzus ornatus Laing, 1932; M. persicae (Sulzer, 1776); Toxoptera aurantii Boyer de Fonscolombe, 1841; T. citricidus (Kirkaldy, 1907); Rhopalosiphum padi (Linnaeus, 1758); Tuberolachnus salignus (J. F. Gmelin, 1790); Cerataphis brasiliensis (Hempel, 1901); C. orchidearum (Westwood, 1879) y Siphaflava (Forbes, 1885).
En el país los problemas de virosis transmitidas por áfidos a las plantas cultivadas son relevantes para la agricultura. Uno de los casos más importantes es la transmisión del virus de "la tristeza de los cítricos" (Citrus tristeza virus -CTV); además de otros virus en cultivos como caña de azúcar, papa, fríjol, maíz, cebada y algodón (Bustillo y Sánchez 1977). Para Colombia, se han reportado 28 especies de áfidos transmisoras de más de 100 virus fitopatógenos (Bustillo y Sánchez 1977). Más aún, los problemas económicos causados por áfidos a los cultivos se favorecen por las relaciones mutualistas que establecen con hormigas, abejas y avispas, gracias a sus deyecciones azucaradas como el rocío de miel (Simbaqueba et al. 2014, Serna et al. 2019).
Desde el estudio de Bustillo y Sánchez (1977), no se conoce otro trabajo a gran escala sobre la identificación de áfidos para Colombia. Además, se desconoce el destino de la colección que sirvió como base para dicho estudio, lo cual dificulta los trabajos de corroboración de identificaciones y los estudios taxonómicos posteriores. Estudios más recientes se centran en los primeros registros para el país; entre estos, los de Bustillo y Posada (1986) reportan el áfido del helecho Idiopterus nephrelepidis Davis, 1909; Madrigal (2003) lista nueve especies de áfidos como plaga en árboles de importancia forestal; David Giraldo et al. (2009) señalan la presencia de Greenidea ficicola en guayabo (Psidium guajava L.); Kondo y Simbaqueba (2014) registran el áfido asiático Sarucallis kahawaluokalani (Kirkaldy, 1907) sobre plantas de Lagerstroemia indica L. (Lythraceae); Rodas et al. (2015) reportan a Pineus boerneri Annand, 1928 hallado en plantaciones forestales; Simbaqueba et al. (2015) documentan el áfido "formador de agallas" Tetraneura fusiformis Matsumura, 1899 asociado a Linepithema angulatum (Emery, 1894) (Hymenoptera: Formicidae); y Simbaqueba et al. (2016) reportan el áfido del bambú Takecallis taiwana (Takahashi, 1926) y Ta. arundinariae (Essig, 1917).
El objetivo del presente estudio fue actualizar el conocimiento de los áfidos de Colombia, superando el número de especies registradas en Simbaqueba et al. (2014). Para estas especies se incluyen las diagnosis con base en su anatomía externa, las ilustraciones, y una clave ilustrada para el reconocimiento de la mayoría de los áfidos asociados agroecosistemas. Así mismo, se presenta su distribución geográfica y un listado de sus plantas hospedantes.
MATERIALES Y MÉTODOS
Para la curaduría de los áfidos, se siguieron los protocolos establecidos en Simbaqueba et al. (2014). Los especímenes estudiados fueron recolectados en 38 municipios en nueve departamentos de Colombia a saber: Antioquia, Boyacá, Caldas, Caquetá, Cundinamarca, Norte de Santander, Archipiélago de San Andrés, Providencia y Santa Catalina, Tolima y Valle del Cauca. Los especímenes estudiados se encuentran depositados en la Colección Taxonómica Central (CTC) del Museo entomológico Universidad Nacional Agronomía Bogotá (UNAB), de la Facultad de Ciencias Agrarias de la Universidad Nacional de Colombía, Sede Bogotá (Tabla 1); con algunos duplicados en la Colección Taxonómica Nacional de insectos Luís María Murillo (CTNI), ubicada en el Centro de Investigación Tibaitatá de AGROSAVIA (Mosquera, Cundinamarca) y en el Museo entomológico Francisco Luis Gallego (MEFLG) de la Universidad Nacional de Colombia, Facultad de Ciencias, sede Medellín.
Tabla 1 Especies de áfidos que cuentan con curaduría en el museo entomológico UNAB y su probable región biogeográfica de procedencia. Et: Etiópica. Ho: Holártica. Na: Neártica. Nt: Neotrópica. Or: Oriental o Asiática. Pa: Paleártica. Pt: Pantrópica. --: Desconocida (Cermeli 2006).
| Especies | No. de figura | No. Catálogo UNAB | Hospedante | Pos. Origen |
|---|---|---|---|---|
| Aphis aurantii Boyer de Fonscolombe, 1841 | -- | 579, 3113, 3562, 3564, 3565 | Vismia cayennensis (Jacq.) Pers., Annona muricata L., Citrus sp., Theobroma cacao L., Vigna unguiculata (L.) Walp., Coffea arabica L., Citrus aurantium L., Citrus reticulata Blanco, Manihot esculenta Crantz | Or |
| Aphis citricidus (Kirkaldy, 1907) | -- | 3563,576, 577, 578, 3431, 3432, 3566 | Citrus sp., Citrus aurantium L., Citrus reticulata Blanco | Or |
| Aphis craccivora Koch, 1854 | -- | 3684, 3685 | Vitis sp, Mimosa pudica L., Ulex sp. | Pa? |
| Aphis gossypii Glover, 1877 | -- | 3686 | Solanum betaceum cav., Cestrum nocturnum L., Hibiscus grandiflorus Michx Lafoensia acuminata (Ruiz & Pav.) DC. | Pa |
| Aphis nerii Boyer de Fonscolombe, 1841 | -- | 3567 | Nerium oleander L. | -- |
| Aphis spiraecola Patch, 1914 | 1 | 600 | Citrus aurantium L., Lafoensia acuminata (Ruiz & Pav.) DC. | Or? |
| Brevicoryne brassicae (Linnaeus, 1758) | -- | 3466, 3467 | Brassica oleraceae L., Brassica rapa L., Lactuca sativa L. | Pa |
| Carolinaia cyperiAinslie, 1915 | 2 | 492 | Cyperus sp. | Na |
| Cerataphis brasiliensis (Hempel, 1901) | -- | 1482, 3572 | Cocos nucifera L. | Or |
| Cerataphis orchidearum (Westwood, 1879) | -- | 3573 3574 | Anguloa sp. | Or |
| Cinara cupressi (Buckton, 1881) | 3 | 1484, 816 | Cupressus lusitanica Mill | -- |
| Dysaphis apiifolia (Theobald, 1923) | 4 | 493 | Arracacia xanthorrhiza Bancr. | Pa? |
| Eriosoma lanigerum (Hausmann, 1802) | 5 | 702 | Malus sp. | Na |
| Greenidea ficicola Takahashi, 1921 | -- | 3544, 3545 | Ficus benjamina L., Psidium guajava L. | Or |
| Hyperomyzus lactucae (Linnaeus, 1758) | 6 | 602 | Sonchus oleraceus L. | Pa |
| Macrosiphum euphorbiae (Tomas, 1878) | -- | 2588, 2589, 3643, 3644, | Rosa sp., Hortensia sp., Tecoma stans (L.) Kunth,, Cupressus lusitanica Mill, Hibiscus grandiflorus Michx, Physalis peruviana L. | Na |
| Macrosiphum rosae (Linnaeus, 1758) | 7 | 809, 811, 2592, 2593 604 | Rosa sp., Abutilon pictum (Gillies ex Hook. & Arn.) Walp., Trifolium repens L., Solidago sp. | Pa |
| Microparsus brasiliensis (Moreira, 1925) | 8 | 494 | Phaseolus vulgaris L. | Nt |
| Myzus ornatus Laing, 1932 | -- | 3659, 3660 | Citrus sp.,Tecoma stans (L.) Kunth | -- |
| Myzus persicae (Sulzer, 1776) | -- | 491, 580, 2590, 3500 | Sesamum indicum L., Malva sp., Solanum betaceum Cav., Antirrhinum majus L., Solanum tuberosum L. | Or |
| Neotoxoptera formosana (Takahashi, 1921) | 9 | 3580 | Allium fistulosum L. | Or? |
| Pentalonia nigronervosa Coquerel, 1859 | 10 | 629 | Musa sp. | -- |
| Rhopalosiphoninus latysiphon (Davidson 1912) | 11 | 1481 | Solanum tuberosum L. | -- |
| Rhopalosiphum maidis (Fitch, 1856) | -- | 628, 4466 | Zea mays L. | Or? |
| Rhopalosiphum padi (Linnaeus, 1758) | -- | 3498, 3499 | Zea mays L. | Pa |
| Rhopalosiphum rufiabdominale (Sasaki, 1899) | 12 | 599 | Solanum tuberosum L. | Or |
| Sarucallis kahawaluokalani (Kyrkaldy, 1907) | 13 | 813 | Lagerstroemia indica L. | Or |
| Sipha flava (Forbes, 1885) | -- | 592 | Pennisetum clandestinum Hochst. ex Chiov., Pennisetum purpureum Schumach. x Paspalum macrophylum Kunth | Na |
| Takecallis arundinariae (Essig, 1917) | 14 | 885 | Phyllostachys sp. | Or |
| Takecallis taiwana (Takahashi, 1926) | 15 | 884 | Phyllostachys sp. | Or |
| Tetraneura fusiformis Matsumura, 1917 | -- | 701 | Melinis minutiflora P.Beauv., Panicum sp. | Or |
| Tetraneura nigriabdominalis (Sasaki, 1899) | -- | 1483 815 | Trifolium repens L. | Or |
| Tuberolachnus salignus (J. F. Gmelin, 1790) | -- | 575, 3546 | Salix babylonica L. | Ho |
| Uroleucon ambrosiae (Thomas, 1878) | 16 | 3687 | Tithonia diversifolia (Hemsl.) A. Gray | Na |
| Uroleucon sonchi (Linnaeus, 1767) | 17 | 601 | Sonchus oleraceus L. | Pa |
| NUEVOS REGISTROS PARA COLOMBIA | ||||
| Greenidea psidii van der Goot, 1917 | 18 | 1486, 818 | Citrus reticulata Blanco, Callistemon citrinus (Curtis) Skeels | Or |
| Eulachnus rileyi (Williams, 1911) | 19 | 934 | Pinus radiata D.Don | Pa |
| Neomyzus circumflexus (Buckton, 1876) | 20 | 1480 | Physalis peruviana L. | Or |
| Myzus ascalonicusDoncaster, 1946 | 21 | 812 | Allium fistulosum L. | -- |
| Illinoia morrisoni (Swain, 1918) | 22 | 1485 817 | Cupressus lusitanica Mill | Na |
| Ovatus crataegarius (Walker, 1850) | 23 | 4159 | Mentha spicata L. | Pa |
| Wahlgreniella nervata (Gillette, 1908) | -- | 3567 | Rosa sp. | Na |
Empleamos algunos términos morfológicos seguidos -entre paréntesis y comillas- del término en su uso común, el cual consideramos menos informativo y sugerimos evitar; ejemplo: filamento ("proceso") terminal. Para un mejor uso de la clave, en varios de sus pasos se recomienda examinar figuras de Simbaqueba et al. (2014).
Las claves y diagnosis desarrolladas en este trabajo se basan en las siguientes publicaciones: Ainslie (1915), Doncaster (1946), Higuchi (1968), Ortiz (1973), Holman (1974), Bustillo y Sánchez (1977), Blackman y Eastop (1994, 2000, 2006), Nieto Nafría et al. (2002), Halbert (2004), García Prieto y Nieto Nafría (2005), Pérez Hidalgo y Mier Durante (2005), Lazzari et al. (2006), Mier Durante et al. (2010), Yovkova y Petrovic-Obradovic (2011), Cermeli et al. (2012), Joshi et al. (2014), Kondo y Simbaqueba (2014), Kanturski et al. (2017).
RESULTADOS
Se incluyen nuevos registros de especies para el norte de Sudamérica -por lo común, aquellas regiones al norte del río Amazonas hasta el norte de Colombia-, una clave taxonómica para la identificación de 42 especies de áfidos, la diagnosis de 27 especies y un registro de 51 especies vegetales hospedantes.
Para el norte de Sudamérica se registra por primera vez la especie Eulachnus rileyi (Williams, 1911), la cual se conoce para Argentina (Delfino y Binazzi 2002, Ortego et al. 2004), y para Colombia, se registran por primera vez siete especies (Tabla 1).
Clave para las especies de áfidos (Hemiptera: Aphididae) de Colombia.
Las claves para identificación de áfidos parten usualmente de la relación con las plantas hospedantes, ya sean grupos de cultivos, especies vegetales, o familias vegetales (Blackman y Eastop 2006). En el presente estudio, se propone una clave de identificación sin referencia inicial a sus hospedantes. En general, esta clave es válida para áfidos ápteros. Algunos áfidos alados se indican en la alternativa respectiva.
Esta clave permite identificar 42 especies pertenecientes a 27 géneros (Tabla 1), donde se incluyen también aquellas de Simbaqueba et al. (2014). Con el fin de obtener una clara verificación de las estructuras anatómicas solicitadas en la clave o en las diagnosis, se sugiere observar los especímenes en un microscopio de contraste de fases, con luz blanca. Si los especímenes se montan sólo con interés diagnóstico, para usar la clave se sugiere hacer un aclarado del espécimen con KOH al 10 % y su montaje temporal con glicerina, en una lámina portaobjetos excavada.
El segmento apical de la antena (antenómero V o VI, según la especie) se compone de dos tramos: uno proximal (=proximidad) más grueso, y otro distal, más delgado, que se llama filamento ("proceso") terminal (Fig. 3 en Simbaqueba et al. 2014). En caso de no hallar la cantidad de setas indicadas, posiblemente estén rotas; en esta situación, se debe buscar y contar cada tormo (sitio o espacio donde la seta estuvo).
1. Sifúnculo poriforme (Fig. 15d, 19d en Simbaqueba et al. 2014) o en forma de cono bajo (Fig. 3e); cauda en forma de verruga (Fig. 8a y 8b en Simbaqueba et al. 2014), vesícula, o semicírculo.................................................2
1'. Sifúnculos cilíndricos (Fig. 18d), subcilíndricos o cónicos (Fig. 16d); cauda digitiforme, triangular (Fig. 8c y 8d en Simbaqueba et al. 2014), lanceolada, o semicircular ......................................................................................12
2. Sifúnculo fuertemente pigmentado (Fig. 3e); o sin pigmentación y poriforme (Fig. 19d); cabeza, tórax y abdomen recubiertos por setas delgadas (Fig. 19a); placa anal redondeada (Fig. 3g); cauda semicircular (Fig. 3h).........................................................................3
2'. Sifúnculo debilmente pigmentado (Fig. 5d); tórax y abdomen con setas filiformes o gruesas (Fig. 23a en Simbaqueba et al. 2014); placa anal redondeada o bilobulada (Fig. 15e); cauda en forma de verruga, vesícula (Fig. 18e) o semicircular..................................................5
3. Cuerpo alargado (Fig. 19a); rostro extendido hasta coxas medias; setas abdominales sobre escleritos redondeados y pequeños, organizados en filas transversales (Fig. 19e).................................................................... Eulachnus rileyi (Fig. 19)
3'. Cuerpo piriforme; rostro extendido más allá de las coxas posteriores (Fig. 3a); setas entre el mesión y el borde lateral no necesariamente en escleritos.........................................................................4
4. Abdomen con prominencia dorsomedial espiniforme (Fig. 18c en Simbaqueba et al. 2014) (en caso de estar roto podrá verse como una prominencia con forma irregular), casi a la altura de los sifúnculos. Generalmente en Salix spp. . . Tuberolachnus salignus (Fig.18 en Simbaqueba et al. 2014)
4'. Abdomen carente de prominencia dorsomedial espiniforme. En coníferas............................Cinara cupressi (Fig. 3)
5. Cuerpo ovalado (Fig. 5a) (Fig. 19a en Simbaqueba et al. 2014); glándulas ceríferas o cerarios presentes a lo largo del cuerpo (Fig. 5d), o en su margen (Fig. 19a en Simbaqueba et al. 2014); formas ápteras con ojo reducido al triommatidio (Fig. 5c); formas aladas con ojos compuestos...........................................................................6
5'. Cuerpo oblongo; cerarios ausentes; formas ápteras y aladas con ojos compuestos............................................9
6. Deprimido (en vivo); con cerarios marginales unicamente; prominencias ("procesos") frontales pareadas, corniformes (Fig. 19a en Simbaqueba et al. 2014), sifúnculo poriforme; cauda en forma de verruga;......................................................Cerataphis 7
6' Piriforme, globoso; con cerarios distribuidos dorsalmente; sin prominencias ("procesos") frontales pareadas, sifúnculo poriforme o cono bajo; cauda semicircular...................................................................8
7. Dos setas frontales gruesas, cortas, en forma de lanza, o incrasada (gruesa) (ver en 20x o más); sifúnculo de alados rodeado por un pequeño anillo esclerosado................................Cerataphis brasiliensis (Fig. 19 en Simbaqueba et al. 2014)
7'. Setas frontales filiformes; prominencia ("proceso") frontal (cuerno) más corto que segundo tarsómero de pata posterior; sifúnculo de alados no rodeado por un pequeño anillo esclerosado... Cerataphis orchidearum (Fig. 20 en Simbaqueba et al. 2014)
8. Antena con seis segmentos (Fig. 5b); filamento terminal la mitad o casi la mitad de la longitud del tramo proximal ("base"); dorso corporal con cerarios distribuidos en cuatro hileras; tarso de dos tarsómeros; sifúnculo poriforme, con reborde anterior bien definido (Fig. 5d); placa genital y anal sin apertura evidente... Eriosoma lanigerum (Fig. 5)
8'. Antena con cuatro a cinco segmentos; filamento terminal casi de la misma longitud del tramo proximal; dorso corporal sin cerarios, en caso de presentarse, son pocos y pequeños, distribuidos irregularmente; tarsos de un tarsómero; sifúnculo en forma de cono bajo; placa genital y anal con apertura evidente............ Tetraneura fusiformis
9. Antena de cinco segmentos; dorso torácico y abdominal con setas largas y gruesas; tubérculos abdominales ausentes; segmento apical del rostro aproximadamente 0,5 de la longitud del segmento II del metatarso; placa anal redondeada..............................Sipha flava (Fig. 23 en Simbaqueba et al. 2014)
9'. Antenas de seis segmentos; dorso torácico y abdominal, si recubierto por setas, no gruesas; tubérculos abdominales presentes; placa anal bilobulada (Fig. 15e) .....................................................................................10
10. Cuerpo oblongo (Fig. 15a); clípeo con prominencia en forma de naso (Fig. 15c) (no confundir con el ocelo medio, ver montaje lateral); tergo abdominal II con tubérculo mesial no bífido. Alas anteriores pigmentadas tenuemente en el área Costal o sin pigmentación.......................... Takecallis 11
10'. Cuerpo piriforme (Fig. 13a); clípeo carente de prominencias; tergo abdominal II con tubérculo mesial bífido grande (Fig. 13d). Alas anteriores con áreas pigmentadas (Fig.13a)................... Sarucallis kahawaluokalani (Fig. 13)
11. Cabeza con un área mesial pigmentada en forma de banda (Fig. 14c). Abdomen con doble hilera de tubérculos dorsomesiales, pigmentados (Fig. 14d) ..................... Takecallis arundinariae (Fig. 14)
11'. Cabeza sin área mesial pigmentada en forma de banda (Fig. 15c). Prominencias tuberculares dorso-mediales de segmentos abdominales I y II más grandes que en otros segmentos y sin pigmentación......................................................................... Takecallis taiwana (Fig. 15)
12. Sifúnculo 0,66 o más que la longitud del cuerpo; con setas largas y gruesas (Fig. 18d); cauda semicircular y con una prominencia papiliforme (Fig. 18e) ............................................................................. Greenidea 13
12'. Sifúnculo menos de 0,6 la longitud del cuerpo; carente de cualquier tipo de setas; cauda no como la alternativa anterior.....................................14
13. Formas ápteras con sifúnculo reticulado; alados con antenómero III con 17 a 21 rinarios secundarios, dispuestos en forma lineal a lo largo del segmento, sin aglomerarse o tocarse entre sí (Fig. 11c en Simbaqueba et al. 2014).........................................Greenidea ficicola (Fig. 11 en Simbaqueba et al. 2014)
13'. Formas ápteras con sifúnculo reticulado sólo basalmente y con espículas distribuidas irregularmente; alados con antenómero III con 20 a 31 rinarios secundarios y algunos de estos aglomerados en una porción proximal, dispuestos irregularmente y no en línea recta (Fig. 18b) .......................Greenidea psiidi (Fig.18)
14. Distancia entre espiráculos abdominales I y II amplia (mínimo la mitad o la misma distancia que entre espiráculos abdominales II y III) (nota: ubicar el espiráculo I por lo general lateral a la coxa posterior); tubérculos protorácicos laterales ("tubérculos marginales") presentes; papilas abdominales laterales ("tubérculos marginales") I y VII presentes (nota: se pueden presentar papilas laterales en los segmentos abdominales II a VI, pero siempre más pequeñas que en segmentos I y VII) (Fig. 6b en Simbaqueba et al. 2014). Cabeza sin ornamentaciones como espículas, corrugaciones, asperitos o microtriquias; antena más corta que el cuerpo .............tribu Aphidini 15
14'. Distancia entre espiráculos abdominales I y II muy corta (menos de la mitad de la distancia entre los espiráculos abdominales II y III); tubérculos protorácicos laterales y papilas abdominales laterales I y VII ausentes (de presentarse son de menor tamaño que aquellos de los segmentos abdominales II a VI) (Fig. 6a en Simbaqueba et al. 2014). Cabeza con ornamentación variada como espículas, corrugación, asperitos o microtriquias; antena generalmente más larga que el cuerpo........................................tribu Macrosiphini 23
15. Sifúnculo casi cilíndrico, ligeramente ensanchado distalmente y con constricción subapical bien definida formando reborde (Fig. 12c); dorso de tórax y abdomen con un patrón reticulado de pequeñas espículas arregladas en polígonos, y la mayoría de los polígonos encierran pequeñas espículas similares.................................................................................16
15'. Sifúnculo gradualmente adelgazado hacia el ápice, sin constricción subapical y usualmente con reborde pequeño y moderado (Fig. 1d); dorso liso, rugoso, reticulado, pero si presenta espículas, nunca localizadas en polígonos....................18
16. Cuerpo alargado. Sifúnculo 0,07 a 0,08 del largo del cuerpo, cónico, con ligera constricción subapical y pequeño reborde; filamento terminal 1,8 a 2,5 veces la longitud del tramo próximal.....Rhopalosiphum maidis
16'. Cuerpo ovalado. Sifúnculo 0,08 a 0,20 del largo del cuerpo, casi cilíndrico, subapicalmente constreñido, formando reborde apical notable; filamento terminal 2,5 a 5,6 veces la longitud del tramo proximal ........17
17. Antenas de 0,4 a 0,5 de la longitud del cuerpo; sifúnculo 0,11 a 0,15 de la longitud del cuerpo; cauda 0,40 a 0,60 de la longitud del sifúnculo, con cuatro (rara vez cinco) setas.............Rhopalosiphum rufiabdominale (Fig. 12)
17'. Antena de 0,6 - 0,65 de la longitud del cuerpo; sifúnculo 0,13 - 0,20 de la longitud del cuerpo; cauda como máximo 0,5 de la longitud del sifúnculo, con cuatro o cinco setas............Rhopalosiphum padi (Fig. 17 en Simbaqueba et al. 2014)
18. Tubérculo frontal ausente; tubérculo antenal medianamente desarrollado; aparato estridulador a nivel de los sifúnculos (se observa como unas crestas cuticulares ventrolaterales en los segmentos abdominales V y VI, similar a una huella digital (Fig. 16d en Simbaqueba et al. 2014) y metatibia con setas cortas y rígidas, claviformes) .. Aphis subgénero Toxoptera 19
18'. Tubérculo frontal presente (puede estar poco desarrollado); tubérculo antenal de desarrollo variable; antena 0,3 - 1,0 de la longitud del cuerpo; aparato estridulador ausente (puede presentarse un patrón cuticular en forma de "huella digital", pero metatibia carente de setas claviformes); sifúnculo 0,15 - 0,25 de la longitud del cuerpo y sin rebordes ni constricciones; cauda digitiforme, con 4 a 18 setas.................................... Aphis (subgénero nominotípico) ........................... 20

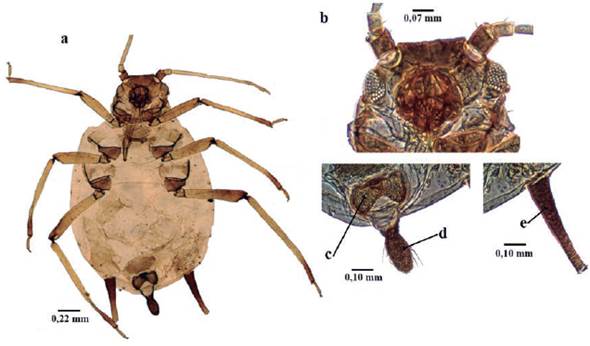
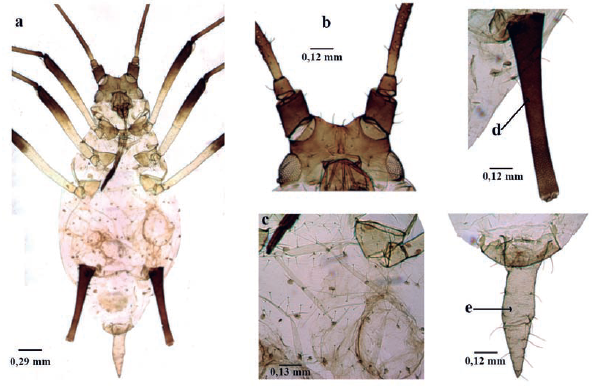
Figura 3 Cinara cupressi a. habitus, b. Antenómero III hembra adulta alada, c. Antenómero VI hembra adulta áptera, d. Cabeza, e. Sifúnculo, f. Placa genital, g. Placa anal, h. Cauda.
19. Cauda con menos de 20 setas; filamento terminal entre tres y cinco veces más largo que el tramo proximal; vena medial de las alas anteriores con una sola bifurcación; pterostigma oscuro........... Aphis aurantii (Fig. 15 en Simbaqueba et al. 2014)
19'. Cauda con más de 20 setas; filamento terminal 4,0 - 5,5 veces más largo que el tramo proximal; vena medial de las alas anteriores con dos bifurcaciones; pterostigma hialino..................................Aphis citricidus (Fig.16 en Simbaqueba et al. 2014)
20. Cuerpo 1,5 - 2,4 mm de longitud; tubérculos frontal y antenal poco desarrollados; antena de 0,6 a 0,8 de la longitud del cuerpo; filamento terminal de 3,5 a 4,5 veces más largo que el tramo proximal. En vivo, áfido de color amarillo intenso o naranja, con apéndices de color marrón muy oscuro o negros................Aphis nerii (Fig. 9 en Simbaqueba et al. 2014)
20'.Cuerpo 0,9 - 2,7 mm de longitud; tubérculo frontal de desarrollo variable; antena de 0,5-0,7 la longitud del cuerpo; filamento terminal 1,9-3,0 veces más largo que el tramo proximal.........................................21
21. Cauda pálida u oscura, con 4 a 7 setas; cuerpo 0,9 - 1,9 mm de longitud; tubérculo frontal medial evidente; antena de 0,5 - 0,65 de la longitud del cuerpo; sifúnculo 1,3 - 2 veces más largo que la cauda; setas femorales 0,4 a 0,7 el diámetro de la sutura trocanterofemoral....................................Aphis gossypii (Fig. 21 en Simbaqueba et al. 2014)
21'. Cauda siempre oscura, portando 7 a 24 setas .....................................................22
22. Longitud corporal 1,25 a 2,7 mm; tubérculo frontal y antenal de constitución variable; antena 0,55 - 0,70 la longitud corporal; sifúnculo 0,15 - 0,25 la longitud corporal; cauda digitiforme; con 7 setas; escudo o placa dorsal abdominal formada por la fusión de franjas transversales de los terguitos II a VI (Fig. 22a en Simbaqueba et al. 2014)........ Aphis craccivora (Fig. 22 en Simbaqueba et al. 2014)
22'. Longitud corporal 1,2 a 2,2 mm; tubérculo frontal y antenal no desarrollados (Fig. 1b); filamento terminal 1,9 a 2,9 veces la longitud del tramo proximal; dorso abdominal sin escudo o marca esclerosada; sifúnculo 0,9 a 1,7 veces la longitud de cauda (Fig. 1d); cauda usualmente con una constricción medial y portando 7-15 setas (Fig. 1d).......... Aphis spiraecola (Fig. 1)
23. Sifúnculo con la parte basal muy estrecha y poca imbricación, seguido de una parte muy ensanchada lisa y un ápice estrecho muy imbricado, dando una apariencia clara de clava o botella (Fig. 11c)................... .........................Rhopalosiphoninus latysiphon (Fig. 11)
23'. Sifúnculo con otra combinación de caracteres....................................24
24. Sifúnculo claviforme (Fig. 22d) o cilíndrico; en este último caso, con adelgazamiento gradual hacia su ápice (Fig. 16d); 2 o más veces la longitud de la cauda; cauda liguliforme (Fig. 16e); antena más larga que el cuerpo; cabeza lisa (Fig.16b);...................................................25
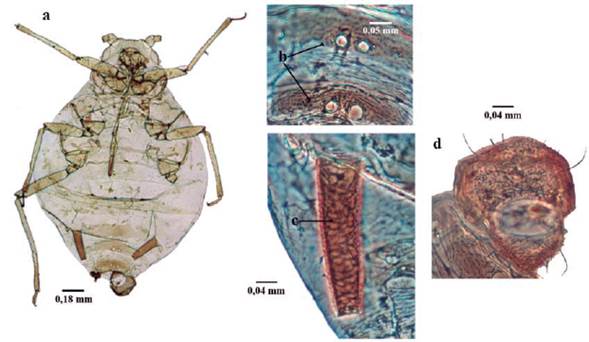
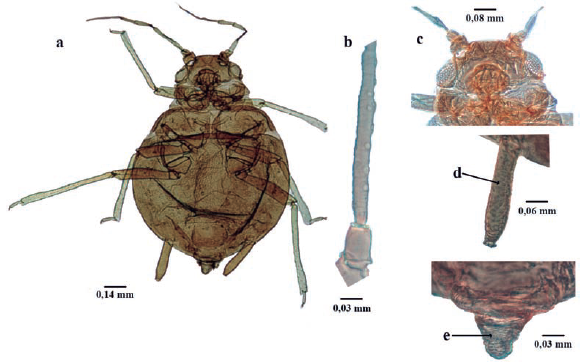
Figura 4 Dysaphis apiifolia. a. habitus, b. Tubérculos mediales de urotergitos VII y VIII, c. Sifúnculo, d. Cauda.
24'. Sifúnculo cilíndrico; cónico, o ligeramente claviforme (Fig. 9c); dos o menos veces la longitud de la cauda; cauda de otro tipo; antena de longitud variable; cabeza lisa, corrugada, u ornamentada con numerosas y pequeñas espículas (Fig. 9b); .....................29
25. Sifúnculo claramente claviforme, con reticulación apical (Fig. 22d); cauda liguliforme (Fig. 22e); tubérculos antenales con bordes mesiales divergentes (Fig. 22c) .............................................Illinoia morrisoni (Fig. 22)
25'. Sifúnculo tubular, adelgazado gradualmente hacia su apice; con reticulación apical (Fig.16d); cauda liguliforme (Fig. 16e); tubérculos antenales desarrollado (Fig. 16b)............................26
26. Sifúnculo reticulado como máximo 0,25 de su sección distal (Fig. 7d); áptero con uno a 36 rinarios secundarios en segmento antenal III; basitarso siempre con tres setas (Fig. 7c)......................................Macrosiphum 27
26'. Sifúnculo reticulado de 0,25 a 0,40 de su sección distal (Fig. 16d); ápteros con 10-40 rinarios secundarios en segmento antenal III; basitarso con cinco setas...........................................................Uroleucon 28
27. Formas ápteras con dos a ocho rinarios secundarios en sección proximal de segmento antenal III (Fig. 12b en Simbaqueba et al. 2014); sifúnculo oscuro solo distalmente; cauda más oscura que región proximal de sifúnculo....... Macrosiphum euphorbiae (Fig. 12 en Simbaqueba et al. 2014)
27'. Formas ápteras con 10 a 36 rinarios secundarios en sección proximal de segmento antenal III; sifúnculo oscuro en toda su longitud (Fig. 7a); cauda de tonalidad más clara que el sifúnculo (Fig. 7e) ...................... Macrosiphum rosae (Fig. 7)
28. Cauda, placa anal y genital pálidas (Fig. 16a); sifúnculo, ápice del fémur y tibia oscuros; áptera: antenómero III con 14 a 27 rinarios secundarios; dorso abdominal con setas en su mayoría que surgen de un esclerito oscuro (Fig. 16c); cauda portando 14 a 16 setas.................... Uroleucon ambrosiae (Fig. 16)
28'.Cauda pálida; placa anal y genital oscuras (Fig. 17a); áptera con antenómero III con 17 a 28 rinarios secundarios (Fig. 17b); abdomen con setas dorsales nunca o casi nunca surgiendo de un esclerito; cauda portando 14 a 16 setas....Uroleucon sonchi (Fig. 17)
29. Cabeza lisa, carente de cualquier tipo de ornamentación..........................................30
29'.Cabeza ornamentada con espículas (Fig. 23b) o rugosidades (Fig. 2c).......................................33
30. Sifúnculo cónico y corto (Fig. 10c PA); cauda triangular (Fig.10c en Simbaqueba et al. 2014) o pentagonal (Fig. 4d)......................................31
30'.Sifúnculo claviforme (Fig. 6d) o ligeramente claviforme (Fig. 2d); cauda liguliforme (Fig. 6e) .......................32
31. Segmento antenal III muy largo, más largo que segmentos IV y V conjugados (Fig. 10b en Simbaqueba et al. 2014); sifúnculo de la misma longitud que la cauda; cauda triangular; con seis a nueve setas (Fig. 10c en Simbaqueba et al. 2014); cabeza y uroterguitos VII y VIII carentes de cualquier tipo de tubérculos dorsomediales....Brevicoryne brassicae (Fig. 10 en Simbaqueba et al. 2014)
31'. Segmento antenal III igual o más corto que segmentos IV y V conjugados; sifúnculo más largo que la cauda (Fig. 4c); cauda triangular o pentagonal (Fig. 4d); generalmente con 5 setas; protórax y segmentos abdominales I a VI con tubérculos laterales largos y aplanados; cabeza y uroterguitos VII y VIII con uno o dos tubérculos dorsomediales (Fig. 4b)........................................................................Dysaphis apiifolia (Fig. 4)
32. Longitud corporal 2 a 3,2 mm; antena de seis antenómeros; antenómero III con 5 a 20 rinarios secundarios (Fig. 6b); sifúnculo más ancho en la mitad distal que en la proximal; con apariencia claviforme (Fig. 6d); cauda liguliforme (Fig. 6e), o algunas veces con una ligera constricción; cauda con seis a ocho setas.........................Hyperomyzus lactucae (Figura 6)
32'.Longitud corporal 1,4 a 2,5 mm; antena con seis antenómeros; formas ápteras sin rinarios secundarios; sifúnculo ligeramente claviformes; cauda liguliforme con una ligera constricción; portando cinco a siete setas............................................Wahlgreniella nervata
33. Cuerpo esclerosado uniformemente (Fig. 2a); rugoso; cabeza rugosa, sin espículas; tubérculo frontal no desarrollado (Fig. 2c); sifúnculo ligeramente claviforme (Fig. 2d); cauda triangular o digitiforme, pero sin constricción; cauda con cuatro setas.......................................Carolinaia cyperi (Fig. 2)
33'.Cuerpo carente de esclerotización fuerte y uniforme; cabeza ornamentada, con numerosas espículas; tubérculo frontal con desarrollo variado; sifúnculo ligeramente claviforme, tubular o cónico; cauda digitiforme, triangular o casi triangular.....................................................................34
34. Formas ápteras con parche dorsal abdominal negro irregular (Fig. 20a); sifúnculo tubular; cauda digitiforme, sin constricción; portando seis a ocho setas.........................Neomyzus circumflexum (Fig. 20)
34'. Formas ápteras sin parche abdominal dorsal negro; sifúnculo tubular o de otro tipo; cauda digitiforme o de otro tipo.......................................................................35
35. Formas ápteras fuertemente esclerosadas, oscuras y corrugadas (Fig. 8a); sifúnculo tubular o ligeramente claviforme; placa anal muy pigmentada; alas con patrones oscuros bordeando la venación (Fig. 8e) ....................................Microparsus brasiliensis (Fig. 8)
35'. Formas ápteras ligeramente esclerosadas y pigmentadas; liso o con espículas; sifúnculo de otro tipo; placa anal ligeramente pigmentada o pálida; alas con o sin patrones oscuros..........................................................36
36. Sifúnculo cilíndrico o cónico, con adelgazamiento gradual hacia su ápice...................................................37
36'. Sifúnculo ligera pero claramente con ensanchamiento gradual desde la mitad hacia el ápice (Fig. 9c).............39
37. Sifúnculo pigmentado desde la mitad hasta su ápice; cauda digitiforme, con constricción evidente; pálida; alas con patrones oscuros bordeando la venación...................Pentalonia nigronervosa (Fig. 10)
37'.Sifúnculo pigmentado en su totalidad o solo en su ápice; cauda de otro tipo; pigmentada; alas sin ningún tipo de patrón oscuro.............................................................38
38. Longitud corporal 1,4 a 2,4 mm; sifúnculo cilíndrico, pálido, o solo pigmentado en su ápice (Fig. 23c); abdomen sin marcas; tubérculos antenales protuberantes; convergentes (Fig. 23b).............Ovatus crataegarius (Fig. 23)
38'.Longitud corporal 1 a 1,7 mm; sifúnculo con adelgazamiento gradual hacia su ápice, pigmentación uniforme; dorso con algunas arrugas de apariencia coriácea y oscura; tubérculo antenal bien desarrollado...............................Myzus ornatus (Fig. 13 en Simbaqueba et al. 2014)
39. Longitud corporal 1,1 a 2,3 mm; antenómeros I y II y parte distal del fémur pálidos (Fig. 21a); alas sin patrones oscuros bordeando la venación..................................................................Myzus ascalonicus (Fig. 21)
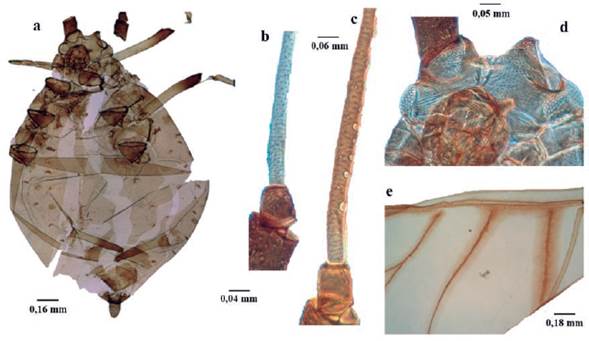
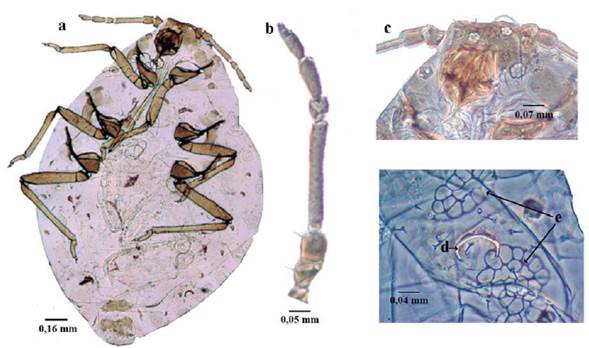
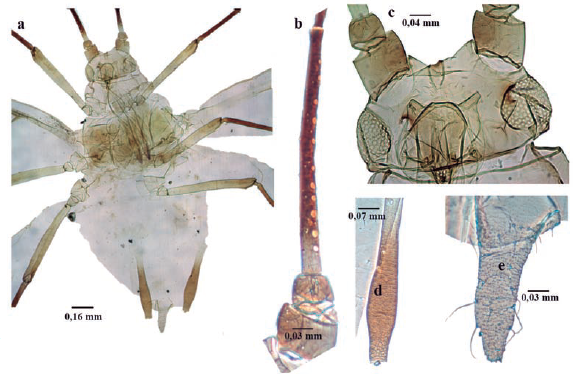
Figura 8 Microparsus brasiliensis. a. habitus; b. Antenómero I, II y III áptero; c. Antenómero II y III alada; d. Cabeza; e. Ala.
39'. Longitud corporal 1,6 a 2,3 mm; antenómeros I y II y parte distal del fémur oscuros (Fig. 9a); alas con patrones oscuros bordeando la venación... Neotoxoptera formosana (Fig. 9)
Diagnosis de las especies.
Aphis spiraecola Patch, 1914 (Fig. 1)
Longitud 1,2 a 2,7 mm; color verde amarillento a verde manzana; sifúnculos, cauda, ápice de fémures y de tibias oscuros (Fig. 1a). Tubérculos antenales no desarrollados (Fig. 1b). Antenas de seis antenómeros de 0,5 a 0,7 veces el cuerpo. Filamento terminal 1,8 a 3 veces el tramo proximal. Alados con cuatro a doce rinarios secundarios en el antenómero III y cero a cinco en el antenómero IV. Protórax con tubérculos laterales similares que en los segmentos abdominales I y VII, rara vez con tubérculos más pequeños en los segmentos abdominales II a IV. Cutícula con reticulación poco marcada. Rostro alcanzando o sobrepasando las coxas medias (Fig. 1a). Segmentos abdominales II a IV generalmente sin papilas laterales, algunas veces hasta tres de pequeño tamaño. Sifúnculos cónicos, longitud 0,8 a 1,8 veces la cauda, con cutícula imbricada casi en su totalidad (Fig. 1e); escleritos postsifunculares presentes algunas veces. Placa genital con dos a siete setas. Cauda digitiforme con o sin constricción media, con doce a catorce setas, rara vez con seis a 16 (Fig. 1d) (Holman 1974, Bustillo y Sánchez 1977, García Prieto y Nieto Nafría. 2005, Blackman y Eastop 2006).
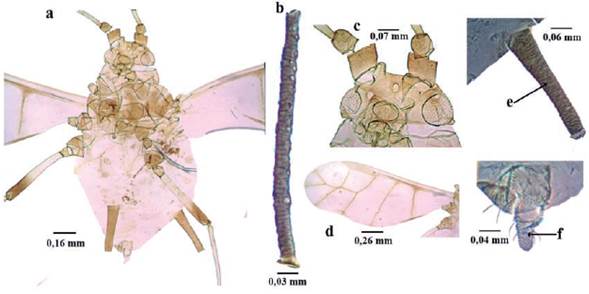
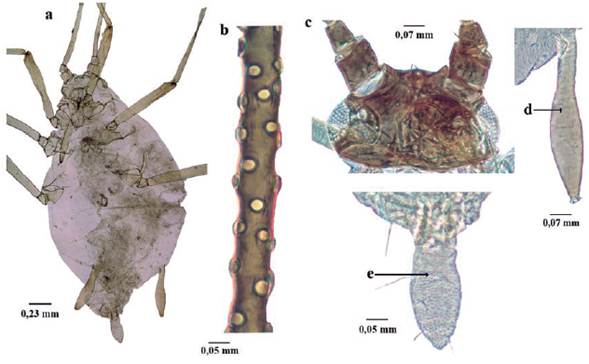
Figura 10 Pentalonia nigronervosa. a. habitus hembra alada;b. Antenómero III; c. Cabeza; d. Ala; e. Sifúnculo; f. Cauda.
Carolinaia cyperiAinslie, 1915 (Fig. 2)
Longitud 1,0 a 1,5 mm. Adultas ápteras, de color negro o verde negruzco, con lustre metálico; cuerpo uniformemente esclerosado; superficie de la cabeza, tórax y abdomen rugosa (Fig. 2a y 2c). antena de seis antenómeros y de 0,5 a 0,6 veces el cuerpo; I, II, V y VI oscuros, III y IV pálidos. Filamento terminal 1,9 a 2,5 veces la longitud del tramo proximal. Aladas, con siete a once rinarios secundarios en antenómero III (Fig. 2b), y cero o uno en el IV. Rostro con longitud que alcanza las coxas anteriores o medias. Sifúnculos ligeramente claviformes (Fig. 2d). Cauda triangular o digitiforme, sin constricción (Fig. 2e), 0,3 a 0,45 la longitud de los sifúnculos, con cuatro setas (Ainslie 1915, Holman 1974, Blackman y Eastop 1994, 2006).
Cinara cupressi (Buckton, 1881) (Fig. 3)
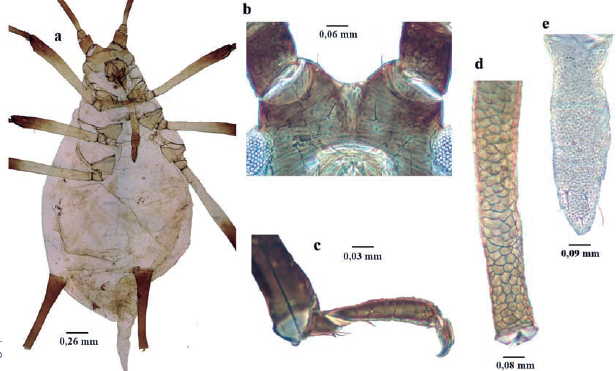
Longitud 1,8 a 3,9 mm; ápteros y alados de color naranja-marrón a marrón-amarrillo; cuerpo piriforme, recubierto por muchas setas finas (Fig. 3a); dorso recubierto generalmente con cera de color gris. Antenas de seis antenómeros, Alados con rinarios secundarios en el antenómero III (Fig. 3b); filamento terminal aproximadamente 0,5 del tramo proximal (Fig. 3c); mitad proximal del antenómero VI con cuatro a seis setas. Tubérculos antenales no desarrollados (Fig. 3d). Rostro con longitud que sobrepasa las coxas posteriores. Parte distal del fémur y pequeña porción proximal de las tibias oscuras. Sinfúnculo troncocónico más ancho que largo; oscuro; fuertemente esclerosados (Fig. 3e). Cauda redondeada (Fig. 3h). En cupresáceas (Blackman y Eastop 1994).
Dysaphis apiifolia (Theobald, 1923) (Fig. 4)
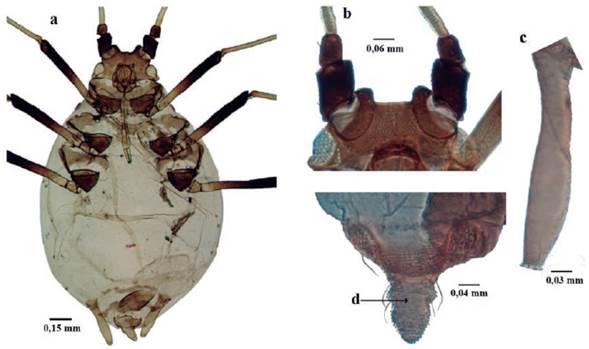
Longitud de 1,6 a 2,4 mm; ápteros de color amarillento a gris verdoso; recubierto por cera pulverulenta. Dorso membranoso, con franjas esclerosadas anchas en el pronoto y otras más estrechas en uroterguitos VI a VIII (Fig. 4a). Tórax y abdomen con tubérculos laterales anchos, bien desarrollados en protórax y en segmentos abdominales I al VI; algunos más pequeños se pueden encontrar en segmento VII en algunas ocasiones. Cabeza y uroterguitos VII y VIII con uno o dos tubérculos mediales (Fig. 4b). Frente con tubérculos antenales bajos. Filamento terminal con longitud de tres a cuatro veces del tramo proximal. Ápteros: sin rinarios secundarios. Rostro alcanzando las coxas posteriores. Sifúnculos casi cilíndricos (Fig. 4c), gradualmente adelgazado hacia al ápice; con reborde apical bien definido. Cauda pentagonal o triangular (Fig. 4d); longitud 0,5 de los sifúnculos; usualmente con cinco setas. Alados con 40 a 99 rinarios en el segmento antenal III, de 10 a 34 en el IV y de O a 7 en el V. Cabeza con dos grandes tubérculos espinales. Franjas dorsales de uroterguitos III al V, y algunas veces del VI, parcialmente fusionadas formando una placa irregular (Holman 1974, Blackman y Eastop 2006).
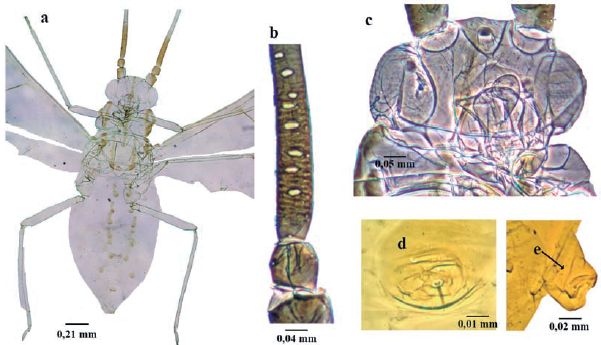
Figura 14 Takecallis arundinariae. a. habitus; b. Antena; c. Cabeza; d. Prominencia tuberculosa dorso-medial; e. Sifúnculo.
Eriosoma lanigerum (Hausmann, 1802) (Fig.5)
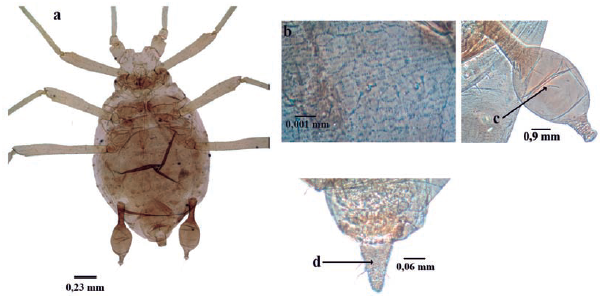
Longitud de 1,2 a 2,6 mm; cuerpo piriforme u ovalado (Fig. 5a); color rosado a café rojizo; en vivo, recubierto por secreciones cerosas muy largas, especialmente en el abdomen, semejantes a lana o algodón; dorso con cuatro hileras de glándulas ceríferas (dos laterales y dos mediales) desde la cabeza hasta el último segmento abdominal. Antenas de seis antenómeros (Fig. 5b); filamento terminal muy corto, la mitad o casi la mitad del tramo proximal (Fig. 5b). Rinarios secundarios únicamente en alados, anulares, en número de 16 a 24 en segmento III, tres a seis en IV, tres a seis en V y cero a tres en VI. Ojos reducidos al triommatidio (Fig. 5c). Rostro terminado entre las coxas medias y posteriores, muy corto en alados, llegando casi a coxas medias. Sifúnculos poriformes con un reborde anterior definido (Fig. 5d). Cauda y placa anal redondeada (Bustillo y Sánchez 1977, Blackman y Eastop 1994, 2000, 2006).
Hyperomyzus lactucae (Linnaeus, 1758) (Fig. 6)
Longitud 2 a 3,2 mm; color verde a verde pálido; Cuerpo fusiforme (Fig. 6a). Antenas tan largas como el cuerpo, de seis antenómeros; ápices de cada antenómero oscuros, al igual que ápices de fémures y tibias. Cuerpo, cabeza, antenómeros I, II y base del III palidos. Filamento terminal 4,2 a 7 veces la longitud del tramo proximal. Rinarios secundarios en número de cinco a 20 en el antenómero III, rara vez en segmento IV (Fig. 6b). Alados con 35 a 60 rinarios secundarios en antenómero III, ocho a 20 en antenómero IV y de cero a diez en antenómero V. Cabeza lisa, tubérculo frontal conspicuo (Fig. 6c). Rostro casi llegando a las coxas posteriores. Sifúnculos de 1,65 a 2 veces la longitud de la cauda, mitad distal más amplia que la base, con apariencia claviforme, sin reticulación o con unas franjas imbricadas en los ápices (Fig. 6d). Cauda liguliforme, o algunas veces con una ligera constricción; con seis a ocho setas (Fig.6e) (Bustillo y Sánchez 1977, Blackman y Eastop, 2000, 2006).
Macrosiphum rosae (Linnaeus, 1758) (Fig. 7)
Longitud 1,7 a 4,2 mm; cuerpo piriforme; color verde, rosado, rojo-marrón o magenta; ápices de fémures, tibias y tarsos oscuros, al igual que la cabeza y algunas partes de las antenas (Fig. 7a). Tubérculos antenales desarrollados (Fig. 7b). Antenas igual o ligeramente más largas que el cuerpo, de seis antenómeros; antenómero III en ápteras con diez a 35 rinarios concentrados en base del segmento. Basitarso con tres setas (Fig. 7c). Escleritos pre y postsinfúnculares generalmente presentes; sifúnculos oscuros o negros en su totalidad y reticulados en su 10 a 17% distal (Fig. 7d). Cauda liguliforme más pálida que los sifúnculos, con seis a diez setas (Fig. 7e) (Bustillo y Sánchez 1977, Blackman y Eastop 1994, 2006).
Microparsus brasiliensis (Moreira, 1925) (Fig. 8)
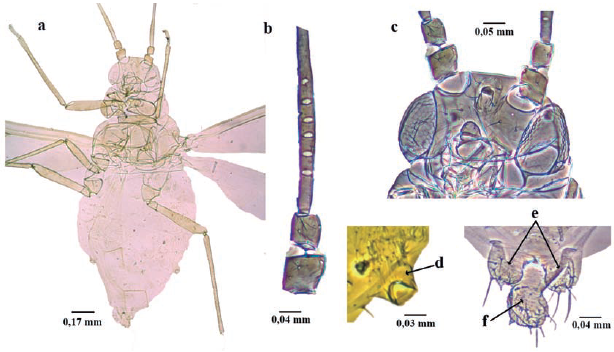
Longitud 1,6 a 2,3 mm; cuerpo piriforme (Fig. 8a), marrón verdoso, marrón oscuro, o negro. Antenas un poco más largas que el cuerpo; antenómeros I al III espiculados (hileras de pequeñas prominencias cuticulares puntiagudos), similar a la escultura de la cabeza. Ápteras sin rinarios secundarios (Fig. 8b). Aladas con tres a diez rinarios secundarios en el antenómero III (Fig. 8c). Cabeza con pequeñas espículas. Tubérculos antenales divergentes; dando a la frente la apariencia de "W" (Fig. 8d). Rostro sobrepasando las coxas medias. Dorso membranoso, si bien uroterguitos VII y VIII con algunos escleritos tranversales incompletos; con tubérculos marginales sobre terguitos abdominales II-IV. Venas flanqueadas por áreas pigmentarias oscuras (Fig. 8e) (similar a aladas de Pentalonia nigronervosa). Sifúnculos ligeramente claviformes, con reborde apical bien desarrollado. Cauda digitiforme, con seis a ocho setas (Holman 1974, Blackman y Eastop 1994, 2006).
Neotoxoptera formosana (Takahashi, 1921) (Fig. 9)
Longitud 1,6 a 2,3 mm; cuerpo piriforme (Fig.9a), de color rojo-magenta brillante, marrón oscuro o casi negro. Alados rojo intenso a casi negro. Antenas de seis antenómeros; antenómeros I y II oscuros al igual que las partes distales de los fémures. Cabeza con pequeñas espículas. Tubérculos antenales bien desarrollados (Fig. 9b). Venación negra, con una pigmentación oscura a lo largo de las márgenes (similar a las alas de Microparsus brasiliensis). Sifúnculos ensanchados desde la parte media hacia su ápice, dando la apariencia de ser ligeramente claviformes, con reborde apical bien definido (Fig. 9c). Cauda triangular (Fig. 9d) (Blackman y Eastop 1994, 2006).
Pentalonia nigronervosa Coquerel, 1859 (Fig. 10)
Longitud 1 a 1,8 mm; color vino tinto oscuro, morado o casi negro; cuerpo piriforme (Fig. 10a). Antenas de seis antenómeros casi o de la misma longitud del cuerpo; alados con seis a doce rinarios secundarios en el segmento antenal III (Fig. 10b), cuatro a nueve en el IV y de dos a seis en el V; filamento terminal de seis a siete veces la longitud del tramo proximal del segmento VI. Cabeza con pequeñas espículas; tubérculos antenales bien definidos, bajos (Fig. 10c). Rostro terminando entre las coxas medias y posteriores. Alas con márgenes de las venas oscuros (Fig. 10d). Sifúnculos cilíndricos, con ligero adelgazamiento gradual en su parte distal, con imbricaciones de la base al ápice, con reborde apical bien definido, algunas veces con ligera constricción medial de manera que la parte distal parece más ancha (Fig. 10e). Cauda digitiforme, con constricción cerca a la base; portando cuatro a seis setas (Fig. 10Í) (Holman 1974, Bustillo y Sánchez 1977, Blackman y Eastop 2000, 2006).
Rhopalosiphoninus latysiphon (Davidson, 1912) (Fig. 11)
Longitud 1,4 a 2,5 mm; cuerpo piriforme (Fig. 11a), color verde olivo oscuro, brillante; sifúnculos marrón muy oscuro o negro. Dorso esclerosado, cutícula del mesión (cuerpo sin considerar apéndices) con pequeñas espículas arregladas en polígonos (Fig. 11b). Cabeza lisa, excepto por los tubérculos antenales que son ásperos y rugosos. Antenas de 1,2 a 1,3 veces el cuerpo. Alada con 16 a 27 rinarios secundarios en el segmento antenal III. Filamento terminal 4,3 a 4,7 veces la longitud del tramo proximal del antenómero VI. Rostro sobrepasando las coxas posteriores. Sifúnculo 0,2 a 0,3 la longitud del cuerpo; con la parte proximal muy estrecha y menos imbricada que la parte distal, con una parte media muy ensanchada (globosa) y lisa; y un ápice estrecho e imbricado (Fig. 11c). Cauda triangular alargada, con longitud 0,25 a 0,3 el largo del sifúnculo; cauda con cinco setas (Fig. 11d) (Ortiz 1973, Holman 1974, Blackman y Eastop 2000, 2006).
Rhopalosiphum maidis (Fitch, 1856)
Longitud 0,9 a 2,4 mm; alargado en comparación a otras especies del género; color general verde y verde oscuro cerca a los sifúnculos; cubierto con cera fina; algunas veces con una capa fina de cera pulverulenta. Cabeza rugosa. Frente sinuosa. Antenas de seis antenómeros y de 0,3 a 0,5 veces la longitud del cuerpo; rinarios secundarios ausentes; filamento terminal 1,5 a 2 veces la longitud del tramo proximal del antenómero VI. Alado con seis a 30 rinarios secundarios en el antenómero III, cero a catorce en el IV y cero a cinco en el V. rostro con longitud hasta las coxas anteriores o medias; urotergo VII con uno o dos escleritos mediales y VIII con una franja oscura esclerosada. Sifúnculo 1,1 a 1,6 veces la longitud de la cauda; sinfúnculo tubular o cónico; ligeramente distendido en su parte media; imbricado; con reborde apical bien definido. Cauda digitiforme, sin constricción media, 0,5 la longitud del sifúnculo; cauda con cuatro a seis setas, (Holman 1974, Bustillo y Sánchez 1977, Blackman y Eastop 2000, Pérez Hidalgo y Mier Durante 2005, Blackman y Eastop 2006).
Rhopalosiphum rufiabdominale (Sasaki, 1899) (Fig.12)
Longitud 1,2 a 2,8 mm; cuerpo piriforme, color verde y área postsifuncular con franja naranja o marrón (Fig. 12a). Antena 0,4 a 0,7 veces la longitud del cuerpo; con cinco o seis antenómeros. Tubérculos antenales pequeños (Fig. 12b). Filamento terminal 4 a 6,5 veces la longitud del tramo proximal del antenómero VI; alado con once a 22 rinarios secundarios en el antenómero III, dos a doce en IV y cero a cuatro en V. Rostro con longitud que sobrepasa las coxas posteriores, algunas veces hasta el primer segmento abdominal en los alados. Sifúnculo 2 a 2,3 veces la longitud de la cauda; sifúnculo tubular, con reborde apical bien definido, con imbricaciones casi en su totalidad (Fig. 12c). Cauda digitiforme, con constricción poco definida; con cuatro a seis setas (Fig. 12d) (Holman 1974, Bustillo y Sánchez 1977, Pérez Hidalgo y Mier Durante 2005, Blackman y Eastop 2006).
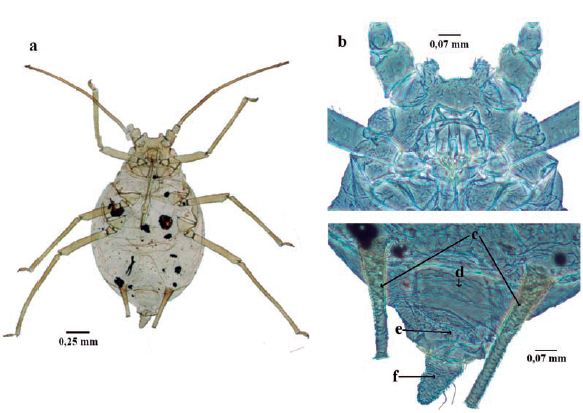
Sarucallis kahawaluokalani (Kyrkaldy, 1907) (Fig. 13)
Longitud 1 a 1,8 mm; cuerpo piriforme (Figura 13a); amarillo o verde pálido, con marcas negras o marrón en cabeza, tórax y patas. Antenas de seis antenómeros; antenómero III con rinarios ovalados (Fig. 13b); cada segmento antenal pigmentado en su ápice, filamento terminal 1,5 o menos de la longitud del tramo proximal del antenómero VI. Cabeza pigmentada, con dos pequeños tubérculos frontales (Fig. 13c). Alas anteriores con patrones de pigmentación negra. Tergo abdominal I con un par de tubérculos mesiales pareados, tergo abdominal II con un tubérculo mesial grande bífido (Fig. 13d). Abdomen con tubérculos laterales bien desarrollados y pigmentados. Escleritos laterales bien desarrollados. Sifúnculos más cortos que los tubérculos laterales; sifúnculos cónicos y pigmentados; placa anal (vientre Abd VIII) bilobulada (Fig. 13e) y cauda en forma de verruga, con ocho a nueve setas (Fig. 13f) (Yovkova y Petrovic-Obradovic 2011, Kondo y Simbaqueba 2014).
Takecallis arundinariae (Essig, 1917) (Fig. 14)
Longitud 1,7 a 2,4 mm. Hembras adultas aladas vivíparas (Fig.14a); Antena 1,2 veces la longitud del cuerpo; rinarios secundarios usualmente en número de cuatro a ocho (Fig. 14b). Cabeza lisa con una línea anteroposterior mesial marrón; sin tubérculos antenales, frente lisa (Fig.14c). Rostro corto, con longitud como máximo hasta las coxas anteriores. Clípeo con una prominencia (tubérculo) en forma de naso, que posee dos setas. Primer segmento tarsal con 9 setas. Abdomen con una doble fila de prominencias tuberculosas dorso-mesiales, marrones, cada uno con una seta (Fig. 14d); segmento abdominal VIII con dos a cuatro setas. Sifúnculo corto, con una seta (Fig. 14e). Placa genital (vientre Abd VII) con 18 a 24 setas. Placa anal (vientre Abd VIII) bilobulada. Cauda en forma de verruga, con doce a quince setas (Higuchi 1968).
Takecallis taiwana (Takahashi, 1926) (Fig. 15)
Longitud 1,4 a 2,3 mm. Hembras adultas aladas (Fig. 15a); antena 0,8 veces la longitud del cuerpo. Rinarios secundarios usualmente en número de cinco a seis, arreglados en primer tercio 1/3 del antenómero III (Fig. 15b). Cabeza lisa, carente de tubérculos antenales, clípeo con una prominencia (tubérculo) en forma de naso, que porta dos setas (Fig. 15c). Rostro corto, con longitud como máximo hasta las coxas anteriores. Primer segmento tarsal con cinco a siete setas. Segmentos abdominales I-IV con prominencias tuberosas dorsales, pareados, especialmente grandes en segmentos I-II, cada uno portando una seta. Sifúnculo corto, sin setas (Fig. 15d). Placa genital con 17 a 20 setas. Placa anal bilobulada (Fig. 15e). Cauda en forma de verruga, con 14 a 16 setas (Fig. 15f) (Higuchi 1968).
Tetraneura fusiformis Matsumura 1917
Longitud 1,5 a 2,5 mm; verde claro, marrón claro, o blanco; cuerpo globoso, ovoide, sin placas cerosas -en caso de presentarse son pocas y pequeñas-, constituidas por una o dos glándulas y algunas acompañantes muy pequeñas; dorso corporal membranoso, a excepción de los segmentos VII y VIII. Cabeza diferenciada del tórax. Frente convexa, carente de prominencias, casi lisa; tubérculos antenales no desarrollados. Ojos reducidos al triommatidio. Rostro obtuso, de cinco segmentos, IV y V parcial o totalmente fusionados; margen apical del segmento rostral apical (IV+V) aproximadamente igual o de la misma amplitud que su longitud; termina en la coxa media. Antenas de cuatro o cinco antenómeros, todos con setas finas. Filamento terminal casi de la misma longitud que el tramo proximal de su respectivo antenómero. Rinarios secundarios ausentes, los primarios distribuidos en el margen posterior del penúltimo antenómero; último antenómero con setas distribuidas a su alrededor. Tarsos de un solo segmento, con dos uñas, cada una con dos placas unguitractoras. Segmentos abdominales VII y VIII, con una fila lateral de setas largas y gruesas; sin escleritos espiraculares. Áreas pre y postsifunculares con pequeños escleritos; sifúnculo corto, en forma de cono bajo, con pliegues y reborde apical definido. Placa genital (vientre Abd VII) con apertura genital evidente. Placa anal (vientre de segmento VIII) con apertura anal evidente. Cauda semicircular, con dos setas (Blackman y Eastop 2006).
Nota: esta especie es a menudo citada en Latinoamérica como T. nigriabdominalis (Sasaki, 1899) (Simbaqueba et al. 2015).
Uroleucon ambrosiae (Thomas, 1878) (Fig. 16)
Longitud 2,5 a 4,0 mm; color rojo oscuro, marrón oscuro, o rojo mate; coxas, cauda y placa anal pálidas; sifúnculos, ápice de los fémures y tibias oscuros (Fig. 16a). Tubérculos antenales desarrollados (Fig. 16b). Antenas de seis antenómeros, más largas que la longitud del cuerpo, oscuras, excepto los segmentos I y II y la base del III, que son más claros. Áptera con catorce a 27 rinarios secundarios en el antenómero III. filamento terminal 5 a 6,3 veces la longitud del tramo proximal del antenómero VI. Rostro alcanzando las coxas posteriores. Basitarso con cinco setas. Abdomen con setas del dorso en un esclerito oscuro en su mayoría (Fig. 16c). Sifúnculos tubulares, 0,2 a 0,25 veces la longitud del cuerpo, con escleritos postsifunculares (Fig. 16d). Cauda liguliforme, puntiaguda, 0,7 a 0,9 del largo de los sifúnculos portando catorce a 16 setas (Fig. 16e) (Bustillo y Sánchez 1977, Blackman y Eastop 1994, 2006).
Uroleucon sonchi (Linnaeus, 1767) (Fig. 17)
Longitud 2,5 a 3,0 mm; color marrón o negro-marrón. Antenas principalmente negras; coxas, ápices de los fémures y tibias negruzcos; cauda palida, placa anal y genital oscuras (Fig. 17a). Antenas de seis antenómeros, más largas que la longitud del cuerpo, Áptera con 17 a 28 rinarios secundarios en el antenómero III (Fig. 17b). Tubérculos antenales desarrollados (Fig. 17c). Rostro sobrepasando las coxas medias. Basitarso con cinco setas. Abdomen con setas dorsales nunca o casi nunca en escleritos. Sinfúnculos cónicos, con adelgazamiento gradual hacia el ápice, dos veces el largo de la cauda, de color negro, reticulados en Vs de su tramo distal (Fig. 17d). Escleritos postsifúnculares presentes. Cauda liguliforme, portando catorce a 16 setas (Fig.17e) (Bustillo y Sánchez 1977, Blackman y Eastop 1994, 2006).
NUEVOS REGISTROS
Greenidea psidii Van der Goot, 1917 (Fig. 18)
Longitud 1,8 a 2,6 mm; cuerpo piriforme en ápteras y fusiforme en alados (Fig. 18a); marrón o amarillo parduzco. Antenas de seis antenómeros; alados con antenómero III con 20 a 30 rinarios ovalados, dispuestos irregularmente y algunos agrupados en la proximidad (Fig. 18b). Tubérculos antenales no desarrollados (Fig. 18c). Basitarso con siete setas. Sifúnculos 2/3 la longitud del cuerpo, divergentes distalmente, reticulados solo en la parte proximal; con espinulas irregularmente espaciadas y portando setas gruesas y largas (Fig. 18d). Cauda redondeada con una prominencia medial con forma de papila (Fig. 18e) (Halbert 2004, Lazzari et al. 2006, Cermeli et al. 2012).
Comentarios. Se registra por primera vez para Colombia. su distribución natural es asiática. su ruta de dispersión hacia Colombia se desconoce. Se distribuye en Australia, Indonesia, Filipinas, Bangladés, India, Nepal, China Taiwán, Japón, Venezuela, Costa Rica, Cuba y EE.UU., tanto en Hawái como en territorio americano. Hospeda en Myrtaceae y Moraceae, generalmente (Barsley 1993, Blackman y Eastop 1994, 2006, Gill 1998, Halbert 2004, Lazzari et al. 2006, Sugimoto 2008, Pérez Hidalgo et al. 2009, Álvarez y Grillo 2011, Cermeli et al. 2012). Sin embargo, las primeras muestras colombianas examinadas se recolectaron alimentándose en Citrus sp.
Material estudiado: Cuatro montajes en láminas para microscopia, [UNAB 818]. Colombia: Cundinamarca, Fusagasugá, vía Bogotá-Melgar, Km 53 frente al Yep, Vivero Bioagro II, 4°20' Norte, 74°21' Este, 1728m, 22 oct 2013, Col. R. Simbaqueba, en Citrus reticulata (Rutaceae) var. arrayana. Colombia: Cundinamarca, Bogotá, Universidad Nacional de Colombia, 4°38'07'' Norte, 74°04'57'' Este, 2600 m alt., 25 mar 2015, Col. R. Simbaqueba, en Callistemon citrinus (Myrtaceae).
Eulachnus rileyi (Williams, 1911) (Fig. 19)
Longitud de áptera 1,8 a 2,4 mm; cuerpo fusiforme (Fig. 19a); verde claro; con cera pulverulenta gris. Antenas de seis antenómeros; antenómero III con nueve a 17 setas; antenómero IV con sensorio secundario; antenómeros V y VI con un rinario primario cada uno (Fig. 19b). Antena amarillenta, con antenómeros I y II marrón y antenómeros del III al VI distalmente marrón claro a marrón. Setas frontales de 0,800 a 0,115 mm (Fig. 19c). Cabeza y tórax marrón claro a marrón, con escleritos más oscuros en las bases de las setas. Cabeza, protórax y mesotórax con esclerotización dorsal, y portan ocho a diez y ocho a 16 setas dorsales, respectivamente; mesotórax con seis escleritos dorsolaterales y con una seta cada uno; setas dorsales 0,075 a 0,115 mm. Sifúnculos poriformes (Fig. 19d). Abdomen pálido, con escleritos en sus bases setales marrón claro a marrón. Fémures y tibias posteriores uniformemente marrón a negro. Tibias anteriores y medias amarillentas, con las partes proximales y distales marrones. Placa subgenital con diez a 20 setas. Cauda redondeada (Fig. 19g). Alada longitud 2,3 a 2,5 mm. Cabeza marrón a marrón oscuro con escleritos más oscuros en las bases setales. Tórax marrón a marrón oscuro. Urómeros I a VII con cuatro a cinco setas mediales-pleurales en escleritos redondeados y pequeños (Nieto Nafría et al. 2002, Kanturski et al. 2017)
Comentarios. Se cita por primera vez para el norte de Sudamérica. Descrita de Rusia. Su distribución natural es Paleártica. Su ruta de dispersión hacia Colombia se desconoce. Se encuentra distribuido en Turquía, Italia, Francia, Andorra, España y Argentina. En coníferas del género Pinus (Blackman y Eastop 1994, Delfino y Binazzi 2000, 2002, §enol et al. 2014).
Material estudiado: Seis montajes en láminas para microscopia, [UNAB 934] Colombia: Cundinamarca, Bogotá, Universidad Nacional de Colombia, 4°38'07'' Norte, 74°04'57'' Este, 2600m, 7 ago 2014, Col. R. Simbaqueba, en Pinus radiata (Pinaceae).
Wahlgreniella nervata (Gillette, 1908)
Longitud 1,4 a 2,5 mm; cuerpo piriforme; verde o verde amarillento, algunas veces con moteado rojo; parte distal de sifúnculos y reborde apical oscuro; Antenas de seis antenómeros; en ápteras, rinarios secundarios ausentes. Tubérculos antenales desarrollados. Sifúnculos ligeramente claviformes. Alado con bandas dorsales esclerosadas en el abdomen, algunas veces fusionadas, que forman un parche irregular. Cauda liguliforme, con constricción ligera, y cinco a siete setas (Blackman y Eastop 1994, 2006, Joshi et al. 2014).
Comentarios. Se cita por primera vez en Colombia. Descrita de Colorado (EE.UU.). Su distribución natural es neártica. Su ruta de dispersión hacia Colombia se desconoce. Se distribuye en India, Pakistán, Irán, Israel, Turquía, Grecia, Italia incluyendo Cerdeña, Francia incluyendo Córcega, Bélgica, Reino Unido, Andorra, España incluyendo Islas Canarias, Portugal incluyendo Madeira, Burundi, Canadá, México, Perú, Brasil, Chile y Argentina.
En Rosa sp., algunas Ericaceae y Empetraceae (Smith y Cermeli 1979, Halperin et al. 1988, Heie 1994, Nieto Nafría et al. 1994, Eastop et al. 1997, Blackman y Eastop 2000, Tsitsipis et al. 2007, Barjadze et al. 2011, Mallqui y Cobian 2011, Joshi et al. 2014).
Material estudiado: Un montaje en lámina para microscopia [UNAB 3567] Colombia: Cundinamarca, Choachí, 4°31' Norte, 73°55' Este, 1920m, oct 2010, Col. E. Vergara, en Rosa sp. (Rosaceae).
Neomyzus circumflexum (Buckton, 1876) (Fig. 20)
Longitud de 1,2 a 2,6 mm; cuerpo piriforme (Fig. 20a); verde brillante, verde claro o amarillo con bandas oscuras dorsales en los segmentos torácicos; abdomen con un parche dorsal negro irregular. Antenas de seis antenómeros y 1,1 a 1,5 veces el cuerpo; áptera carente de rinarios secundarios. Tubérculos antenales desarrollados. Cabeza con numerosas espículas (Fig. 20b). Sifúnculos tubulares; oscuros; con reborde apical más oscuro; 1,8 a 2,3 veces la longitud de la cauda (Fig. 20c); imbricados desde la base al ápice. Cauda digitiforme, sin constricción, con seis a ocho setas (Fig. 20e) (Blackman y Eastop 1994, 2000, 2006).
Comentario. Se cita por primera vez para Colombia. Su distribución natural es asiática, su ruta de dispersión hacia Colombia se desconoce. Distribuido en la isla de Sumatra en Indonesia, Taiwán, Marruecos, Suiza, Bélgica, Gran Bretaña, Irlanda, Letonia, Suecia, los EE.UU., tanto en Hawái como en territorio americano, Cuba, Nicaragua, Costa Rica, Panamá, Venezuela y Argentina. Polífago (Fullaway 1909, Theobald 1913, Timberlake 1924, Essig 1938, Hille Ris Lambers 1949, Cermeli 1970, 2006, 2007, Homan 1974, Ortego et al. 2004, Quirós et al. 2009).
Material estudiado: Tres montajes en láminas para microscopia, [UNAB 1480]. Colombia: Cundinamarca, Bogotá, Universidad Nacional de Colombia, 4°38'07'' Norte, 74°04'57'' Este, 2600m, jul 2014, Col. R. Simbaqueba, en Physalis peruviana (Solanaceae).
Myzus ascalonicusDoncaster, 1946 (Fig. 21)
Longitud 1,1 a 2,3 mm; cuerpo piriforme; verde claro a amarillo; patas y antenas pálidas (Fig. 21a). Antenas de seis antenómeros. Tubérculos antenales desarrollados, ligeramente convergentes. Antenómeros I y II con pequeñas espículas. Rostro con longitud que llega casi hasta las coxas posteriores. Cutícula abdominal generalmente con patrón poligonal. Alada con un parche dorsal abdominal negro, siete a 21 rinarios secundarios en antenómero III, cero a seis en IV, cero a tres en el V. Sifúnculos distendidos en su tramo distal (desde la parte media hacia el ápice); más cortos que antenómero III (Fig. 21b). Cauda triangular (Fig. 21c), con cuatro a seis setas, 1/3 de la longitud de los sifúnculos (Doncaster 1946, Blackman y Eastop 1994, 2000, 2006).
Comentarios. Se cita por primera vez para Colombia. Procedencia desconocida, distribuido en Gran Bretaña, Norte América, Venezuela, Argentina y las Islas suban-tárticas, (Doncaster 1946, MacGillivray 1954, Ortego et al. 2004, Cermeli 2006, Hullé 2012). Hospeda en más de 20 familias de plantas, en particular Alliaceae, Caryophyllaceae, Asteraceae, Cruciferae, Liliaceae y Rosaceae (Blackman y Eastop 1994, 2000, 2006).
Material estudiado: Un montaje en lámina para microscopia [UNAB 812]. Colombia: Antioquia, Medellín,
Cgto. San Cristóbal, Vda. La Palma, 6°14'41'' Norte, 75°34'29'' Este, 1479, 17 oct 2013, Col. R. Mejía, en hojas de Allium fistolosum (Liliaceae).
Illinoia morrisoni (Swain, 1918) (Fig. 22)
Longitud 1,5 a 2,3 mm; cuerpo fusiforme (Fig. 22a); verde manzana a verde oscuro, sin marcas dorsales oscuras. Antenas de seis antenómeros. Segmento antenal III con rinarios secundarios (Fig. 22b). Filamento terminal más de 1,3 veces el tramo proximal del antenómero VI. Cabeza lisa. Tubérculos antenales desarrollados, con aspectos mesiales divergentes (Fig. 22c). Rostro con longitud hasta las coxas medias. Sifúnculo fusiforme, con reticulación en 0,06 a 0,2 de la longitud (Fig. 22d). Cauda liguliforme, 0,35 a 0,45 la longitud del sifúnculo (Fig. 22e) (Blackman y Eastop 1994, Mier Durante et al. 2010).
Comentarios. Se cita por primera vez para Colombia. Su distribución natural es neártica. Su ruta de dispersión hacia Colombia se desconoce; distribuida en Inglaterra, Canadá, EE.UU., México, Costa Rica, Panamá, Venezuela y Argentina (Blackman y Eastop 1994, Cermeli 2007, Quirós et al. 2009, Villalobos Muller et al. 2010, Mier Durante et al. 2010). Hasta donde se conoce, solo Illinoia morrisoni desarrolla su ciclo de vida sobre especies de Cupressaceae, entre ellas varias del género Cupressus; se encuentra también en Araucariaceae, Taxodiaceae y raramente Pinaceae (Mier Durante et al. 2010).
Material estudiado: Un montaje en lámina para microscopia, [UNAB 817]. Colombia: Cundinamarca, Bogotá, Universidad Nacional de Colombia, 4°38'07'' Norte, 74°04'57'' Este, 2600m, 7 feb 2014, Col. R. Simbaqueba, en Cupressus lusitanica (Cupressaceae).
Ovatus crataegarius (Walker, 1850) (Fig. 23)
Longitud 1,0 a 2,4 mm, cuerpo piriforme (Fig. 23a), amarillo verdoso a verde claro. Antena 1,2 a 1,5 veces la longitud del cuerpo. Alados con once a 52 rinarios secundarios en el antenómero III, dos a 24 en el antenómero IV, cero a nueve en el antenómero V. Cabeza con numerosas espículas. Tubérculos antenales desarrollados, claramente diferenciables (Fig. 23b). Sifúnculo tubular, imbricado, con adelgazamiento gradual hacia el ápice, 1,7 a 2,6 veces la longitud de la cauda (Fig. 23c). Cauda digitiforme; sin constricción en ápteras (Fig. 23f); triangular en aladas (Blackman y Eastop 2000).
Comentarios. Se cita por primera vez para Colombia. Su distribución natural es Paleártica. Su ruta de dispersión hacia Colombia se desconoce; distribuida en Chile, Argentina, Panamá, EE.UU., España (Ghoshl y Nieto Nafría 1994, Fuentes-Contreras et al. 1997, Berry 1998, Suay y Gonzalez 1998, Ortego et al. 2004, Quirós et al. 2009). Por lo general, se encuentran en plantas de Mentha y algunas otras Lamiaceae (Melissa, Nepeta) (Blackman y Eastop 2000, 2006).
Material estudiado: Tres montajes en láminas para microscopia, [UNAB 4159]. Colombia: Cundinamarca, Rosal, Vda. Buena Vista, 4°52' Norte, 74°15' Este, 2734 m alt., 29 ago 2012, Col. L. Betancurth, en hojas de Mentha spicata (Lamiaceae) - Menta.