INTRODUCCIÓN
La heterogeneidad espacial es una propiedad inherente a cualquier ecosistema (Hamm y Drossel 2017). Es uno de los factores que afecta la presencia y abundancia de los organismos (Keller et al. 2009), por lo que tiene efectos significativos en la dinámica de las poblaciones, y por tanto en la diversidad de los ensamblajes (Tuanmu y Jetz 2015). Algunos estudios reportan un incremento en la diversidad de especies, en función de la heterogeneidad espacial (Tews et al. 2004, Kallimanis et al. 2010). Una de las condiciones que puede generar heterogeneidad espacial es la vegetación (Walz 2011), que para la mayoría de los animales determina la estructura física del ambiente, influenciando la distribución de las poblaciones y las interacciones intra e interespecíficas (González-Megías et al. 2007). Sin embargo, la respuesta de las especies a la heterogeneidad espacial varía acorde con sus características de historia de vida y manera de usar los recursos del hábitat (Suárez et al. 2016).
Los páramos son ecosistemas neotropicales de alta montaña, caracterizados por presentar una alta heterogeneidad espacial la cual es generada por la interacción entre diversos mosaicos de vegetación natural (Cabrera y Ramírez 2014). Estos ecosistemas, registran un alto grado de en-demismo, el cual se encuentra explicado por procesos históricos tales como eventos tectónicos (pj, glaciaciones, levantamiento de las cordilleras andinas; entre otros Gregory-Wodzicki 2000) y adaptaciones ecológicas y fisiológicas de la biota a las condiciones climáticas extremas y la topografía ondulada (Madriñán et al. 2013).
Uno de los linajes de vertebrados ectotermos con mayor endemismo en los páramos son los anuros (Ardila-Robayo y Acosta-Galvis 2000, Lynch y Suárez-Mayorga 2002). La distribución espacial de estas especies puede estar determinada por factores como: (1) los requerimientos fisiológicos de los organismos (Navas 1996a, b, 1997), (2) la disposición de los recursos (Navas 2006), y (3) las características del hábitat (Navas 1996a). Se ha demostrado que diferentes variables ambientales y estructurales, analizadas a escalas espaciales finas (ej. temperatura ambiental, radiación ultravioleta, presión parcial de oxígeno y humedad relativa; Navas 2002, 2006), están relacionadas con la diversidad y distribución de estos organismos (Navas 1996a). Por otra parte, algunos estudios muestran una relación de los gradientes ambientales con la estructura de la vegetación, debido a que los mosaicos brindan una amplia variedad de microhábitats para los anuros (Hoyos 1991, Navas 1996a, Tews et al. 2004).
Debido a las condiciones mencionadas anteriormente, los páramos son un excelente modelo para estudiar los efectos multiescalares de la heterogeneidad espacial en los mosaicos naturales de vegetación, sobre la diversidad de anuros. Hasta ahora, la mayoría de los estudios en anuros de páramo de Colombia, se han concentrado en realizar inventarios y descripciones taxonómicas (Hoyos 1992, Ardila-Robayo y Acosta-Galvis 2000, Lynch 2001, Méndez-Narváez 2014), analizar las adaptaciones comportamentales y fisiológicas de las especies (eg. búsqueda y selección de microhábitats y comportamientos termoconformistas; Hoyos 1991, Navas 1996a, b, Carvajalino-Fernández et al. 2011, Navas et al. 2013) y evaluar su distribución potencial bajo escenarios de cambio climático y de uso del suelo (Agudelo-Hz et al. 2019). Es importante considerar que la estructura y diversidad de ensamblajes de anuros, así como la distribución de especies, se encuentran determinadas por los gradientes ambientales, estructurales y de paisaje que operan a diferentes escalas espaciales (Keller et al. 2009). En ese sentido, nuestra investigación complementa los estudios previos realizados en anuros de páramo al plantear la siguiente pregunta: ¿de qué manera se relaciona la heterogeneidad espacial, a tres escalas, con la estructura de ensamblajes de anuros en el Valle de los Frailejones en el PNN Chingaza? Los objetivos específicos del presente estudio son: 1) comparar la estructura de los ensamblajes de anuros presentes en mosaicos de vegetación en el sector del Valle de los Frailejones en el Parque Nacional Natural (PNN) Chingaza, y 2) determinar la relación de los anuros con los gradientes ambientales, estructurales y de paisaje, a diferentes escalas espaciales.
MATERIALES Y MÉTODOS
Área de estudio: La investigación se llevó a cabo a 3150 m de altitud, en el sector del Valle de los Frailejones ubicado dentro del PNN Chingaza, Colombia, entre los 4°31' Norte, -73°46' Oeste (Fig 1). El sector se caracteriza por ser una transición entre subpáramo y páramo. La vegetación es principalmente herbácea y arbustiva, predominando las coberturas vegetales de frailejonales de las especies Espeletia grandiflora Humb. & Bonpl. y Espeletia argéntea Bonpl., arbustales del género Hypericum y Pentacalia, pajonales y turberas (Betancur et al. 2018). La topografía tiende a ser entre plana a suavemente ondulada y cuenta con alta densidad de cuerpos de agua estacionales y permanentes entre quebradas, riachuelos y turberas (UAESPNN 2016).
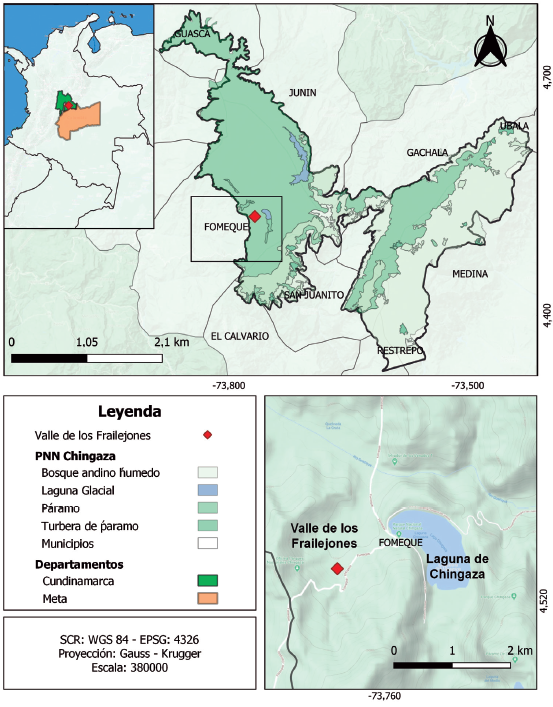
Figura 1 Área de estudio en el Valle de los frailejones, ubicado dentro del PNN Chingaza. (Información de ©Google terrain)
Diseño de la investigación: Dentro del Valle de los Frailejones se establecieron seis parcelas permanentes de 10 m x 10 m, que representan diferentes mosaicos de vegetación: a) Turbera-Pajonal, b) Frailejonal bajo, c) Turbera, d) Frailejonal alto con suelo desnudo e) Frailejonal alto y f) Turbera-Arbustal. Cada parcela se ubicó a una distancia mínima de 200 m de otra parcela, con el fin de garantizar la independencia de cada muestra y evitar que al momento de realizar el procesamiento de las imágenes las áreas de influencia de las unidades de paisaje se superpusieran. La vegetación se identificó con las guías de Madriñán (2010) y Betancur et al. (2018).
Caracterización de la estructura de las unidades de paisaje: Cada mosaico de vegetación fue caracterizado a partir de fotografías aéreas tomadas con un dron (DJI Mavic Pro) a 50 metros de altura del suelo. Por cada mosaico, se tomaron entre 30 y 50 fotos y se procesaron en una sola imagen con el programa Pix4Dmapper v4.0 (Pix4D 2017). A partir de estas imágenes, desde el centro de cada parcela, se establecieron dos áreas de influencia de 50 y 100 m de diámetro, a los cuales se les denominó "unidades de paisaje" (Suplemento 1).
Las dos unidades de paisaje (50 y 100 m) de cada mosaico de vegetación fueron analizadas con el programa ArcGIS v10.3 (ESRI 2012) y para la interpretación se utilizó una variante de la metodología de clasificación visual a partir de las categorías de coberturas vegetales de páramo, propuesta por Arellano-P y Rangel-Ch (2010). Se interpretaron trece clases a partir de las fotografías aéreas, las cuales fueron verificadas con salidas de campo para comprobar su respectiva categoría (Fig. 2). Con la información procesada de las imágenes se pudieron estimar diferentes métricas de paisaje como: extensión por clase (m2), riqueza o número de clases, diversidad de clases (índice Shannon log10) y dominancia de clases (Índice de Simpson) (Suplemento 2a).
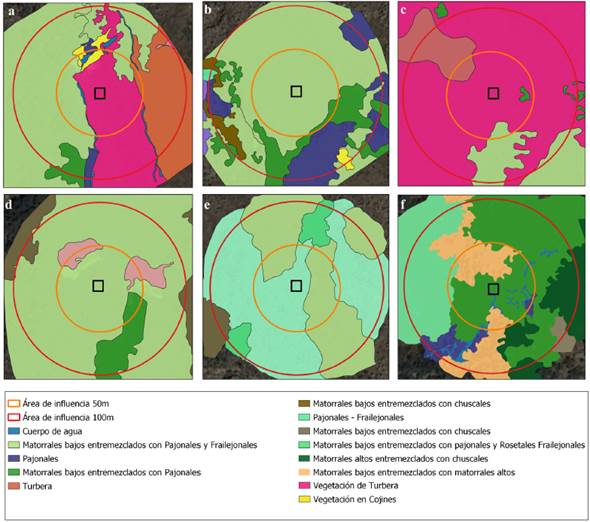
Figura 2 Clases de vegetación de cada mosaico muestreado. Las fotografías fueron procesadas para la caracterización de las unidades de paisaje a escalas de 50 m (círculo pequeño) y 100 m (círculo grande) de diámetro. a= Mosaico 1: Turbera-Pajonal; b = Mosaico 2: Frailejonal bajo; c = Mosaico 3: Turbera; d = Mosaico 4: Frailejonal alto con suelo desnudo; e = Mosaico 5: Frailejonal alto; f = Mosaico 6: Turbera-Arbustal.
Muestreo de Anuros y caracterización del gradiente ambiental y estructural de los mosaicos:
Se realizaron tres salidas de campo de cuatro días cada una, en temporada de lluvias, durante agosto, septiembre y octubre 2017. Se utilizó la técnica de muestreo de parcelas donde cada parcela representa uno de los seis mosaicos de vegetación estudiados. Los muestreos de anuros, los realizaron tres investigadores durante 45 minutos por mosaico de vegetación y durante las franjas horarias de 8:00 a 12:00 y 18:00 a 24:00. El esfuerzo de muestreo total de la presente investigación fue de 162 horas/persona.
Para caracterizar el gradiente ambiental de los mosaicos se evaluaron veinte variables ambientales y de estructura vegetal a nivel de la parcela y de microhábitat (Cortés-Gómez et al. 2013). En cada microhábitat en donde fue ubicado un individuo se midieron las siguientes variables: (1) temperatura del sustrato con termómetro infrarrojo de alta precisión (Extech® 50:1) (2) temperatura del aire, (3) velocidad del viento y (4) humedad relativa; estas tres variables fueron medidas a 5cm del sustrato donde era encontrado el individuo y se utilizó un medidor ambiental marca Kestrel® 4000 para su registro. Para cada parcela se registró la (5) temperatura del aire con un sistema automatizado de toma de datos HOBO® Pro v2. También se anotó el sustrato o microhábitat en donde fue observado por primera vez cada individuo.
Para caracterizar la estructura del hábitat se siguió el método de cuadrantes planteado por Mostacedo y Fredericksen (2000) y se evaluaron las siguientes variables como porcentaje de cobertura: (6) puyas, (7) Hypericum, (8) frailejones, (9) Pentacalia, (10) necromasa, (11) vegetación en colchones, (12) helecho, (13) Calamagrostis, (14) pasto (diferente a Calamagrostis), y (15) suelo desnudo. También se registró el número de (16) puyas, (17) arbustos del género Hypericum, (18) Pentacalia, (19) frailejones y (20) troncos de frailejones caídos (como parte de la necro-masa en suelo).
Análisis de datos: Diversidad y estructura del ensamblaje de anuros: Se determinó la riqueza específica de anuros como el número de especies encontrada en cada una de las parcelas. Para la identificación de las especies se utilizaron las claves de campo propuestas por Hoyos (1992), así como las reportadas en Cochran y Goin (1970) y Lynch (1994). Se evaluó la representatividad del mues-treo a partir de estimadores no paramétricos Bootstrap, Jacknife 1 y 2 (Gotelli y Colwell 2011). Basado en una matriz de Bray-Curtis, previamente transformada a raíz cuadrada, se evaluaron los cambios en la estructura de los ensamblajes entre los mosaicos de vegetación. Se utilizó un PERMANOVA con suma parcial de cuadrados (tipo III) y la permutación de residuales bajo un modelo reducido con 9999 permutaciones. Para determinar las diferencias entre mosaicos de vegetación se realizó una comparación a posteriori por pares con el estadístico t basado en 9999 permutaciones. Con el fin de visualizar los patrones en la estructura de los ensamblajes de anuros entre mosaicos de vegetación, se realizó una ordenación multivariada con un análisis de coordenadas principales (PCoA). En el PCoA se visualizaron aquellas especies con un coeficiente de correlación de Pearson superior a 0,7 con alguno de los dos primeros ejes de ordenación.
Relación entre el gradiente ambiental de los mosaicos con la estructura del ensamblaje de anuros: Se determinaron los coeficientes de correlación de Pearson entre las variables ambientales-estructurales para identificar variables colineales (valores mayores al 70 % fueron excluidos de posteriores análisis; Bray y Curtis 1957) (ver suplemento 2b). Se realizó el mismo procedimiento con las métricas de paisaje evaluadas a un área de influencia de 50 y 100m (ver suplemento 2c y d). Para identificar las variables que están relacionadas con cambios en la estructura de los ensamblajes de anuros se evaluaron diferentes modelos lineales basados en distancias (DistLM) para cada una de las áreas de influencia (a) microhábitat, (b) unidad de paisaje a 50 m y (c) unidad de paisaje a 100 m. Estos modelos se construyeron a partir de una matriz de similitud de Bray-Curtis, previamente transformada a raíz cuadrada, como variable de respuesta y la matriz de distancias euclidianas de las variables del microhábitat o métricas del paisaje, previamente estandarizadas, como variables predictoras. Se escogieron los mejores modelos, usando como criterio el valor del coeficiente de regresión ajustado (Adj R2). Para cada área de influencia, el mejor modelo fue graficado con un análisis de redundancia basado en las distancias (dbRDA). Todos los análisis se realizaron en paquete PRIMER v7 y PERMANOVA add on v1.0.4 (Anderson et al. 2008, Clarke y Gorley 2015).
RESULTADOS
Diversidad y estructura del ensamblaje de anuros del Valle de Frailejones. Se registró un total de 45 individuos de cuatro especies de anuros, pertenecientes a dos géneros y dos familias (Tabla 1). Craugastoridae fue la familia más representativa con tres especies pertenecientes al género Pristimantis. Pristimantis bogotensis (Peters, 1863) fue la única que se registró en todos los mosaicos de vegetación. Las especies Pristimantis nervicus (Lynch, 1994) y Pristimantis elegans (Peters, 1863) sólo se encontraron en mosaicos de Frailejonal alto (mosaico 5) y Dendropsophus molitor (Schmidt, 1857) únicamente se registró en turberas (mosaicos 1, 3 y 6). El Frailejonal Alto (mosaico 5) registró el mayor número de especies (S=3), y en contraste, el Frailejonal Alto (mosaico 4) presentó la menor riqueza (S=1).
Tabla 1 Abundancia de las especies de anuros registradas en los diferentes mosaicos de vegetación en 162 h/persona durante tres salidas de cuatro días por tres personas.
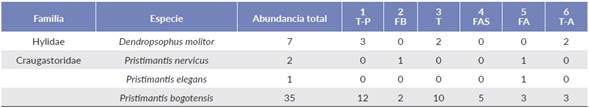
T-P= Turbera-Pajonal, FB= Frailejonal bajo, T= Turbera, FAS= Frailejonal alto con suelo desnudo, FA= Frailejonal alto, T-A= Turbera-arbustal.
Para el número total de especies, los estimadores de Boostrap, Jacknife 1 y 2 sugieren una representatividad entre el 80,5 % y 89,2 % de la riqueza esperada para el Valle de Frailejones. La estructura de los ensamblajes de anuros no presentó cambios entre los mosaicos de vegetación (Pseudo-F=1,35; Pperm=0,24). Sin embargo, las similitudes al interior de los mosaicos fluctuaron entre 50 % (Mosaico 6: Turbera-Arbustal) y 93,7 % (Mosaico 4: Frailejonal Alto con Suelo Desnudo), mientras que entre mosaicos la similitud fluctuó de 57 % a 82 % (ver suplemento 3). La primera coordenada del PCoA separó la estructura de los ensamblajes de anuros entre los Frailejonales Bajo (mosaico 2) y Alto (mosaico 5) del resto de mosaicos de vegetación; en estos dos primeros mosaicos se incrementó la abundancia de P. nervicus y P. elegans y se redujo en las especies P. bogotensis y D. molitor. La segunda coordenada diferenció el Frailejonal Alto con suelo desnudo (mosaico 4) del resto de mosaicos de vegetación (Fig. 3).
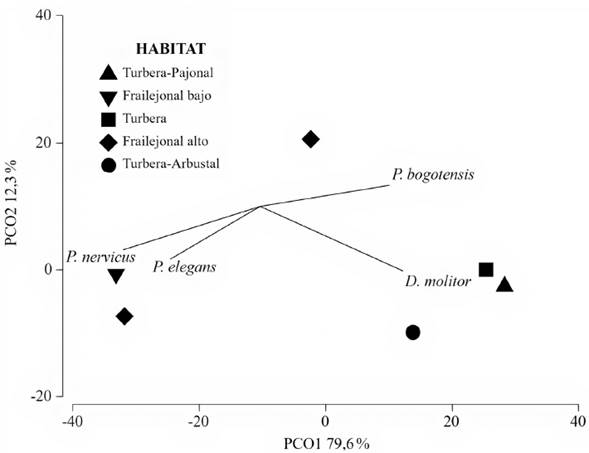
Figura 3 Análisis de coordenadas principales (PCoA) de las especies de anuros asociadas a cada mosaico de vegetación en el sector del Valle de los Frailejones en e PNN Chingaza.
Relación entre la heterogeneidad espacial, a diferentes escalas, con la estructura del ensamblaje de anuros. A escala del microhábitat, los mejores modelos lineales basados en distancias (DistLM) explicaron el 99 % en la variación en la estructura de los ensamblajes de anuros (Adj R2=0,99) a partir de cuatro variables ambientales y de estructura vegetal (ver suplemento 4). La variable que por sí sola explicó mejor la variación en la estructura del ensamblaje de anuros fue el porcentaje de frailejones (Adj R2= 0,64), seguido por la interacción entre el porcentaje de frailejones y el número de troncos de frailejones caídos (Adj R2= 0,80), y por la interacción entre el porcentaje de frailejones, el número de troncos de frailejones caídos y la temperatura del aire de la parcela (Adj R2= 0,91). El análisis de redundancia basado en distancias (dbRDA) explicó el 91,5 % de la variación del ensamblaje de anuros en los dos primeros ejes, a partir de la interacción entre seis variables: la temperatura del aire (ambiental y en el micro-hábitat), el viento, % de frailejones, % de suelo desnudo y número de troncos de frailejones caídos (como parte de la necromasa en suelo) (Fig. 4a).
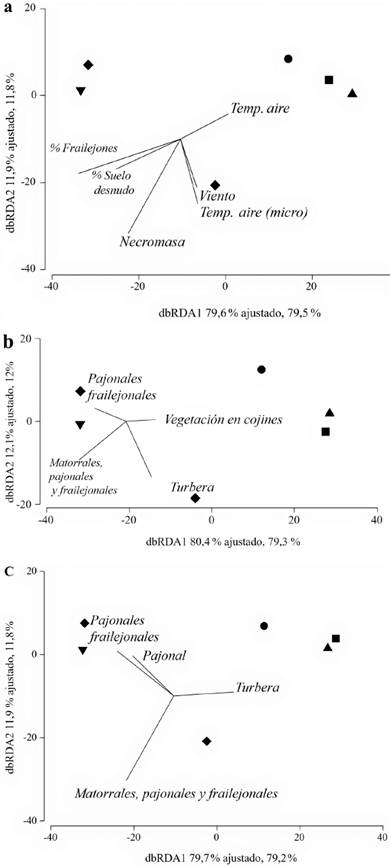
Figura 4 Análisis de redundancia basado en distancias (dbRDA) que relaciona cambios en la estructura de los ensamblajes de anuros con: a los cambios en las variables ambientales - estructurales (escala de microhábitat); b las clases en un área de influencia delpaisaje de 50m: y c las clases en un área de influencia de 100m. ▼ = Frailejonal bajo, ▲ = Turbera-Pajonal, ♦ = Frailejona alto, • = Turbera-Arbustal, ■ = Turbera
A un área de influencia de 50m en las unidades de paisaje, el modelo mejor ajustado incluyó cuatro métricas a nivel de extensión de las clases (Turbera, Matorrales, Pajonales y Frailejonales, Vegetación en Cojines y Pajonales Fraile-jonales; suplemento 4). La variable que por sí sola explica mejor la variación en la estructura de los ensamblajes de anuros fue la riqueza de clases (Adj R2= 0,33), seguida por la interacción entre la riqueza de clases y la Extensión de la Turbera (Adj R2= 0,63), y por la interacción entre la riqueza de clases, la Extensión de la Turbera y la Vegetación asociada a la Turbera (Adj R2= 0,78). El dbRDA explicó el 91,3 % de la variación del ensamblaje de anuros en los dos primeros ejes, a partir de la interacción entre cuatro variables: la Extensión de Pajonales-Frailejonales, Extensión de Vegetación en Cojines, Extensión de Turbera y la Extensión de Matorrales Bajos Entremezclados con Pajonales y Frailejonales (Fig. 4b).
Para las unidades de paisaje, analizadas a un área de influencia de 100m, se identificaron dos modelos ajustados, a partir de cuatro variables, las cuales explican entre el 95,9 - 96,3 % de la variación en la estructura de los ensamblajes de anuros (suplemento 4). De las nueve variables incluidas solo cuatro fueron significativas en el modelo ajustado, las cuales corresponden a la extensión de las siguientes clases: turbera, matorrales, pajonales y frailejonales, pajonales-frailejonales. La variable que por sí sola explica mejor la variación en los ensamblajes de anuros fue la extensión de la turbera (Adj R2= 0,30), seguida por la interacción entre la extensión de la turbera y la extensión de matorrales, pajonales y frailejonales (Adj R2= 0,57). Finalmente, la interacción entre la Extensión de la Turbera, la Extensión de los Matorrales, Pajonales y Frailejonales, y la Extensión de los Pajonales-Frailejonales explicó el 71,9 % de la variación. El dbRDA explicó el 90 % de la variación del ensamblaje de anuros en los dos primeros ejes, a partir de la interacción entre cuatro variables: la extensión de Pajonales-Frailejonales, la Extensión de Turbera, la Extensión de Pajonales y la Extensión de Matorrales Bajos Entremezclados con Pajonales y Frailejonales (Figura 4c).
DISCUSIÓN
Estructura de los ensamblajes de anuros del Valle de Frailejones: El presente trabajo representa el primer estudio a nivel de ensamblajes para los anuros del Valle de Frailejones, lugar donde hasta el momento no existe un listado de anfibios con sus abundancias. Sin embargo, para el PNN Chingaza se han publicado algunos estudios en ecología de hace más de 20 años (Hoyos 1991, Hoyos 1992, Navas 1996a b) y más recientemente una caracterización de la herpetofauna en la zona de transición bosque-paramo por parte de Henao et al, (2019), así como y el listado de anfibios del PNN Chingaza (Caballero-Arias et al. 2019). Al observar el registro de anuros de altas elevaciones (3000m), en los estudios mencionados anteriormente (Hoyos 1991, Navas 1999, Méndez-Narváez 2014), se identifican 14 especies que posiblemente podrían estar en el Valle de Frailejones. Al comparar los datos de riqueza observada en el presente estudio, con los que se reportan históricamente para el PNN Chingaza (Caballero-Arias et al. 2019), se puede ver que, de las doce especies registradas para el ecosistema de páramo sólo se registraron cuatro.
Las investigaciones que se han realizado en hábitats paramunos tienden a reportar un bajo número de especies (Lynch y Suárez-Mayorga 2002, Méndez-Narváez 2014, Buitrago-Gonzáles et al. 2016). Si bien el presente estudio obtuvo una representatividad alrededor del 80 %, la ausencia de más especies como: Hyloxalus subpunctatus (Cope, 1899), Pristimantis affinis (Werner, 1899), Strabo-mantis ingeri (Cochran & Goin, 1961) y Atelopus muisca Rueda & Hoyos, 1991, en el área de estudio, puede explicarse por tres razones: (1) la falta de mayor esfuerzo de muestreo, abarcando otros meses y temporadas climáticas en el año; (2) históricamente estas especies nunca llegaron al Valle de Frailejones por lo que se debe incrementar la representatividad geográfica del muestreo a otros sectores del PNN Chingaza; o (3) algunas de estas especies estuvieron presentes en el Valle de Frailejones en el pasado, pero actualmente, diferentes factores de amenaza han hecho que estas hayan sido extirpadas localmente (Méndez-Narváez 2014). Tal podría ser el caso de las especies de Atelopus con registro para el PNN Chingaza y en particular con cercanía al Valle del Frailejón (Pj. Atelopus muisca), las cuales no han sido avistadas en esta zona desde 1995 (Caballero-Arias et al. 2019).
Pristimantis bogotensis fue la especie más abundante y la única que se registró en todos los mosaicos de vegetación y ha sido considerada como una de las más abundantes en el PNN Chingaza (Hoyos 1991, Caballero-Arias et al. 2019). Las especies P. nervicus y P. elegans se encontraron sólo en frailejonales y con abundancias muy bajas. Por otra parte la especie Dendropsophus molitor fue la única registrada de la familia Hylidae, lo cual concuerda con otros estudios dentro del PNN Chingaza (Hoyos 1991, Bernal y Guzmán 2000); esta especie fue encontrada exclusivamente en los sitios de turbera y mayormente registrada en horas de la noche dentro de charcas o en sus alrededores.
Ensamblajes de anuros y su relación con el microhábitat: Una de las variables que tuvo mayor efecto sobre la estructura de los ensamblajes fue el porcentaje de frailejones, seguido por el número de troncos de frailejones caídos. Tanto los frailejones como su necromasa, han sido reportados como microhábitats de importancia para las especies del género Pristimantis, las cuales fueron mayormente registradas en parcelas con este tipo de estructura vegetal (Fernández-Roldán 2014, Buitrago-González, 2016). El uso de estos sitios, contribuye a resguardarse de la gran variación higro-térmica que se da durante el día en el páramo (Hoyos 1991, Fernández-Roldán 2014). Por otra parte, estas especies presentan desarrollo directo, que es uno de los modos reproductivos más higrodependientes que existen (Lynch y Suárez-Mayorga 2002); tienen huevos que no son pigmentados, por lo que las ranas buscan sitios de anidación protegidos del sol y con humedad, como es el caso de Pristimantis elegans, en la cual adicionalmente, se ha reportado cuidado parental (Martínez 2017).
Por otra parte, los modelos utilizados en el análisis muestran a la temperatura del aire como una de las que mayormente afecta a los ensamblajes en los mosaicos de vegetación. Esta respuesta se explica por el papel importante que juega la temperatura en el desempeño de los anuros como organismos ectotérmicos (Andrade et al. 2016, Navas 1996b, 1999). En mosaicos dominados por turberas, esta variable tuvo los valores más altos debido a la ausencia de arbustos lo cual genera mayor exposición a la radiación solar y al viento. Las condiciones ambientales y estructurales de estos sitios permite que organismos de hábito terrestre, como P. bogotensis, hagan uso de elementos presentes como puyas o pastos para evitar sobrexposición en horas de mayor radiación, en busca de microhábitat con mayor humedad. El uso de los cuerpos de agua en las turberas, por parte de D. molitor, se encuentra asociado a sus hábitos semiacuático y modo reproductivo con huevos y renacuajos exotróficos en aguas lénticas (Méndez-Narváez 2014, Blanco-Torres et al. 2018) e incluso en el presente estudio se registraron algunas posturas y actividad vocal nocturna, lo que demuestra la actividad reproductiva en este mosaico de vegetación.
Por último, los mejores modelos ajustados incluyen a la velocidad del viento y al porcentaje de suelo desnudo como otras variables que afectan la estructura del ensamblaje. Los sitios que registraron mayores valores para estas variables también registraron un menor número de especies (Frailejonal Alto con Suelo Desnudo; mosaico 4), por lo que se podría vislumbrar un efecto negativo en el balance hídrico de los anuros debido a la deshidratación. El suelo desnudo expone a los organismos a las altas temperaturas que se dan en el páramo durante el día (Navas 1996a) y una alta velocidad del viento puede contribuir a una mayor pérdida de agua en ellos (Andrade et al. 2016).
Ensamblaje de anuros y su relación con el paisaje: Las variables que explican los cambios en el ensamblaje actúan de manera diferente de acuerdo con el área de influencia (50 y 100 m). A 50 m de área de influencia, la Riqueza de Clases (o tipos de vegetación) tiene un mayor efecto en la estructura del ensamblaje. La composición del paisaje a escalas espaciales más finas puede ser más importante que la configuración, lo cual indica la relevancia de elementos heterogéneos en el espacio, para las especies distribuidas en estas zonas. La segunda clase con mayor relevancia es la Extensión de Turbera, seguida por la Vegetación Asociada a Turbera. En estos lugares se registra una mayor abundancia de estructuras vegetales de tipo arrosetada como las puyas, las cuales son usadas por las especies de Pristimantis y juveniles de D. molitor.
Cuando se analiza el efecto del área de influencia de 100 m, la configuración y el tamaño de las clases, tienen mayor efecto en la estructura el ensamblaje de anuros. A esta escala, el área de Turbera es la variable más importante, seguida por el área de los Matorrales Bajos Entremezclados con Pajonales y Frailejonales. En mosaicos con grandes extensiones de estas clases se registraron bajas abundancias o incluso la ausencia de anuros. Tal vez esto se debe a que en estos mosaicos de vegetación no predominan estructuras vegetales que provean microhábitats óptimos para los anuros de paramo (Hoyos 1991, Navas 1996a). En contraste, a esta área de influencia, el área de los Pajonales, Pajonales-Frailejonales, y Vegetación en Cojines fueron clases con una influencia positiva en los ensamblajes de anuros. Estos microhábitats se reportan como de uso común por parte de especies de páramo como Pristimantis simoterus (Lynch, 1980), Pristimantis racemus (Lynch, 1980) y Pristimantis peraticus (Lynch, 1980) (Buitrago-González et al. 2016).
Para que la ecología del paisaje sea informativa en estudios de comunidades bióticas, se debe tener en cuenta la escala ecológica del efecto y los requerimientos de los organismos de estudio (Jackson y Fahig 2015). En el caso de anuros, la estructura y diversidad de los ensamblajes, así como su distribución, se encuentran determinadas por diversos componentes que operan a diferentes escalas espaciales (Keller et al. 2009). A escalas espaciales más amplias, algunos procesos como los patrones de diversidad alfa y beta podrían estar afectados por factores como la capacidad de dispersión de los organismos, la geomorfología, el clima y la composición y estructura del paisaje (Luiz et al. 2016). Por otra parte, a escalas espaciales más finas, la diversidad de especies puede estar mejor explicada por las condiciones ambientales y estructurales del microhábitat y su relación con rasgos de historia de vida y fisiología (Navas 1996a)
Es importante mencionar que una aproximación que integre análisis de paisajes en ambientes naturales como los presentes en el PNN Chingaza, contribuye a entender los mecanismos que estructuran los ensamblajes de anuros de páramo, teniendo en cuenta la escala ecológica, o escala de efecto a la cual el paisaje influye en estos organismos. Estos datos pueden ayudar a detectar cambios en los ensamblajes y poblaciones de anuros de alta montaña y con esta información se podrían generar enfoques más proactivos para la gestión de la conservación de la biodiversidad de anuros en el Parque Nacional Natural Chingaza.















