INTRODUCCIÓN
El manglar es uno de los ecosistemas tropicales más importantes del planeta (Rodríguez-Zuñiga et al. 2013), el cual, a pesar de sus condiciones adversas, es capaz de soportar una considerable cantidad de insectos de diferentes niveles tróficos (Cannicci et al. 2008, Nagelkerken et al. 2008; Castaño-Meneses 2012), desde barrenadores, defoliadores y detritívoros, hasta depredadores; los cuales se encuentran distribuidos en diferentes microhábitats que van desde las raíces hasta el dosel (Hogarth 2007). Se ha documentado la interrupción estructural y funcional de los insectos herbívoros en el crecimiento de los árboles (Schowalter 2000, Ballina-Gómez et al. 2008), afectando la arquitectura, reproducción y expresión sexual de la vegetación (Whitham y Mopper 1985, Rodgers et al. 1995). Dentro de estos insectos podemos encontrar a los coleópteros barrenadores de madera (Nagelkerken et al. 2008, Ortíz-Reyes et al. 2018), mismos que juegan un papel fundamental en el ciclo de los nutrientes, ya que están relacionados con la descomposición de materia orgánica vegetal. El número limitado de especies arbóreas en el manglar proporciona una abundante e importante fuente de alimento para este grupo de insectos (Nagelkerken et al. 2008), entre los cuales sobresalen los escolítidos, platipódidos y bostríquidos, que en su gran mayoría son especies secundarias, que se alimentan de troncos y ramas de árboles recién muertos, moribundos o debilitados por alguna deficiencia fisiológica o perturbación externa; sin embargo, algunas especies pueden ser primarias y capaces de causar la muerte de árboles sanos y vigorosos (Ng y Sivasothi 2002, López-Romero et al. 2007, Nagelkerken et al. 2008). Jones y Eggleton (2000), mencionan la importancia de determinar el agrupamiento de los insectos para conocer la composición de las especies, la cual varia tanto horizontal como verticalmente (Erbilgin y Raffa 2003). El presente estudio tuvo como objetivo comparar la fluctuación y distribución vertical de la comunidad de escarabajos barrenadores asociados al borde e interior de un manglar.
MATERIALES Y MÉTODOS
Sitio de estudio
El estudio se realizó en el manglar de Chiltepec, Sección Banco (18°25' Norte, 93°06' Oeste) en el municipio de Paraíso, Tabasco, México, de agosto de 2016 a julio de 2017. En este trabajo se hizo una caracterización cualitativa y general de la vegetación resultando en lo siguiente: El interior de este ecosistema presenta una mezcla de Rhizophora mangle L., Avicennia germinas (L.) L. y Laguncularia racemosa (L.) Gaertn., con un área basal promedio de 1,3 m2/0,1ha y una altura promedio de 12 m. El suelo es principalmente arenoso y profundo, de mediana fertilidad, denominado Arenosol. En el borde del manglar es muy abundante L. racemosa, con algunas especies vegetales acompañantes principalmente de las familias Burseraceae, Fabaceae, Arecaceae y Anacardiaceae.
Captura de insectos
Para recolectar la mayor riqueza y abundancia de insectos posible se utilizaron trampas de intercepción cebadas con alcohol etílico al 70 % y trampas de luz ultravioleta. Se seleccionaron seis puntos de muestreo; tres ubicados en el borde del manglar, separados a 50 m entre ellos y tres puntos ubicados en el interior del ecosistema, separados a la misma distancia que los del borde. Las trampas del interior estuvieron separadas a 200 m del borde. Con el propósito de analizar la distribución vertical, en cada punto de muestreo se instalaron tres trampas de alcohol etílico a 1,5 m, 6 m y 12 m de altura. Las trampas de alcohol utilizadas consistieron en un embudo de plástico, en cuyo extremo inferior hay un recipiente para recolectar los insectos y en la parte superior una pantalla de plástico transparente, por encima de la cual se adicionó una tapa de plástico. Dentro de la pantalla se colocó un tubo de plástico con diámetro de 15 mm, en el cual se agrega alcohol etílico al 70 % como material atrayente. La recolección de los insectos atraídos en cada una de las trampas se realizó quincenalmente durante todo el año. Las trampas de luz ultravioleta fueron similares a las de alcohol, el material atrayente fue sustituido por una fuente de luz ultravioleta proporcionada por una lámpara STEREN modelo: SEG-045 de 6 watts, las cuales fueron colocadas una vez al mes a una altura de 1,5 m a las 18:00 horas y levantadas al día siguiente. Los especímenes se conservaron en alcohol etílico al 70 % para su posterior determinación (Pérez-De la Cruz et al. 2009a, 2009b).
Determinación taxonómica de los insectos
Se realizó mediante las claves taxonómicas de Fisher (1950), Wood (1982, 1986), Binda y Joly (1991), Bahillo et al. (2007), Pérez-De la Cruz et al. (2011) y se hicieron comparaciones con material depositado en la Colección de Insectos de la Universidad de Tabasco (CIUT).
Análisis de datos
La eficiencia del muestreo en cada uno de los estratos verticales se obtuvo mediante las curvas de acumulación de especies utilizando el estimador no paramétrico chao 1 (Moreno 2001). Para comparar la diversidad de insectos del borde y del interior del manglar se tomaron en cuenta los tipos de trampas, utilizando el programa EstimateS 9.1.0, donde se calculó el índice de diversidad verdadera de orden 1 (1D) (Jost 2006, 2007, Tuomisto 2010, 2011, Moreno et al. 2011). La riqueza y abundancia de los insectos recolectados mensualmente por las trampas de alcohol en cada una de las alturas se compararon gráficamente con la precipitación, temperatura y humedad promedio del área de estudio. La información meteorológica proviene de la estación de la Comisión Nacional del Agua (CONAGUA) (18°25' Norte, 93°09' Oeste). Para comparar la diversidad de insectos en cada uno de los estratos verticales del borde e interior del manglar en los meses de muestreo, se utilizaron los datos de las trampas de alcohol con los cuales se calculó el índice de diversidad de orden 1 (1D), (Jost 2006, 2007, Tuomisto 2010, 2011, Moreno et al. 2011). Posteriormente, se compararon los valores de diversidad y la abundancia mensual registrada, mediante modelos lineales generalizados y un análisis post-hoc Xi2 para coeficientes estandarizados (Saldaña-Vázquez et al. 2010), usando el software R versión 3.0.2 (The R Core Team c2018) y el paquete Rcmdr versión 2.0-2 (Fox et al. c2013). Finalmente, Para analizar la equitatividad de la comunidad entre las alturas se utilizó el índice de Pielou y para la similitud el índice de Sorensen (Magurran 1989, Moreno 2001).
RESULTADOS
Se recolectaron 5496 especímenes pertenecientes a 45 especies de 23 géneros; Scolytinae fue la subfamilia con mayor diversidad, con 35 especies distribuidas en quince géneros, en tanto que de Platypodinae se recolectaron seis especies de cuatro géneros y de Bostrichidae cuatro especies de cuatro géneros. Los géneros con mayor riqueza de especies fueron Hypothenemus con ocho y Xyleborus con siete. La especie que registró mayor abundancia fue Xyleborus volvulus (Fabricius, 1775) con 1265 individuos, representando el 23,02 % de la recolección total. Para las capturas con trampas de alcohol, se registraron 5168 especímenes pertenecientes a 42 especies de 21 géneros: La subfamilia Scolytinae presentó los mayores registros con 32 especies de trece géneros, seguidos de Platypodinae con seis especies de cuatro géneros y de Bostrichidae con cuatro especies de cuatro géneros. En las trampas de luz se capturaron 328 especímenes pertenecientes a 19 especies de diez géneros, de las cuales quince especies de siete géneros pertenecen a Scolytinae, tres especies de dos géneros a Platypodinae y una especie de un género a Bostrichidae. Las especies Araptus tabogae (Blackman, 1942), Cnesinus sp1 y Xyleborus macer Blandford, 1898 fueron capturadas solo con este método.
El estimador de riqueza Chao 1 muestra que la completitud del muestreo en el borde fue de 85,71, 86,86 y 83,90 % para 1,5, 6 y 12 m respectivamente. En el interior del manglar la completitud del muestreo fue de 89,29, 90,03 y 88,28 % para 1,5, 6 y 12 m respectivamente. El borde tiene una diversidad mayor (1D), de 15,82, frente al interior con 11,67. En el borde del manglar con las trampas de alcohol se recolectaron 2915 individuos, pertenecientes a 37 especies de 19 géneros, de los cuales 29 especies de doce géneros son Scolytinae, cinco especies de cuatro géneros son Platypodinae y tres especies de tres géneros son Bostrichidae. Las trampas ubicadas a 1,5 m de altura capturaron la mayor abundancia con 1684 individuos y una riqueza de 30 especies, donde X. volvulus, Xyleborus posticus Eichhoff, 1869, Hypothenemus seriatus (Eichhoff, 1872) e Hypothenemus eruditus Westwood, 1836 registraron mayor abundancia con el 60,93 %. Las trampas ubicadas a 6 m de altura capturaron la mayor riqueza con 33 especies, donde X. volvulus e H. seriatus tuvieron la mayor abundancia con 37,55 % de los individuos. Las trampas ubicadas a 12 m capturaron menor riqueza con 26 especies, donde X. volvulus e H. eruditus registraron mayor abundancia con 29,53 %.
En el interior del manglar se recolectaron 1596 individuos, pertenecientes a 31 especies de 16 géneros, de los cuales 23 especies de diez géneros pertenecen a Scolytinae, cuatro especies de dos géneros a Platypodinae y cuatro especies de cuatro géneros a Bostrichidae. Las trampas ubicadas a 1,5 m de altura capturaron la mayor abundancia con 808 individuos y una riqueza de 25 especies, donde X. volvulus e H. seriatus fueron las que registraron mayor abundancia con el 70,17 %. Las trampas ubicadas a 6 m de altura capturaron la mayor riqueza con 26 especies con una abundancia de 841 individuos, donde X. volvulus y X. posticus fueron las que registraron mayor abundancia con el 32,43 %. Las recolecciones a 12 m registraron la menor abundancia con 307 individuos y una riqueza de 25 especies, donde Cryptocarenus seriatus Eggers, 1933, Microcorthylus minimus Schedl, 1950 e H. eruditus registraron mayor abundancia con el 37,47 % (Tabla 1).
Tabla 1 Abundancia de las especies de escarabajos capturados en trampas a diferentes alturas en el borde e interior del manglar en Tabasco, México.
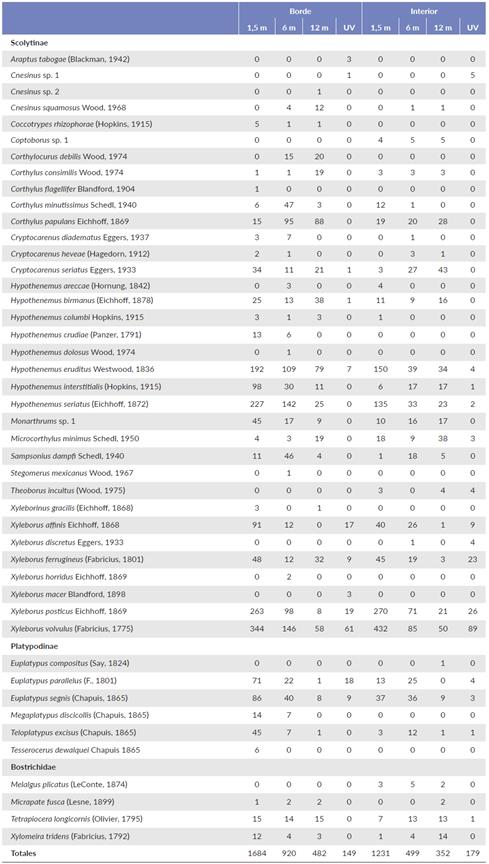
m= metros de altura, y UV= Luz ultra violeta.
En el borde e interior del manglar la máxima diversidad se obtuvo a 6 m y la mínima a 1,5 m (Tabla 2). En el borde los análisis de similitud entre las comunidades mostraron que 86 % de las especies registradas a 1,5 m se comparten a 6 y 12 m. En el interior, 86 % de las especies registradas a 6 m se comparten a 1,5 y 12 m (Tabla 3).
Tabla 2 Diversidad de escarabajos capturados a diferentes alturas en el borde e interior de manglar en Tabasco, México.
| Riqueza | Diversidad (1D) | Equitatividad | Chao 1 | |
|---|---|---|---|---|
| Borde 1,5 m | 30 | 11,98 | 0,73 | 35,00 |
| Borde 6 m | 33 | 14,50 | 0,76 | 37,99 |
| Borde 12 m | 26 | 12,77 | 0,78 | 30,99 |
| Interior 1,5 m | 25 | 6,72 | 0,59 | 28,00 |
| Interior 6 m | 26 | 16,65 | 0,85 | 29,99 |
| Interior 12 m | 25 | 15,25 | 0,84 | 28,32 |
Tabla 3 Especies compartidas (diagonal inferior izquierda) y valores de similitud entre sitios y alturas de captura (diagonal superior derecha) de un manglar de Tabasco, México.
| Borde 1,5 m | Borde 6 m | Borde 12 m | Interior 1,5 m | Interior 6 m | Interior 12 m | |
|---|---|---|---|---|---|---|
| Borde 1,5 m | - | 0,86 | 0,86 | 0,76 | 0,79 | 0,76 |
| Borde 6 m | 27 | - | 0,81 | 0,80 | 0,82 | 0,75 |
| Borde 12 m | 25 | 24 | - | 0,82 | 0,79 | 0,75 |
| Interior 1,5 m | 21 | 24 | 21 | - | 0,86 | 0,84 |
| Interior 6 m | 22 | 25 | 21 | 22 | - | 0,86 |
| Interior 12 m | 22 | 22 | 19 | 21 | 22 | - |
La abundancia de la comunidad de escarabajos en el borde presentó notables diferencias durante el año de estudio, obteniendo su máximo pico en junio en las trampas ubicadas a 1,5 m de altura. En las capturas realizadas a 6 m su máximo pico se presentó en marzo con un repunte en noviembre. Sin embargo, a los 12 m la mayor abundancia se registró en enero (Fig. 1). En el interior del manglar la abundancia presentó sus máximos picos en enero, noviembre y diciembre a 1,5 m de altura. A los 6 m se registró la mayor abundancia en enero, marzo y abril, mientras que a los 12 m se registró en julio (Fig. 2). Al contrastar las fluctuaciones de las comunidades con las variables ambientales, se puede observar que el máximo pico reportado en el borde a 1,5 m y el mínimo valor de abundancia a la misma altura en el interior coincide con el promedio de precipitación (158,20 mm) más elevado durante el estudio (Fig. 1a y 2a).
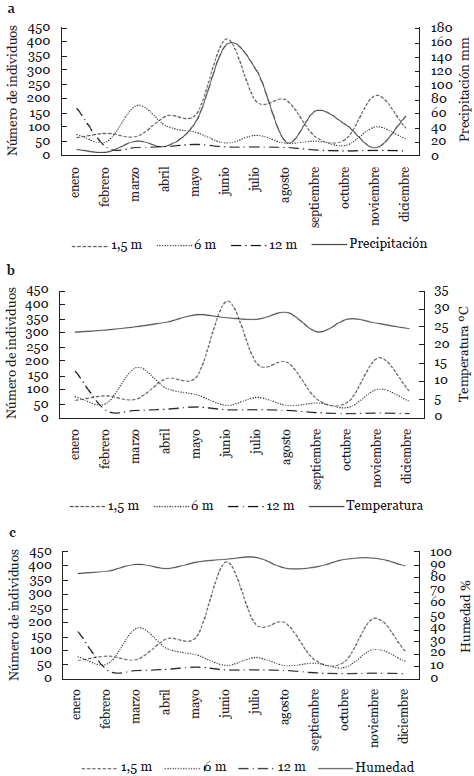
Figura 1 Fluctuación de la abundancia de escarabajos capturados en trampas a diferentes alturas y variables climáticas en el borde de un manglar de Tabasco, México. a. precipitación; b. Temperatura; c. humedad
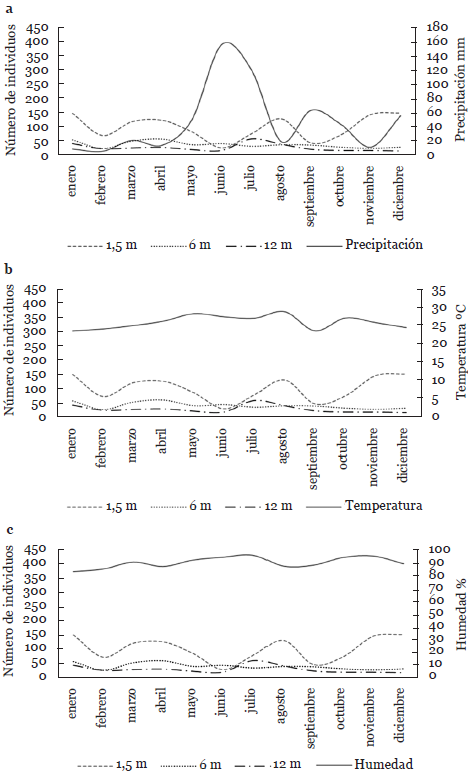
Figura 2 Fluctuación de la abundancia de escarabajos capturados en trampas a diferentes alturas y variables climáticas en el interior de un manglar de Tabasco, México. a. precipitación; b. Temperatura; c. humedad.
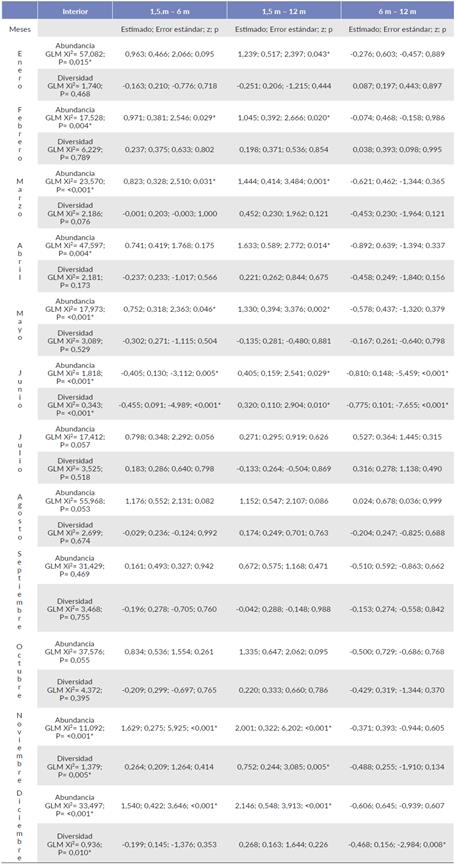
El borde presentó diferencias estadísticas en cuanto a su abundancia en diez de los doce meses de estudio. Así mismo, en el interior estas diferencias estadísticas se presentaron en ocho de los doce meses. Se presentaron diferencias estadísticas en la diversidad en el borde en abril, mayo, julio y agosto (Tabla 4), y para el interior estas diferencias se registraron en junio, noviembre y diciembre (Tabla 5).
Tabla 4 Modelo lineal generalizado de la abundancia y diversidad de insectos capturados en el borde, entre alturas de recolección en un manglar de Tabasco, México.
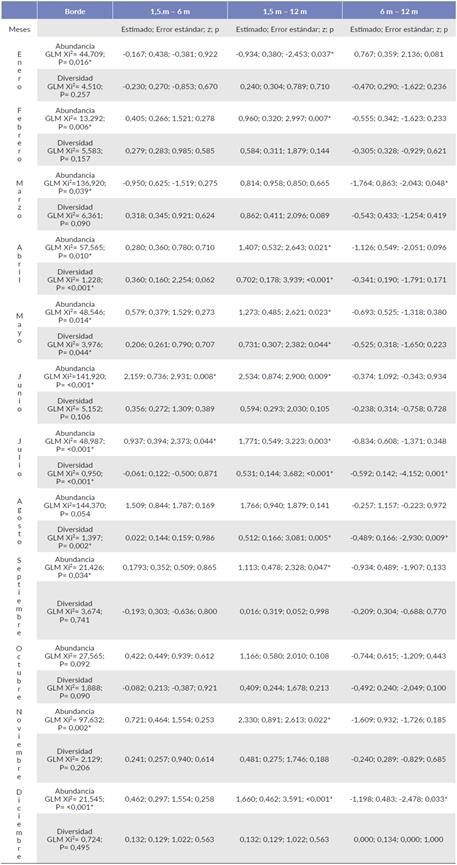
[*] Indica diferencias estadísticamente significativas.
DISCUSIÓN
La riqueza de especies de los géneros Hypothenemus y Xyleborus en nuestro estudio es similar a lo descrito por Gerónimo-Torres et al. (2015) en otros manglares de Tabasco, así como, lo reportado en estudios en otros ecosistemas del estado (Pérez-De la Cruz et al. 2009b, 2015, 2016). Estos géneros tienen una amplia distribución y presentan mayor riqueza de especies en las regiones tropicales, ya que poseen una alta tasa reproductiva (Atkinson y Equihua 1986, Pérez-De la Cruz et al. 2009a, 2009b). La especie X. volvulus fue la más abundante durante el muestreo, dato similar a lo descrito por Gerónimo-Torres et al. en el 2015, así como lo registrado por Pérez-De la Cruz et al. (2015) y Gerónimo-Torres et al. (2019) en selvas de Tabasco. En México, X. volvulus, ha sido registrada en 20 estados de México y en 122 especies hospederas (Wood 1982), siendo Erythrina americana Miller la más importante, un árbol de sombra en el cultivo de cacao, (Baños-Juárez et al. 2012). Se ha registrado que esta especie de escolítido ha causado la muerte de árboles sanos (Cibrián-Tovar et al. 1995), lo que ha hace de interés forestal. La diferencia de la diversidad encontrada entre el borde y el interior del manglar está influenciada por una mayor variedad de plantas hospederas en el borde, donde se tiene la presencia de especies vegetales principalmente de las familias Burseraceae, Fabaceae, Arecaceae y Anacardiaceae, lo que proporciona mayor variedad de recursos alimenticios y lugares de desarrollo, atributos importantes para una mayor diversificación y éxito reproductivo de estos organismos (Menéndez et al. 2007).
La fluctuación de la comunidad de barrenadores mostró comportamientos diferentes entre el borde e interior del manglar, principalmente en las capturas a 1,5 m de altura, registrando el mes de junio como el de mayor abundancia en el borde, datos que difieren de lo reportado por Pérez-De La Cruz et al. (2009b, 2015) quienes mencionaron que las mejores condiciones para el aumento de la abundancia de estos barrenadores es a inicio y final de año, lo cual coincide con nuestro estudio en el interior del manglar. Dorval y Peres Filho (2001) reportaron que la abundancia de escolítidos se incrementa en el período de sequía y se reduce durante el período de lluvia. Así mismo, Marini et al. (2013) y Stadelmann et al. (2013) mencionaron que altos niveles de precipitación pueden afectar la dinámica poblacional de estos escarabajos al impedir la dispersión de los adultos a un nuevo hospedero. Sin embargo, en nuestro estudio, el aumento de la abundancia de barrenadores en el borde del manglar se presentó en el mes que se registró la precipitación mayor, esto podría atribuirse a la estructura del manglar, el cual presenta árboles de mayor talla y altura en el borde, lo que puede brindarles protección.
Los resultados de abundancia de barrenadores a las tres alturas de vuelo fueron similares a los registrados por Aikens et al. (2013) en un bosque templado, quienes reportaron que el sotobosque contiene un mayor número de insectos, destacándose grupos como Curculionidae, Chrysomelidae, Scirtidae, Lampyridae y Coccinellidae. Del mismo modo, Vega-Badillo et al. (2018) en un bosque tropical subcaducifolio muestran a las familias Curculionidae y Bostrichidae como las más abundantes en el sotobosque.
Por otro lado, la mayor diversidad en nuestro estudio se registró a 6 m de altura, lo que difiere de lo descrito por varios autores en ecosistemas tropicales y templados, los cuales ponen de manifiesto que el dosel es el estrato donde se encuentra una fuente importante de insectos, independientemente del taxón estudiado (Novotny y Basset 2005, Fermon et al. 2005, Dial et al. 2006, Roisin et al. 2006).
Se registraron especies que solo fueron capturadas a una sola altura. Para el caso del borde, Corthylus flagelli-fer Blandford, 1904 y Tesserocerus dewalquei Chapuis, 1865 solo se capturaron a 1,5 m; Hypothenemus areccae (Hornung, 1842), Hypothenemus dolosus Wood, 1974, Stegomerus mexicanus Wood, 1967 y Xyleborus horridus Eichhoff, 1869 a 6 m; y Cnesinus sp 2 a 12 m. En el interior, las especies fueron H. areccae e Hypothenemus co-lumbi Hopkins, 1915 a 1,5 m; Cryptocarenus diadematus Eggers, 1937 y Xyleborus discretus Eggers, 1933 a 6 m; y Euplatypus compositus (Say, 1824) y Micrapate fusca (Lesne, 1899) a 12 m. Son pocos los estudios sobre las alturas de vuelo de este grupo de insectos, a pesar de ello, se ha reportado alta abundancia de Xyleborus affinis Eichhoff, 1868 y de Premnobius cavipennis Eichhoff, 1878 por debajo de los 2 m, así como la preferencia de los géneros Ips y Dendroctonus a alturas no mayores a 10 m y Cryptocarenus heveae (Hagedorn, 1912) por encima de este valor (Gara y Vité 1962, Forsse y Solbreck 1985, Duelli et al. 1986, Byers 1989, Abreu et al. 1997).
Las diferencias estadísticas durante el año de muestreo entre las tres alturas del borde e interior del manglar, son producto de la variabilidad registrada en la composición y número de individuos a través del tiempo, ya que como mencionan diversos autores, los cambios estacionales tienen implicaciones significativas en dicha distribución al regular principalmente la disponibilidad de luz, temperatura, precipitación y exposición al viento (Basset et al. 2003, Vulinec et al. 2007, Gossner 2009, Heepe et al. 2016, Vega-Badillo et al. 2018). Al igual que nuestros resultados, Rodríguez y Barrios (2017) al estudiar la distribución vertical y temporal de Platypodinae en un bosque tropical, identificaron diferencias estadísticamente significativas entre el sotobosque y el dosel en diferentes meses del año. Los cambios en las condiciones climáticas presentes en un manglar pueden ser muy drásticos, al aumentar o disminuir el nivel del agua en el transcurso del día, por épocas del año o al presentar altos niveles de agua por tiempos prolongados (Rico-Gray y Palacios-Ríos 1996). Así mismo, el estrés de los árboles, producto del aumento o disminución de la salinidad y concentración de taninos (Jiménez y Delgado-Sánchez 1992, Rico-Gray y Palacios-Ríos 1996, Kausrud et al. 2012) podría explicar las diferencias en la composición de especies entre las alturas evaluadas en el transcurso del año.
El presente estudio proporciona un mayor entendimiento de los insectos barrenadores en uno de los ecosistemas más importantes y productivos del planeta. Se describe y analiza la distribución vertical de estos coleópteros con una clara diferencia entre el borde e interior del manglar y entre los estratos a lo largo de los meses de muestreo. Sin embargo, se recomienda continuar con muestreos por tiempos prolongados y estudios más detallados, en especial de aquellas especies abundantes, para conocer cómo interactúan con sus hospederos, con la finalidad de mantener la viabilidad y salud del ecosistema.