INTRODUCCIÓN
Conocer las características ecológicas y de comportamiento de las especies, ayuda a evaluar la resiliencia de sus poblaciones a los cambios de las condiciones ambientales, ya sea a causa de fenómenos naturales o por actividades antrópicas (Roncancio-Duque et al. 2010, González-Garzón 2012). Esta evaluación se puede llevar a cabo mediante el monitoreo de variables ecológicas espaciales que brindan ventajas en la cuantificación numérica de los efectos adversos de las trasformaciones, convirtiéndose en un tema de prioridad en la conservación (Chediack 2009, Puerta-Piñero et al. 2014).
La tasa de deforestación anual de los bosques tropicales es de aproximadamente 0,5 % desde la década de los 90 (Achard et al. 2014), debido a cambios en el uso del suelo relacionados con actividades agropecuarias, así como a la extracción maderable, de minerales e hidrocarburos (Ochoa-Gaona 2001, Galván-Guevara 2015). Un efecto derivado de la deforestación es la fragmentación de los bosques y la disminución de la calidad de los hábitats, factores identificados como la principal causa de pérdida de la biodiversidad (Crooks y Sanjayan 2006). La fragmentación puede alterar la estructura de los bosques, reducir la disponibilidad de recursos, aumentar el efecto de borde y disminuir la conectividad entre los parches afectando la movilidad de las especies (terrestres y arborícolas), dado que la matriz que rodea los fragmentos suele ser un ambiente hostil para su desplazamiento (Dobson y Lees 1989, Gascon et al. 1999, Galván-Guevara 2015). Esto a su vez, aumenta el riesgo de extinción por la pérdida de diversidad genética debido a la endogamia (Cowlishaw y Dunbar 2000, Kattan 2002).
Con el 90 % de sus especies dependientes de sistemas boscosos, los primates han sido identificados como uno de los grupos de mamíferos más vulnerables a la deforestación de los bosques tropicales (Marsh 2003), lo que ha determinado que, a nivel mundial, más de la mitad de las especies de primates arborícolas se encuentren en algún grado de amenaza de extinción (Chapman y Peres 2001). Colombia, a pesar de ser un país megadiverso y estar posicionado como el tercer país con mayor diversidad de primates en el Neotrópico (Defler 2010), no está exento a la pérdida del hábitat. Esta situación es particularmente cierta para la región Andina y sus valles asociados, en la cual el 80 % de su cobertura vegetal original presenta algún grado de transformación; reportándose pérdidas de bosque hasta de 81 000 ha anualmente en áreas del Magdalena Medio (Rudas et al. 2007). En este escenario, los primates endémicos o con distribución restringida, están predispuestos a un incremento en su riesgo de extinción (Roncancio-Duque et al. 2010). De las 38 especies de primates que se encuentran en el país, 20 se ubican en alguna categoría de amenaza (Guzmán-Caro c2017), alertando la urgencia de desarrollar estrategias de conservación a nivel nacional para su preservación.
El parque Nacional Natural (PNN) Selva de Florencia ubicado en la región del Magdalena Medio, es un área protegida de importancia para la conservación de los primates, ya que alberga cinco especies, de las cuales Ateles hybridus (Geoffroy, 1829) está en peligro crítico de extinción (CR), Cebus versicolor (Pucheran, 1845) en peligro (EN); Aotus lemurinus (Geoffroy, 1843) y Saguinus leucopus (Günther, 1877) en estado vulnerable (VU) y Alouatta se-niculus (Linnaeus, 1766) con preocupación menor (LC) (Link et al. c2020, Link et al. c2021a,b,c,d). Sin embargo, al interior del área protegida, existen presiones antrópi-cas que históricamente han afectado la conservación de sus ecosistemas y que pueden afectar la viabilidad de estos primates, tales como tala selectiva, actividades agropecuarias, cacería, minería, infraestructura y contaminación de fuentes hídricas, entre otras (Herrera-Caicedo et al. 2016).
Anteriormente se han realizado estudios ecológicos y de historia natural de estas especies a lo largo de su distribución. Sin embargo, son escasos los trabajos en la zona, contando para A. hybridus con el estudio de Roncancio-Duque (2012); el proyecto de conservación de A. hybridus en PNN Selva de Florencia por Acosta et al. (2014), y el realizado por Castro-Salamanca (2014) en el que se incluye también A. seniculus; y el de Choperena Palencia y Mancera-Rodríguez (2017), para C. versicolor. Lo que refleja la necesidad de aumentar las investigaciones sobre estas especies para diagnosticar el estado de conservación de sus poblaciones.
En esta área protegida es clave implementar un programa de monitoreo efectivo determinando las diferencias de abundancia entre las poblaciones de primates, en relación con el grado de intervención antrópica, para llevar a cabo estrategias de manejo. Se concibe que la abundancia relativa de estas especies es baja (Castro-Salamanca 2014), y a pesar de ser susceptibles a ser registradas por observación directa, obtener el número suficiente de datos para lograr estimaciones precisas con metodologías como el muestreo por distancias (Buckland et al. 2001, 2015) no sería efectivo. En ese sentido, se estimó la proporción de área usada como medida substituta de la abundancia, para el mono araña café (A. hybridus), el mono maicero (C. versicolor) y el aullador rojo (A. seniculus), como aproximación al entendimiento de las causas de las variaciones en la probabilidad de presencia al interior del área protegida.
MATERIALES Y MÉTODOS
Área de estudio
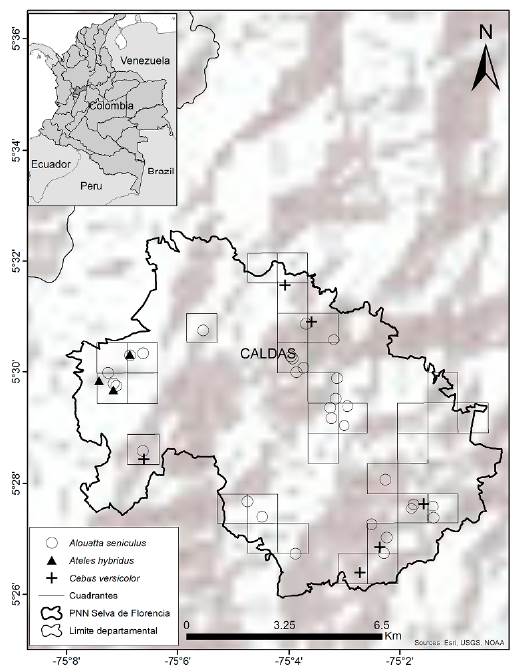
El PNN Selva de Florencia declarado, reservado y alinderado en el año 2005, con una extensión de 10 019 ha, está ubicado sobre la vertiente oriental de la Cordillera Central, al oriente del departamento de Caldas y se proyecta estratégicamente sobre la unidad de contexto regional, identificado como Ecorregión Eje Cafetero. Político-administrativamente se localiza en jurisdicción de los municipios de Samaná (78 % - Corregimientos de Florencia y Encimadas) y Pensilvania (22 % - Corregimiento de Pueblo Nuevo) (05° 29', -75° 04') (Fig. 1). Presenta una diversidad característica del piso térmico húmedo y piso térmico templado o selva subandina con variaciones de temperatura entre los 17 °C y 22 °C, que aún persisten en las estribaciones de la Cordillera Central en la franja entre los 850 y 2400 metros sobre el nivel del mar. Además, tiene importancia estratégica en la regulación hídrica, pues con sus más de 8000 mm anuales de precipitación, se enmarca como la segunda zona más lluviosa del país después del Chocó. Se considera como la única área de bosque natural con esta representatividad ecosistémica en el departamento de Caldas (Herrera-Caicedo et al. 2016).
Proporción de área usada
1. Diseño de muestreo. Las unidades muestreales se establecieron por debajo de los 2000 m, considerando el bajo uso de hábitat que hacen los primates evaluados por encima de esta altitud (Acosta et al. 2014). Para estimar la proporción de área usada por los primates en el PNN Selva de Florencia se implementó el método de modelos de ocupación (ip) (Mackenzie et al. 2002), modificado por WCS (Márquez et al. 2017). El área de estudio se dividió en cuadrantes de 1*1 Km y de ellos se seleccionaron aleatoriamente 31 cuadrantes como réplicas para determinar la proporción de área usada, de esa forma la muestra abarcó diferentes tipos de coberturas vegetales ubicadas en elevaciones menores a 2000 m (Fig. 1). Con ayuda del equipo del área protegida, se evaluó cuáles de los cuadrantes eran inviables como unidad muestral, debido a deslizamientos, situaciones de accesibilidad irresolubles o con posible presencia de minas antipersona. Los cuadrantes con alguna de las situaciones anteriores se descartaron y reemplazaron por otro seleccionado nuevamente al azar. Dentro de cada cuadrante se ubicaron cuatro transectos con una longitud de aproximadamente 700 m cada uno como réplicas para determinar la probabilidad de detección, tratando de abarcar la mayor cantidad de área posible dentro del cuadrante, separando cada transecto mínimo 150 m de distancia solo si los transectos eran paralelos, y mínimo 50 m de distancia entre un transecto y otro.
El método de ocupación fue propuesto para determinar la proporción de sitios ocupados o usados por una especie teniendo en cuenta que ésta no siempre es detectada; es decir, la probabilidad de detección (p) es menor a uno. Así mismo, el método asume que los sitios no experimentan cambios en el estado de la ocupación durante el tiempo de estudio (i.e. sitios cerrados); es decir, se asume que la población está cerrada a cambios demográficos como nacimientos, muertes y migraciones (Mackenzie y Royle 2005).
Para las especies con bajas densidades poblacionales, pero altamente móviles o con ámbitos de hogar amplios, es difícil establecer si están usando u ocupando el área muestreada (Mackenzie y Royle 2005). El ámbito de hogar de una especie cambia dependiendo de diferentes variables como el tipo de ecosistema, la densidad poblacional, la disponibilidad de recursos, entre otros (Santamaría-Gomez 2004). Teniendo en cuenta que no se ha establecido el ámbito de hogar para estos primates al interior del área protegida, la evaluación del área ocupada no fue específica para cada primate, sino que se utilizó una medida estándar para las tres especies (1 Km2) y esta es posiblemente diferente al ámbito de hogar de cada especie, lo que no permite la independencia de los datos, por lo cual se asume que estos primates están usando el área más no ocupándola.
2. Toma de datos. La recolección de los datos se llevó a cabo entre el 21 jun 2018 y el 5 sep 2018 y entre el 18 sep 2019 y el 13 nov 2019. Se realizaron muestreos simultáneos con dos observadores por transecto, desde las 7:00 hasta las 13:00 horas y entre las 14:00 y 18:00 horas. Los cuadrantes seleccionados se marcaron en un mapa cargado a los navegadores de GPS Garmin Etrex 30X, Map 64 sc y Monterra.
Para determinar la presencia de las especies se tuvieron en cuenta rastros como excrementos, vocalizaciones y registros visuales, identificados con la ayuda de material audiovisual y con binoculares. A partir de estas observaciones se construyeron historiales de detección compuestos por matrices binarias que indicaban si la especie fue detectada (y = 1) o no (y = 0) a lo largo del transecto. Se asumió que los cambios en el estado de ocupación de los sitios (i.e. cuadrantes) eran aleatorios.
3. Covariables. Como variables explicativas para evaluar su efecto sobre la probabilidad de ocupación, asumiendo que la probabilidad de detección era constante, se registró durante los recorridos la presencia de cacería (trampas, andamios, encuentros con perros, personas), viviendas y caminos en la categoría Gente para cada transecto. Además, para cada cuadrante seleccionado se estimó la cantidad (Km2) de bosque, cultivos y pastos sobreponiendo el polígono del cuadrante sobre la capa de coberturas vegetales del área protegida, la cual está construida siguiendo la metodología Corine Land Cover adaptada para Colombia a una escala 1: 25 000 con niveles de clasificación de tres a seis (Ceballos et al. 2017). En la categoría Bosques se integraron las coberturas de bosque incluyendo Vegetación Secundaria y en Transición; en la categoría Cultivos se incluyeron todos los cultivos incluyendo las coberturas clasificadas como Mosaico de cultivos; Mosaico de cultivos, pastos y espacios naturales; Mosaico de cultivos y espacios naturales, y en la categoría Pastos se incluyeron todos los pastizales incluyendo las coberturas Mosaicos de pastos; Mosaico de pastos y cultivos; y Mosaico de pastos con espacios naturales.
Análisis de datos
La proporción de área usada por cada especie se estimó bajo abordaje bayesiano, usando para A. hybridus y C. versicolor una distribución a priori uniforme informativa de entre O y 0,5; para A. seniculus una distribución a priori uniforme no informativa de entre O y 1, teniendo en cuenta el conocimiento que se tiene sobre cada una de las especies al momento de iniciar el muestreo, con base en estudios previos que brindaban información sobre el estado poblacional de las especies para esta zona geográfica y la información de los expertos locales. Se asumió que la distribución a posteriori de la proporción de área usada (Psi) y de la probabilidad de detección se ajustan a una distribución de probabilidad tipo Bernoulli. Para evaluar la relación entre las cuatro variables explicativas consideradas con la probabilidad de uso, se realizó una regresión logística. Para el intercepto y las pendientes se asumieron distribuciones a priori no informativas (0, 1) tipo normal (McCarthy 2007, Pfeiffer et al. 2008). No se consideraron efectos multiplicativos entre las variables explicativas y todas las variables se asumieron aleatorias.
Para la selección del modelo más parsimonioso (relación entre las posibles variables explicativas y la probabilidad de uso de cada especie), es decir, el que tuviera la mayor verosimilitud, pero usara el menor número de parámetros se estimó el Deviance Information Criterion (DIC) con la siguiente fórmula DIC = deviance + 2pD en dónde pD es el número de parámetros usados (Psip, b0, bl, ...). Inicialmente se corrió un modelo con todas las posibles variables explicativas y se estimó el DIC. Después, se extrajo una variable y se corrió de nuevo el modelo para estimar el DIC. Si el DIC del segundo modelo resultaba más alto que el anterior, la variable excluida se retornaba y se extraía otra. Si el DIC era menor, se removía la variable definitivamente y se extraía otra hasta obtener el menor valor del DIC.
Para la estimación de la probabilidad de uso y de detección como el intercepto y las pendientes se utilizaron cadenas de Markov con 100 000 iteraciones y considerando después de la 10 001 para la estimación final. Los análisis fueron ejecutados en el programa OpenBugs 3.2.2 (Lunn et al. 2000).
RESULTADOS
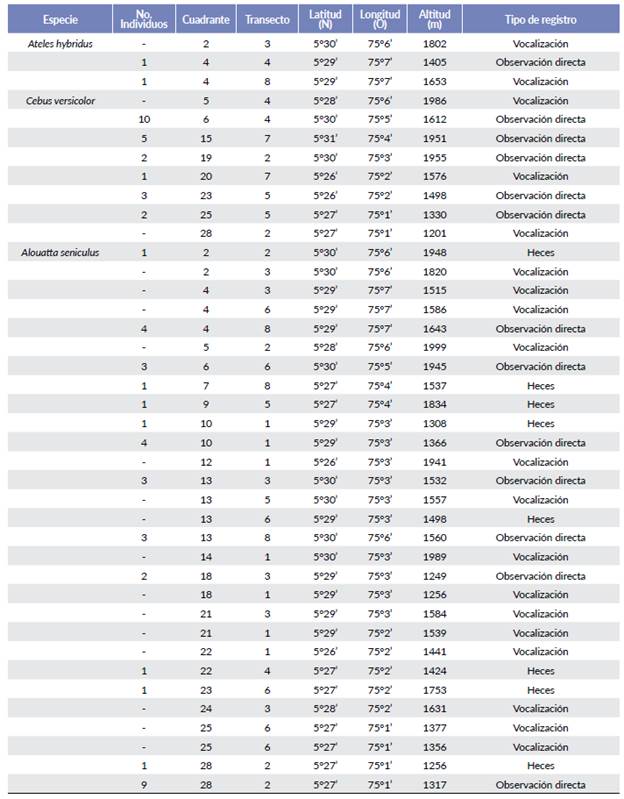
Durante de los siete meses de muestreo, se obtuvieron un total de 40 detecciones para las tres especies. Para A. hybridus se obtuvieron dos registros vocales y un registro visual de un juvenil en el municipio de Pensilvania en tres cuadrantes; para C. versicolor se obtuvieron tres registros vocales y cinco avistamientos de grupos, observándose en ocho cuadrantes. Alouatta seniculus, estuvo presente en 17 cuadrantes, fue registrado siete veces mediante observación directa, catorce vocalizaciones y ocho heces (Fig. 1, Tabla 1).
Tabla 1 Ubicación y tipo de observación de tres primates diurnos registrados en el Parque Nacional Selva de Florencia.
Proporción de área usada
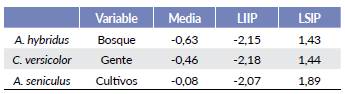
La proporción de área usada por A. hybridus al interior del área protegida es de alrededor del 0,16 (IP95 % = 0,03 - 0,43) con una probabilidad de detección del 0,14. Cebus versicolor presentó una proporción de uso de alrededor del 0,36 (IP95 % = 0,17 - 0,49) y una probabilidad de detección del 0,08; en cuanto a A. seniculus, presentó la mayor probabilidad de área usada con alrededor del 0,82 (IP95 % = 0,58 - 0,99) y una probabilidad de detección de 0,21 (Fig. 2).
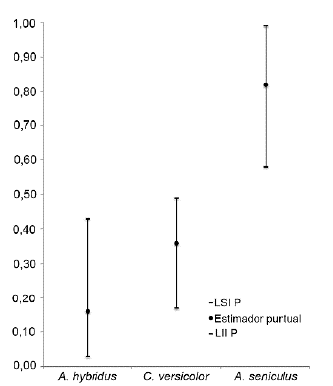
LSIP: límite superior intervalo de probabilidad, LIIP: límite inferior intervalo de probabilidad
Figura 2 Proporción de área usada por tres primates diurnos al interior del PNN Selva de Florencia.
En cuanto a la relación entre las variables explicativas y la probabilidad de presencia de las especies (Tabla 2), ninguno de los modelos más parsimoniosos para las tres especies reflejó un efecto significativo (el intervalo de probabilidad de 13 incluye el 0). No obstante, preliminarmente se determinó que, a mayor cantidad de bosque en el cuadrante, menor será la probabilidad de uso de A. hybridus. Para C. versicolor la variable con mayor peso fue Gente, sugiriendo que el uso de área por parte del mono maicero disminuirá en áreas con actividad humana. Para A. seniculus se encontró que la presencia de cultivos afecta negativamente su probabilidad de presencia.
DISCUSIÓN
Ateles hybridus
A pesar de ser un resultado relativamente impreciso, se puede suponer que la abundancia de esta especie en el área es relativamente baja, entre otras cosas, porque el PNN Selva de Florencia podría considerarse un refugio de hábitat no idóneo remanente que, además de estar aislado, está ubicado en el extremo sur de toda la extensión de ocurrencia de la especie y por ende, con mayores probabilidades de extinción local. Aproximadamente el 7 % de la distribución histórica propuesta para A. hybridus, está contenida bajo alguna categoría de Área Natural Protegida, y menos de la mitad permanece actualmente con hábitat potencial para esta especie (Link et al. c2020). La figura de PNN resultó siendo la que menor pérdida proporcional de hábitat ha sufrido, y esto realza la necesidad de declarar otras áreas protegidas en la zona de distribución de la especie.
Contradictoriamente, A. hybridus, reconocida como una especie altamente dependiente de coberturas boscosas no perturbadas para mantener poblaciones viables (Defler 2010), se vio afectada en su probabilidad de presencia en coberturas boscosas. No obstante, este hallazgo se basó sólo en tres registros y no es significativo. Es necesario aumentar el esfuerzo de muestreo, quizás en la primera mitad del año, incluyendo un análisis de la oferta de recursos, particularmente frutos, como covariable de sitio y de visita, en esquemas multitemporales para poder determinar su impacto en la probabilidad de presencia y de detección (Chapman et al. 1995, Stevenson et al. 2000, Zimmerman et al. 2007, Wallace 2008, Link et al. 2012).
Para A. hybridus, sólo se observó un individuo en todo el tiempo de muestreo, fenómeno que puede deberse al sistema de organización fisión-fusión (Symington 1990), el cual permite a los monos araña reducir la competencia de alimentación intragrupo, al variar en subgrupos más pequeños durante los períodos de escasez de fruta. Por ejemplo, en el PNN Tinigua, se ha reportado que los individuos de monos araña son solitarios más a menudo durante los períodos de poca disponibilidad de fruta (Shimooka 2003). Sin embargo, este suceso puede ser atribuido también a una emancipación, un centinela, una separación forzada del grupo u otro evento estocástico.
Cebus versicolor
En este trabajo se observaron cinco grupos con máximo diez individuos. C. versicolor se puede encontrar en grupos conformados por ocho a 35 individuos (Defler 2010), lo que sugiere que esta especie presenta bajas abundancias para el área muestreada. C. versicolor presentó baja probabilidad de detección. No obstante, se logró observar en los dos municipios que abarca el área protegida y las observaciones se efectuaron en cuadrantes relativamente lejanos entre ellos, por lo cual el área usada por esta especie es mayor a la de A. hybridus. Los primates del género Cebus se han descrito como adaptables a cambios ecosistémicos, pues han sobrevivido en hábitats altamente perturbados a pesar de que estos cambios pueden influir negativamente sobre la disponibilidad y abundancia del recurso alimenticio, afectando directamente la dinámica de las poblaciones (Mammides et al. 2009, Defler 2010).
Las especies del género Cebus son omnívoras (Defler 2010), sin embargo, se ha reportado que Cebus versicolor consume principalmente frutos (91 %), seguido por invertebrados, semillas y pequeños vertebrados (de la Cadena 2012). Una de las estrategias de supervivencia adoptadas por este primate ha sido el uso de cultivos para la obtención de recurso alimenticio, lo que ha creado un conflicto con la comunidad campesina, dado que C. versicolor afecta la producción agrícola en gran medida (Defler 2010). Debido a esto, la especie ha sido perseguida y desplazada hacia zonas lejanas de los asentamientos humanos por parte de los campesinos, que la consideran una plaga; sin embargo, esta especie sigue utilizando los cultivos como fuente de alimento, como lo refleja el registro de una pareja en un cultivo de plátano que se encontraba lejos de los asentamientos humanos. Este conflicto puede explicar la mayor relación que tuvo la probabilidad de presencia del primate con la presencia de gente, aunque no haya sido significativa (de la Torre et al. 2015).
Alouatta seniculus
El aullador rojo presentó mayor proporción de área usada en comparación con los otros primates, reflejado en la distribución de los registros a lo largo de toda el área protegida, sin embargo, la probabilidad de detección de esta especie fue baja pues no se encontró más de dos veces por cuadrante, a excepción del cuadrante trece en el que se registró por observación directa, vocalización y heces. Los resultados sugieren una presencia generalizada en el área y con tamaños de tropa de hasta nueve individuos. Las poblaciones A. seniculus pueden variar ampliamente en tamaño, tanto en tierras bajas como en zonas montañosas, encontrandose densidades poblacionales desde 4 ind/km2 hasta 377 ind/ km2 en la Cordillera Central colombiana, las altas densidades para esta especie se han registrado en fragmentos boscosos pequeños, en los cuales las poblaciones de aulladores rojos se encuentran hacinadas (Londoño y Gómez-Posada 2009). En este sentido, es probable que a pesar de que este primate se encuentre en buena parte del área protegida, su densidad sea baja toda vez que el área protegida pueda considerarse configurada por bosques continuos.
Se ha documentado que los aulladores rojos utilizan los agroecosistemas como fuente de alimento y zonas de conectividad entre parches de bosque (Estrada et al. 2005, Quintero y Botero-Botero 2014). En este trabajo, la presencia de cultivos fue la covariable que tuvo mayor efecto en la disminución del uso de área por esta especie. Esto, puede deberse al tipo de cultivos presentes, pues correspondían principalmente a cafetales, cultivos de caña panelera y cultivos de uso ilícito, los cuales no brindan las condiciones adecuadas para el establecimiento o uso por parte de A. seniculus, ya que tiene preferencia por árboles de gran porte y utiliza los estratos medio y alto del dosel (Londoño y Gómez-Posada 2009), a diferencia de los cultivos evaluados en los trabajos de Estrada et al. (2005) y Quintero y Botero-Botero (2014), los cuales contienen árboles de sombrío y algunos árboles frutales como aguacate y cítricos.
Interacción entre especies
Es interesante notar que mientras que A. seniculus comparte el área de uso con A. hybridus y C. versicolor (Fig. 1), A. hybridus y C. versicolor no se registraron en cuadrantes cercanos. Este fenómeno puede atribuirse a comportamientos de costo - beneficio, pues en épocas de escases de recursos, los primates con el mismo nicho ecológico se distribuyen en el área y usan el hábitat de manera que se disminuya la competencia interespecífica, para evitar gasto energético por encuentros agonísticos (Eisenberg 1979). De esta manera, es posible que A. seniculus, al disminuir la cantidad de frutos consumidos en épocas de baja productividad (Alvis et al. 2012), pueda compartir el hábitat con otras especies de primates, caso observado por Acosta et al. (2014) para el área protegida, en el que se hallaron dos individuos juveniles de A. seniculus, desplazándose con un juvenil de A. hybridus.
Consecuencias de la disminución de las abundancias de primates
Las bajas abundancias de las especies de primates en el área protegida alertan sobre la posibilidad de extinciones locales, principalmente para A. hybridus que es la especie más vulnerable ante la fragmentación y las actividades antrópicas. Se ha encontrado que, para el valle del Magdalena medio, estas especies de primates están amenazadas y en varias localidades han desaparecido (Rimbach et al. 2013, de Luna y Link 2018).
Una de las principales consecuencias de la disminución de sus poblaciones y su extinción local, es la pérdida de especies clave en procesos como la dispersión de semillas dada la dieta de estos primates (Beck et al. 2013, Brocardo et al. 2013, Kurten 2013). Por ejemplo, en el estudio realizado por Urbina-Bermudez (2010), se encontró que A. hybridus y A. seniculus son especies de gran importancia en la dispersión de semillas de Spondias mombin (Linneo, 1753). O como los primates del género Cebus, pues algunos individuos se alimentan de especies de estratos bajos del bosque como Bactris sp. (Wehncke et al. 2004, Urbina-Bermúdez 2010). Por tanto, la disminución en sus poblaciones probablemente puede desencadenar cambios en la dinámica de los bosques, disminuyendo su diversidad, alterando sus comunidades y el funcionamiento del ecosistema (Farwig y Berens 2012).
Aportes del monitoreo a partir de modelos de ocupación para un área protegida
Los modelos de ocupación permiten obtener un mayor conocimiento de las áreas protegidas, tanto de las especies que albergan y el estado de sus poblaciones, como el impacto que provocan diversos factores ambientales y antrópicos sobre las poblaciones silvestres. Además, este tipo de metodologías pueden contribuir a conocer las problemáticas socioambientales que se puedan estar presentando al interior de las áreas protegidas y aunque en la mayoría de áreas protegidas existen corredores para realizar monitoreo, estos en muchas ocasiones no permiten una buena visibilización del área, ya que cubren una mínima fracción.
La planeación de un monitoreo continuo a partir de este tipo de metodologías permite observar cómo la ocupación-uso de las especies puede cambiar entre estaciones y a lo largo de los años. También permite comprender la dinámica de las poblaciones en estos ecosistemas, analizando procesos de formación de nuevos grupos o extinciones locales, además del cambio en las tasas de ocupación a lo largo de los años que se podría modelar en funciones de las tasas de colonización y extinción (Mackenzie y Royle 2005). Adicionalmente, dada la escala de tiempo relativamente corta en la que la perturbación antropogénica puede afectar notablemente a las poblaciones de primates, entender las necesidades de las especies, puede resultar útil para la implementación de estrategias de conservación (Marsh et al. 2016).