INTRODUCCIÓN
El Piedemonte Andino-Amazónico, es una subregión biogeográfica transicional estratégica en la que confluyen elementos bióticos y abióticos de las regiones Andina y Amazónica; estas características, le confieren una integridad ecológica considerable en términos de conservación de la biodiversidad por su alto número de endemismos y riqueza de especies, así como bienes y servicios ecosistémicos que provee al país (Barrera et al. 2007, Hoorn et al. 2010). A pesar de su singularidad, en las últimas dos décadas esta región no ha estado exenta de presentar altos índices de deforestación y transformación de su cobertura forestal original (González 1994, Armenteras et al. 2006, Etter et al. 2006, Ruíz et al. 2007, Ruíz et al. 2011, Murcia et al. 2016) comprendidas dentro del 62 % de la deforestación del país calculada para la Amazonia en el año 2019 (IDEAM y SMBYC c2020) y el 40,7 % de detecciones tempranas de deforestación para el territorio colombiano en el segundo trimestre del año 2020 (IDEAM c2020). Esta situación se debe en gran medida a los conflictos socio ambientales de la región (MADS c2012), generados por cuatro agentes principales de deforestación: 1) agricultura, que incluye la producción agropecuaria tradicional y de gran escala, al productor agrícola de coca y de cultivos industriales, 2) ex-tracción formal e informal de minerales e hidrocarburos, 3) expansión formal e informal de infraestructura vial, y 4) extracción de madera, que vincula al extractor informal de madera para la venta y el extractor informal de madera para el autoconsumo (González 2018).
El Mico Bonito del Caquetá, Plecturocebus caquetensis (Defler, Bueno y García, 2010), es una especie de primate descrita recientemente en Colombia, endémica del Piedemonte Andino-Amazónico y registrada únicamente en los departamentos de Caquetá y Cauca. Su área de distribución es una de las más restringidas entre los primates del mundo (4029 km2) y se estima que, debido a la pérdida y fragmentación de los bosques, tan solo el 36 % (1366 km2) representan hábitat remanente para la especie (Defler et al. 2016). Por ello, está categorizada como críticamente amenazada (CR) (Defler et al. c2012), e incluida en la lista de los 25 primates más amenazados del mundo (Schwitzer et al. 2017). Las investigaciones en torno a esta especie se han centrado en el sur del departamento del Caquetá (Defler et al. 2010, García et al. 2010, García y Defler 2011, Defler et al. c2012, García y Defler 2013, Defler et al. 2016, Villota 2017, Acero-Murcia et al. 2018, Villota et al. 2021), y a la fecha, no se cuenta con datos sobre su ecología y patrones demográficos en la región de la baja Bota Caucana.
En primates no humanos, los censos poblacionales han sido históricamente usados como una aproximación al estado de la salud y la demografía de las poblaciones, haciendo más efectiva la implementación de medidas de conservación (Butynski 1990, Ganzhorn et al. 1997). La densidad poblacional expresada en número de individuos por unidad de superficie es un estimativo que refleja la relación entre la población y el área que ocupa (Begon et al. 2009), lo que nos permite comprender cómo este parámetro se modula en el tiempo, por factores como: la tasa de natalidad, tasa de mortalidad, emigraciones, inmigraciones, competencia intraespecífica y depredación (Smith 1980, Clarke et al. 2002, Rylands et al. 2008). Esto, en conjunto con datos referentes a la organización social como tamaño de los grupos, la edad y la composición por sexos, proveen información sobre la viabilidad de las poblaciones (Van Schaik y Van Hoof 1983, Akçakaya et al. 1999, Plumptre 2000, Walker et al. 2000, Kappeler y van Schaik 2002, Valderas-G 2004), y su tolerancia a la pérdida y fragmentación del hábitat (Estrada et al. 1994, Offerman et al. 1995, Estrada y Coates-Estrada 1996, Laurance et al. 2002).
Considerando que aún existen vacíos de este tipo de información para P. caquetensis en la región de la baja Bota Caucana y teniendo en cuenta las amenazas de pérdida de hábitat por la transformación de la cobertura boscosa en su área de distribución, es prioritario analizar el estado de sus poblaciones en estos bosques. En este estudio, se reporta la primera estimación de densidad poblacional y organización social de P. caquetensis en fragmentos de bosque de un paisaje de planicie aluvial, en el Piedemonte Andino-Amazónico de la baja Bota Caucana.
MATERIALES Y MÉTODOS
Área de estudio
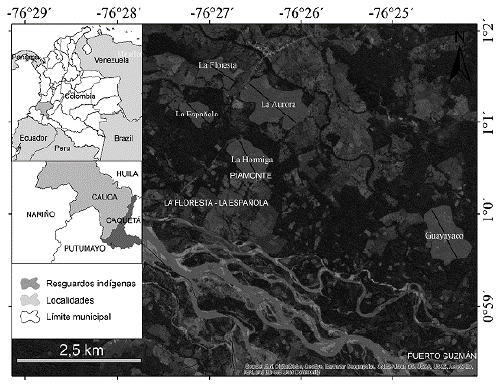
El estudio se realizó en el corregimiento de Miraflor, en 263 ha de bosques aluviales del municipio de Piamonte, Departamento del Cauca. Esta región es conocida como la baja Bota Caucana, en el Piedemonte Andino-Amazónico del departamento del Cauca (Fig. 1). El área hace parte de la zona de influencia del Parque Nacional Natural Serranía de los Churumbelos Auka Wasi (Casa de los Espíritus). La elevación promedio es de 300 m (min.: 250 m; max.: 2500 m). La temperatura promedio es de 25 oC y la humedad relativa del 80 %. La precipitación media es de 460 mm/mes, la más alta del piedemonte amazónico colombiano. La mayor precipitación ocurre entre los meses de mayo y julio (600 mm/mes, periodo de aguas altas) y en el periodo de noviembre a febrero las precipitaciones son bajas con valores entre los 100-200 mm/mes (PNN 2018).
Según el IDEAM et al. (2017) el área de muestreo corresponde a la planicie aluvial del alto río Caquetá, en este paisaje se encuentran arbustales inundables basales en plano de inundación, bosques inundables basales, y áreas transicionales transformadas sobre terrazas de nivel uno. Esta investigación se desarrolló en cuatro fragmentos de bosque.
Selección de sitios de muestreo
Se identificaron áreas potenciales para los transectos por medio de imágenes satelitales Landsat 2018 Digital Globe de Google Earth Pro (Google c2018). Las coberturas vegetales de los fragmentos preseleccionados fueron clasificadas a partir de la metodología Corine Land Cover adaptada para Colombia (IDEAM c2010). Se determinó su área en hectáreas por medio del software ArcGIS 10.1. La clasificación de coberturas indicó que los fragmentos de estudio se por bosques densos altos y vegetación secundaria (Murcia et al. 2016), con diferente intensidad de intervención antrópica.
Las áreas preseleccionadas para la toma de datos se hallaron dentro del territorio indígena de los Resguardos Ingas La Floresta-La Española y Guayuyaco y, de la comunidad campesina del Corregimiento de Miraflor. Con el fin de obtener los permisos de tránsito y uso de los fragmentos para el estudio de los primates, se visitaron los habitantes y propietarios de los fragmentos de bosque y se participó en encuentros y diálogos de la comunidad indígena Inga. Con la aceptación de la comunidad, se visitaron los fragmentos en compañía de pobladores residentes y conocedores del territorio, con el fin de trazar los transectos de forma participativa, respetando sus áreas de cultivo y zonas restringidas por su carácter cosmológico-cosmogónico.
Establecimiento de los transectos
Se establecieron cinco unidades de muestreo (Fig. 1) a partir de criterios como la delimitación de linderos de la comunidad residente, presencia de carreteras y fuentes hídricas inmersas en los cuatro fragmentos de bosques previamente visitados. En campo se estableció su posición y rumbo con la ayuda de una brújula, manteniendo la linealidad del transecto en la medida de lo posible. Los transectos fueron medidos con un decámetro y señalizados con una cinta de mareaje cada 50 metros, a su vez se georreferenciaron con un GPS Garmin 64s. Los censos iniciaron diez días después de terminada la apertura de los transectos con el propósito de garantizar que la fauna de la zona se readaptara al disturbio generado (Buckland et al. 2001, Thomas et al. 2010).
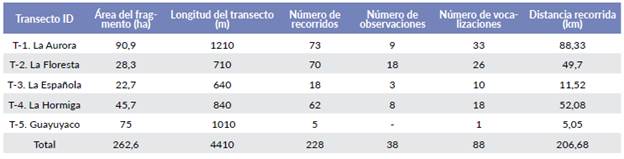
Se trazaron dos transectos en predios de la comunidad campesina: El transecto T-1 (La Aurora) ubicado en un bosque delimitado por pastos para la ganadería y cultivos de cacao (Theobroma sp.) y el transecto T-4 (La Hormiga), asociado a un cuerpo de agua y delimitado por pastizales y cultivos de yuca (Manihot esculenta Crantz.). Dos transectos fueron establecidos en el Resguardo indígena Inga La Floresta-La Española: El transecto T-2 (La Floresta) ubicado en un fragmento de bosque de 28, 9 ha, aislado completamente por un área de pastos y el transecto T- 3 (La Española) ubicado en un bosque que contenía parches de cultivos de maíz (Zea mays L.), cacao (Theobroma sp.) y plátano (Musa paradisiaca L.). Por último, el transecto T-5 (Guayuyaco), en un bosque con parches de pastos y cultivos, ubicado en el territorio del Resguardo indígena Inga Guayuyaco (Tabla 1).
Toma de datos
Densidad poblacional
Durante los meses de julio, agosto, septiembre y noviembre de 2018 se realizaron muestreos en los cinco transec-tos utilizando la metodología propuesta por Buckland et al. (2001) y Thomas et al. (2010). La secuencia de mues-treo de los transectos se definió aleatoriamente, por medio de la aplicación móvil Choose Random (Prerak Trivedi c2019). Los recorridos se realizaron a una velocidad constante de 1 km /hora, desde las 07:00 hasta las 12:00 horas (Villota 2017). No se realizaron recorridos con lluvias para evitar sesgos por baja visibilidad.
Las observaciones se realizaron con binoculares Nikon Monarch 5 10x42. Para cada observación se registró fecha, hora, número del transecto, distancia recorrida en metros, número de individuos y grupos, el tamaño de los grupos se estimó en un tiempo máximo de diez minutos (Buckland et al. 2001). La distancia perpendicular al centro del grupo fue calculada con ayuda de un telémetro láser e hipsómetro (Nikon Forestry pro/10-500mm) y las coordenadas del avistamiento registradas con un GPS Garmin 64s.
Organización social
El número de grupos de cada transecto se determinó de acuerdo con: i) la estabilidad espacial de cada unidad de individuos, inferida a partir de sus coordenadas de observación en el transcurso de los meses de muestreo, ii) composición, como máximo número de individuos y características individuales, se reconoció como individuos del grupo a aquellos que se encontraron entre 1 a 10 m del centro del grupo, teniendo en cuenta que machos y hembras de P. discolor pasan la mayor parte del tiempo a distancias menores a 10 m (Spence-Aizenberg et al. 2015), iii) vocalizaciones matutinas y despliegues agonísticos de defensa territorial, realizados principalmente en dueto por el macho y la hembra del grupo (Fernandez-Duque et al. 2013), iv) hora de observación, i.e. dos unidades grupales observadas a largas distancias en un tiempo corto, y, v) eventos de detección bajo la metodología de transectos lineales.
De cada grupo se registró el número de individuos, sexo y edad, dividiéndose en cuatro categorías: adultos, suba-dultos, juveniles e infantes (Kinzey 1981). El sexo y la edad se determinaron tomando como parámetros: i) el patrón de coloración, ii) el tamaño, y iii) el grado de dependencia de los individuos (Sánchez-Dueñas 1998, Basto-González y Defler 2009). A pesar de que el dimorfismo sexual físico en titis es mínimo (Spence-Aizenberg et al. 2015), la longitud cabeza-cola en machos es ligeramente superior a las hembras adultas de P. caquetensis; para nuestras observaciones fue consistente que individuos adultos presentarán corona con pelos blancos y grisáceos, que cambian a naranja y negro hacia la parte posterior de la frente, los machos exhiben una coloración homogéneamente blanquecina en cuarto distal de la cola, mientras que en hembras ésta tiene matices agutí. En los subadultos, el patrón de coloración es igual para machos y hembras adultas y probablemente difieran en tamaño, debido a la falta de certeza, no se realizó una identificación precisa del sexo en esta categoría de edad. En los juveniles, la corona no es marcada, y su desplazamiento es parcialmente independiente. Por último, los infantes son completamente dependientes de los parentales y usualmente los machos cargan a la cría en los desplazamientos y las hembras solo para alimentarlos. Se consideran individuos inmaduros a los pertenecientes a las categorías juvenil e infante. Vale anotar que las observaciones se dieron a distancias no mayores a 20 metros.
Análisis de datos
Densidad poblacional
Se estimó la densidad poblacional utilizando el software Distance 7.3 (Thomas et al. 2010). Se escogió el modelo que mejor se ajustó a la distribución de abundancias de las distancias perpendiculares, en combinación con el valor más bajo del criterio de información Akaike (Buckland et al. 2001).
Organización social
Se estimó el tamaño promedio de grupo y se caracterizó su composición y la relación entre machos y hembras adultos (PHM), hembras adultas e inmaduros (juveniles e infantes) (PIH) (Smith 1999).
RESULTADOS
Densidad poblacional
Se calculó un área efectiva de muestreo de 17,49 km2. Se obtuvieron 38 eventos de detección de P. caquentesis en coberturas de bosque denso alto, arbustales, vegetación secundaria y guaduales. Se estimó una densidad de 12,5 individuos/km2 (IC: 4,9-31,2) y una densidad de 5,3 grupos/ km2 (IC: 2-13,3), ambos con un coeficiente de variación de 34,6 %. La distribución de frecuencias de las distancias perpendiculares presentó un mejor ajuste al modelo Uniforme con serie de expansión Simple polinomial y la varianza de la densidad estuvo compuesta por la tasa de encuentro en un 97,8 % y el tamaño del grupo con 2,2 %. El ancho efectivo de banda (ESW) fue de 17,4 m, con probabilidad de observar un objeto en el área de 1,00.
Organización social
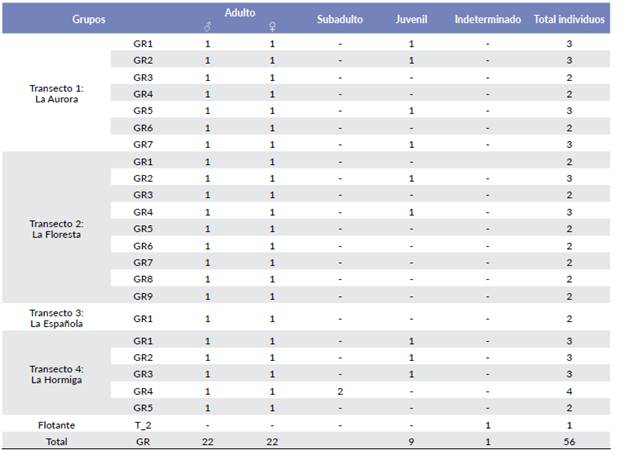
Se registraron 56 individuos de P. caquetensis, 22 grupos y un individuo solitario, cuyo sexo no pudo ser determinado (Material suplementario). El 41 % de los grupos registrados de la especie fueron observados en el transecto T-2 (La Floresta), 32 % en el transecto T-1 (La Aurora), seguido de T-4 (La Hormiga) con el 22,7 % (N=5) y T-3 (La Española) con 4,5 % (N=1). Adicionalmente, se registraron 88 vocalizaciones, entre las 6:30 y 10:45 horas, con mayor frecuencia de emisión antes de las 8:00 horas. Treinta y cuatro (34) eventos de vocalización estuvieron relacionados con encuentros agonísticos durante el periodo de estudio; El tamaño del grupo varió entre dos y cuatro individuos (IC= 2,0-2,6). El 54,5 % de los grupos lo componen una pareja adulta, 41 %, una pareja adulta con un juvenil, y 4,5 % una pareja adulta con dos individuos subadultos. La proporción de machos-hembras adultos (PMH) fue de 1:1 y la de hembras adultas-inmaduros- (PHI) de 1: 0,40.
DISCUSIÓN
La densidad poblacional registrada en este estudio es similar al dato de 12,1 individuos/km2 reportado para la especie mediante conteos directos en fragmentos de bosque de lomerío en el Departamento del Caquetá (Defler et al. 2016) y es tres veces menor a la densidad de 38,5 individuos/km2 estimada por Villota (2017) mediante el método de muestreo por distancias en un fragmento de bosque inundable de aguas negras en el departamento del Caquetá. Esto último no corresponde a lo esperado, debido a que se considera, que las densidades poblacionales de primates en el occidente de la Amazonía son consistentemente más altas en drenajes de aguas blancas que en drenajes de aguas negras (Peres 2008). Sin embargo, el área mues-treada por Villota (2017) se encuentra influenciada por la dinámica fluvial del río Orteguaza, que durante el Holoceno y Pleistoceno introdujo a su drenaje depósitos aluviales provenientes de los Andes (Gómez y Montes c2020) por otro lado, esta región corresponde a la de mayor fragmentación dentro de la distribución de P. caquetensis (García y Defler 2013, Defler et al. 2016), lo que implica un mayor efecto de borde (García obs. pers.) que favorece a los titis del género Plecturocebus (Sánchez-Dueñas 1998, Van Roosmalen et al. 2002, Carrillo-Bilbao et al. 2005, Haugaasen y Peres 2005, Voss y Fleck 2011, Defler y Carretero-Pinzón 2019). Estas dos situaciones podrían estar influenciando positivamente las estimaciones, que son mayores a las encontradas en nuestro estudio. Sin embargo, se deben adelantar investigaciones que permitan corroborar estas hipótesis y en estudios venideros se deben aplicar los principios de replicación y la aleatorización de los transectos lineales (Buckland et al. 2010a), con el fin de mejorar las estimaciones de las densidades poblacionales y la comparación de resultados.
A pesar de que el estudio de las densidades poblacionales de P. caquetensis en esta y otras investigaciones se ha realizado en fragmentos de bosque (Defler et al. 2016, Villota 2017), las estimaciones son bajas en comparación con las altas densidades registradas para Plecturocebus ornatus (Gray, 1866) por Mason (1966) y Wagner et al. (2009) de 400 individuos/km2 y 165 individuos/km2 respectivamente para fragmentos de bosques de galería en el Departamento del Meta. Si bien nuestras estimaciones coinciden con las densidades obtenidas por Defler et al. (2016), se deben entender las relaciones causales entre las variables del hábitat de P. caquetensis y sus estimaciones poblacionales, en este sentido Carretero-Pinzón y Defler (2016) proponen para P. ornatus integrar y evaluar la densidad-área en función de la disponibilidad de recursos, las características estructurales de los fragmentos de bosque y variables de paisaje.
Nuestros datos concuerdan, además, con estimaciones realizadas en bosques continuos para otros titis de tamaño mediano (Hershkovitz 1990, Kobayashi 1995) como Plec-turocebus cupreus (Spix, 1823) con una densidad de 14,6 individuos/km2 en el noreste de Perú (Bennett 2001) y sus especies hermanas P. discolor (I. Geoffroy Saint-Hilaire & Deville, 1848), en la estación de biodiversidad Tiputini en Ecuador con una densidad entre 15,3 a 47,6 individuos/ Km2 (Dacier 2011) y P. ornatus en los llanos orientales de Colombia, con densidades de 15,63 individuos/ km2 y 16,66 individuos/ km2 en fragmentos de bosque de 46,5 ha y 186 ha respectivamente (Carretero-Pinzón 2013a).
Las estimaciones de densidad para P. caquetensis se han realizado en áreas de estudio que difieren de la nuestra en su geomorfología, el tipo de bosque y el tipo de suelo; para primates en la amazonia colombiana y otras regiones, se ha demostrado que la abundancia varía en relación con estas características del hábitat (Emmons 1984, Peres 1997, 1999, 2008, Peres y Dolman 2000, Haugaasen y Peres 2005, Palacios y Peres 2005, Defler 2013, Palacios 2020), por lo tanto estas variables deben ser tenidas en cuenta a la hora de realizar estimaciones poblacionales con el fin de disminuir la varianza y permitir comparaciones más acordes que faciliten tomar decisiones de conservación en las diferentes unidades en las cuales habita la especie. La varianza de la densidad estuvo determinada en un alto porcentaje por la tasa de encuentro, ya que según Hernández y Díaz (2010), esta está influenciada por el bajo número de transectos muestreados; para próximos estudios se requiere aumentar el número de transectos y establecer un programa de monitoreo para la especie en esta porción de su distribución (Buckland et al. 2007, Buckland et al. 2010b, Thomas et al. 2010).
En nuestra área de estudio, P. caquetensis habita en fragmentos de bosque con coberturas de bosque denso alto, vegetación secundaria, arbustales y guaduales; con excepción de los guaduales, estas coberturas también fueron registradas para la especie por Moynihan (1976), Defler et al. (2010) y García y Defler (2011).
En los fragmentos de bosque La Aurora y La Floresta registramos un alto número de grupos de la especie (nueve y siete respectivamente) estos valores también han sido reportados para P. ornatus en fragmentos de bosques de galería en los llanos orientales de Colombia (Wagner et al. 2009, Carretero-Pinzón 2013b), probablemente por el tamaño y área de hogar pequeño (Fimbel 1994), así como el consumo en su dieta de plantas pioneras de bordes de bosque (Carretero-Pinzón y Defler 2016) y la facultad de incrementar el consumo de hojas en hábitats intervenidos antrópicamente (Acero-Murcia et al. 2018), que permite a los titis del género Plecturocebus habitar pequeños fragmentos de bosque en condiciones de hacinamiento.
En los encuentros agonísticos registrados, macho y hembra coordinaron duetos por la defensa del territorio, comportamiento característico del género Plecturocebus (Mason 1968, Robinson 1979, 1981). En el fragmento La Floresta, que se encuentra aislado por una matriz de pastos, se registraron el mayor número de estos encuentros. Los pitecinos rara vez se observan cruzando pastizales (Ferrari et al. 2013) y aquellos que lo hacen algunas veces son atacados por perros (García obs pers), esto afecta la dispersión y el establecimiento de nuevos grupos familiares fuera del territorio ocupado por grupos parentales (Wittenberger y Tilson 1980), lo cual incrementa la competencia intraespecífica (Sánchez-Dueñas 1998) y la frecuencia de encuentros agonísticos (Mason 1966), ello podría explicar el elevado número de registros para este comportamiento en este fragmento de bosque.
En relación con la organización social de P. caquetensis, el tamaño promedio de grupo (2,3 individuos) y su composición concuerdan con lo reportado para el género Plecturo-cebus en Colombia (Mason 1966, Basto-González y Defler 2009, Defler et al. 2010, García y Defler 2013, Carretero-Pinzón 2013b), en P. ornatus este tamaño promedio de grupo solo se presenta en fragmentos de bosque con tamaños menores o iguales a 50 hectáreas (Carretero-Pinzón y Defler 2016). Según Fuentes (2002) esta organización social está influenciada por el fuerte vínculo en pareja y cohesión. Para el periodo de trabajo no se registraron crías, a pesar de que en el departamento del Caquetá se ha identificado que la temporada de nacimientos inicia a partir del mes de octubre (Acero-Murcia et al. 2018).
La proporción de machos-hembras 1:1 sugiere que la especie presenta estabilidad en términos de selección reproductiva (Fisher 1930, Wright 1940, Sterck et al. 1997, Wade et al. 2003), en respuesta a su condición de especie monógama donde los roles de macho y hembra son de igual importancia y donde la presión de selección por alguno de los sexos no predomina (Wittenberger y Tilson 1980). La baja proporción hembras adultos - inmaduros (1:0,40), puede ser interpretada como el resultado de un potencial reproductivo deficiente (Estrada et al. 2002, Clarke et al. 2002). Según Ramírez y Robinson (1982) de la proporción de individuos juveniles depende principalmente la recuperación frente a descensos poblacionales, y por el contrario, un gran número de juveniles pueden ser indicativo de una población estable o incluso en expansión (Primack et al. 2001, Valderas-G 2004); es necesario monitorear estas variables, pues lo registrado durante este estudio puede corresponder a fluctuaciones intra e interanuales en el número de individuos debido a la variación intrínseca en la natalidad o supervivencia de los juveniles (Struhsaker 1981, Struhsaker 2008).
En la baja Bota Caucana se encuentra el 23 % (194 km2) del hábitat remanente de P. caquetensis (Defler et al. 2016), debido a que esta especie no se encuentra protegida por ninguna figura del Sistema Nacional de Áreas Protegidas, se sugiere la declaración de áreas de conservación regionales, privadas y colectivas en este territorio del piedemonte amazónico, que contiene los mejores bosques en toda el área de distribución de la especie sobre unidades geomorfológicas únicas en todo el alto río Caquetá. Finalmente, por su ubicación, diversidad y representación de figuras territoriales y administrativas como Resguardos indígenas, zonas de reserva forestal y Parques Nacionales, la baja Bota Caucana constituye una oportunidad para la articulación y complementariedad de instituciones gubernamentales, no gubernamentales, academia y comunidades campesinas e indígenas que puedan apoyar y fortalecer proyectos de manejo y conservación de la especie y de los ecosistemas del Piedemonte Andino-Amazónico. Se hace necesario la formulación de planes de educación ambiental y monitoreo comunitario con indígenas y habitantes locales de la región que fortalezcan valoración por su patrimonio natural y promuevan espacios de diálogo intercultural.