INTRODUCCIÓN
La colonización humana incluye la introducción de especies exóticas en los ambientes, lo que trae efectos negativos sobre la fauna nativa (Lowe et al. 2004). En particular, la conquista de América por parte de los españoles implicó la introducción del perro Canis lupus familiaris (Linnaeus, 1758), registrándose su presencia por primera vez en 1514 en Urabá (Patiño 1970, Ramírez-Cháves et al. 2011). A la Sabana de Bogotá, en lo alto de los Andes, el perro llegó con Jiménez de Quezada en 1536 (Jiménez 2011). La presencia de perros se ha incrementado con la abundancia de humanos que se concentran principalmente en centros urbanos y, entre sus impactos sobre la biodiversidad, se encuentra la depredación de mamíferos silvestres (Doherty et al. 2017). Además, estudios en la cordillera oriental de los Andes, particularmente en la Sabana de Bogotá, indican efectos negativos asociados a la depredación por perros salvajes sobre mamíferos nativos, incluyendo el fara Didelphis pernigra (Allen, 1900) (Ramírez y Ordóñez 2006, Ramírez-Cháves et al. 2011, López-Barragan y Sánchez 2017).
El riesgo a ser depredado se asocia al costo percibido de un organismo a ser lesionado o muerto, lo que conlleva, entre otras cosas, a cambios en su comportamiento para evitar el encuentro con los depredadores (Brown y Kotler 2007). El tiempo forrajeando implica un incremento en el riesgo de depredación para las presas, porque al buscar alimento el individuo deja la seguridad de su refugio y se incrementa la probabilidad de ser atacado, afectando comportamientos como la vigilancia o la selección de hábitat (Brown y Kotler 2007). Por este motivo, los estudios que examinan la influencia del riesgo de depredación proporcionan información valiosa sobre la naturaleza de la conducta animal y aportan a la comprensión de los efectos del riesgo de depredación en la estructura de las comunidades (Lima y Dill 1990, Orrock et al. 2004).
Si bien la presencia humana en un área puede representar una amenaza que no implica necesariamente efectos letales directos sobre las especies silvestres, puede tener una serie de efectos no letales (Altendorf et al. 2001, Brown y Kotler 2007). El tiempo invertido en estrategias antidepredadoras se debe incrementar ante la percepción riesgo, incluidas situaciones en las que se encuentra con estímulos desconocidos, y esto ocurre a expensas de otras actividades que contribuyen a incrementar la eficacia biológica del individuo (Frid y Dill 2002). Por ello estos efectos no letales tienen un impacto considerable sobre la distribución de energía y tiempo por parte de las presas.
Según el modelo de uso óptimo de parches (Brown 1988), un forrajeador debe dejar un parche alimentario cuando los beneficios, relacionados con la tasa de cosecha, son iguales a los costos por el riesgo percibido de depredación, los costos energéticos asociados a la explotación del parche y los costos debidos a otras actividades que contribuyen a la eficacia biológica del individuo. Entre estas actividades se incluye por ejemplo la defensa de territorio, la preparación de nido, la búsqueda de pareja, o forrajear en otro tipo de parche (Olsson y Molokwu 2007). La tasa de cosecha a la que el individuo decide dejar de explotar un parche de forrajeo se conoce como tasa de cosecha de abandono ("quitting harvest rate"). El modelo de uso de parches asume que la cantidad de alimento que el forrajeador puede obtener decrece con el tiempo en el parche, es decir el forrajeador experimenta ganancias decrecientes y la tasa de cosecha depende de la cantidad de alimento en el parche. Por lo tanto, la cantidad de alimento dejada en el parche por un animal después de alimentarse, o densidad de abandono (DDA) ("giving-up density", GUD), permite estimar la tasa de cosecha de abandono, que es una medida de la eficiencia del forrajeo, y permite evaluar el comportamiento de un individuo, por ejemplo, ante la posible presencia de un depredador (Brown 1988, 1992).
Las DDA son usadas para probar efectos específicos, porque este método es sensible a los costos que un individuo afronta en el momento de forrajear, y provee una medida cuantitativa de cómo percibe su ambiente (Brown 1988, Kotler et al. 1993). Si las DDA de un forrajeador son distintas en dos sitios, esto indica que hay diferencias en los costos de forrajeo para el animal entre esos hábitats, y la técnica ha sido ampliamente utilizada para examinar el comportamiento de forrajeo bajo riesgo de depredación en estudios con varios tipos de mamíferos (Brown et al. 1992, Kotler et al. 1993, Stokes et al. 2004, Hochman y Kotler 2006).
Con base en el modelo de uso óptimo de parches de Brown (1988), evaluamos distintos factores que podrían afectar el comportamiento de forrajeo del fara en un área exurbana de la Sabana de Bogotá. El fara D. pernigra es un marsupial que se distribuye en Colombia aproximadamente entre los 2000 y 3900 m de altitud (Solari et al. 2013). Su hábitat natural son los bosques andinos y páramos, y puede aprovechar bosques con distintos grados de intervención. El fara se encuentra también entre las especies nativas que pueden sobrevivir en ambientes cercanos a las ciudades andinas colombianas. El conocimiento de la ecología de la especie en Colombia es limitado, particularmente en ambientes intervenidos, aunque se ha indicado que puede ser afectado por la cantidad de iluminación artificial o por la luz reflejada por la luna (Barrera-Niño y Sánchez 2014). Adicionalmente, se ha sugerido que el uso de microhábitat de los faras puede estar afectado por el riesgo de depredación, por los perros domésticos, y por la heterogeneidad espacial presente en ambientes urbanos (López-Barragan y Sánchez 2017, Suárez-Cáceres et al. 2020). Con base en todo lo anterior, analizamos cómo el comportamiento de forrajeo de los marsupiales podría ser afectado por la presencia humana y de un depredador exótico como el perro, bajo diferentes factores como tipo de cobertura, iluminación de la luna y variables meteorológicas como la temperatura del aire, la precipitación y la humedad relativa (Porter et al. 2000, Jayatilaka et al. 2011). En particular, esperábamos que el fara reconociera humanos o perros como amenazas, lo que causaría una reducción de su forrajeo, es decir, incrementando sus DDA. Así mismo esperábamos altas DDA en noches con alta iluminación de la luna, como se ha observado en estudios anteriores (Barrera-Niño y Sánchez 2014), dado que algunos depredadores son más efectivos durante periodos de alta iluminación (Kotler et al. 1991, Bouskila 1995, Orrock et al. 2004). También esperábamos reducción en las DDA de los faras en sitios con abundante vegetación, que parece reducir el costo percibido de depredación en la Sabana de Bogotá (López-Barragan y Sánchez 2017). Por último, relacionamos la temperatura promedio del aire y la humedad relativa de cada noche para controlar su posible efecto sobre el forrajeo de los faras (Jayatilaka et al. 2011).
MATERIALES Y MÉTODOS
Área de estudio
La Sabana de Bogotá es una subregión del altiplano cundiboyacense ubicada aproximadamente a 2600 m de altitud en la cordillera oriental de los Andes colombianos, incluye 19 municipios, incluyendo Cajicá (DANE c2005). La vegetación original en los cerros de la Sabana era de bosques andinos y matorrales, mientras que en la zona plana había bosques inundables y humedales (Guhl 1981). La influencia del ser humano mediante actividades como la agricultura y la urbanización modificaron radicalmente esta zona, y hoy es abundante la vegetación de origen exótico, los cultivos y las construcciones (Hernández-Camacho y Sánchez 1992, Rojas-B 2017). Desarrollamos el estudio en Cajicá, particularmente en el campus de la Universidad Militar Nueva Granada (UMNG), que presenta un mosaico de zonas urbanizadas, pastizales, cultivos, plantaciones de eucaliptos y zonas en regeneración natural sobre la ribera del río Bogotá (Fig. 1a). Además, el campus se encuentra a menos de 300 m de los barrios periféricos del municipio de Cajicá, y en una circunferencia de 2 km2 alrededor del campus hay aproximadamente un 5 % del área urbanizada. Vecino al campus también hay zonas dedicadas a la agricultura y hay un campo de golf. Por todo esto, consideramos que el campus está en un área exurbana (Marzluff et al. 2001).

Figura 1 Área de estudio para el análisis de comportamiento de forrajeo del fara Didelphispernigra. a. Campus de la Universidad Militar Nueva Granada en Cajicá, Colombia, y sitios donde se evaluó el forrajeo de Didelphis pernigra: plantación de eucaliptos y área en regeneración. b. Los números corresponden a la respectiva disposición de los comederos en las áreas de estudio. e= Plantación de eucaliptos (4°56'34.26"N -74°00'31.62"E), r= Zona en regeneración (4°56'16.76''N 74°00'28.55''E) (Google Earth, 2013). Nótese la cercanía de edificios a la plantación.
Realizamos muestreos dentro del campus en dos zonas (Fig. 1). La primera es una plantación de eucaliptos (Eucalyptus globulus Labill), con árboles de entre 10 y 20 m de altura y un sotobosque con plantas entre 0,5 y 1,5 m de altura, y pasto kikuyo (Cenchrus clandestinus Hochst. ex Chiov.) creciendo en el estrato rasante; la plantación se encuentra a menos de 100 m de edificios con salones de clase. La segunda es un área en regeneración de bosque andino en la ronda del río Bogotá dominada por chilco (Baccharis latifolia Ruiz & Pav., ~3-4 m de altura), pasto kikuyo, mora (Rubus sp. Linneo) y sauce (Salix humboldtiana Willd) (~7-15 m de altura). Información adicional sobre la fauna y vegetación del campus está disponible en Sánchez et al. (2015).
Especie estudiada
Didelphis pernigra tiene una masa corporal adulta que varía entre 600 g y 2000 g (Eisenberg 1989, Mendoza y Sánchez 2014). Este marsupial se encuentra en Venezuela, Colombia, Ecuador, Perú y Bolivia (Cerqueira y Tribe 2008) y es una de las especies nativas más frecuentemente registrada en la cordillera oriental de los Andes en Colombia por encima de 2000 m de altitud (Zúñiga et al. 1990, Mendoza y Sánchez 2014, Liévano-Latorre y López-Arévalo 2015). Tiene una dieta omnívora que incluye frutas y animales (Eisenberg 1989, López-Arévalo y Montenegro-Díaz 1993, Sánchez y Alvear 2003), y por ello posiblemente actúa como dispersor de semillas y controlador de poblaciones de invertebrados y pequeños vertebrados, como ha sido reportado en otros Didelphis (Cáceres 2002). La presencia del fara ha sido reportada en el campus de Cajicá previamente y allí se hicieron evaluaciones iniciales de su uso de hábitat usando DDA (Barrera-Niño y Sánchez 2014). Además, trampeos previos a este estudio indicaron que en el campus habitan al menos cinco individuos de D. pernigra (F. Sánchez, datos no publ.).
Evaluación del forrajeo
Usamos DDA para evaluar la respuesta comportamental de forrajeo del fara ante un incremento del riesgo de depredación bajo dos experiencias: i) presencia de humanos con y sin depredador exótico (perro Canis lupus familiaris); y ii) presencia del depredador exótico en distintos momentos de la noche.
En las experiencias establecimos estaciones de forrajeo que consistieron en comederos hechos de cilindros plásticos (altura 12 cm, diámetro de la base 6 cm) abiertos en la parte superior para que los faras pudieran acceder al alimento (diámetro 6 cm) (Suárez-Cáceres et al. 2020). En cada comedero colocamos 150 g de una mezcla de agua y azúcar (29,41 % p/p) como alimento. Para aplicar esta técnica generalmente se usa el alimento mezclado en un sustrato no comestible para generar ganancias decrecientes en la tasa de cosecha y así cumplir con los supuestos del teorema del valor marginal (Charnov 1976), que es el fundamento de la teoría de Brown (1988). Por lo tanto, adicionalmente colocamos 60 esferas de vidrio de 10 mm de diámetro en cada comedero, como obstáculo para la obtención de alimento y para generar ganancias decrecientes en la tasa de cosecha del fara (Sánchez 2006) (Fig. 2a). En el campo instalamos los comederos dentro de tubos de PVC (diámetro 7 cm) en posición vertical sujetos a árboles, para evitar que los faras dañaran los comederos. Asimismo, las estaciones tenían un techo plástico para protegerlos de la lluvia (Fig. 2b). En experimentos anteriores hicimos mediciones que indicaron que la pérdida de líquido por evaporación es menor a 1 g/noche, por lo que consideramos este efecto despreciable. La disposición de los comederos dependió de las características de cada cobertura, zona en regeneración o plantación de eucaliptos (Fig. 1b). Previo al inicio de la experiencia habituamos los faras a los comederos, según lo propuesto en trabajos previos en la Sabana de Bogotá, donde se usó el mismo modelo de comedero aplicando la misma técnica de DDA (Barrera-Niño y Sánchez 2014, Suárez-Cáceres et al. 2020). Para reconocer el uso de los comederos por parte de D. pernigra durante el tiempo de habituación, se colocó cinta doble faz en el borde superior de los comederos para recolectar pelos de los animales que los visitaran, y también se usaron trampas de huellas. Dado que el fara es un forrajeador nocturno, cada día de experiencia instalamos los comederos aproximadamente a las 17:30 h para retirarlos al día siguiente a las 06:00 h. Cada comedero fue pesado en una balanza analítica antes y después de cada día de experiencia para medir la cantidad de alimento dejado por los faras, i.e., la DDA.

Figura 2 Estación usada para medir el forrajeo del fara Didelphis pernigra. a. Fara haciendo uso de la estación. Nótese las esferas de vidrio dentro del comedero para generar ganancias decrecientes y así medir densidades de abandono, b. Instalación de la estación en campo en la base de un árbol, con un techo plástico, cinta doble-faz y algodón con esencia de banano.
Obtuvimos la temperatura promedio del aire, precipitación y humedad relativa de una estación meteorológica ubicada en el sitio de estudio. Además, obtuvimos el porcentaje de iluminación de la luna del sitio para cada noche del estudio de www.timeanddate.com. Como depredador exótico utilizamos un perro de aproximadamente 50 cm a la altura de la cruz y 15 kg de masa, que fue enseñado previamente a cazar fauna silvestre en el área de estudio por habitantes del lugar y antes de haber conocido a los autores.
Experiencia 1 - Presencia de humano con o sin depredador exótico
Entre los meses de agosto y septiembre, instalamos diez comederos en cada una de las coberturas en estudio. En la plantación de eucaliptos ubicamos los comederos cubriendo más del 50 % de la plantación, en una grilla con 20-40 m de separación entre comederos (Fig. 1b-e). En el área en regeneración natural instalamos seis de los comederos a lo largo de la ribera del río Bogotá y los otros cuatro en arbustos aislados o parches pequeños (~208 m2) de vegetación nativa, con al menos 15 m de distancia entre comederos debido a la irregularidad de la zona (Fig. 1b-r).
Manipulamos el riesgo de depredación percibido por los faras mediante recorridos nocturnos entre comederos en tres tratamientos: i) presencia de humano y depredador, ii) presencia de humano sin depredador, y iii) ausencia de ambos (control). Cada tratamiento fue repetido por seis noches, para un total de 18 noches totales de experiencia. Aplicamos los tratamientos aleatoriamente cada noche. Para los primeros dos tratamientos, los recorridos por los comederos tuvieron una duración aproximada de diez minutos a las 18:30, 00:00 y 04:00. En el tratamiento con presencia del perro, éste iba sujeto a una correa retráctil.
Experiencia 2 - Presencia de depredador exótico
Con base en los resultados de la experiencia 1, desarrollamos una segunda experiencia exclusivamente en la zona en regeneración. En esta experiencia utilizamos solamente el perro, medimos las DDA cada seis horas solamente en las cuatro estaciones más utilizadas en la primera experiencia, aquellas ubicadas sobre la ribera del río (estaciones seis, siete, ocho y nueve; Fig. 1b), para evaluar el riesgo de depredación percibido bajo tres tratamientos: i) presencia de depredador entre las 18:00 h y las 24:00 h, ii) presencia de depredador entre las 00:00 h y las 06:00 h, y iii) ausencia de depredador toda la noche. Repetimos cada tratamiento por seis noches, con un total de 18 noches de experiencia y la asignación del tratamiento para cada noche fue aleatoria. En las noches con depredador, durante tres horas atamos el perro a un árbol al inicio de la experiencia entre las estaciones seis y siete (Fig. 1b) y al cabo de tres horas lo trasladamos 50 m entre las estaciones ocho y nueve (Fig. 1b) y allí lo atamos de nuevo por otras tres horas, para cubrir toda la zona de muestreo. La correa con la cual fue atado tenía 10 m de largo, lo cual permitía el movimiento del perro en todas las direcciones. En todos los tratamientos medimos las DDA a las 00:00 h y 06:00 h. Ubicamos los comederos con 150 g de alimento en cada uno de los periodos de la noche.
Los aspectos bioéticos del proyecto fueron examinados por dos grupos de diferentes de evaluadores asignados por el Programa de Biología Aplicada de la UMNG. El perro que usamos para el estudio vivía en el campus y por decisión de sus dueños, estuvo atado fuera de la casa meses antes de iniciar las observaciones, i.e., el perro estaba acostumbrado a las condiciones climáticas presentadas durante el experimento. Durante el estudio el perro estuvo tranquilo y sin comportamientos que pudiesen asociarse con sufrimiento. Así mismo, se aseguró el perro para evitar posibles ataques a los faras.
Análisis de datos
Para identificar las variables que afectaron el forrajeo del fara utilizamos modelos lineales generalizados (MLG) con una distribución gama y función de enlace logarítmica (Mangeaud y Videla 2005). Las variables en el modelo estadístico fueron previamente identificadas mediante análisis de correlación no paramétrica. En el MLG la variable dependiente fue la DDA, mientras que para la primera experiencia las variables independientes fueron el tipo de riesgo de depredación y la estación de forrajeo. Para la segunda experiencia, usamos las mismas variables independientes adicionando el periodo de la noche (antes o después de la media noche), asimismo, la temperatura del aire, la precipitación, humedad y la iluminación de la luna entraron en el modelo como covariables (Zar 2010). Trabajamos únicamente con aquellos modelos que incluyeron factores con efectos significativos (Wilson y Hardy 2002). Para las comparaciones múltiples utilizamos pruebas de Bonferroni. Los datos fueron analizados con PASW Statistics 18 (Marques de Sá 2007) y el nivel de significancia para evaluar las hipótesis estadísticas fue de α = 0,05.
RESULTADOS
Experiencia 1 - Presencia de humano con o sin depredador exótico
Con base en los rastros detectados en las trampas de huella y la cinta doble faz, determinamos que los únicos visitantes de los comederos fueron los faras. De los diez comederos dispuestos en la plantación de eucaliptos, sólo uno fue visitado en cuatro oportunidades durante toda la experiencia. Este comedero se encontraba rodeado de plantas de mora, y era el único en esta área que no fue puesto en la base del tronco de un eucalipto. Por el contrario, en la zona de regeneración los faras usaron regularmente siete de los comederos; principalmente aquellos que estaban rodeados de enredaderas (estaciones uno, dos, seis a diez; Fig.1b). En otras palabras, el valor de los parches fue mayor en el área de regeneración que en la plantación. Por la baja cantidad de datos en la plantación, realizamos los análisis estadísticos usando exclusivamente los datos del área de regeneración. El MLG resultante indicó que las DDA de los faras fueron afectadas por el tipo de riesgo de depredación (X2 Wald=12,24, g.l.=2, P = 0,02) y la estación de forrajeo (X2 Wald=49,30, g.l.=9, P < 0,01). Las DDA de los faras en el tratamiento control fueron menores que en presencia humana. También, contrario a lo esperado, la presencia del perro no afectó el forrajeo con respecto al control o a la presencia humana (Fig. 3).
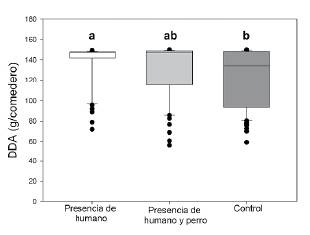
Figura 3 Densidades de abandono (DDA) de los faras en un área en regeneración de bosque andino para cada manipulación de riesgo de depredación: presencia de humano, presencia de humano y perro, y ausencia de ambos (control). Las DDA fueron diferentes entre noches control y con humano, pero no entre éstas y las noches con perro. La línea dentro de cada caja representa la mediana, sus extremos los percentiles 25 y 75, la barra de error los percentiles 10 y 90, y los puntos indican valores atípicos. Letras diferentes sobre las cajas indican diferencias significativas (Bonferroni, P <0,05).
Durante el tiempo de estudio registramos encuentros directos con faras donde el perro reaccionó a su presencia siendo sujetado a tiempo antes de poder atacar los marsupiales, y ninguno resultó lesionado. Sin embargo, meses previos al inicio del proyecto habitantes del lugar relataron un ataque de perros sobre una hembra de fara con crías. Así mismo, evidenciamos en dos ocasiones ataques de perros a curies (Cavia aperea Erxleben, 1777), así como la persecución por parte de perros a otras especies de mamíferos, incluyendo una comadreja (Mustela frenata Lichtenstein, 1831). Estos ataques se registraron durante un periodo en que los perros permanecieron libres en el campus, pero por determinaciones ajenas al presente estudio fueron encadenados por sus dueños meses antes de iniciar observaciones.
Experiencia 2. Presencia de depredador exótico
Las DDA de los faras fueron significativamente afectadas por la estación de forrajeo (X2 Wald= 69,61, g.l.=3, P < 0,01), el período de muestreo (X2 Wald= 40,56; g.l.=1, P < 0,01), la iluminación de la luna (X2 Wald= 3,68; g.l.=1; P < 0,05), y las interacciones estación de forrajeo x periodo (X2 Wald= 21,44, g.l.=3; P < 0,01), y periodo x iluminación de la luna (X2 Wald= 12,83; g.l.=1; P < 0,01). La presencia del perro tampoco tuvo un efecto significativo en esta experiencia. Entre las estaciones de forrajeo, dos fueron las más utilizadas y estas diferencias fueron más evidentes durante las primeras seis horas de la noche (Fig. 4).
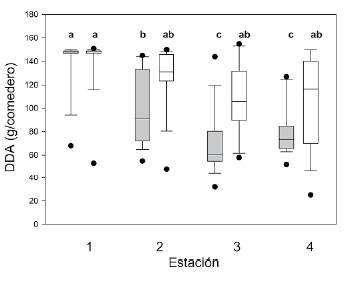
Figura 4 Densidades de abandono (DDA) de los faras en función de las estaciones y el período de la noche (barras grises 18:00-24:00 h; barras blancas 00:00-06:00 h) en la segunda experiencia. Los faras prefirieron forrajear en las estaciones tres y cuatro antes de la media noche. La línea dentro de cada caja representa la mediana, sus extremos los percentiles 25 y 75, la barra de error los percentiles 10 y 90, y los puntos indican valores atípicos. Letras diferentes sobre las cajas indican diferencias significativas (Bonferroni, P<0,05).
Los resultados indican también que los faras prefirieron forrajear antes de la media noche (Fig. 4). Adicionalmente, prefirieron forrajear en condiciones de baja iluminación lunar durante la primera parte de la noche, mientras que después de la media noche prefieren condiciones de alta iluminación (X2 Wald= 12,83; g.l.=1; P < 0,01). La temperatura del aire, la precipitación y la humedad relativa no tuvieron efecto sobre el forrajeo de los faras.
DISCUSIÓN
Los resultados no indicaron que el perro incremente los costos de forrajeo para el fara, mientras que en el primer experimento la presencia de humanos tuvo efecto negativo. Así mismo, encontramos una considerable diferencia entre el forrajeo de los faras en las dos áreas de estudio, siendo el eucaliptal muy poco utilizado frente a un uso continuo en la mayoría de las estaciones en el área de regeneración.
En el segundo experimento, el perro tampoco fue reconocido como un riesgo por los faras. Por otra parte, el forrajeo fue afectado por la hora de muestreo y la iluminación de la luna.
Dado que la plantación de eucaliptos y la regeneración estaban tan cerca (~349 m), los costos de movilización entre esos dos ambientes debieron ser despreciables para el fara; hay reportes en especies cercanas como D. albiventris Lund, 1840 que pueden desplazarse en áreas superiores a 50 000 m2 (Cáceres 2002). Por lo tanto, en estas condiciones este marsupial podía demostrar su preferencia, y así nuestros resultados indican un efecto a nivel de hábitat, prefiriendo la regeneración sobre la plantación. Un estudio previo registró faras que utilizan plantaciones de eucaliptos en la Sabana de Bogotá, particularmente aquellas con árboles de más de 20 m de altura, que parecen servir como refugios (Mendoza y Sánchez 2014). En el campus, los eucaliptos tienen entre 10 y 20 m, no presentan ramas gruesas, y probablemente no brindan refugio apropiado para estos marsupiales. Asimismo, la plantación en el campus se encuentra a menos de 100 m de edificios con salones y presencia frecuente de humanos, y como sugieren los resultados de la primera experiencia, esto podría reducir la calidad del hábitat y por lo tanto influir en el bajo uso dado por estos animales. El estudio realizado anteriormente en el área también demostró el uso por faras de cercas vivas de eucalipto rodeadas con pastizales e incluso se capturaron individuos en la plantación de nuestro estudio (Barrera-Niño y Sánchez 2014). Sin embargo, en ese trabajo previo no se habían construido los edificios, y esto puede explicar por qué actualmente la plantación es poco utilizada por los faras. Los animales presa tienden a usar en menor proporción aquellos ambientes que sean percibidos como más peligrosos (Brown 1988, Brown et al. 1992, Kotler 1992, Kotler et al. 1993), y así nuestros resultados sugieren que la plantación de eucaliptos, por sus características y probablemente debido a la proximidad a edificios, es ahora un ambiente percibido como peligroso. Esto muestra la utilidad de las DDA para rastrear cambios en el comportamiento de las especies con respecto a cambios en un paisaje o el manejo de este (Morris et al. 2009).
Como esperábamos, en el área en regeneración evidenciamos un uso diferencial de las estaciones, siendo las más utilizadas aquellas que se encontraban rodeadas por enredaderas como la mora (Rubus sp.) y Passiflora sp. L., lo cual sugiere que la presencia de estas plantas favorece el forrajeo de los faras. Estas enredaderas forman parches densos que podrían servir como madrigueras o para protección del ataque de depredadores, y además aportan frutos que pueden ser consumidos por los faras (Cáceres 2002, Smith 2007). De hecho, durante el trabajo de campo encontramos evidencias del fara consumiendo frutos de Passiflora sp. en la zona de regeneración. Además, la única estación de forrajeo que fue utilizada en la plantación de eucaliptos estaba rodeada de mora, las estaciones más cercanas se encontraban a ~20 m de distancia, atadas a troncos de eucalipto y aun así nunca fueron visitadas.
Esto apoya la idea de que la presencia de estas plantas incrementan el valor marginal de los parches de forrajeo. Esto también concuerda con resultados previos sobre este marsupial que muestran que el incremento de cobertura vegetal a escala de microhábitat puede hacer una zona más valiosa (López-Barragan y Sánchez 2017). Por otra parte, la disponibilidad de alimentos asociados a las enredaderas, u otras plantas de la zona de estudio, podría incrementar los costos de oportunidades perdidas para los faras en el sitio de estudio (Brown 1988). Sin embargo, la cercanía entre los días de muestreo en cada experiencia probablemente hizo que este costo fuera muy parecido a lo largo de las experiencias y por lo tanto no debería afectar la detección de otros efectos asociados al forrajeo en el campus.
Los depredadores pueden inducir efectos no letales en sus presas (Altendorf et al. 2001, Brown y Kotler 2007). Un individuo puede incrementar el tiempo dedicado a la vigilancia cuando aumenta la tasa de encuentro con los depredadores, lo que conlleva a una reducción de la letalidad del depredador, pero también una disminución del tiempo dedicado al forrajeo (Brown 1999). Contrario a lo esperado, los resultados de las dos experiencias indican que el forrajeo de los faras no fue afectado por la presencia del perro, lo que sugiere que esos depredadores exóticos no fueron percibidos como letales o no fueron detectados por los faras. Esto parece concordar con un estudio en las afueras de la ciudad de Bogotá, que sugieren que la orina de los perros puede afectar el forrajeo de los faras, pero solo en contextos particulares relacionados con la cantidad de vegetación (López-Barragan y Sánchez 2017). El fara es una especie conocida por su habilidad para trepar, y según nuestros resultados prefiere sitios cubiertos por vegetación densa con enredaderas y zarzas. Dadas las características del área de estudio, los resultados sugieren que la percepción del nivel de letalidad del perro por parte de estos marsupiales nativos es baja, ya que posiblemente se encuentre en ventaja al encontrar los comederos en zonas aledañas a su refugio, en árboles como los sauces, cuya estructura le permitiría huir fácilmente en caso de peligro. El nivel de letalidad explica cómo varía la eficiencia de un depredador para capturar presas según las características del hábitat (Laundré et al. 2010), y por ejemplo, los perros son buenos cazadores especialmente en hábitats abiertos como sabanas y páramos (Ojasti 2001). Es posible que el fara no perciba al perro como una amenaza porque no ha tenido tiempo para reconocer las señales que deja, no tiene las herramientas para detectarlas o confía en la elección que hace de hábitats para reducir el riesgo de ser depredado.
Por otra parte, la respuesta comportamental de los faras sugiere que la presencia de los humanos implica mayores costos de forrajeo comparado con la presencia de perros o de ambas especies juntas. Sí bien la presencia humana no implica necesariamente la muerte de los individuos, y por tanto no puede asumirse como un depredador, se debe tener en cuenta que su presencia conlleva a una serie de estímulos nuevos que pueden perturbar a otras especies (Frid y Dill 2002). Dichos estímulos se pueden considerar análogos al riesgo de depredación (Frid y Dill 2002), y por esta razón, consideramos que las respuestas comporta-mentales de los faras respecto al perro y al humano obedecerían las mismas reglas de decisión respecto al riesgo de depredación percibido.
Los faras prefirieron forrajear antes de la media noche, lo cual puede relacionarse con la necesidad de adquirir nutrientes luego de un período de ~12 h sin alimento. Durante esta parte de la noche el valor del alimento se incrementa si la iluminación de la luna es baja, mientras que en la segunda parte de la noche hay una inversión del comportamiento y parecen preferir mayor iluminación de la luna. El incremento en la iluminación de la luna se ha relacionado con incrementos en el riesgo de depredación (Kotler et al. 1991, Julien-Laferriére 1997). Esto sugiere que la primera parte de la noche es menos peligrosa para el fara. Estos resultados concuerdan parcialmente con un trabajo anterior realizado en la zona, donde se evidenció que los faras prefieren noches oscuras para su forrajeo (Barrera-Niño y Sánchez 2014). En la madrugada, parecen preferir mayor iluminación, y posiblemente estos marsupiales podrían necesitar más luz de luna para utilizar señales visuales y encontrar alimento extra (Volchan et al. 2004, Norris et al. 2010). Sin embargo, otro estudio con faras en un área suburbana de Bogotá no encontró un efecto de la iluminación de la luna sobre el forrajeo (López-Barragan y Sánchez 2017). Así, la diferencia en los resultados podría ser metodológica, debido a que en los estudios previos no se midieron DDA a media noche, o podría indicar respuestas diferenciales de los faras a la iluminación de la luna dependiendo del lugar.
En conclusión, los resultados del presente trabajo indican que la presencia de humanos implica mayores costos sobre el forrajeo del fara que la presencia de perros. Si bien no encontramos un efecto directo de la presencia del perro como depredador, nuestros resultados indican que los fa-ras reconocen diferencias a nivel de hábitat, i.e., plantación de eucaliptus vs. zona en regeneración, y también a nivel de microhábitat. Así, es posible que el riesgo de depredación pueda inducir a las especies presa como el fara a forrajear en microhábitats más seguros (Bouskila 1995), como aquellos abundantes en enredaderas. La posible incapacidad del fara de reconocer al perro como una amenaza, puede convertir a esta especie en una presa vulnerable al ataque por parte de este depredador, con posibles consecuencias sobre su abundancia y conservación, principalmente en aquellos sitios donde la presencia de perros sea frecuente y hay poca vegetación arbórea y enredaderas. Esto explicaría las muertes de faras reportadas en la Sábana de Bogotá por parte de perros domésticos (Ramírez y Ordóñez 2006, López-Barragan y Sánchez 2017).















