INTRODUCCIÓN
El aprovechamiento de la fauna silvestre requiere, entre otras cosas, el establecimiento de cuotas de cosecha anuales que permitan mantener en el tiempo la población en un tamaño determinado (Saltz 2001). La estimación de la cuota máxima de extracción depende del valor de la tasa intrínseca de crecimiento poblacional, que se obtiene a partir de la diferencia entre los valores estimados del tamaño de la población, en los periodos muestreados. En consecuencia, el registro de la dinámica de la población en el tiempo permite hacer predicciones de la tendencia poblacional y plantear medidas de manejo para un uso sostenible (Ojasti y Dallmeier 2000).
En Colombia la especie Hydrochoerus hydrochaeris (Linnaeus, 1766) se distribuye a lo largo de las regiones de la Orinoquía y Amazonia y diferentes estudios han mostrado que las mayores poblaciones se encuentran en las sabanas inundables de Casanare y Arauca, donde se tienen registros de densidades de entre 0,3 a 1,7 individuos/ha en Caño Limón, Arauca, 2,16 ind/ha en Puerto Rondón, Arauca (Corporinoquía y UNAL 2015) y de 6,41 ind/ha en Paz de Ariporo, Casanare (Atuesta et al. 2014). Las poblaciones orinocenses han estado sometidas en muchos casos a la sobreexplotación asociada al consumo histórico de la especie en Colombia y la alta demanda de carne en Venezuela (Mesa-González et al. 2014), e incluso se han presentado eventos de muerte masiva, la más reciente registrada en marzo del 2014 (Contraloría General de la República c2014, Corporinoquia 2014).
El aprovechamiento sostenible ha surgido como una opción viable para su conservación, y aunque a la fecha no se ha puesto en práctica en Colombia, la investigación hacia este objetivo ha sido impulsada por más de una década (Aldana et al. 2007, Giraldo y Perilla 2001, López-Arévalo et al. 2014) teniendo como referente las prácticas de uso sostenible de la especie llevadas a cabo en países como Venezuela, Argentina y Brasil, donde se realizan actividades de aprovechamiento legal de diversos productos a partir de poblaciones silvestres de este roedor (Ojasti 1991, Moreira et al. 2013).
Para realizar actividades de uso sostenible, como la cacería comercial, se requiere información que permita el manejo de las poblaciones en vida libre mediante la estimación de parámetros poblacionales como la estructura, tamaño y tasa de crecimiento poblacional. Al mismo tiempo, es necesario conocer los factores bióticos y abióticos que inciden en las tasas de nacimiento y mortalidad de los individuos, y de qué forma contribuyen a la dinámica de las poblaciones; por ejemplo, para el caso de sabanas inundables colombianas se han registrado mayores poblaciones en época de lluvias en comparación con la época seca (Aldana et al. 2002). Dado que los parámetros poblacionales no son estáticos pues resumen la dinámica de una población, su monitoreo es determinante en la viabilidad de la conservación, control o aprovechamiento de las poblaciones silvestres (Mandujano-Rodríguez 2012).
Considerando la posibilidad de manejo sostenible de la especie, el objetivo de este estudio fue estimar en diferentes años algunos parámetros poblacionales del chigüiro, como la densidad, abundancia, tasa de crecimiento e índice de cosecha sostenida, entre otros, de una población en las sabanas inundables de Paz de Ariporo, Casanare, Colombia.
MATERIALES Y MÉTODOS
Área de estudio
El estudio se llevó a cabo en el predio privado denominado Hato Miramar, con coordenadas: 5°39'47,6oi"Norte 7l°8'l9,939"Oeste (Datum: WGS84), ubicado en la vereda Normandía del municipio de Paz de Ariporo, en el departamento de Casanare (Fig. 1). Pertenece al ecosistema de sabanas inundables de los Llanos Orientales, caracterizado por cambios contrastantes entre épocas climáticas, con una marcada época seca durante los meses de noviembre y marzo y una época de lluvias e inundaciones entre los meses de abril y octubre, ambas con aproximadamente un mes de transición (IDEAM 2003). En el sitio de estudio predominan las áreas abiertas como sabanas con pajonales y sabanas limpias, además esteros (áreas inundadas temporales o permanentes) y algunos caños y zanjas formadas por el flujo de agua, entre otros (Guzmán-Lenis et al. 2014).
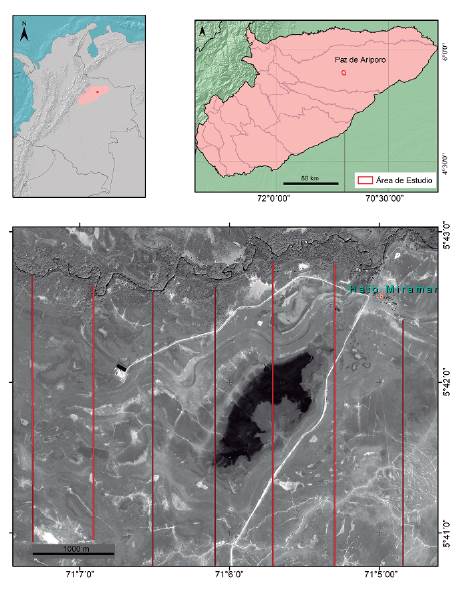
Figura 1 Localización general del área de estudio. Las líneas verticales rojas muestran los transectos que se usaron.
Posterior al año 2007 la zona ha sufrido cambios en la configuración del paisaje, debido al establecimiento de la industria petrolera y la introducción de líneas de oleoductos y carreteras (terraplenes) con zonas de préstamo lateral (zonas de sustracción de material para construcción de terraplenes u otras obras de infraestructura asociadas a la industria petrolera), que en época de lluvias forman pozos que los chigüiros y demás fauna utilizan (IAVH 2016).
Ocasionalmente, en la región se presentan mortandades masivas de chigüiros, ganado vacuno y demás fauna. En la época seca de 2014 se presentó una mortandad masiva, que para la zona de estudio registró más de 4500 chigüiros muertos, siendo una de las localidades más afectadas en el país (Contraloría General de la República c2014, Corporinoquia 2014).
Evaluación poblacional
Con el fin de aportar información hacia el uso sostenible de la especie, el Grupo en Conservación y Manejo de Vida Silvestre de la Universidad Nacional de Colombia ha realizado muestreos poblacionales estandarizados de la población de chigüiros en el Hato Miramar para seis periodos: julio 2004, julio 2005, octubre 2015 y noviembre 2017 en época de lluvias, marzo 2006 y marzo 2016) en sequía (Atuesta et al. 2014, IAvH 2016).
La evaluación poblacional se llevó a cabo en una cuadrícula de 3600 ha la cual fue delimitada desde 2004 como parte de un programa de monitoreo de las poblaciones y su hábitat en diferentes localidades (Atuesta et al. 2014, Guzmán-Lenis et al. 2014). En esta cuadrícula se trazaron transectos lineales en sentido Norte - Sur, distanciados 700 m entre sí. La cuadrícula incluyó diferentes tipos de cobertura como bosque, arbustal denso, arbustal disperso, pajonal, pajonal disperso, sabana y esteros, sin embargo, la fuerte estacionalidad en las sabanas inundables ocasiona variaciones en las áreas de estas coberturas (Guzmán-Lenis et al. 2014), principalmente en cuerpos de agua que afectarían la distribución de los grupos de chigüiro, dada su dependencia a este recurso. Debido a la presencia de cercas que impedían la movilidad, los seis transectos que cubren la cuadrícula (Fig. 1) fueron subdivididos en trece transectos de longitud variable para un total de 35,8 km recorridos por cada periodo de muestreo. Los transectos se recorrieron a caballo entre las 7:00 y las 17:00 horas, realizando la búsqueda de individuos a lado y lado de la línea media (250 m a cada lado), con la ayuda de binoculares 8 x 40 y con un número constante de dos observadores por muestreo.
Se utilizó el método de distancias (Buckland et al. 1993), que consiste en el conteo de individuos a ambos lados de un transecto, y el registro de las distancias perpendiculares desde el punto donde se encuentra cada individuo, o el centroide del grupo, hasta la línea media del transecto; estas distancias permiten determinar la probabilidad de detectar un individuo g(x), término definido como función de detección (Conroy et al. 2015).
Para cada grupo observado se registró la distancia perpendicular al transecto estimada por el observador, quien previamente entrenó sus estimaciones, usando un distanciómetro Nikon PROSTAFF 5. Además, se registró la localización sobre el transecto, el número de individuos por categoría de edad y el número total de individuos por grupo, para establecer el tamaño de grupo en cada época de muestreo.
Se estableció la estructura de edades en la población de chigüiros categorizando tres clases de edad a partir de la comparación visual del tamaño de los individuos y el cálculo de la longitud de la alzada: crías <30 cm, juveniles entre 30 y 40 cm y adultos >45 cm. Dicha categorización fue utilizada debido a que la edad relativa solo puede ser determinada a partir de la osificación de las suturas de la región occipital del cráneo y la osificación progresiva de las suturas de las epífisis humerales (Ojasti 1973, Ojasti 2011b), sin embargo, la longitud del húmero que se refleja en la longitud de alzada, permite diferenciar las categorías de edad (Ojasti 2011b).
Análisis de la información
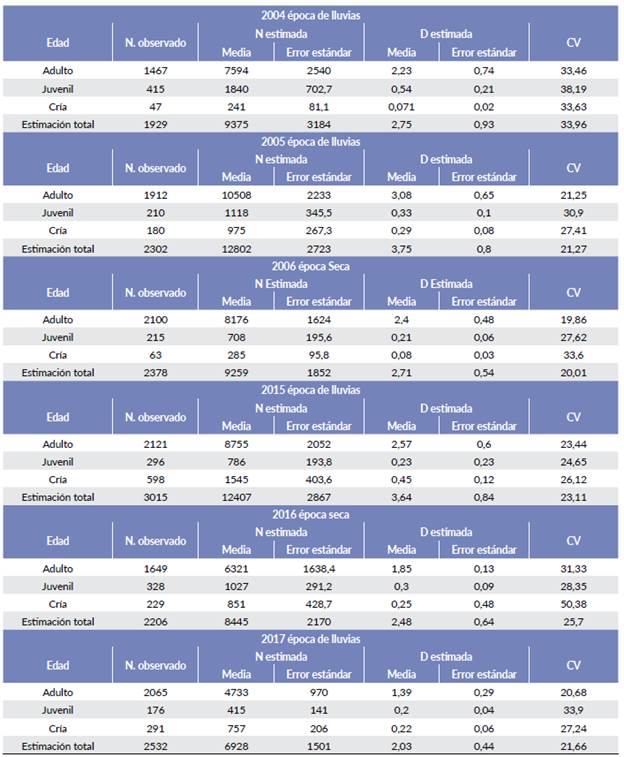
A partir del análisis de distribución de los datos utilizando el software DISTANCE 7.1 (Thomas et al. 2010), se seleccionaron los intervalos de clase y la distancia de truncamiento que mejor se ajustaron al modelo teórico (siete intervalos y 250 m de truncamiento), con las cuales se construyeron las distribuciones de frecuencia de los modelos. La información analizada corresponde a evaluaciones poblacionales hechas en 2004 (época de lluvias), 2005 (lluvias) y 2006 (época seca) y 2015 (lluvias), 2016 (seca) y 2017 (lluvias).
La estimación de la densidad poblacional en los diferentes periodos de muestreo se realizó con el software DISTANCE 7.1 (Thomas et al. 2010), la cual se basa en la selección de un modelo f(x) adaptado con funciones clave, que describen la forma en la que cambia la curva de detección como función del aumento de distancia del objeto observado desde la línea central (transecto). Se utilizaron las distintas combinaciones de las funciones clave y ajustes de serie que ofrece DISTANCE 7.1 (Thomas et al. 2010) para seleccionar los modelos que mejor describieran la densidad y abundancia de la especie en cada periodo muestreado. La selección del modelo se llevó a cabo teniendo en cuenta el principio de parsimonia, evaluada mediante el criterio de información de Akaike (AIC Akaike's Information Criterion), se escogió el modelo de menor valor de AIC y su validez estadística se comprobó a partir de pruebas de bondad de ajuste de Chi2 con una significancia del 95 %.
El análisis poblacional se llevó a cabo de dos maneras: en primer lugar, se analizaron los conteos de todos los años, con una post-estratificación por año para hacer una comparación multitemporal de la población, este análisis no tuvo en cuenta las categorías de edad registradas, sino que consideró el número total de individuos de cada grupo registrado en los conteos. El segundo análisis se hizo individualmente para cada año, con una post-estratificación por edades, para obtener información acerca de la estructura de edades de la población en cada periodo muestreado.
Para establecer si hubo diferencia entre los promedios del tamaño poblacional en los seis muestreos se hizo una tabla de contingencia, utilizando el paquete estadístico PAST 3.11 (Hammer et al. 2001). La comparación de las medias de las densidades de los diferentes periodos de muestreo, y la estructura de edades en diferentes épocas se hizo mediante la aplicación de pruebas Z. Se hicieron tres tipos de comparaciones: 1) Interanuales, comparando periodos climáticos iguales en muestreos contiguos: lluvia 2004-lluvia 2005 (doce meses); lluvia 2015-lluvia 2017 (25 meses), 2) Estacionales, comparando diferentes periodos climáticos de años contiguos: lluvia 2005-seca 2006 (ocho meses); lluvia 2015-seca 2016 (cinco meses), y 3) por década, comparando periodos climáticos iguales en intervalos de una década: lluvia 2005-lluvia 2015 (123 meses); seca 2006seca 2016 (120 meses), para este caso, los valores comparados fueron los obtenidos de cada año señalado.
La tasa finita de crecimiento (λ) se calculó con la media estimada del tamaño poblacional, utilizando la ecuación: λ = Nt/N0 (Rockwood 2006), donde Nt es la abundancia de la población en el año t+1 y N0 es la abundancia del periodo anterior. Para el cálculo de À se utilizaron las abundancias de distintos periodos: 1) Interanuales, periodos climáticos iguales en muestreos contiguos: lluvia 2004-lluvia 2005; lluvia 2015-lluvia 2017), 2) Estacionales, diferentes periodos climáticos de años contiguos: lluvia 2005-seca 2006; lluvia 2015-seca 2016, y 3) por década, periodos climáticos iguales en intervalos de una década: lluvia 2005-lluvia 2015; seca 2006-seca 2016, y periodos climáticos diferentes en intervalos de una década: Seca 2006-Lluvia 2015 y Lluvia 2005-Seca 2016, para las comparaciones entre décadas, se utilizaron los valores promedio del tamaño po-blacional de cada muestreo.
Estimación de la cosecha
El cálculo de la producción máxima de la población (Pmax), se hizo a partir del modelo de Robinson y Redford (1997), que requiere información específica de la capacidad de carga (K), la tasa finita máxima de crecimiento (λmax) y la densidad poblacional (D). Este modelo hace las siguientes suposiciones conservadoras: 1) las poblaciones tienen un crecimiento denso-dependiente y 2) alcanzan la producción máxima cuando la población está al 60 % de su capacidad de carga (0,6 K). El modelo se basa en la ecuación Pmax = (0,6 K x λmax ) - 0,6 K; donde λmax = ermax, donde rmax corresponde al índice intrínseco del crecimiento natural.
La estimación de la P max utilizó el valor de K reportado para Venezuela, que corresponde a 3 ind/ha (Ojasti 1973, Ojasti 2003), y el rmax = 0,69, calculado para las poblaciones silvestres de chigüiro en sabanas naturales (Robinson y Redford 1986), el cual es uno de los mayores reportados dentro del grupo de mamíferos neotropicales.
Teniendo en cuenta que en Colombia el periodo de aprovechamiento, 1 enero al 31 de marzo, se da en la época de lluvia previo al inicio de la época seca, se calculó el índice de cosecha sostenida (h) para esta época en 2005 y 2015 con el fin de evaluar su potencial de cosecha en dos años diferentes. Este índice se basa en la tasa instantánea de extracción (H = r) (Caughley 1977), y permite combinar caza con mortalidad y fraccionar la extracción en diferentes periodos (Caughley 1977). La ecuación para su cálculo es h = 1 - e-H, donde H = r. La tasa intrínseca de crecimiento r = lnλ.
RESULTADOS
Estimaciones poblacionales
El tamaño poblacional presentó diferencias entre los seis muestreos (P < 0,005, Cramer's V = 0,44). Por su parte, las comparaciones interanuales del tamaño poblacional presentaron diferencias significativas (lluvia 2004-lluvia 2005 P = 1,1E -16; lluvia 2015-lluvia 2017 P = 4,1E -46), al igual que las comparaciones estacionales (lluvia 2005-2006 seca P = >0,001; lluvia 2015-2016 seca P > 0,001). Por último, las estimaciones por década no fueron diferentes entre lluvias de 2005 y 2015 (P = 0,26), pero sí se presentaron diferencias entre épocas secas de 2006 y 2016 (P = 0,02), y entre seca 2006-lluvia 2015 y lluvia 2005-seca 2016 (P = 1,6E-15 y P = 1,3 E-27, respectivamente).
Las comparaciones estacionales muestran una tendencia hacia la disminución de la densidad en la época seca, mientras que las densidades interanuales no tienen una fluctuación muy grande, a excepción de la época de lluvias de 2017, donde la densidad alcanzó un valor promedio de 2,03 ind/ha (Fig. 2).
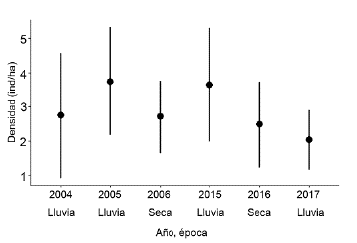
Figura 2 Densidad promedio (ind/ha) estimada y error estándar de chigüiros en los diferentes años de monitoreo, Hato Miramar, Casanare.
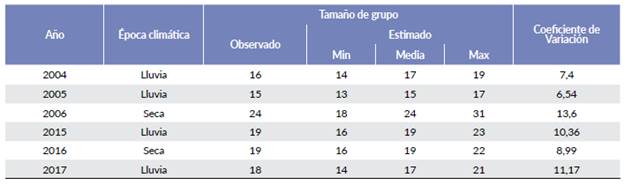
Con respecto al tamaño de grupo, en las evaluaciones de 2015 y 2016 el valor promedio fue de 19 individuos, mientras que en 2017 fue de 17 individuos El mayor tamaño promedio de grupo (24 individuos) se presentó en la época seca de 2006 y el menor (quince) en la época de lluvia de 2005 (Tabla 2).
Tabla 2 Estimaciones de tamaño (individuos/grupo) de grupo de chigüiro en los diferentes años, Hato Miramar, Casanare. CV=Coeficiente de variación.
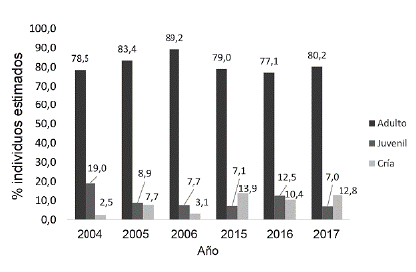
La estructura de edades fue similar y con una clara dominancia de la categoría de adultos en todos los periodos (>75 %). La mayor proporción de juveniles se dio en los años 2004 (lluvia) y 2016 (seca), mientras que las crías se encontraron en mayor proporción en 2015 (lluvia) y 2017 (lluvia) (Fig. 3).
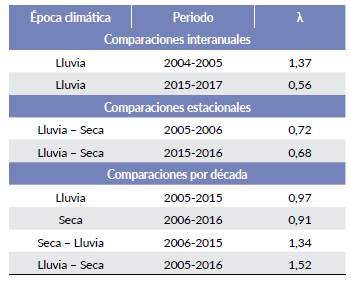
Las comparaciones interanuales mostraron un aumento de la tasa finita de crecimiento (λ) del 37 % (λ = 1,37) en 2005 y del 34 % (λ = 1,34) para 2015 (Tabla 3). Por otra parte, las comparaciones estacionales mostraron un patrón de reducción del 28 % (λ = 0,72) en la época seca de 2006 y del 32 % (λ = 0,68) para la época seca de 2016. Por último, las comparaciones por década muestran valores similares entre épocas climáticas iguales y un crecimiento del 32 % (λ = 1,32) de 2006 (seca) a 2015 (lluvia), y del 52 % (λ = 1,52) de 2005 (lluvia) a 2016 (seca).
Tabla 3 Valores de X para diferentes periodos en Hato Miramar, Casanare. Los valores se derivan de las cifras de abundancia estimada en cada muestreo presentes en la Tabla 1.
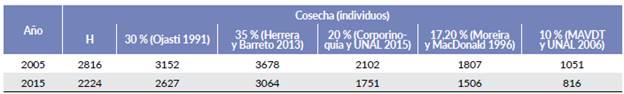
La producción máxima calculada de la población de chigüiro en la zona fue Pmax=179 individuos/km2 (1,79 ind/ ha) que son los individuos que podría producir una población natural con las mejores condiciones ambientales posibles. Por otra parte, el índice de cosecha sostenida (h) para los años de cosecha hipotética 2005 y 2015, sugiere una cosecha de más de 2000 individuos por año siendo mayor la estimada para el 2005 con un valor cercano a 2800 individuos (Tabla 4).
DISCUSIÓN
Abundancia poblacional
La densidad estimada para los diferentes periodos se encuentra dentro de los límites de la capacidad de carga que se estableció para los llanos de Venezuela, la cual se encuentra alrededor de 3 ind/ha (Ojasti 1973, Ojasti 2003); esto sugiere la viabilidad del aprovechamiento sostenible en el Hato Miramar, si se quisiera adoptar el mismo criterio de Venezuela. Incluso los valores promedio (Fig. 2) son muy superiores tanto al límite inferior de la condición explotable 0,15 ind./ha y a las densidades moderadas para explotación, 0,6 ind/ha, en las que se plantea la explotación según la tasa de productividad anual, 30 % de las existencias (Ojasti 2011a).
A pesar de la muerte masiva registrada en marzo del 2014 (Contraloría General de la República c2014, Corporinoquia 2014) la evaluación poblacional que se llevó a cabo durante octubre de 2015 en época de lluvias muestra valores de densidad y tamaño poblacional similares a los valores de la época de lluvias de una década anterior (2005 = 3,75; 2015 = 3,64 ind/ha; p = 0,26); lo que sugiere dos escenarios: la recuperación de la población ya que en cerca de 20 meses esta alcanzó valores de densidad de 3,64 ind/ha, o que la población que enfrentó este fenómeno era muy superior a la población evaluada en 2015. Sin embargo, dada la ausencia de un programa de monitoreo no podemos eliminar ninguna de las dos opciones, aunque la estimación de 4500 chigüiros muertos en el área que fueron enterrados por la autoridad ambiental como medida de precaución (Contraloría General de la República 2014), puede dar indicios de una alta densidad previa y una tendencia a la reducción en años posteriores. En el Hato Miramar, los eventos de mortandad masiva de chigüiro y otra fauna, pueden estar asociados a la existencia de zonas de préstamo lateral constituidas por grandes huecos paralelos a las vías, formados por la extracción de tierra para su construcción o la de infraestructura asociada a la actividad petrolera (IAvH 2016) ya que aumentan la oferta del recurso hídrico y hábitat para la especie en lluvias, pero se convierten en una especie de trampa mortal en sequías extremas, dada la baja movilidad registrada en la especie (Camargo-Sanabria et al. 2014).
El comportamiento cíclico de disminución y recuperación poblacional rápida se ha visto en otros mamíferos como los canguros (Macropus rufus (Desmarest, 1822) y M. giganteus (Shaw, 1790)), cuyas poblaciones han mostrado crecimientos acelerados posteriores a una baja drástica en su número, producto de factores denso-independientes como son las fuertes sequías, seguidos por periodos donde se presentan disminuciones poblacionales (Grigg 2002). En general, se han registrado eventos de muertes masivas de especies silvestres (Ameca y Juárez 2012, Fey et al. 2015), que constituyen catástrofes poblacionales en las que todos los rangos de edades se ven afectados (Lande 1993) y que se ve reflejada en una disminución sustancial de la población, en un periodo menor al del ciclo de reproducción de la especie (Reed et al. 2003).
Tamaño de grupo
El tamaño óptimo del grupo para una población es dependiente del costo - beneficio asociado a cada hábitat en particular (Herrera et al. 2011), el tamaño de grupo promedio en el Hato Miramar para la época de lluvias fue superior a lo reportado para Venezuela, Argentina y Brasil, con un intervalo de quince individuos en 2005 (D = 3,75) a 19 individuos en 2015 (D = 3,64). En los llanos venezolanos se reportan grupos con una media de diez individuos y densidad de 1,5 ind/ha (Herrera y Macdonald 1987) a 16 individuos con densidades de dos a cuatro ind/ha (Salas 2009); mientras que, en los Esteros del Iberá, en Argentina, el tamaño de grupo es de quince individuos (Herrera et al. 2011), y en el Pantanal Brasilero el grupo promedio es de seis individuos, con densidades de 0,095 ind/ha y once individuos con densidad de 0,125 ind/ha (Alho y Rondón 1987). Para época seca se presentó el mayor promedio de tamaño de grupo: 24 individuos (D = 2,71) para 2006 y 19 individuos (D = 2,48) para 2016 (Tabla 2), lo cual está relacionado con el comportamiento de fisión-fusión de las poblaciones, donde en época seca los grupos se fusionan alrededor de los cuerpos de agua remanentes, conformando agregaciones de hasta 100 individuos (Ojasti 1973, Jorgenson 1986).
Estructura de edades
Al igual que en Brasil (Moreira et al. 2013) y otras localidades de las sabanas inundables colombianas (Atuesta et al. 2014), en Miramar se encontraron grupos compuestos por individuos de todas las clases de edad a lo largo del año, aunque con diferente proporción. En la región de los Llanos de Venezuela los chigüiros son fértiles a lo largo del año, con un pico de nacimientos durante el final de la temporada de lluvias en el mes de octubre (Ojasti 1973, Herrera 2010, Moreira et al. 2013), este mismo patrón fue observado en este estudio. Pese a la alta tasa de mortandad que se presenta en el primer año de vida (Moreira 1996), el aumento en la proporción de juveniles en época seca puede reflejar la supervivencia de las crías nacidas en la época de lluvias inmediatamente anterior.
Crecimiento poblacional
Pese a que el crecimiento poblacional en Miramar es menor al reportado para los llanos de Venezuela, cuyo valor fluctuó entre 1,42 y 1,58 por año, durante 1967 a 1971 (Ojasti 1991), en las sabanas inundables de la Orinoquia colombiana las expansiones y contracciones periódicas del ambiente acuático son el principal factor que rige la dinámica de las poblaciones de chigüiro, de ahí que λ exhibe valores positivos o de crecimiento en la época de lluvias (34 %), mientras que los periodos que corresponden a verano presentan valores negativos o de disminución poblacional (cercanos al 30 %). Aldana et al. (2002), registran descensos en la población entre épocas de lluvia y época seca en las sabanas inundables de Arauca, Colombia. La relación entre precipitación y el crecimiento de las poblaciones silvestres de la especie, se expresa en forma diferencial a lo largo de su distribución, siendo positiva en Pirassununga, estado de São Paulo, Brasil, negativa en los Llanos de Venezuela y sin significancia estadística para la Isla Marajó en la Amazonía Brasilera (Moreira et al. 2013).
Producción máxima y Cosecha
El porcentaje de aprovechamiento se ha propuesto como máximo del 40 % de la producción máxima anual según Robinson y Redford (1997), lo que permitiría en Miramar un máximo de 71 ind/km22 Esta estimación es considerablemente mayor a la calculada por Moreira et al. (1996) donde el Pmax es de 60 ind/km2 y la máxima cosecha (40 % del Pmax) de 24 ind/km2, calculados para poblaciones de chigüiro de sabanas naturales de Venezuela. La densidad es usualmente la contribución numérica más grande al modelo de Robinson y Redford (1997), por lo que en la medida que este valor cambie, repercutirá en la estimación del Pmax y así de la cosecha (40 % como máximo) que proponen sus autores.
Los valores de h obtenidos para Miramar (0,27 para 2005 y 0,25 para 2016) son menores al porcentaje de crecimiento poblacional, y levemente menores en comparación con los reportados para Venezuela entre los años 1967 y 1971 (h = 0,30 - 0,37) (Ojasti 1991). En los llanos venezolanos, el monitoreo de los cambios en las tasas de crecimiento ha permitido la adaptación de la cuota de aprovechamiento de las poblaciones (Ojasti 1991).
La experiencia del país vecino demuestra que establecer cuotas de aprovechamiento cercanas a las tasas de crecimiento de las poblaciones conduce a la sobreexplotación, así durante la década del 70 se mantuvo una cuota de aprovechamiento anual del 30 %, y para los 80 aumentó a 35 % (Herrera y Barreto et al. 2013), a lo cual siguió una baja ostensible en las poblaciones y una reevaluación de la cuota, que condujo a un aprovechamiento del 20 % a partir de la década del 90 (Ojasti 1991).
En comparación con Venezuela, Colombia ha sido mucho más restrictiva en permitir la cosecha legal, la cual está suspendida desde 2020. Mesa (2005) desarrolló un modelo de simulación determinístico de la dinámica de poblaciones de chigüiros para dos localidades de Casanare, incluyendo el Hato Miramar, cuyos resultados indican que simulaciones a 20 años con una tasa de aprovechamiento del 30 %, muestran una tendencia fuerte de reducción de la población. Teniendo en cuenta que los parámetros poblacionales, además de los índices de producción y cosecha estimados, confirman que en ecosistemas como las sabanas inundables de la Orinoquia colombiana persisten poblaciones con un potencial de aprovechamiento alto, se propone usar máximo el 10 % como una medida conservadora para el aprovechamiento de las poblaciones, que para el caso de Miramar osciló entre 800 y 1000 individuos (Tabla 4).
El uso de la tasa de crecimiento como una tasa de extracción o cosecha apropiada, es indiferente a si la población está activamente dispersándose, si está sujeta a la depredación o no, y si las fuentes de mortalidad son aditivas o compensatorias (Caughley y Sinclair 1994). El aprovechamiento de la población y control de la densidad podrían en el futuro contrarrestar grandes mortandades en épocas de sequía fuerte, ya que, al extraer una proporción de individuos menor a la tasa de crecimiento, es probable que la supervivencia aumente cuando los recursos escaseen. Finalmente, es indispensable monitorear anualmente el tamaño poblacional desde el enfoque de manejo adaptativo (Wilhere 2002), en especial teniendo en cuenta el comportamiento de la población posterior al fenómeno de mortandad masiva ocurrido en 2014.