INTRODUCCIÓN
Especies cercanamente relacionadas usualmente exhiben caracteres similares que son conservados filogenética-mente, tales como la morfología, fisiología, reproducción, comportamiento y desarrollo, lo cual resulta en requerimientos ambientales similares (Zhou et al. 2016). Como consecuencia, puede ocurrir competencia interespecífica intensa entre ellas, especialmente cuando ocupan el mismo hábitat (Harvey et al. 2019).
La estrategia reproductiva de una especie es el conjunto de características estructurales y funcionales que maximizan la probabilidad de fertilización y la tasa de sobrevivencia de la progenie (Fenner 1985). En plantas, dicha estrategia, incluye la asignación de una fracción de recursos a la reproducción, el balance entre la reproducción sexual y vegetativa, floración y fructificación en el tiempo adecuado, producción del número y tamaño óptimo de semillas (Fenner 1985, Bazzaz et al. 2000, Revel et al. 2012). La cantidad de recursos asignados a la reproducción es determinada por disyuntivas con otros caracteres de historia de vida como la sobrevivencia, crecimiento o forrajeo (Stearns 1989). Un individuo que invierte una cantidad desproporcionada de recursos metabólicos en la producción de flores (i.e. esfuerzo reproductivo) debe experimentar una reducción en la producción de frutos o en reproducción futura (i.e. costo de la reproducción), debido a que los recursos destinados para reproducción no son ilimitados (Bazzaz et al. 2000, Harvey et al. 2019). De esta manera, una producción alta de semillas ocurre a expensas de la sobrevivencia, el crecimiento o la reproducción futura de la planta (Begon et al. 2006).
La estrategia reproductiva en algunas especies está fuertemente influenciada por gradientes ambientales (Phillips et al. 1983) o características del hábitat (Zhou et al. 2016). También pueden variar en función de la densidad de las poblaciones de polinizadores (Esposito et al. 2018, Mu et al. 2018). Específicamente, aspectos como la producción de flores y frutos se correlacionan positivamente con la precipitación y con la disponibilidad de nutrientes (Sperens 1997).
En especies con requerimientos de nicho similares, la divergencia fina en estrategias reproductivas, fenología, resistencia a la herbivoría, modo de polinización y esfuerzo reproductivo juega un rol importante en la segregación del nicho facilitando la coocurrencia de especies hermanas (Zhou et al. 2016).
El éxito en la reproducción en plantas con polinización biótica depende no solo de los caracteres florales sino también de la inversión en reproducción, longevidad floral y síncronía de la floración (Conner y Rush 1996, Ramírez 1998). Por ejemplo, la producción de semillas puede variar no solo con la abundancia de flores, sino con la densidad de polinizadores y con la producción de néctar o atrayentes (Mu et al. 2018). Por otro lado, cuando taxa relacionados coocurren con solapamiento en periodos de floración, pueden compartir polinizadores y si las barreras genéticas entre ellos están poco desarrolladas podrían producir híbridos (Esposito et al. 2018). De manera que la divergencia en el tiempo de floración entre especies (i.e. aislamiento fenológico) puede contribuir a reducir la competencia por polinizadores y al aislamiento reproductivo entre congéneres (Baack et al. 2015, Esposito et al. 2018).
En bosques montanos Andinos se ha observado que la abundancia y diversidad de los ensamblajes de insectos visitantes florales disminuye con la elevación (Arroyo et al. 1982), y que cambian significativamente su composición cada 100 m de elevación (Cuartas-Hernández y Gómez-Murillo 2015). Dichos cambios en el contexto ecológico de la polinización pueden afectar el éxito en la reproducción (Hargreaves et al. 2015).
El género Anthurium es el más diverso de la familia Araceae, con un estimado de 1000 especies, (Boyce y Croat c2020). Presenta gran variación en tamaño y coloración de sus inflorescencias y síndromes de polinización (Hentrich et al. 2009, Gibernau 2016, Díaz-Jiménez et al. 2019, Hartley y Gibernau 2019), y, además, es un componente estructural importante de los bosques montanos neotropicales (Croat 1992, Mayo et al. 1997). Anthurium panduriforme Schott y Anthurium caucanum Engl. se solapan en distribución a lo largo de un intervalo de elevación en el sotobosque en un bosque Andino tropical en la Reserva Mesenia-Paramillo localizada en el municipio de Jardín, Antioquia, en Colombia (Gómez-Murillo 2012).
En este estudio, se analizó la divergencia en la estrategia reproductiva entre A. caucanum y A. panduriforme, y su variación a lo largo de un intervalo altitudinal en: 1) la fenología reproductiva como la dinámica de la floración y fructificación, 2) patrones de inversión individual y poblacional en reproducción como número de estructuras reproductivas y 3) éxito reproductivo femenino identificado como número de infrutescencias y semillas producidas.
Se espera que la producción de semillas sea mayor en A. panduriforme comparada con A. caucanum debido a que posee inflorescencias de mayor tamaño, aromáticas y de color amarillo brillante (Cuartas-Hernández et al. 2019), lo cual podría promover mayor atracción de insectos polinizadores. Además, considerando la menor abundancia y diversidad de insectos polinizadores a altas elevaciones detectada en estudios anteriores en la zona de estudio (Cuartas-Hernández y Gómez-Murillo 2015), se puede esperar una reducción en la producción de semillas en función de la elevación para ambas especies.
Se estudiaron a lo largo de un año poblaciones de las dos especies localizadas cada 100 m de elevación entre 2200 y 2900 m en un bosque montano tropical. Esto permitió relacionar factores bióticos y abióticos (i.e., visitantes florales, elevación y precipitación) con la reproducción, lo cual es esencial para conocer la biología reproductiva de las especies y el ajuste en sus estrategias en condiciones que promueven la competencia entre especies congenéricas.
MATERIALES Y MÉTODOS
Sitio de estudio
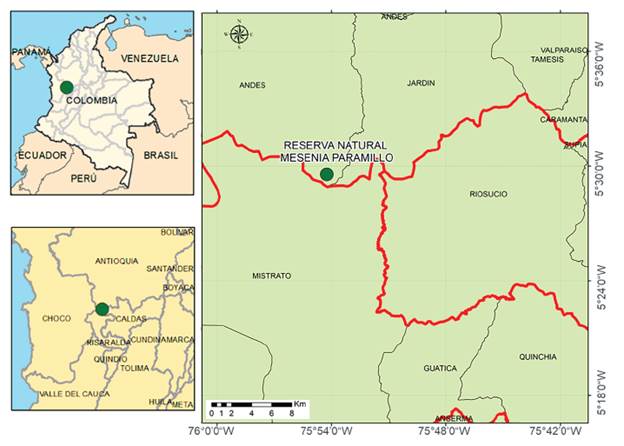
El estudio se realizó en el sector las Brisas en la Reserva Natural Mesenia-Paramillo (5°30' Norte, 75°5l' Oeste), área protegida de carácter civil. La Reserva se encuentra ubicada en la Cordillera Occidental de los Andes Tropicales colombianos, con predios en los Departamentos de Antioquia, Chocó, Risaralda y Caldas (Fig. 1). La Reserva cuenta con áreas de regeneración del bosque, plantaciones de pino y eucalipto, cultivos de café y tomate de árbol y 1723 ha de bosque montano pluvial (Cuesta et al. 2009). La precipitación promedio mensual es de 161 mm, con un intervalo de 61 a 225 mm, y presenta un patrón bimodal con dos temporadas lluviosas (marzo-mayo y octubre-diciembre) y dos temporadas secas (enero-febrero y junio-septiembre). La temperatura anual varía entre 13°C a 23°C (Ledesma-Castañeda 2011).
El intervalo de elevación evaluado está entre 2200 y 2900 m con cobertura continua de bosque e incluye toda el área de distribución de las especies de estudio (Croat et al. 2011, observaciones personales). Además, el alto recambio de especies de insectos visitantes florales, indicado por un 75 % de disimilitud entre transectos ubicados cada 100 metros de elevación (Cuartas-Hernández y Gómez-Murillo 2015) y la disminución en la diversidad y abundancia de insectos visitantes florales a mayor elevación (Gómez-Murillo y Cuartas-Henández 2016), permiten evaluar las hipótesis planteadas.
Especies estudiadas
El género Anthurium se caracteriza por poseer inflorescencias en forma de espiga no ramificada que sostienen las flores, llamadas espádices, subtendidos por una bráctea llamada espata. Cada flor posee cuatro pétalos y cuatro estambres rodeando un pistilo, son usualmente numerosas, muy pequeñas, sésiles, hermafroditas y con una marcada protoginia, es decir, el estigma es receptivo al inicio del ciclo floral y después de esta fase, los estambres empiezan a liberar polen (Croat 1980, Mayo et al. 1997). En algunas especies, el solapamiento al final de la fase femenina y el inicio de la fase masculina permite que ocurra autopolini-zación (Chouteau et al. 2006).
Las especies de Anthurium se agrupan en 18 secciones con base en caracteres morfológicos vegetativos dada la poca variación en la estructura de la inflorescencia dentro del género, ésta presenta la mayoría de su variación en coloración y tamaño (Croat y Sheffer 1983). De acuerdo con dicha clasificación A. panduriforme pertenece a la sección Polyneurum y A. caucanum pertenece a la sección Xyalophylum (Croat y Sheffer 1983). Estudios moleculares de un amplio número de especies de Anthurium sugieren que especies típicas de ambas secciones están agrupadas en un solo clado (17) (Carlsen 2011), indicando que las especies dentro de estos grupos están estrechamente relacionadas; incluso, algunas de ellas pasaron de la sección Polyneurum a la sección Xyalophylum en una reconstrucción de las relaciones filogenéticas dentro del género (Carlsen 2011). De manera que, aunque las especies de estudio no estén incluidas directamente en la filogenia del género Anthurium (Carlsen 2011), puede inferirse que están estrechamente relacionadas, no solo pertenecen al mismo género sino a secciones dentro del mismo clado, e incluso podrían estar ambas dentro de misma sección (Carlsen 2011). Por otro lado, el hecho de que la inflorescencia no presente restricciones mecánicas para el acceso de los polinizadores que conduzca a la especialización de algún grupo funcional, sugiere que estas especies podrían presentar competencia por polinizadores mediante mecanismos como la emisión de volátiles o segregación en los tiempos de floración. Por otro lado, entre los polinizadores del género Anthurium se han reportado abejas, coleópteros, moscas y tripidos (Gibernau 2003, 2011, 2016, Gómez-Murillo y Cuartas-Hernández 2016, Díaz-Jiménez et al. 2019, Hartley y Gi-bernau 2019).
En el sitio de estudio, A. panduriforme y A. caucanum viven de forma terrestre, aunque A. caucanum puede encontrarse eventualmente como epífita. Ambas especies tienen inflorescencias similares, pero presentan variación en algunos caracteres (Fig. 2). Anthurium panduriforme presenta inflorescencias de mayor longitud (longitud media del espádice 200 mm vs 56 mm). Las inflorescencias de A. panduriforme son amarillas y liberan aroma dulce, mientras que las de A. caucanum son marrón-rojizo y no producen aroma reconocible (Cuartas-Hernández et al. 2019).

Figura 2 Especies de estudio. Anthurium panduriforme: a. Lámina foliar de un individuo adulto, b. Inflorescencia inmadura, c. Inflorescencia madura, d. Infrutescencia madura. Anthurium caucanum: e. Individuo adulto, f. Inflorescencia inmadura, g. Inflorescencia madura, h. Infrutescencia madura.
Se ha reportado que A. caucanum es una especie autocompatible, con una baja tasa de producción de frutos por autofertilización y que tiene el potencial de propagarse vegetativamente, mientras que A. panduriforme es una especie con entrecruzamiento obligado (Cuartas-Hernández y Moreno-Betancur 2020).
Fenología reproductiva y visitantes florales
Se delimitaron siete transectos transversales a la pendiente de 100 x 50 m cada 100 m de elevación, desde 2200 hasta 2900 m (T1 a T7, respectivamente). En cada transecto, se marcaron todos los individuos terrestres en estado reproductivo y fueron monitoreados mensualmente de mayo de 2014 a abril de 2015. En total se muestrearon 84 unidades transecto/mes (siete transectos x 12 meses). Cada monitoreo se realizó durante tres días. El estado fenológico se clasificó de la siguiente manera: a) inflorescencia, b) infrutescencia inmadura y, c) infrutescencia madura.
Se caracterizó la sincronía en la floración como el porcentaje de individuos del total de la población y dentro del transecto que florecieron cada mes. Se consideró como evento asincrónico cuando menos del 20 % de los individuos florece, sincronía baja entre 21 % y 60 % y sincronía alta cuando más del 60 % de los individuos florece al mismo tiempo (Bencke y Morellato 2002).
También se observaron los insectos visitando las inflorescencias de ambas especies mediante recorridos en los transectos entre las 09:00 y 17:00 h por dos observadores. Se recolectaron todos los insectos que se encontraban sobre el espádice y se depositaron en tubos Eppendorf con alcohol al 70 % para su preservación e identificación. Se siguieron diferentes claves taxonómicas para la identificación de los insectos al nivel de orden y familia (Fernández y Sharkey 2006, Borror et al. 1992, Brown et al. 2010). La recolección de especímenes de insectos y plantas están amparadas por el permiso marco de recolección de especímenes de la Universidad de Antioquia, resolución 0524 de 2014.
Éxito reproductivo femenino
Se estimaron dos componentes de éxito reproductivo femenino: la proporción de infrutescencias maduras/inflorescencias (InfrM/Inflo) y la proporción semillas/óvulos (S/O). El éxito reproductivo total se calculó como el producto de (InfrM/Inflo) y (S/O) (Wiens et al. 1987).
Las inflorescencias fueron monitoreadas en cada visita y una vez alcanzaron la madurez se recolectaron para el conteo de frutos y semillas. El número total de óvulos por inflorescencia de cada especie se calculó multiplicando el número de flores por dos óvulos, debido a que previamente se determinó que cada flor femenina presenta dos lóculos y un óvulo por cada lóculo (Cuartas-Hernández et al. 2019). Se calculó la proporción S/O por inflorescencia y el promedio para cada transecto. También se obtuvo la probabilidad de que una inflorescencia alcance el estado de infrutescencia inmadura (número de infrutescencias inmaduras/número de inflorescencias) y la probabilidad de que una infrutescencia inmadura alcance su maduración (número de infrutescencias maduras/número de infrutescencias inmaduras).
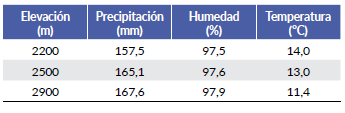
Finalmente, se midió la precipitación, humedad relativa y temperatura promedio mensual del período de estudio usando pluviómetros plásticos (Stratus®, RG-202) y dataloggers en las elevaciones 2200, 2500 y 2900 m para evaluar si ocurren cambios significativos en dichas variables ambientales a lo largo del intervalo de elevación.
Análisis de datos
Se realizaron pruebas de distribución normal a las variables y se evaluó la homogeneidad de varianzas para realizar comparaciones entre especies. Se compararon las proporciones del número de infrutescencias inmaduras/ número de inflorescencias, número de infrutescencias maduras/número de infrutescencias inmaduras y número de infrutescencias maduras/número de inflorescencias entre transectos mediante una prueba chi-cuadrado. La producción de semillas por infrutescencia fue comparada entre transectos usando un análisis de varianza (ANOVA) y entre especies mediante una prueba t -student (Zar 1999).
Se evaluaron las relaciones lineales entre el número de inflorescencias, infrutescencias, proporción Infr/Inflo, S/O y éxito reproductivo total con la elevación. Se compararon estas mismas variables entre especies usando una prueba de Kruskal-Wallis a lo largo del intervalo de elevación. Las relaciones entre la precipitación promedio mensual y el número de individuos en inflorescencia e infrutescencia se evaluaron mediante el coeficiente de correlación de Pearson (Zar 1999). Se comparó la precipitación, humedad relativa y temperatura promedio mensual entre tres elevaciones (2200, 2500 y 2900 m) mediante una prueba de Kruskal-Wallis. Todas las pruebas estadísticas se realizaron con el software SPSS versión 19 (IBM Corp 2010) y las gráficas se construyeron con el software Sigmaplot versión 14,5 (Systat Software c2020).
RESULTADOS
Producción de inflorescencias e infrutescencias en el intervalo de elevación
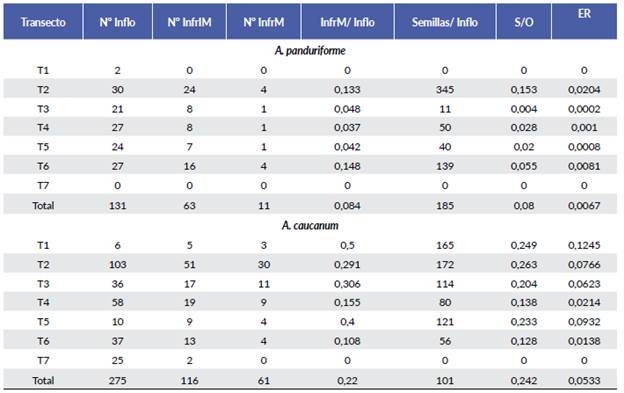
El número total de inflorescencias producidas fue de 131 en A. panduriforme y 275 en A. caucanum durante el año de monitoreo y en todo el intervalo de elevación. El promedio del número de inflorescencias por unidad transecto/mes fue significativamente menor para A. panduriforme (1,86 ± 4,45; intervalo 0 - 8) comparado con A. caucanum (3,16 ± 12,81; intervalo 0 - 16) (t = -2,81, P = 0,005). El número de inflorescencias registradas a lo largo de todo el año fue mayor en T2 para A. panduriforme y A. caucanum. A su vez, este transecto presentó el mayor número infrutescencias maduras. El número de inflorescencias en A. panduriforme fue similar desde T2 hasta T6, sin embargo, en T1 la floración fue muy escasa y en T7 no se encontraron individuos de esta especie. El número de inflorescencias por transecto varió entre 2 y 30 con un promedio de 21,8 ± 10,4 y no varió en función de la elevación (R 2 = 0,00; β = -0,107; P≥0,05).
La abundancia de individuos de A. caucanum fue baja en T1 y hubo poca floración. El número de inflorescencias por transecto varió entre 6 y 103 con un promedio de 39,3 ± 9,6 y entre T2 y T7 decreció con la elevación (R2 = 0,51; β= -12,4; P = 0,026). En T2 se registró el mayor número de infrutescencias y en T7 no se produjo ninguna (Tabla 1).
Tabla 1 Características de las dos especies de Anthurium por transecto. Inflo= número de inflorescencias, InfrIM= infrutescencias inmaduras, InfrM= infrutescencias maduras, InfrM/Inflo= proporción infrutescencia madura/inflorescencia, semillas/inflo= promedio de semillas por inflorescencia, S/O= proporción semillas/óvulos y ER= éxito reproductivo femenino estimado como el producto de (InfrM/Inflo)*(S/O).
Fenología reproductiva y visitantes florales
Ambas especies florecen durante los doce meses de seguimiento. El número de inflorescencias por mes en el sitio de estudio varió entre cuatro y 27 con un promedio de 11,2 ± 7 para A. panduriforme y entre dos y 37 con un promedio de 22,2 ± 10,4 para A. caucanum, siendo significativa la diferencia entre especies (t = -3,06; P = 0,003). El pico de floración de A. panduriforme fue en los meses de agosto y septiembre, mientras que para A. caucanum ocurrió entre diciembre y enero que presentó además un pico más bajo en julio y agosto. No se encontró relación entre los niveles de precipitación promedio mensual y la producción de inflorescencias o infrutescencias para ninguna de las dos especies (r2 ≤ 0,2; P > 0,05). Dado que las infrutescencias toman entre tres y cuatro meses en madurar en A. panduriforme, la mayor producción de infrutescencias ocurrió cuatro meses después del pico de floración (diciembre a marzo). En A. caucanum las infrutescencias tomaron alrededor de un mes en madurar, por lo cual la mayor cantidad de infrutescencias fue registrada en febrero y marzo (Fig. 3). La precipitación promedio mensual no difirió entre elevaciones (x 2 = 0,096, df= 2, P = 0,95). La humedad relativa tampoco cambió (F 2 2066 = 1,64; P = 0,16). La temperatura fue 2.57°C menor a alta elevación comparado con baja elevación (x2 = 726,08; df = 2; P << 0,001) (Tabla 2).
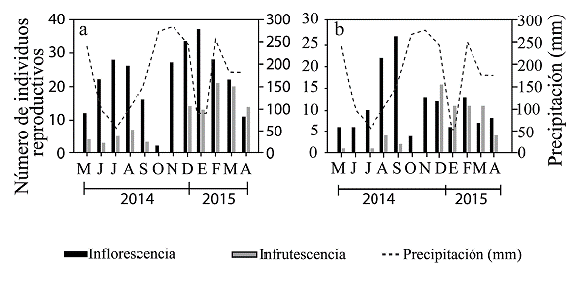
Figura 3 Fenología reproductiva expresada como número de inflorescencias e infrutescencias de a. Anthurium caucanum y b. A. panduriforme, indicando la precipitación promedio mensual para el periodo de estudio comprendido entre los meses de mayo 2014 a abril de 2015.
El 35 % y 40 % de las unidades transecto/mes muestrea-das no presentaron individuos de A. panduriforme y A. caucanum en floración, respectivamente. La floración fue asincrónica (sincronía <5 %) para ambas especies cuando se estimó frente al total de individuos en todo el sitio de estudio. Sin embargo, la sincronía aumentó cuando se estimó con relación al total de individuos por transecto. El 12 % y 13 % de las unidades transecto/mes presentaron sincronía mayor al 20 % para A. panduriforme y A. caucanum, respectivamente. En general, la sincronía fue mayor en los transectos de baja elevación (T2 a T4). Cuando una especie presentó mayor sincronía en un transecto o mes, la otra tuvo baja sincronía. Los meses en los cuales ocurrió el pico de floración en A. panduriforme alcanzaron el 20 % y 24 % de sincronía (agosto y septiembre, respectivamente), mientras que en A. cuacanum aún en el pico de floración la sincronía no alcanzó el 20 % (Fig. 4). En A. panduriforme 88 % de las plantas produjeron una inflorescencia mientras que en A. caucanum el 58 % y el 28 % de las plantas produjeron una y dos inflorescencias, respectivamente. Plantas produciendo tres o más inflorescencias fueron escasas.
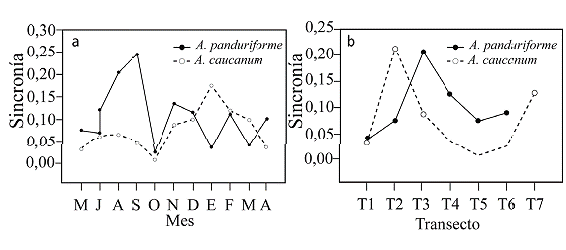
Figura 4 Sincronía en la floración de Anthurium pan-duriforme y A. caucanum. a. Para cada mes y b. Para cada transecto.
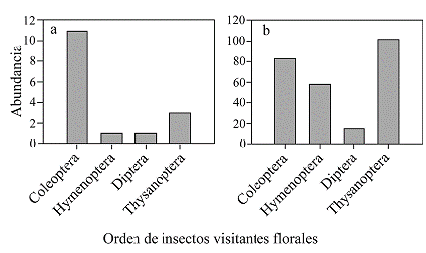
Se registraron 274 individuos de insectos visitando las inflorescencias, de los cuales 16 visitaron A. caucanum y 258 visitaron A. panduriforme. Los insectos fueron asignados a cuatro grupos funcionales (Coleoptera, Hymenoptera, Diptera y Thysanoptera), presumiendo que los insectos dentro de cada grupo se comportan de manera similar sobre las flores y que ejercen presiones de selección semejantes sobre los caracteres florales (Fenster et al. 2004). El 38 % de los visitantes pertenecieron al orden Thysanoptera (únicamente de la familia Thiripidae), y el 34 % a Coleoptera (con mayor representación de la familia Curculionidae). En A. caucanum, aunque con muy baja abundancia Coleoptera fue el orden dominante, representado por el 69 % de los individuos (Fig. 5). No se registraron insectos visitantes en Ti en ambas especies y solo un insecto en T7 visitando A. caucanum, perteneciente al orden Hymenoptera, familia Diapriidae. El 56 % de las inflorescencias de A. panduriforme fueron visitadas, mientras que en A. caucanum solo el 8 %. La abundancia total de los insectos decreció con la elevación (R2 = 0,87; β = -0,37; F = 12,58; P = 0,024). Ambas especies presentaron un nivel de disimilitud del 87,8 % en composición de grupos funcionales.
Éxito reproductivo
La probabilidad de pasar de inflorescencias a infrutescencias inmaduras (Infr-IM/Inflo) fue similar en A. panduriforme y A. caucanum (48 % vs 42 %; c2 = 0,42; gl = 1; P = 0,51). Sin embargo, la probabilidad de que las infrutescencias inmaduras alcancen la madurez (Infr-M/infr-IM) fue mayor en A. caucanum comparada con A. pandurifor-me (53 % vs 17 %; c 2 = 9,8; gl = 1; P = 0,002). De hecho, la proporción de inflorescencias que alcanzan el estado de infrutescencia madura (Infr-M/Inflo) fue mayor para A. caucanum (22 %) mientras que en A. panduriforme fue solo el 8 % (c2 = 8,6; gl = 1; P = 0,003) (Tabla 1).
No se encontró diferencia entre transectos en relación con la probabilidad de transición de inflorescencia a infrutescencia inmadura [Infr-IM/Inflo (c2 = 7,l; gl = 4; P = 0,13)] y de infrutescencia inmadura a madura [Infr-M/ infr-IM (c2 = 0,66; gl = 4; P = 0,95)] para A. panduri-forme. En A. caucanum la proporción Infr-IM/inflo fue diferente entre transectos (c 2 = 12,8; gl = 6; P = 0,045), pero no la proporción Infr-M/infr-IM (c 2 = 2,6; gl = 6; P= 0,85) (Tabla 1).
El número total de semillas producidas durante los meses de muestreo para la especie A. caucanum fue 8502 y en A. panduriforme 2037. No se detectaron diferencias significativas en el número promedio de semillas entre transectos para A. caucanum (F = 1,562; P = 0,18). Considerando que para A. panduriforme no hubo formación de más de una infrutescencia en estado completo de madurez en los transectos T3, T4 y T5, únicamente se compararon los transectos T2 y T6 con relación a la producción de semillas, sin mostrar diferencia significativa (t = 0,865; P = 0,39).
Tanto las proporciones InfrM/Infl y S/O como el éxito reproductivo total no presentaron variación en función de la elevación en el caso de A. panduriforme (InfrM/Infl: .R2 = 0,17; β = 0,0001; F = 0,83; P = 0,41; S/O: R 2 = 0,09; β = 0,0002; F = 0,52; P = 0,50; ERtotal: R 2 = 0,10; β = -0,00001; F = 0,05; P = 0,83) pero sí en A. caucanum, con una disminución en la parte alta del intervalo (InfrM/Infl: R 2 = 0,62; β = -0,0006; F = 8,08; P = 0,03; S/O: R 2 = 0,67; β = -0,0003; F = 10,40; β = 0,02; ERtotal: R 2 = 0,62; P = -0,0002; F = 8,11; P = 0,03) (Fig. 6).
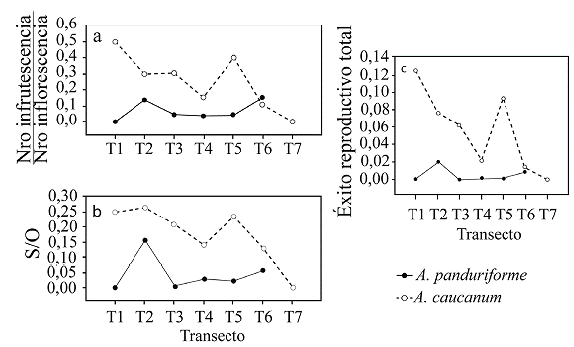
Figura 6 Éxito reproductivo femenino de Anthurium panduriforme y A. caucanum en el intervalo de elevación. a. Éxito en la producción de infrutescencias estimado como la proporción del número de infrutescencias maduras/número de inflorescencias, b. Proporción semillas/óvulos (S/O) y c. Éxito reproductivo total.
El éxito reproductivo estimado como InfrM/Inflo o como S/O fue muy bajo para las dos especies (Tabla 1). El éxito reproductivo difirió entre especies en el componente InfrM/Infl (c2 = 7,38; P= 0.006) pero no el componente S/O (c2 = 1,51; P = 0,28). El éxito reproductivo total fue casi ocho veces mayor para A. caucanum que para A. panduriforme (0,0533 vs. 0,0067; c2 = 4,30; P = 0,038) (Fig. 7).
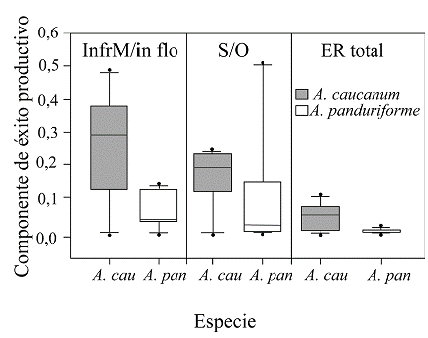
Figura 7 Éxito reproductivo femenino de Anthurium panduriforme y A. caucanum. a. Número de infrutescencias maduras/número de inflorescencias (InfrM/Inflo), b. Proporción semillas/óvulos (S/O) y c. Éxito reproductivo total (ER total). Las cajas en el diagrama representan el rango intercuartílico y los bigotes representan los valores mínimo y máximo. Los círculos negros representan valores atípicos. La línea en el centro de las cajas es la mediana del conjunto de datos. Se monitorearon 275 inflorescencias de A. caucanum y 131 de A. panduriforme hasta su maduración para la estimación de los dos componentes de éxito reproductivo y el éxito reproductivo total.
DISCUSIÓN
Patrones de inversión individual y poblacional a la reproducción
Las dos especies contrastan en sus patrones de asignación a la reproducción a nivel individual y poblacional, obedeciendo a una disyuntiva entre número y tamaño de las inflorescencias (Messina y Fox 2001). Si bien el número de inflorescencias fue bajo para ambas especies, A. caucanum produjo más del doble de inflorescencias comparado con A. panduriforme en todo el periodo de estudio y un 70 % más en las unidades transecto/mes, a la vez posee menor tamaño de las inflorescencias, menor número de flores y menor cantidad de granos de polen (Cuartas-Hernández et al. 2019). Por otro lado, a nivel individual, la mayoría de las plantas de ambas especies producen solamente una inflorescencia. Sin embargo, en A. caucanum, el 42 % de las plantas producen dos o tres inflorescencias, que no se solapan en sus periodos de antesis. De acuerdo con la inversión en atracción, la cual incluye tanto el número como el tamaño de las inflorescencias (i.e., exhibición floral), la abundancia de visitantes florales fue quince veces mayor en A. panduriforme comparado con A. caucanum.
Fenología reproductiva
Anthurium panduriforme y A. caucanum presentaron patrones temporales de floración diferentes, la primera presenta floración con un pico discreto en la transición de temporada seca a lluvias, mientras que la segunda florece durante casi todo el año con dos picos que ocurren en la transición de temporadas de lluvias a secas; lo cual sugiere que las dos especies responden de manera diferente a las señales ambientales que promueven la floración (Montoya y Raffaelli 2010, Scaven y Rafferty 2013). Adicionalmente, ambas especies presentan bajo número de individuos floreciendo en cada unidad transecto/mes (máximo 16 inflorescencias de A. caucanum y ocho de A. panduriforme), representando asincronía en la floración. Aunque los valores de sincronía se mantienen por debajo del 20 % en la mayoría de los transectos o meses, ocurre alternancia entre ambas especies: cuando una especie tiene mayor sincronía, la otra disminuye. Se observó que el mes de mayor floración para A. panduriforme coincide con el mes de menor floración en A. caucanum, sugiriendo un ajuste fenológico entre las especies. En otras especies se ha observado que dicho ajuste reduce la competencia por polinizadores, lo cual podría ocurrir también en las especies estudiadas, dado que los polinizadores parecen ser un recurso limitante en la zona de estudio y al mismo tiempo promover el aislamiento reproductivo de ambas especies (Esposito et al. 2018).
Adicionalmente, la asincronia en la floración promueve el entrecruzamiento, de manera que los polinizadores deben desplazarse para encontrar las inflorescencias que se encuentran en bajas densidades en busca de recompensas, que para el caso de las especies estudiadas pueden ser a) nutritivas, principalmente polen, dado que lo producen en altas cantidades, u otros tejidos para nutrición de larvas, o b) no nutritivas, como sitio para apareamiento u oviposición de algunas especies de visitantes (Simpson y Neff 1981, Chartier et al. 2013).
Éxito reproductivo
En ambas especies el éxito reproductivo, estimado como el número de infrutescencias que alcanzan la madurez, la proporción S/O, ó el éxito reproductivo total, fue bajo. Esta condición ha sido reportada previamente en la familia Araceae debido a que los granos de polen pierden rápidamente la viabilidad (Albre y Gibernau 2008), a que la polinización es infrecuente o inefectiva (Uemura et al. 1993) o a causa de daño floral por herbivoría (Young 1988). La proporción S/O para las dos especies fue inferior a los valores reportados en otras especies de la familia Araceae (Cuartas-Hernández y Núñez-Farfán 2006, Albre y Gibernau 2008, Chai y Wong 2019).
Por su parte, las bajas temperaturas en bosques montanos afectan la actividad y abundancia de los polinizadores (Arroyo et al. 1985), disminuyendo así la probabilidad de producir frutos, con mayor efecto a alta elevación. También la baja sincronía en la floración es un factor que reduce la reproducción (Ollerton y Diaz 1999).
A pesar de que el éxito reproductivo estimado fue bajo, el número de semillas por transecto puede ser suficiente para asegurar el reclutamiento de nuevos individuos en A. pandurirme (11-1380 semillas/transecto) y en A. caucanum (224-5160 semillas/transecto). De esta manera se podrían manterner las poblaciones estables en el tiempo como ocurre en otras especies de la familia Araceae. Por ejemplo, poblaciones de Dieffenbachia seguine (Jacq.) Schott, una hierba de sotobosque creciendo en un bosque tropical en Tuxtlas (México), mantiene sus poblaciones estables aun con bajo éxito reproductivo (Cuartas-Hernández y Núñez-Farfán 2006).
Aunque A. panduriforme presentó mayor abundancia de insectos visitantes florales comparada con A. caucanum, esto no resultó en mayor proporción de infrutescencias maduras. Lo anterior puede deberse a múltiples causas. Por un lado, es posible que las fuentes cercanas de donadores de polen son muy escasas (Méndez y Díaz 2001) o que los polinizadores presentan estrategias de forrajeo localizado, lo cual puede resultar en bloqueo de los estigmas debido a la saturación con polen de baja calidad genética (Barrett 2002). De hecho, los trips que fueron los visitantes florales más abundantes de A. panduriforme, presentan un patrón de forrajeo que podría promover la autofertilización (Baker y Cruden 1991), y resultar en alta tasa de aborto de óvulos fertilizados en esta especie autoincompatible (Cuartas-Hernández y Moreno-Betancur 2020). Por el contrario, en A. caucanum, una mayor fracción de infrutescencias alcanzó la madurez, lo cual podría asociarse a que los polinizadores sean muy eficientes; sin embargo, es necesario indagar con mas detalle sobre este aspecto ya que no se evaluó el papel de los insectos visitantes como polinizadores efectivos.
Por otra parte, en las infrutescencias maduras de ambas especies la proporción S/O no difirió. El resultado sugiere que estas infrutescencias fueron visitadas por al menos un insecto, debido a que a nivel individual la producción exitosa de frutos puede no estar relacionada al número de insectos, sino a su eficiencia, dado que un solo insecto portando el polen es necesario para producción completa de frutos como se ha reportado en otras especies de plantas (Ollerton y Diaz 1999, Ne'eman et al. 2009, Hoe et al. 2016).
El éxito reproductivo total fue diez veces mayor en A. caucanum que en A. panduriforme. Una alta inversión individual de A. panduriforme en inflorescencias de mayor tamaño (Cuartas-Hernández et al. 2019) y en atracción o recompensas para insectos visitantes florales, como color llamativo y producción de aroma, representa un alto costo energético (i.e., esfuerzo reproductivo), y puede limitar la producción de frutos y semillas. Al contrario, inflorescencias que demandan menor inversión en A. caucanum, considerando que no solo son de tamaño pequeño, sino que no emiten aromas ni secreciones estigmáticas, permiten además de producir más infrutescencias, que los individuos tengan más recursos disponibles para el desarrollo de frutos y semillas (De Jong et al. 2008). Por otro lado, es posible que se produzcan semillas mediante autofertili-zación (Cuartas-Hérnandez y Moreno-Betancur 2020), lo cual puede funcionar como mecanismo para asegurar la producción de frutos en respuesta a la escasez de poliniza-dores en esta especie (Lloyd y Schoen 1992).
El intervalo de elevación no tuvo un efecto significativo en el número de inflorescencias producidas, ni en ningún estimador de éxito reproductivo en A. panduriforme. Sin embargo, aunque baja, A. panduriforme, mantuvo la producción de semillas promedio constante a lo largo del intervalo, debido probablemente a que inflorescencias más grandes y mayor número de óvulos pueden funcionar como mecanismo para compensar una baja tasa de visita de insectos florales a alta elevación.
Por otro lado, en A. caucanum el número de inflorescencias, la proporción InfrM/Inflo, la proporción S/O, y el éxito reproductivo total disminuyeron a mayor elevación. Esto posiblemente como resultado de la menor abundancia de insectos visitantes florales. Otros factores, como la menor temperatura a mayor elevación podrían afectar la producción de semillas (Bergman et al. 1996). Además, se ha reportado mayor propagación clonal en poblaciones de A. caucanum a alta elevación, lo cual puede funcionar como un mecanismo para compensar la baja tasa de reclutamiento de individuos a la población vía reproducción sexual (Cuartas-Hernández y Moreno-Betancur 2020).
Este estudio provee evidencia de como dos especies con estrecha relación filogenética del género Anthurium exhiben diferentes estrategias reproductivas y responden de manera diferente a un intervalo ambiental (i.e., elevación), de manera que la divergencia en patrones de inversión de recursos entre especies facilita su coexistencia a pequeña escala (Sedio et al. 2012, Harvey et al. 2019). Esto, acoplado al aislamiento reproductivo fenológico restringe el flujo génico entre especies (i.e. prepolinización), condición esencial para el mantenimiento de la biodiversidad de plantas (Baack et al. 2015, Esposito et al. 2018).
Finalmente, se reconoce la importancia de realizar estudios para identificar los polinizadores efectivos de ambas especies para un mejor entendimiento de su biología reproductiva e identificar las recompensas florales, así como compuestos volátiles de las inflorescencias y su rol discriminante en los polinizadores. También es necesario evaluar otros factores importantes en la dinámica de las poblaciones de plantas como el banco de semillas germinable, el éxito en la germinación, el reclutamiento y la supervivencia de los juveniles.