INTRODUCCIÓN
Los mecanismos y factores que determinan la distribución espaciotemporal de las especies han sido de interés en ecología (Krebs 2001). Uno de estos mecanismos es la competencia interespecífica que influye en la distribución geográfica de las especies (Tilman 1987). Es el caso de las garzas (Ardeidae) que se agrupan en islas formando colonias reproductoras mono o multiespecíficas (Kushlan 1992) presentando requerimientos ecológicos similares, donde compiten por los sitios de anidación, alimento y material para el nido (Kazantzidis et al. 2013). Por su parte, la diferenciación de nicho ecológico permite la coexistencia de especies que usan los mismos recursos en un área determinada, lo que facilita una segregación espacial y temporal (Griffin y Silliman 2011). De este modo, se espera que la distribución y abundancia de individuos o nidos presenten diferencias espaciales en donde construyen sus nidos y temporales en los periodos de reproducción.
La abundancia, estacionalidad y distribución de las especies durante la reproducción están fuertemente determinadas por factores ambientales como la disponibilidad de sitios adecuados para anidar, alimento, las condiciones climáticas e hidrológicas como el nivel de inundación, distancia a otras colonias, el riesgo a disturbios, así como las interacciones específicas y las historias de vida de las especies (Kelly et al. 1993, Kazantzidis et al. 2013). En cuanto al hábitat, se ha demostrado que en las colonias reproductoras de garzas la estructura y arreglo espacial de la vegetación influye en la colocación de los nidos, lo que determinará la tasa de supervivencia de los polluelos, su capacidad de movimientos y el éxito de forrajeo (Gjerdrum et al. 2005).
Burger (1979) encontró que las especies de garzas seleccionan sus lugares de anidación y se estructuran verticalmente de acuerdo con las características fisionómicas de la vegetación como la altura, pero también al número de especies de garzas presentes y a su tamaño. Mientras que Beaver et al. (1980), sugiere que la estructura de la vegetación influye mucho en la distribución y posición de los nidos, pero que las interacciones sociales también determinan esto cuando la disponibilidad de sitios disminuye por una abundancia de aves en la colonia. Los nidos de las especies se estratifican verticalmente de acuerdo con la vegetación, pero también como resultado de su dominancia y su tamaño corporal; donde especies más grandes anidan en las partes más altas de la vegetación que los subordinados más pequeños. El estudio de estos factores ecológicos es importante para identificar los mecanismos y estrategias de las especies para sobrevivir y reproducirse en sitios con altas densidades y a su vez proveen conocimiento clave para fines de conservación y manejo de las áreas de anidación, ante posibles disturbios antropogénicos y ambientales (Kushlan 1992).
Isla Pájaros se localiza en la Laguna Mar Muerto, ubicada entre los estados de Oaxaca y Chiapas, México. Allí se reproducen 19 especies de aves acuáticas (Ramos 2015), de las cuales nueve son de la familia Ardeidae: Ardea alba (Linnaeus, 1758), Egretta thula (Molina, 1782), Egretta caerulea (Linnaeus, 1758), Egretta tricolor (Statius Muller, 1776), Egretta rufescens (Gmelin, JF, 1789), Bubulcus ibis (Linnaeus, 1758), Nycticorax nycticorax (Linnaeus, 1758), Butorides virescens (Linnaeus, 1758) y Cochlearius cochlearius (Linnaeus, 1766). Estas especies de garzas tienen características ecológicas y evolutivas similares relacionadas con sus hábitos de anidación, por lo que son más susceptibles de competir por los mismos recursos (Kushlan y Hancock 2005). Sin embargo, si estas relaciones interespecíficas se intensifican, puede existir una segregación de algunas dimensiones de sus nichos facilitando la coexistencia (Toledo 2000). Por ello, se espera que ocho de estas especies, B. virescens no fue incluida porque no se registró anidando durante el muestreo, tengan una distribución espacial diferencial de sus sitios de nido y presenten diferentes tiempos de anidación.
También, se estimaron las abundancias de las parejas reproductoras, se determinó el patrón temporal y espacial de reproducción para cada especie, y se describió el sitio de nido por especie en función de las variables de la vegetación y físicas del área durante la temporada reproductiva de 2018. Esta información contribuirá a explicar los mecanismos de segregación ecológica que permiten su coexistencia espacial.
MATERIALES Y MÉTODOS
Área de estudio
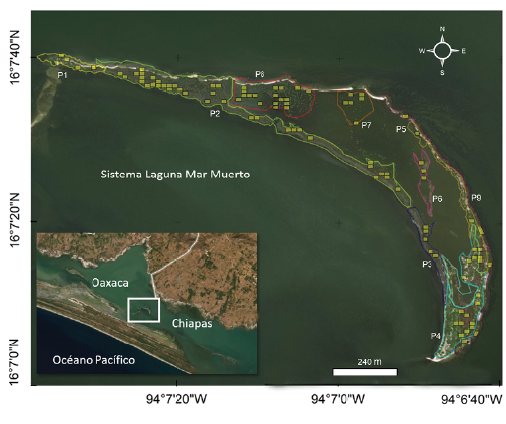
La Isla Pájaros (16°18' a 15°55' Norte y 94°28' a 93°48'Oes-te) tiene un área aproximada de 37,5 ha y se encuentra en el municipio de San Francisco del Mar, Oaxaca (Fig. 1). El clima es cálido subhúmedo, con un régimen de precipitación de 144,6 mm en época de estiaje y 1253 mm en lluvias (García 2004). La distribución de las especies de mangle varía en la isla, así como la altura de los árboles, la cobertura del dosel y las características físicas del sitio como el nivel de inundación. En la parte sur, la especie dominante es el mangle negro, Avicennia germinans (L.) Stearn, en la parte noroeste el mangle rojo Rhizophora mangle L. y mangle blanco Laguncularia racemosa (L.) C.F. Gaertn. y al sureste hay una asociación de botoncillo Conocarpus erectus L. y L. racemosa con cactáceas, ciperáceas, brome-liáceas, poáceas y amarilidáceas (Ramos 2015).
Trabajo de campo
Debido a la heterogeneidad en la distribución de las especies de mangle en la isla, se identificaron nueve parches (Fig. 1). En cada parche se establecieron cuadrículas de 20 m x 15 m (300 m2) mediante el programa ArcGIS 10.3 (ESRI c2020). La selección de los cuadrantes (tamaño de muestra) por parche se realizó de manera proporcional con un muestreo aleatorio estratificado (Otzen y Manterola 2017), con el software estadístico R v3.4.4 (R Core Team c2020). Se seleccionaron y muestrearon 96 parcelas de las cuales solo en el 61,5 % (59) presentaban nidos (Fig. 1).
El muestreo se realizó mensualmente de marzo a agosto de 2018 de 6:00 a 11:00 y de 16:00 a 18:00, porque la temperatura es más fresca y se causa menos estrés a las aves (Torrella 1999, Beovides 2000). El muestreo se realizó en canoa o a pie en función de la accesibilidad al sitio, por medio del método búsqueda en área. Este método consistió en revisar todos los árboles dentro de las parcelas, se cuantificaron los nidos activos, se identificaron las especies anidando y la fecha de registro de cada nido (Ralph et al. 1996). Los nidos activos fueron aquellos en proceso de construcción, con huevos y cuidado parental o con polluelos (Alvarado 2014, Arévalo 2017). Para identificar a quien pertenecía cada nido en ausencia de los adultos, se colocaron cintas de colores numeradas en el soporte natural debajo del nido. Estas cintas permitieron un seguimiento en cada visita y eventualmente encontrar los adultos. Los nidos con poca accesibilidad se revisaron con un espejo cóncavo sujeto a un tubo extensible.
Para reducir la perturbación hacia los adultos y polluelos, se tuvo mucho cuidado de permanecer el menor tiempo posible en las zonas de anidación (Torrella 1999, Beovides 2000). Asimismo, antes de ingresar a cada parcela se realizaron observaciones rápidas con binoculares Vortex 8X42 para identificar a las garzas. La identificación de los polluelos se basó principalmente en la experiencia durante el estudio y se utilizó la guía de nidos y reproducción de las aves argentinas de De la Peña (2013). Cada nido fue registrado con un Geoposicionador Satelital Garmin (GPS eTrex H) calibrado, con una precisión de 5 m; posteriormente se utilizaron los programas Google EarthPro 2018 y ArcGIS 10.3 para ubicarlos en el mapa.
Durante cada visita mensual a la colonia se dio un seguimiento de los nidos previamente registrados, se contabilizó el número de nidos, huevos y polluelos nuevos de cada especie. Este patrón temporal se registró desde la aparición del primer nido activo en marzo hasta el 22 de agosto de 2018 que fue la última visita a la isla. Sin embargo, en estas fechas aún había juveniles en el sitio por lo que el fin de la temporada reproductiva, que se relaciona con el abandono de la isla por parte de los juveniles, pudo ocurrir en septiembre u octubre. El listado de las especies de garzas fue generado de acuerdo con la lista de las aves de la Sociedad de Ornitología Americana (AOS, American Ornithological Society; Chesser et al. c2019).
Caracterización de los sitios de nido
Se definió como sitio de nido el lugar donde una pareja reproductiva construyó un nido y realizó una puesta. Las variables que se consideraron en cada sitio fueron: especie, número de huevos y polluelos, tamaño del nido; dado que los nidos son poco profundos y ligeramente elípticos, su tamaño se registró a partir del promedio de los diámetros externos mayor y menor medidos en cm. También se registró el número de ramas que sostienen al nido, la altura del nido (distancia de la copa del árbol hacia el nido en m), la posición del nido con base en la copa del árbol (categorías alta, media y baja) según el estudio de Scherer et al. (2014). El porcentaje de la cobertura vegetal o dosel arbóreo sobre el nido se registró a partir de una fotografía a una altura de 1 m sobre el nido y analizada con el programa Rapid Green Canopy Cover (Patrignani y Ochsner 2015). Del árbol donde se localizó el nido se registraron: especie, altura (m) estimada usando un clinómetro, cobertura de la copa del árbol (m2) con un flexómetro, y el diámetro a la altura del pecho (DAP >2,5 cm), con una cinta diamétrica. Para R. mangle el DAP se estimó por encima de la última raíz aérea (Cintrón y Schaeffer-Novelli 1984). A nivel de parcela se consideraron otras variables como el nivel de inundación registrado en cm a partir del promedio de tres medidas en cada parcela, la distancia de la parcela a la línea de marea (DLM en m) se calculó utilizando Google Earth Pro (c2018), midiendo en línea recta desde el punto centro georreferenciado de la parcela hacía la periferia de la isla (Arévalo 2017), y el porcentaje de la cobertura del dosel con fotografías de la vegetación a 1 m del suelo, con el programa Canopeo (Ferrer-Sánchez et al. 2017).
Análisis de datos
La estimación de la abundancia relativa (AR) de nidos por especie se definió a partir de la proporción, Dónde ni = número máximo de nidos de la especie i y N= el número total de nidos de todas las especies. Las parejas reproductoras se estimaron a partir del conteo de nidos (Kushlan c2011).
Para determinar variaciones entre la abundancia de nidos por especie y parche se utilizaron modelos lineales mixtos generalizados con distribución binomial negativa (glmerMod), debido a que los datos son conteos con una distribución de Poisson. Para este análisis se utilizaron los paquetes ggplot2 (Wickham 2016), Ime4 (Bates 2015) y effects (Fox 2003) de R. En todos los casos se consideró un a= 0,05. Para describir los patrones de distribución de anidación mensual de las garzas, se realizaron mapas de distribución de los nidos por especie utilizando ArcGIS 10.3 (ESRI c2020). Para caracterizar los sitios de nido de cada especie, se calculó la media (x) y desviación estándar (±) de cada variable. Así también se adelantó un análisis de residuales, para el factor aleatorio y a los residuales del modelo general para comprobar el supuesto de normalidad. Para estos análisis se utilizaron los paquetes MASS (Venables y Ripley 2002), ggplot2 (Wickham 2016) y effects (Fox 2003).
Para identificar la agrupación de las especies en función de las variables de los sitios de los nidos se realizó un escalamiento multidimensional no métrico (NMDS), utilizando la distancia de Bray-Curtis. El análisis se hizo con la función metaMDS del paquete vegan (Oksanen et al. 2018), y consistió en la ordenación de ocho especies en relación a nueve variables descriptoras a nivel de sitio de nido y parcela: 1) cobertura de la vegetación sobre el nido, 2) número de ramas que sostienen el nido, 3) diámetro de la copa del árbol, 4) altura del nido, 5) altura del árbol, 6) diámetro a la altura del pecho (DAP), 7) cobertura de la vegetación en la parcela, 8) nivel de inundación, y 9) distancia de la parcela a la línea de marea. Posteriormente, se realizó un análisis multivariado permutacional PERMANOVA (Anderson 2005) para identificar diferencias entre los grupos. Se aplicaron 999 permutaciones con la función "adonis" del paquete vegan (Oksanen et al. 2019). Complementariamente, se llevaron a cabo pruebas de contraste por pares donde se utilizó la corrección de Bon-ferroni. Todos los análisis se realizaron con el software estadístico R versión 3.4.4. (R Core Team c2020).
RESULTADOS
Nidos por especie y parejas reproductoras
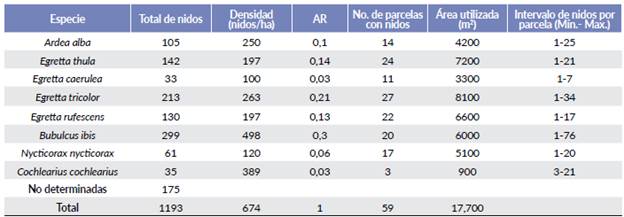
En total se identificaron y midieron 1018 nidos activos en 59 parcelas con un área total muestreada de 1,77 ha, 175 nidos no pudieron identificarse porque en una siguiente visita habían sido destruidos por fuertes vientos. De las ocho especies B. ibis (AR = 0,30; 299 parejas reproductoras), E. tricolor (0,21; 213) y E. thula (0,14; 142) presentaron mayor abundancia relativa de nidos y número de parejas reproductoras, mientras que las especies menos abundantes fueron C. cochlearius (0,03; 35) y E. caerulea (0,03; 33) (Tabla 1). La abundancia de los nidos entre las especies varió significativamente (X2=31,29; gl=7; P < 0,0001).
La distribución de los nidos fue diferente entre las parcelas oscilando entre uno y 114 nidos y entre las especies, de las cuales E. tricolor, E. thula y E. rufescens presentaron la distribución más amplia de nidos en la isla. Mientras que C. cochlearius fue la especie con una menor área de anidación (900 m2, Tabla 1).
Tabla 1 Total de nidos registrados, densidad nidos/ha, abundancia relativa (AR) y área utilizada por especie en la Isla Pájaros, Oaxaca-Chiapas, durante la temporada reproductora de marzo a agosto de 2018.
Otras especies que se encontraron anidando en la isla fueron Fregata magnificens Mathews, 1914, Phalacrocorax brasilianus (Gmelin, 1789) y Eudocimus albus (Linnaeus, 1758). Estas dos últimas comenzaron a anidar en junio, por lo que no hubo traslape temporal con las garzas, donde la mayoría ya tenía polluelos en este tiempo. Ambas especies anidaron principalmente en un parche (P4) localizado al sur de la isla (Fig. 1). Por su parte, F. magnificens se reproduce a inicios del año, por lo que ya se encontraba anidando cuando las garzas llegaron a la isla (marzo). Los nidos de las fragatas son construidos en las copas de los árboles, y en algunos parches donde también anidó A. alba (P2). Las fragatas mostraron agresividad con picotazos hacía los polluelos de las garzas cuando estos deambulaban entre las ramas.
Distribución temporal de anidación
Abril y mayo fueron los meses donde se registraron el mayor número de nidos activos (360 nidos con 799 huevos de seis especies en abril; y 433 nidos con 974 huevos de siete especies en mayo). En junio se reportó el mayor número de polluelos (660), y en julio el número de nidos descendió sustancialmente (siete nidos de dos especies), para agosto hubo un ligero incremento de 18 nidos de tres especies (Fig. 2).
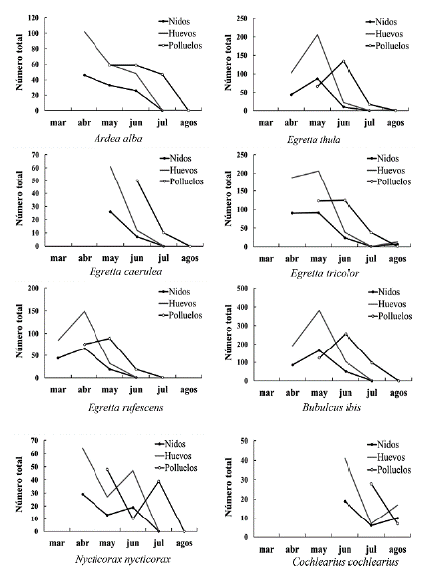
Figura 2 Número de nidos, huevos y polluelos por mes de muestreo de ocho especies de garzas en Isla Pájaros, Oaxaca-Chiapas (marzo a agosto, 2018).
La primera especie de garza que se registró en la isla fue E. rufescens en marzo y alcanzó su mayor abundancia en abril con 66 nidos. Mientras que A. alba, E. thula, E. tricolor, B. ibis y N. nycticorax empezaron a anidar en abril, pero mostraron variación en la duración y pico reproductivo (Fig. 2). Dos especies empezaron más tarde su reproducción; E.caerulea en mayo (26 nidos), y C. cochlearius hasta junio (19 nidos) (Fig. 2). La puesta de huevos para especies como A. alba, E. rufescens, E. caerulea, N. nycticorax y B. ibis se extendió hasta junio, mientras que para E. tricolor, E. thula y C. cochlearius fue en agosto.
Distribución espacial de los nidos
Las características estructurales de la vegetación de cada parche en la isla fueron diferentes, tanto en las especies de mangle, como en la altura de los árboles, la cobertura del dosel y el nivel de inundación (Tabla 2). Aunque en cada parche se registró actividad reproductiva, la composición de especies de garzas y abundancia de nidos varió significativamente entre ellos (X28 = 50,88; P < 0,001). El parche P2 registró la mayor riqueza (siete), y el mayor número de nidos (287) (Fig. 1). Este parche está constituido por Avicennia germinans principalmente y localizado en la periferia oeste de la isla, presentó la mayor área de todos los parches (5,61 ha), con poca cobertura del dosel (0,19 %) y bajos niveles de inundación (6,03 cm; Tablas 2 y 3). Otro parche con alta riqueza fue el P8, con seis especies y 301 nidos. Este parche está formado por Avicennia germinans, localizado en las partes centrales de la isla, y fue el segundo de mayor tamaño (2,79 ha; Tablas 2 y 3). Dos parches presentaron una sola especie reproductora, el P4 constituido por Conocarpus erectus, que presentó la menor cobertura de dosel de todos (0,24 %) y se localizó en la periferia del extremo sur de la isla (Fig. 1, Tabla 2), y el Pl, constituido por C. erectus y A. germinans, localizado en la periferia del extremo norte de la isla (Fig. 1, Tabla 2).
Tabla 2 Características de los nueve parches estudiados. Ag= Avicennia germinans; Ce= Conocarpus erectus; Lr= Laguncularia racemosa; Rm= Rizophora mangle. n= número de parcelas consideradas en cada valor. En cada parcela se consideró el 20 % de los árboles para medir cada variable.
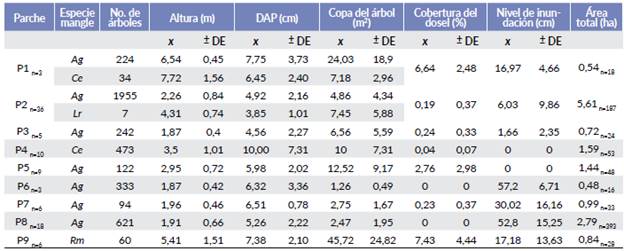
Tabla 3 Distribución del número de nidos de garzas por parche (P) en Isla Pájaros, Oaxaca-Chiapas, de marzo a agosto de 2018. n= número total de parcelas por parche donde se registraron nidos.
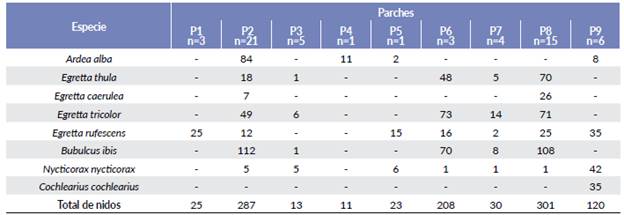
La garza más ampliamente distribuida en toda la isla fue Egretta rufescens que utilizó siete de los nueve parches (Fig. 3). En marzo empezó a anidar en los parches Pl y P9, y en abril comenzó a ocupar los parches centrales. El P9 fue el único parche constituido por Rizophora mangle, donde N. nycticorax presentó el mayor número de nidos; y el único sitio donde C. cochlearius anidó (Tabla 3, Fig. 3).
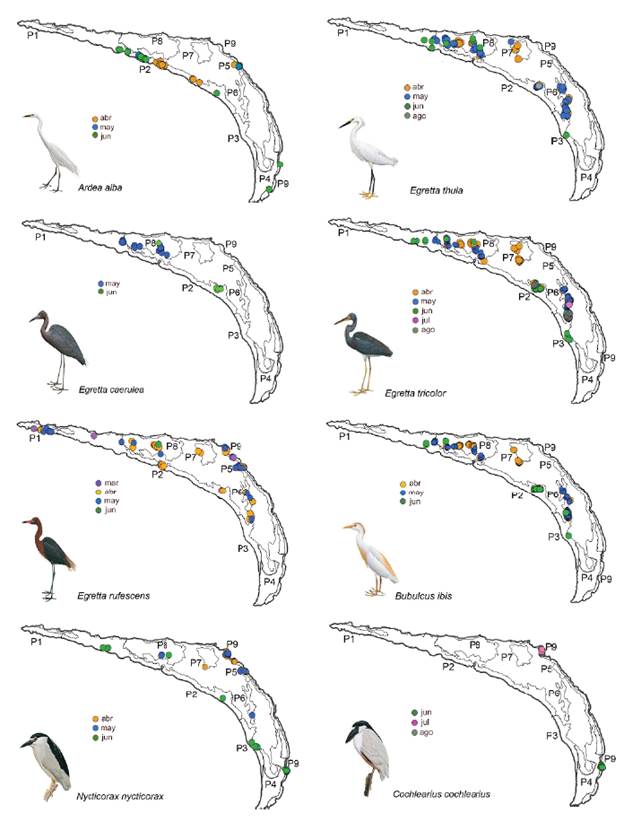
Figura 3 Distribución mensual y espacial de los nidos de ocho especies de garzas en Isla Pájaros, Oaxaca-Chiapas.
Los nidos de A. alba se distribuyeron en cuatro parches (Fig. 3) y tuvieron su mayor abundancia en P2. En este parche anidaron también las cuatro especies del género Egretta, pero distantes de A. alba; el mayor número de nidos de tres de ellas (E. thula, E. caerulea, y E. tricolor) estuvieron en el P8, donde A. alba no anidó (Tabla 3, Fig. 3). B. ibis también presentó muchos de sus nidos en ambos parches. El parche P8 tuvo menores alturas de los árboles (menor a 2 m), una copa arbórea menor a 2,5 m2 y un importante nivel de inundación (52,8 cm) (Tabla 2).
Aunque se encontraron nidos en los tres estratos de la vegetación, su distribución vertical fue diferente (F = 105,04; P < 0,0001). Ardea alba, que es la especie de mayor tamaño, construyó sus nidos en las partes altas de los árboles, mientras que E. rufescens, N. nycticorax E. thu-la, E. caerulea, E. tricolor y B. ibis anidaron en las partes medias, por lo que sus interacciones fueron potencialmente mayores. Por ejemplo, se observaron comportamientos de defensa del nido, donde adultos de E. thula y E. caerulea dieron picotazos a individuos adultos de B. ibis cuando estos se acercaron a sus nidos. Por el contrario, C. cochlearius anidó en las partes bajas del manglar (Tabla 4).
Tabla 4 Características (x ± DE) del sitio de nido y de la parcela en la colonia de anidación de la Isla Pájaros, Oaxaca-Chiapas. Ardalb=Ardeo alba, Egrthu = Egretta thula, Egrcae=Egretta caerulea, Egrtri=Egretto tricolor, Egrruf= Egretta rufescens, Bubibi=Bubulcus ibis, Nycnyc=Nycticorax nycticorax, Coccoc=Cochlearius cochlearius. DAP= Diámetro a la altura del pecho. DLM= Distancia de la parcela a la línea de marea. Letras distintas significan diferencias significativas.
El análisis PERMANOVA detectó diferencias significativas entre las variables a nivel del sitio de nido y parcela de las ocho especies de garzas (F=143,72; P = 0,001) (Tabla 5). Estas diferencias, también se pueden visualizar en el análisis de escalamiento multidimensional NMDS (Fig. 4), con coeficiente de estrés de 0,098. Los nidos de N. nycticorax, C. cohlearius y E. rufescens presentaron similitudes en cobertura del dosel de la parcela, de la copa del árbol y de la vegetación sobre el nido, pero difieren en tamaño y altura del nido y altura del árbol (Tabla 4). Las tres especies anidaron principalmente en R. mangle. Encontramos que A. alba difirió más en las variables del sitio de nido respecto a las otras especies de garzas; sus nidos fueron los de mayor tamaño, mayor número de ramas y mayor DAP; así también, fue una de las especies que ubicó los nidos distantes (horizontal y vertical) de otras especies de garzas; mientras que las cuatro garcitas de tamaño similar (E. thula, E. caerulea, E. tricolor y B. ibis) presentaron una amplia similitud en las variables medidas en el nivel de inundación, en la distancia a la línea de marea (DLM), altura del árbol y altura del nido, por lo que aparecen agrupadas (Fig. 4). Las pruebas por parejas en el PERMANOVA indicaron que E. thula, E. tricolor, E. caerulea y B. ibis no diferían significativamente entre sí (Tabla 5).
Tabla 5 Análisis PERMANOVA de las variables a nivel del sitio de nido y parcela entre ocho especies de garzas. Ardalb=Ardeo alba, Egrthu = Egretta thula, Egrcae=Egretta caerulea, Egrtri=Egretta tricolor, Egrruf= Egretta rufescens, Bubibi=Bubulcus ibis, Nycnyc=Nycticorax nycticorax, Coccoc=Cochlearius cochlearius. *= valores de P que indican diferencias significativas entre pares. Número de permutaciones = 999, Suma total de cuadrados = 64,84, F = 143,72, P= 0,001.
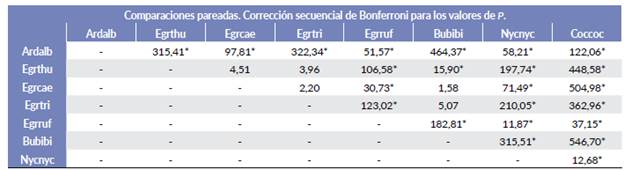
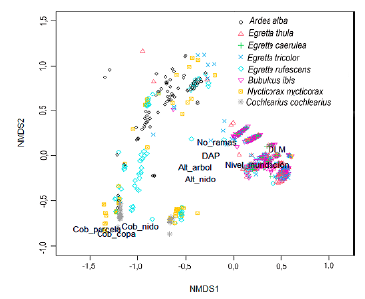
Figura 4 Ordenamiento multidimensional (NMDS) de las especies de garzas en función de las variables ambientales y de vegetación obtenidas de los sitios de nido. Cob_parcela= cobertura dosel en la parcela; Cob_copa= cobertura de la copa del árbol; Cob_nido= cobertura de la vegetación sobre el nido; No_ramas= Número de ramas que sostienen el nido; Alt_árbol= altura del árbol; DAP=diámetro a la altura del pecho; Nivel_inundación= Nivel de inundación; DLM= distancia a la línea de marea. Mientras más cercanos se encuentren los puntos, existen más similitudes en cuanto a las variables medidas, evidenciando así que existe un fuerte solapamiento entre estas especies.
DISCUSIÓN
Nidos por especie y parejas reproductoras
Se registraron ocho especies de garzas reproductoras. Ramos (2015) también reportó a Butorides virescens anidando en Isla Pájaros con un solo nido, la cual fue ausente en este estudio. La reproducción en colonias multi específicas de garzas ha sido una adaptación importante, y aunque estas agregaciones representan ciertos beneficios para las especies (García-Quintas 2015), también involucran competencias interespecíficas. Lo que sugiere que el número y distribución de las especies que utilizan los mismos recursos, en este caso los sitios de anidación pueden verse afectados por la dominancia de ciertas especies. En la isla, de las cuatro garcitas de similar tamaño, B. ibis presentó la mayor abundancia, y aunque no se registró el reclutamiento de parejas diarias, esta especie presentó un acelerado incremento en el número de nidos entre abril y mayo respecto a las demás. Posiblemente al ser una especie exótica y generalista la convierte en una competidora exitosa por espacio y material para construcción de nidos frente a las demás especies, permitiéndole ocupar más rápidamente los sitios de anidación (Hilaluddin et al. 2003, Sharah y Ali 2012). Este comportamiento se ha registrado en otras colonias reproductoras, donde B. ibis se reporta como la más abundante (1900 nidos en Beovides (2000), 695 nidos en Alvarado (2014), 454 nidos en Arévalo (2017).
Distribución temporal de anidación
Durante la temporada reproductiva de marzo a agosto de 2018, se observó una variación en la distribución y disposición de los nidos de cada especie. Esto indica que las especies han desarrollado mecanismos adaptativos de segregación ecológica temporal y espacial permitiendo la coexistencia (Griffin y Silliman 2011). La anidación de cinco especies de garzas fue más temprana al compararla con la fenología reproductiva reportada por Ramos (2015). Este autor reportó los primeros nidos en mayo de 2013 para E. thula y N. nycticorax, mientras que en este estudio fue en abril. También, Ramos (2015) observó los primeros nidos de A. alba, E. caerulea, E. tricolor y B. ibis en junio de 2013, y en este estudio iniciaron en abril. Por el contrario, el inició de reproducción de E. rufescens (marzo), E. caerulea (mayo) y C. cochlearius (junio) coincide con lo registrado por este autor.
Estos resultados son similares a los reportados por Jenni (1969) en Lago Alice, Florida, E.U., Maxwell y Kale (1977) en la Costa Sur de Florida, E.U., Hernández-Vázquez (2005) en Jalisco, México y Denis et al. (2002) en Cayo Norte, Biramas, Cuba (E. tricolor y E. thula). Sin embargo, contrastan con los obtenidos por Toledo (2000), quien registró anidación a partir de agosto-septiembre en el sureste de Brasil, y Contreras (2016) hasta septiembre-octubre en la costa norte de Yucatán, México. La variación en la temporada reproductiva de las diferentes especies puede ser efecto de la situación geográfica de los sitios de anidación.
La segregación temporal se manifestó en las diferencias en el inicio y duración del periodo de reproducción. Estas diferencias fueron mayores entre E. rufescens, E. caerulea y C. cochlearius quienes arribaron a la isla y comenzaron a anidar en distintos meses, caso contrario con A. alba, N. nycticorax, B. ibis, E. tricolor y E. thula que registraron superposición en la puesta de huevos en abril. Aunque estas últimas especies tuvieron arribos sincrónicos, la duración y la intensidad de la puesta varío entre ellas. E. tricolor y E. thula tuvieron una actividad reproductiva de cinco meses, mientras que A. alba, N. nycticorax y B. ibis abarcaron tan solo tres meses. Posiblemente debido a la metodología aplicada en esta investigación no fue posible observar un patrón más definido de la segregación temporal entre las especies que se superponen. Por lo tanto, se sugiere en estudios posteriores se analice la intensidad de reclutamiento de parejas cada semana al inicio de la temporada reproductora (Denis et al. 2002).
Distribución espacial de los nidos
Las especies de garzas se segregaron espacialmente tanto al ocupar distintas áreas de la isla como al colocar sus nidos a diferentes alturas. La estructura de la vegetación y características de los parches definieron la distribución horizontal donde las especies anidaron, al permitir dividir el espacio disponible y minimizar los efectos de la densidad acumulada durante el periodo de reproducción (López 2011, Scherer et al. 2014). E. rufescens, N. nycticorax y C. cochlearius anidaron al interior de la vegetación, por lo que utilizaron principalmente árboles con mayor cobertura del dosel, y que a su vez fueron los de mayor altura. Por su parte Ardea alba ubicó sus nidos en la copa de árboles con fustes gruesos y altos principalmente. Por el contrario, una vegetación de baja altura, distante a la línea de marea y con mayores niveles de inundación fueron características de los parches centrales donde especies medianas y pequeñas anidaron. Posiblemente esta selección de sitios para anidar sea una estrategia de protección ante inclemencias climáticas (Jenni 1969, Frederick y Collopy 1988, Martin 1993) o acceso de depredadores terrestres (Denis et al. 2002, Alvarado 2014).
El número de especies de garzas anidantes en el mismo sitio y cómo se distribuyen dependerá de su tolerancia interespecífica y de la disponibilidad de los recursos (Scherer et al. 2014). A. alba, E. rufescens, N. nycticorax y C. cochlearius mostraron una segregación espacial horizontal. Las diferencias significativas en sus sitios de nido se deben a que seleccionaron distintas características de la vegetación. En A. germinans, A. alba anidó en árboles con mayores valores de DAP, E. rufescens utilizó árboles con mayor cobertura de la copa y N. nycticorax se ubicó en árboles de baja altura y partes bajas de los mangles. Cuando estas especies anidaron en Rizophora mangle, estuvieron restringidas a un solo parche, pero mostraron diferencias en sus sitios de nido, dada por su distinta ubicación vertical a lo largo de la copa, lo que indicó que existe una repartición del espacio de anidación entre especies que coexisten (Jenni 1969, Burger 1979, Frederick y Collopy 1988). Por su parte, C. cochlearius mostró una marcada selección por R. mangle, comportamiento similar que se ha presentado en otros sitios donde se reproduce (Dickerman y Juárez 1971, Hernández-Vázquez y Fernández-Aceves 1999). La asociación con esta especie de mangle puede relacionarse a la densa cobertura vegetal, característica que influye en el ocultamiento de los nidos (Martin 1993).
Este patrón de segregación no se observó para las garzas pequeñas, las cuales presentaron solapamiento y quizás competencia interespecífica. Las cuatro especies de garcitas similares en tamaño compartieron los mismos parches de anidación y el mismo estrato de la vegetación. Además, utilizaron árboles de la misma altura, cobertura de la copa, y cobertura vegetal sobre el nido, lo que sugiere que sus requerimientos de anidación son similares. Denis et al. (2002) en La Ciénaga de Biramas, en Cuba reportó también a estas especies anidando en la franja de vegetación intermedia (1 a 3 m de altura). El construir sus nidos cerca de áreas inundadas y en las partes centrales de la isla, pueden evitar la depredación, así como los fuertes vientos, lo cual optimiza la calidad del hábitat reproductivo (Kelly et al. 1993).
Las especies que se sobreponen temporalmente en la reproducción y que ocupan las mismas áreas para anidar, construyen sus nidos a diferentes alturas del manglar.
La alineación vertical observada en A. alba, E. rufescens, N. nycticorax y C. cochlearius principalmente en árboles altos de (4 a 5 m), podría estar en función del número de especies presentes y del espacio disponible. Este patrón de alineación coindice con lo reportado en otras colonias reproductivas de garzas (Jenni 1969, Burger 1979, Toledo 2000, Denis et al. 2002, Hilaluddin et al. 2003, López 2011, Scherer et al. 2014).
Para las cuatro garcitas de tamaño similar los nidos no estuvieron estratificados, a pesar de la interacción social. Posiblemente el ambiente uniforme y la baja altura de la vegetación de A. germinans (2 m) en el centro de la isla limitó a las especies alinearse verticalmente, por lo que las interacciones entre estas especies pueden ser más intensas. Aunque los patrones de selección observados en las especies de garzas en la isla ya se han reportado previamente, su ubicación horizontal y vertical difiere debido a que la distribución de los recursos y la composición de las especies de garzas varían localmente.
Estudiar los patrones espaciales y temporales de anidación de las ocho especies de garzas permitió ampliar la comprensión de los mecanismos ecológicos que facilitan la reproducción de estas especies reproductoras en Isla Pájaros. Dividir la isla en áreas con características similares (parches) nos permitió disminuir la variación de los datos e interpretar cómo los factores bióticos y abióticos operan a menores escalas en la abundancia y distribución de las especies de garzas en sus sitios de anidación.