INTRODUCCIÓN
Los bosques de los Andes tropicales son considerados zonas prioritarias para la conservación debido a las elevadas tasas de diversidad y de endemicidad de numerosos grupos de organismos (Myers 2000, Brooks et al. 2002, Barthlott et al. 2005). Sin embargo, se sitúan en una de las ecorregiones más amenazadas del planeta (Garavito et al. 2012, Tapia-Armijos et al. 2015), y un claro ejemplo de ello es el sur de Ecuador, donde las tasas de deforestación son las más elevadas de Sudamérica (FAO 2011).
En esta región, una de las zonas más inexploradas es la Cordillera del Cóndor y sus Tepuyes (Guayasamin y Bonaccorso 2011). Los Tepuyes son un sistema de montañas aisladas, con paredes verticales de varios cientos de metros y cimas planas, que están compuestas por areniscas y cuarcitas (Guayasamin y Bonaccorso 2011). Estas características topográficas y geológicas, junto con unas condiciones climáticas muy variables, que incluyen intensas precipitaciones, elevada irradiación solar, fuertes vientos o bajas temperaturas, han propiciado la existencia de una flora y fauna endémica, hasta el punto de ser considerados centros de diversidad y endemicidad (Sipman 1992, Jadán y Mendoza 2011). No obstante, estos Tepuyes sufren algunos problemas de conservación relacionados con la deforestación provocada por el avance de las explotaciones agrícolas y mineras (Jadán y Mendoza 2011).
Recientes estudios se han centrado en la evaluación rápida de la diversidad de los Tepuyes del Alto Nangaritza en la Cordillera del Cóndor, con el objetivo de poder tomar decisiones sobre la conservación de estas zonas, susceptibles de englobar una elevada riqueza de especies endémicas o amenazadas (Guayasamin y Bonaccorso 2011). Hasta la fecha, estos estudios están enfocados en algunos grupos de organismos como anfibios y reptiles (Guayasamin et al. 2011), aves (Freile et al. 2011), mamíferos (Terán 2011), hormigas (Alonso y Davis 2011), insectos hoja y palo (Braun 2011) y algunos grupos de plantas, como árboles o arbustos (Jadán y Mendoza 2011). En cambio, no se han realizado estudios sobre hongos liquenizados (a partir de ahora, líquenes), a pesar del papel que juegan como indicadores de diversidad (Aragón et al. 2019), de contaminación ambiental (Nash 2008) o del estado de conservación de los ecosistemas forestales (Aragón et al. 2010, Nascimbene et al. 2013, Benítez et al. 2018).
En relación con estos organismos, se espera encontrar una elevada diversidad asociada a estas formaciones ya que, en trabajos realizados en países como Brasil o Venezuela, el número de especies encontradas sobrepasó las 200 (Sipman 1992, Sipman y Aptroot 1992). Así, el principal objetivo de este trabajo es elaborar un primer catálogo de las especies de líquenes que habitan en los Tepuyes del Alto Nangaritza.
Materiales y Métodos
Área de estudio
El área de estudio son varios Tepuyes localizados en la Cuenca Alta del río Nangaritza, situada en la Cordillera del Cóndor (SE Ecuador), entre los 900 y 2000 m de altitud (Fig. 1). El clima es subtropical, con una temperatura media anual cercana a los 20 °C y una precipitación anual entre 2000 y 3000 mm (INAMHI 2011).
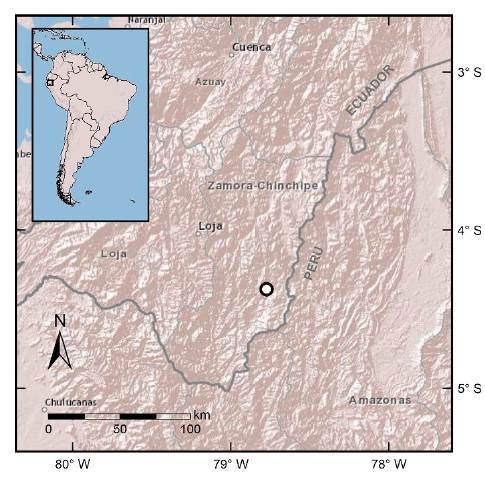
Figura 1 Localización del área de estudio (o), cuenca del Valle Nangaritza, en la Cordillera del Cóndor, sur-este de Ecuador.
Las principales formaciones que colonizan los Tepuyes son bosque denso piemontano, entre los 600 y 1600 m, en una transición entre la vegetación de tierras bajas y la de la cordillera; bosque denso montano bajo, situado entre 1500 y 2000 m de altitud y con una cobertura arbolada superior al 80 %; bosque chaparro, con especies de bosque montano, pero con porte bajo, debido a las condiciones climáticas desfavorables; y páramo arbustivo atípico, entre los 1700 y 2000 m de altitud, dominado por un matorral arbustivo como resultado de la acción del viento, elevada pendiente y suelos poco profundos (Sierra 1999, Jadán y Mendoza 2011).
Muestreo e identificación
Se muestrearon líquenes en árboles y arbustos, desde la base hasta los 2 m de altura, incluyendo también las ramas del suelo y las hojas. El muestreo se llevó a cabo a lo largo de tres intervalos de altitud teniendo en cuenta los tipos de vegetación: zona alta (> 1700 m, páramo arbustivo), zona media (1000-1700 m, bosque piemontano y montano bajo) y zona baja (< 1000 m, bosque piemontano en el entorno del río Nangaritza). Se recolectaron cerca de 1.000 ejemplares de líquenes epífitos.
Para la identificación de las especies se utilizaron claves de carácter general y algunas más específicas para determinados géneros (Hale 1975, Sipman 1983, 2004, Thor, 1990, Brako 1991, Ekman 1996, Jorgensen 1997, Ahti 2000, Timdall y Krog 2001, Cunha 2007, Aptroot et al. 2007, Bungartz 2008, Timdal 2008, Coca y Sanín 2010, Aptroot 2012, Moncada 2012, Benati 2013, Truong y Clerc 2013, Kitaura y Marcelli 2019). Para las especies de los géneros Cladonia, Ramalina y Usnea se identificaron los metabolitos secundarios mediante la técnica de cromatografía en capa fina (TLC, Thin Layer Chromatography), con el uso del disolvente B (Orange et al. 2001). El material identificado se encuentra depositado en el Herbario del Real Jardín Botánico de Madrid (MA) y en el herbario de la Universidad Técnica Particular de Loja (HUTPL) (Material suplementario).
Para cada especie se incluye información sobre sus rasgos funcionales, donde se especifica la forma de crecimiento (talo compuesto, crustáceo, escuamuloso, filamentoso, foliáceo, folícola, fruticuloso, leprarioide) y el tipo de fotobionte (Cianobionte y Ficobionte; Trebouxia y Trentepohlia), para lo cual se consultó la base de datos LIAS light (http://www.lias.net), que contiene información para la identificación de líquenes, como claves o descripciones. El catálogo de líquenes se presenta en orden alfabético (Material suplementario). Se ha utilizado Index Fungorum y Mycobank para la nomenclatura de las especies. Se indica además si la especie es nuevo registro para la provincia de Zamora Chinchipe (*), para Ecuador (**) o para Sudamérica (***). Para determinar los nuevos registros se consultaron la distribución de las especies. Se han empleado diferentes fuentes de información tales como catálogos florísticos, claves de identificación, descripción de especies, base de datos LIAS light (http://www.lias.net), base de datos GBIF (www.gbif.org) y diferentes checklists (e.g. Noske et al. 2007, Bungartz et al. 2016).
Resultados y discusión
Se han identificado un total de 174 especies incluidas en 57 géneros y 26 familias. De ellas, 13 especies se citan por primera vez en Sudamérica, 64 son nuevas para Ecuador, y 132 constituyen nuevos registros para la provincia de Zamora Chinchipe (Material suplementario).
El número de especies identificadas en este estudio es destacable y muy similar a las encontradas en otros Tepuyes como el Cerro Guaiquina en Venezuela (Sipman 1992) o el Monte Roraima en Brasil (Sipman y Aptroot 1992). Además, las especies de géneros como Cladonia, Coenogonium o Sticta, y las pertenecientes a los nuevos registros, como Thelotrema, corresponden con las mencionadas en estos trabajos (Sipman 1992, Sipman y Aptroot 1992). También cabe destacar que se observaron diferencias entre intervalos de altitud como sucede en los Tepuyes del Cerro Guaiquina en Venezuela (Sipman 1992). El elevado número de especies epífitas puede estar relacionado con la gran heterogeneidad que presentan los bosques tropicales, con la gran diversidad de especies arbóreas, y de ambientes diferentes, propiciados por la forma y tamaño de los árboles (Gradstein et al. 1996, Soto Medina et al. 2012).
Se han identificado nuevos quimiotipos para Cladia aggregata (Swartz) Nylander (ác. divaricático), Cladina arbuscula (Wallr.) Flot. (ác. hipotamnólico), Cladonia corymbites Nyl. (ác. hipotamnólico-quimiótipo I, ác. estíc-tico y divaricático-quimiótipo II), Cladonia didyma (Fee) Vainio (ác. hipotamnólico y meroclorofeico-quimiótipo I, ác. norestíctico-quimiótipo II, ác. fumarprotocetrárico-quimiótipo III), Cladonia furcata (Huds.) Schrad. (ác. hi-potamnólico) y Cladonia halei Ahti (ác. hipotamnólico). En gran parte de los ejemplares analizados de los géneros Cladia y Cladonia se ha detectado ácido hipotamnólico. Este compuesto está muy extendido entre las especies de Cladoniaceae y, según un estudio realizado en Europa, favorece la tolerancia a ambientes ácidos, permitiéndoles crecer en sustratos con pH bajos (Hauck et al. 2009), como son los sustratos de los Tepuyes inventariados.
En relación con las especies folícolas, en el área de estudio se han identificado especies creciendo exclusivamente en este sustrato tales como Coccocarpia tenuissima Müll. Arg., Glyphis scyphulifera (Ach.) Staiger y Tricharia carnea (Müll. Arg.) R. Sant.
En algunos casos, no fue posible la identificación exacta debido a diferencias morfológicas con las especies previamente descritas. Así, por ejemplo, en la especie identificada como Graphis aff. cervina Müll. Arg., encontramos que las características morfológicas de su talo y apotecios son similares, pero el tamaño de las esporas es mayor (hasta 40 μm) respecto a G. cervina la cual se conoce con esporas de 15 a 25 μm (Lücking et al. 2009a). Algo similar ocurre con la especie identificada como Megalospora aff. albescens Sipman, donde se encontró que las características morfológicas de su talo y apotecios son similares, pero el tamaño de las esporas es menor (hasta 30 μm) respecto a M. albescens con esporas de 150-180 um (Sipman 1983). En cuanto a las especies Sticta aff. cyphellulata (Müll. Arg.) Hue y S. aff. cordillerana Gyeln. , esta nomenclatura está basada en la descripción de Moncada et al. (2013). Además, incluimos especies por confirmar como Allographa cf. cleistoblephara (Nyl.) Lücking & Kalb., Bacidia cf. insularis Zahlbr. y Bacidina cf. medialis (Tuck. ex Nyl.) Kistenich, Timdal, Bendiksby & S. Ekman en las que no hemos encontrado esporas maduras para su identificación precisa.
Algunas especies que se reportan por primera vez en Ecuador fueron descritas recientemente tales como Dictyonema applanatum Lücking, Dal-Forno & Wilk y D. discocarpum Lücking, Dal-Forno & Wilk que solo se conocen de la localidad tipo en Bolivia, y D. hapteriferum Lücking, Dal-Forno & Wilk de Bolivia y Perú (Lücking et al. 2012). Algo similar ocurre con Herpothallon cinereum G. Thor (Colombia, Venezuela) (Aptroot et al. 2009), H. nigroisi-diatum G. Thor (Brasil, Perú) (Aptroot et al. 2009), Parallopsora brakoae Timdal.) Kistenich, Timdal & Bendiksby (Perú) (Timdal 2008), o algunas especies del género Sticta (S. macrocyphellata Moncada & Coca, S. parahumboldtii Moncada & Lücking, S. plumbeociliata Moncada & Lücking) (Moncada et al. 2013, 2015).
Para algunas especies este hallazgo amplía el conocimiento de sus áreas de distribución y su ecología. Así, las referencias más cercanas de Bacidia laurocerasi (Delise ex Duby) Zahlbr. son de Chile, en bosque valdiviano degradado (Gatica et al. 2011), las de Biatora rufidula (Graewe) S. Ekman & Printzen son de Argentina y Chile, donde habita en zonas muy húmedas y frías (Rodríguez-Flakus y Printzen 2014), y las de Leptogium brebisonii Mont. en Brasil, registrada en zonas con clima subtropical húmedo (Kitaura et al. 2019). Destacamos la presencia de Bulbothrix confoederata (Culberson) Hale, conocido únicamente en Estados Unidos en ambientes de bosques subtropicales (DeBolt et al. 2007), Graphis arbusculiformis (Vain.) Lücking, conocido de Tailandia (Lücking et al. 2012) o Dolichousnea trichodeoides (Vain. ex Motyka) Articus, que se distribuye por Australia, Sudáfrica, Asia, Papua Nueva Guinea y Taiwán en zonas boscosas de montaña (Ohmura 2012) (Figs. 2-4).
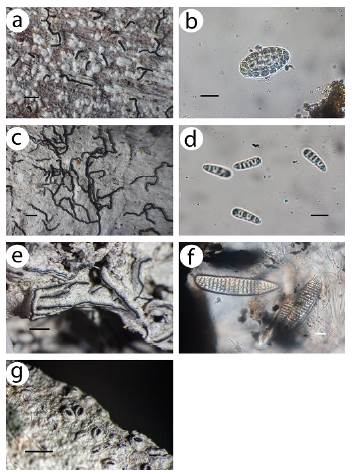
Figura 2 Nuevos registros de líquenes para Sudamérica. a. Graphis anti-llarum Vain., hábito del talo. b. Graphis antillarum Vain., espora. c. Graphis arbusculiformis (Vain.) Lücking, hábito del talo. d. Graphis arbusculiformis (Vain.) Lücking, espora. e. Graphis insulana (Müll.Arg.) Lücking, hábito del talo. f. Graphis insulana (Müll.Arg.) Lücking, espora. g. Graphis cf. cleistoblephara (Nyl.) Lücking & Kalb, hábito del talo. Escala del hábito del talo = 1mm. Escala de esporas = 10 μm.
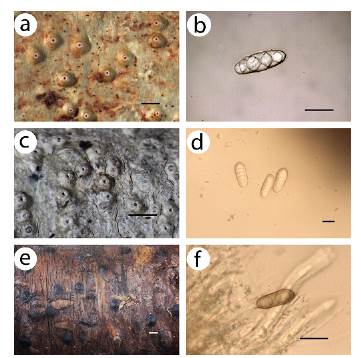
Figura 3 Nuevos registros para Sudamérica. a. Ocellularia chonestoma (Leight.) Zahlbr., hábito del talo. b. Ocellularia chonestoma (Leight.) Za-hlbr., espora. c. Ocellularia diplotrema (Nyl.) Zahlbr., hábito del talo. d. Ocellularia diplotrema (Nyl.) Zahlbr., espora. e. Pyrenula scutata (Stirt.) Zahlbr., hábito del talo. f. Pyrenula scutata (Stirt.) Zahlbr., espora. Escala del hábito del talo = 1mm. Escala de esporas = 10 μm.
Otras especies, aunque se citan por primera vez para Ecuador, están referenciadas en países cercanos, en ambientes parecidos. Esto denota el escaso conocimiento que todavía se tiene de estos organismos en Ecuador. Aquí podemos incluir algunas especies de los géneros Chaenotheca (C. olivaceorufa (Vain.) Zahlbr.), Coenogonium (C. barbatum Lücking, Aptroot & Umaña, C. moliniforme Tuck.), Graphis (G. assimilis Nyl., G. emersa Müll. Arg., G. neo-elongata Lücking, G. palmicola A.W. Archer & Lücking), Phyllopsora (P. subcrustacea (Malme) Brako), Sticta (S. cordillerana Gyeln., S. dioica Moncada & Lücking, S. laciniosa D.J. Galloway) o Allographa nuda (H. Magn.) Lücking & Kalb, géneros que han sido ampliamente estudiados en el Neotrópico (Brako 1991, Tibell 1996, Rivas-Plata et al. 2006, Lücking et al. 2009b, Moncada 2012). Algunas especies, aunque son nuevas para Sudamérica, han sido referenciadas con anterioridad en algunos puntos de Centroamérica como Costa Rica. Es el caso de Graphis antillarum Vain., G. insulana (Müll. Arg.) Lücking (Lücking et al. 2008), Allographa cleistoblephara (Nyl.) Lücking & Kalb (Vargas 2016), Ocellularia diplotrema (Nyl.) Zahlbr. (Grant y Konrat 2019) o Phyllopsora albicans Müll. Arg. (Vargas 2016).
Se han detectado algunas diferencias en la riqueza de especies entre los tres intervalos altitudinales. El mayor número de especies se registra en zonas más bajas y luego disminuye considerablemente conforme aumenta la altitud. Al tratarse de especies epífitas, esto podría estar relacionado con la presencia de una mayor diversidad de especies arbóreas en las zonas más bajas (Jadán y Mendoza 2011). Tamaño y edad de los árboles, rugosidad de la corteza o pH, son factores que afectan al establecimiento de los líquenes epífitos y, por tanto, pueden modular la composición de las comunidades (Cáceres et al. 2007, Fritz et al. 2009, Rosabal et al. 2010, Benítez et al. 2015). Además, se han encontrado especies exclusivas en los intervalos altitudinales estudiados: cinco especies para la zona de mayor altitud, 28 especies en la zona media y 88 especies en la zona más baja (Material suplementario).
Las formas de crecimiento dominantes, especialmente en las zonas bajas y medias, fueron las crustáceas (77 especies), seguidas de las foliáceas (56 especies), (Material suplementario). En bosques tropicales de baja altitud las formas crustáceas suelen ser dominantes (Sipman 1989, Holz 2003, Komposch y Hafellner 2003, Normann et al. 2010, Koch et al. 2013, Cáceres y Aptroot 2017). Las especies crustáceas presentan diferentes tipos de organización del talo (Lakatos et al. 2006, Aragón et al. 2019) que les permite tener estrategias ecológicas diferentes, adaptadas a óptimos fotosintéticos con baja intensidad de luz o a liberar exceso de agua en estas zonas tan húmedas (Lakatos et al. 2006). Ejemplo de ello son las especies de Herpothallon, que carecen de córtex superior, exponen al exterior la médula hidrófoba y desarrollan un hipotalo con hifas paralelas que facilitan la liberación de agua (Lakatos et al. 2006, Nash 2008, Benítez et al. 2018). Por el contrario, y coincidiendo con otros estudios realizados en el sur de Ecuador, existe una mayor proporción de especies fruticulosas en zonas más elevadas, debido a que están bien adaptadas a rehidratarse muy rápidamente en zonas muy expuestas (González et al. 2017). Además, muchas de estas especies, como las pertenecientes al género Cladonia, sintetizan ácido úsnico, que les protege de la excesiva irradiación (Rundel 1969, Huneck 1999, Molnár y Farkas 2010).
En relación con el fotobionte, dominan las especies con alga verde (135 especies), 66 de ellas con Trentepohlia. Un total de 39 especies contienen cianobacteria como principal fotobionte, y además aparecieron con mayor frecuencia en zonas más bajas (Material suplementario). Los resultados son muy similares a los obtenidos por otros autores en ambientes tropicales (e.g. Benítez et al. 2018) y muy diferentes a ambientes como el mediterráneo o templado, donde el número de especies con Trentepohlia es considerablemente menor, y apenas representa el 5 % o 10 % del total de las especies (Marini et al. 2011, Matos et al. 2015). Esto está relacionado con las preferencias ambientales de la citada alga verde, que vive de forma libre, muchas veces como epífita, en ambientes muy húmedos, como son estos bosques tropicales (Friedl y Büdel 2008). Fuera de los trópicos aparece en zonas cálidas y húmedas, cercanas a la costa, evitando áreas más continentales y elevadas y las zonas más áridas y secas (Marini et al. 2011, Matos et al. 2015). El número de especies con cianobacteria también fue elevado, especialmente del género Leptogium (14 especies), muchas de ellas exclusivas de las zonas más bajas. Estas especies están adaptadas a ambientes tropicales con temperaturas elevadas y humedad ambiental por encima del 80 % (Green et al. 2008). Estas condiciones facilitan la hidratación del talo de estos cianolíquenes (por encima de un 80 %) para realizar una fotosíntesis neta positiva (Green et al. 2008).
La familia mejor representada es Graphidaceae con 27 especies, seguida de Lobariaceae (20 spp) y Cladoniaceae (16 spp) (Fig. 5). Esta dominancia de la familia Graphidaceae, coincide con otros trabajos realizados en bosques tropicales (Soto Medina et al. 2012, Benítez et al. 2015). Graphidaceae, con más de 2500 especies, es una de las familias mejor representadas en los trópicos (Cáceres et al. 2014), y probablemente se vea favorecida por el tipo de fotobionte (Trentepohlia) y su forma de crecimiento crustácea. Thelotremataceae es otra familia muy bien representada en este estudio. Su presencia suele estar asociada a bosques naturales (Rivas-Plata et al. 2008, Soto Medina y Rojas Bolaños 2010), constituyendo un excelente indicador del estado de conservación de estas áreas.

Figura 4 Nuevos registros para Sudamérica. a. Bulbothrix confoederata (Culberson) Hale, hábito del talo. b. Chiodecton leptosporum Müll. Arg., hábito del talo. c. Dolichousnea trichodeoides (Vain. ex Motyka) Articus, hábito del talo. d. Leptogium cyanescens (Rabenhorst) Kórber, hábito del talo. e. Megalospora aff. albescens Sipman., hábito del talo. f. Mega-lospora aff. albescens Sipman., espora, g. Phyllopsora albicans Müll. Arg., hábito del talo. Escala del hábito del talo = 1mm, en A y C= 5mm. Escala de esporas = 10 μm.
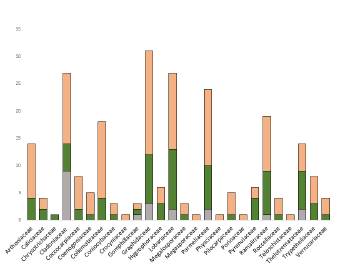
Figura 5 Riqueza de especies por familia para cada intervalo de altitud estudiado. Gris: zona alta (> 1700 m), verde: zona media (1000-1700 m) y naranja: zona baja (< 1000 m).
En conclusión, este catálogo constituye una primera aproximación al conocimiento de la diversidad de líquenes en los Tepuyes del Valle Nangaritza, en Ecuador. Los resultados muestran que, al igual que otros grupos de organismos, la elevada riqueza de líquenes en estas áreas constituye puntos calientes de diversidad para estos organismos epífitos. Los estudios de la biota liquénica en las áreas tropicales ecuatorianas contribuyen de manera importante al conocimiento de estos organismos donde todavía son poco conocidos. Los nuevos registros ayudan en gran medida al conocimiento de su distribución y ecología. Asimismo, es importante resaltar la importancia de los estudios de inventariado y los trabajos taxonómicos. Pese a que son trabajos que han ido en descenso en los últimos años y en ocasiones son complejos, aportan información necesaria sobre zonas o grupos de organismos poco estudiados de los que se necesita información para, por ejemplo, analizar el estado de conservación.















