INTRODUCCIÓN
Los anfibios son organismos inofensivos para el humano e incluso benéficos, ya que controlan insectos dañinos y sirven como fuente alternativa de alimento; a pesar de eso, los anfibios de todo el mundo están en declive y su riesgo de extinción es mayor que el de cualquier otro grupo de vertebrados (Houlahan et al. 2000), la disminución de los anfibios se documentó en 2008, como la evidencia de la inminente sexta extinción masiva (Wake y Koo 2018). Estos organismos contribuyen de manera importante a que México sea considerado un país megadiverso, ya que poseen un alto grado de endemismo, cercano al 60 % (Flores Villela y García Vázquez 2014, Parra Olea et al. 2014).
Aunque existe discrepancia sobre el número de especies catalogadas en alguna de las diferentes categorías de riesgo según distintas listas, es evidente que se trata de un grupo que requiere de atención para ampliar su estudio y proponer estrategias de conservación, ejemplo de esto es que de acuerdo con AmphibiaWeb (c2020), existen 396 especies de anfibios repartidos en 242 anuros, 151 salamandras y tres cecilias, de los cuales 145, 127 y una respectivamente, son endémicos de México (68,93 %); por otro lado, la NOM 059-SEMARNAT-2010, considera 361 especies, de las cuales 174 (48,1 %), son endémicas, cinco se encuentran en peligro de extinción, 44 amenazadas y 125 están sujetas a protección especial (SEMARNAT c2010); por su parte, la IUCN (por sus siglas en Inglés) considera 273 especies endémicas de México (84,24 %), y de acuerdo con las distintas categorías de riesgo, las tiene catalogadas como sigue: 29 en preocupación menor, 57 en peligro de extinción, 83 en peligro crítico, 27 vulnerables, 23 con datos deficientes y 11 casi amenazadas (IUCN c2019).
La heterogeneidad de los hábitats puede ser perturbada por actividades humanas como contaminación, degradación y cambio en el uso del suelo (e. g., deforestación), lo que causa efectos en cascada sobre las comunidades de anfibios (Berriozabal-Islas et al. 2018, Khatiwada et al. 2019), las tasas de transformación de los hábitats naturales no se detienen y es probable que se pierdan especies y poblaciones de anfibios (Frías-Álvarez et al. 2010), sobre todo si se considera que el 50 % de las especies de anfibios en México son micro endémicas (Parra-Olea et al. 2014), esto es, que su tolerancia ambiental es muy estrecha (Pie et al. 2013), por lo que alteraciones ligeras al hábitat repercuten grandemente en las poblaciones. Durante varias décadas, se ha insistido en la importancia de diversos factores como causa del declive de los anfibios en el mundo, hoy sabemos que dichos factores interactúan, y que, a excepción de la modificación del hábitat, ninguno es una verdadera amenaza a escala global para los anfibios (Green et al. 2020).
La selección de sitios de alimentación, descanso y apareamiento que maximicen la supervivencia y el éxito reproductivo (Luna-Gómez et al. 2017), puede estar influenciada por factores bióticos, tales como la presencia de depredadores y competidores, así como por factores abióticos como el riesgo a la desecación (Mageski et al. 2016); estos mismos factores pueden influir en la selección de diferentes sitios para la vocalización y la oviposición (Ferreira et al. 2012). Son pocos los trabajos que abordan los patrones de distribución de anfibios en microhabitats en México, entre los que se encuentran Santos-Barrera y Urbina-Cardona (2011), quienes documentan un patrón diferenciado de uso de microhábitat en anuros del bosque mesófilo de montaña del estado de Guerrero. Luna-Gómez et al. (2017) encontraron que en la Reserva de la Biósfera de Chamela existe además una segregación temporal en la presencia y actividad reproductiva de las especies de anuros, la cual se asoció principalmente con la precipitación, así como una superposición de especies en algunas semanas de la temporada de lluvias.
Leyte-Manrique et al. (2018), compararon el uso del microhábitat y periodo de actividad de una comunidad de anuros en cuatro tipos de vegetación, bosque tropical caducifolio, bosque de galera, matorral xerófilo y pastizal inducido, en un ambiente tropical estacional del estado de Guanajuato; Caracterizaron 17 tipos de microhábitats y compararon los periodos de actividad entre las distintas especies, encontraron una relación positiva entre la temperatura corporal y la temperatura del microhábitat y la ambiental, además la comunidad de anuros presente en el área de estudio puede diferenciarse en tres componentes eco-estructurales, conforme a sus hábitos; especies acuáticas, saxícolas-terrestres y arborícolas, determinados tanto por sus hábitos para la selección de microhábitats, como por sus periodos de actividad diarios. Concluyeron que, aunque la heterogeneidad vegetal es importante en la distribución de las especies y disponibilidad de micro-hábitats, no es el principal factor en la selección y uso de los microhábitats, sino que la selección y uso de los microhábitats y composición de la comunidad de anuros, se determinó por eventos conductuales que se manifiestan en los periodos de actividad y capacidad de termorregular de cada especie.
Para el caso de la Sierra de Quila, existe un trabajo que documenta 22 especies de anfibios (Santiago-Pérez et al. 2011), sin embargo, no se incluye información sobre la riqueza, diversidad y distribución de éstas en los tipos de vegetación o en los distintos microhábitats en esta Área Natural Protegida, lo que constituye información útil para futuros estudios científicos como educativos, enfocados en la conservación, ecología y distribución de los anfibios de la zona. Por lo anterior, el objetivo del presente trabajo fue estimar la riqueza y diversidad de los anfibios en los distintos tipos de vegetación del Área Natural Protegida Sierra de Quila, así como evaluar si existe un patrón de distribución de las especies en los distintos microhábitats del área.
MATERIALES Y MÉTODOS
Área de estudio
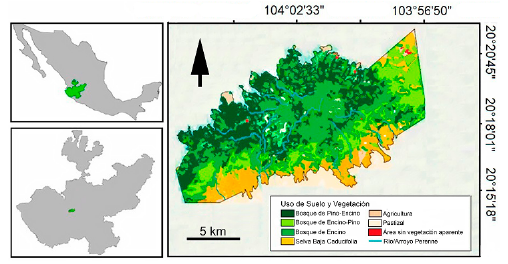
La Sierra de Quila es un área protegida bajo la categoría de Zona de Protección de Flora y Fauna. Se encuentra ubicada a 100 km al suroeste de la ciudad de Guadalajara, Jalisco, México, y cuenta con una extensión de 15 192 ha. Geográficamente se localiza entre los 20° 12' y 20° 23' Norte y los 103° 53' y 104° 11' Oeste. La zona comprende los municipios de Ameca, Atengo, Cocula, San Martín Hidalgo, Te-colotlán y Tenamaxtlán (Villavicencio-García et al. 2005) (Fig. 1). El área se ubica dentro de la región fisiográfica del Eje Neovolcánico Transversal, en un intervalo altitudinal que va de los 1300 a los 2560 m. Prevalecen dos tipos de clima según García (2004): el templado húmedo con lluvias en verano y el caliente húmedo con larga temporada seca, donde se presenta una precipitación media anual de 900 mm. En el área pudimos identificar ocho tipos de vegetación de acuerdo con el criterio de Rzedowski (2006): Bosque de pino, ubicado a 2 500 m, bosque de pino-encino ubicado entre los 1900 y los 2000 m, el bosque de encino se encuentra entre los 1500 y 1900 m, bosque de encino-pino ubicado entre los 1 900 y 2 000 m, el bosque tropical caducifolio ubicado de los 1300 a los 1800 m, bosque mesófilo de montaña, vegetación con elementos relictuales que se presenta en cañadas entre los 1950 y los 2560 m, el bosque de galería se ubica de los 1300 hasta los 2200 m y el bosque espinoso que se sitúa a los 1300 de altitud.
Captura e identificación de especies
Se efectuaron 24 salidas de campo, una cada quince días entre los meses de junio y septiembre de 2016, 2017 y 2018, cada visita con una duración de tres noches de trabajo, dando un total de 72 noches efectivas de búsqueda. Se eligieron seis tipos de vegetación en los que se establecieron tres senderos en cada uno (Bosque de Pino, se trata de pequeños relictos con una superficie menor a las 50 ha pero se incluyó en el estudio debido a que en visitas previas se habían observado organismos en riachuelos intermitentes en temporada de lluvias, Bosque de Pino-Encino con una superficie de 5455 ha, Bosque de Encino-Pino con una superficie de 4050 ha, Bosque de Encino con una superficie de 3248 ha, Bosque Tropical Caducifolio con una superficie de 2143 ha, y Bosque de Galería sólo el de las zonas bajas, circundado por Bosque Tropical Caducifolio entre los 1400 y 1500 m con una superficie aproximada entre 30 y 50 ha). Fue un total de 18 senderos, cada uno con una longitud de 200 m y seis de ancho, con un límite de altura de observación de 1,80 m, en cada uno de los cuales tres personas realizaron recorridos de las 20:00 h a las 00:00 h y durante tres noches, tres senderos por noche, siendo un total de 864 horas/persona para todo el estudio (4 h x 72 noches x tres personas) (Tabla 1). Los anuros fueron detectados usando simultáneamente métodos de encuentro visual y auditivo (Crump y Scott 1994, Luna-Gómez et al. 2017), con la finalidad de realizar un inventario más completo; los individuos que no fue posible identificar a nivel de especie en campo, se capturaron para su identificación y fueron liberados al día siguiente. La nomenclatura de las especies fue cotejada en ITIS (c2021).
Tabla 1 Esquema de muestreo de anfibios por tipo de vegetación en el Área Natural Protegida Sierra de Quila.
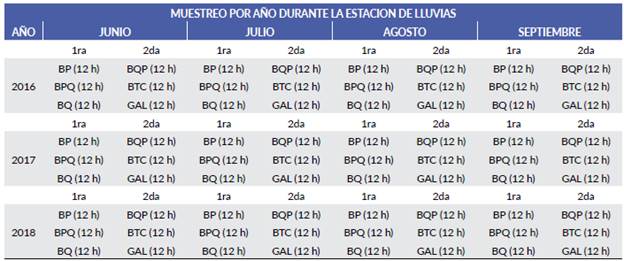
BP= Bosque de pino; BPQ= Bosque de pino-encino; BQ= Bosque de encino; BQP = Bosque de encino-pino; BTC = Bosque tropical caducifolio; GAL = Bosque de Galería. 1ra= primera quincena del mes, 2da= segunda quincena del mes, el número de horas empleadas en tres transectos por tres personas y por comunidad vegetal se indica entre paréntesis.
Categorías de microhábitats
En este estudio el microhábitat se refiere al sitio específico en donde un organismo está posado, dentro de un cuerpo de agua o áreas circundantes (Alfonso y Eterovick 2007). Se definieron ocho tipos de microhábitats, reconocidos como unidades naturales de muestreo. Los microhábitats registrados en los senderos fueron: suelo desnudo, planta/ herbácea, tronco/arbusto, pasto/agua, agua, roca, hojarasca y pastos.
Análisis de Datos
Con los datos de abundancia de las especies se realizó un análisis de predicción de riqueza con distintos estimadores no paramétricos mediante el uso del programa EstimateS 9.1 (Colwell c2019), con la finalidad de conocer el grado de completitud del muestreo. De igual manera se realizaron los análisis correspondientes a diversidad mediante el índice de Shannon-Wiener por tipo de vegetación usando el programa PAST 4.03 (Hammer et al. 2001), así como un análisis de semejanza de Bray-Curtis entre estos, para lo cual se usó el programa PC-ORD V 5.1 (McCune y Mefford 2006), adicionalmente, por tipo de vegetación, se exploró el modelo Gaussiano de distribución de las especies a lo largo del intervalo de elevación mediante el uso del programa PAST 4.03. Finalmente, se realizó una prueba de bondad de ajuste de X2 para conocer si existe una distribución aleatoria de las especies de anuros con respecto al micro-hábitat (Zar 2014).
RESULTADOS
Riqueza, abundancia y diversidad de especies por tipo de vegetación
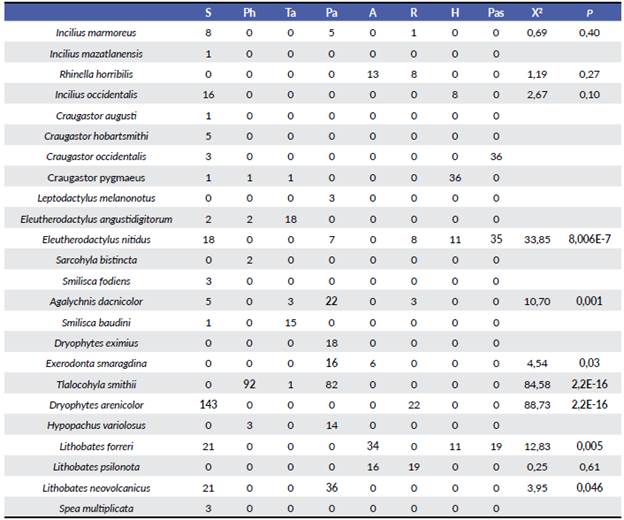
Se registraron un total de 1003 individuos de 24 especies, las cuales representan entre 94,3 % (Bootstrap) y 100 % (Chao1, Chao2 y Jackknife 1) de la riqueza esperada para el área total por los distintos estimadores. Cuatro de ellas se encuentran en la NOM-059-SEMARNAT-2010, bajo alguna categoría de riesgo (Exerodonta smaragdina (Taylor, 1940)), endémica, sujeta a protección especial; Sarcohyla bistinta (Cope, 1877), endémica, sujeta a protección especial; Lithobates forreri, (Boulenger, 1883), no endémica, sujeta a protección especial y Lithobates neovolcanicus (Hillis & Frost, 1985) endémica, amenazada. Con respecto a las proporciones de los individuos encontrados, el 15 % corresponde a Dryophytes arenicolor (Cope, 1866) con 152 individuos, el 13 % a Eleutherodactylus nitidus (Peters, 1870), con 128, el 8 % a Lithobates neovolcanicus con 79 ejemplares y el 7 % a Eleutherodactylus angustidigitorum (Taylor, 1940) con 71 organismos; estas cuatro especies representaron el 43 % del total de los anuros en el área, el restante 57 % correspondió a las otras 20 especies (Tabla 2).
El análisis de diversidad por tipo de vegetación reveló que es en bosque tropical caducifolio y bosque de galería donde se obtuvo el valor más alto, mientras que en el bosque de encino pino y bosque de pino se obtuvieron los valores menores. Los valores de diversidad no fueron estadísticamente diferentes entre el bosque de galería y el bosque tropical caducifolio, ni entre el bosque de encino y el bosque de pino encino, al igual que entre el bosque de encino pino y bosque de pino (Fig. 2). Por otra parte, el análisis de semejanza de Bray-Curtis indica que el bosque de encino pino y el bosque de encino son los más semejantes (74 %), seguidos del bosque de galería y el bosque tropical caducifolio (70 %), en cambio, el bosque de galería y el bosque de pino encino son los que menor semejanza presentaron (17 %). Llama la atención que el bosque de pino tiene semejanza únicamente con el bosque de pino-encino en un 47 % (Tabla 3). Las curvas de distribución de las especies con respecto al intervalo altitudinal, muestran un primer grupo (Fig. 3a), que corresponde con las doce especies que se distribuyen preferentemente en Bosque de galería y Bosque tropical caducifolio (l400-l500 m) ellas son: Incilius marmoreus, Incilius mazatlanensis, Rhinella horribilis, Spea multiplicata, Agalychnis dacnicolor, Exerodonta smaragdina, Smilisca baudini, Smilisca fodiens, Tlalo-cohyla smithii, Leptodactylus melanonotus, Lithobates forreri y Lithobates psilonota; otro grupo de especies con distribución un poco más amplia, pero que tienden a presentar sus máximos hacia la parte baja del intervalo y a partir de la cota de los l600 son: Hypopachus variolosus, Incilius occidentalis, Dryophytes arenicolor, Sarcohyla bistincta, Lithobates neovolcanicus, Craugastor occidentalis, Craugastor hobartsmithi y Eleutherodactylus ni-tidus. La especie que muestra la mayor tolerancia en su distribución es Dryophytes eximius, que fue registrada en bosque tropical caducifolio al igual que en el bosque de pino-encino, aunque no se registró en las cotas intermedias, no sería extraño asumir que se encuentra presente prácticamente en todo el intervalo. Finalmente, en la cota de los 2100, en orden de abundancia, se encuentran las especies Eleutherodactylus angustidigitorum, Craugas-tor pygmeus y Craugastor augusti (Fig. 3b), aunque esta última especie sólo contó con cuatro individuos en bosque de pino y dos en bosque de pino-encino.
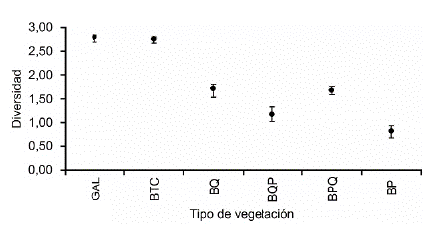
Figura 2 Valores de diversidad de Shannon-Wiener de anuros por tipos de vegetación en la Sierra de Quila. GAL= Bosque de galería, BTC= Bosque tropical caducifolio, BQ= Bosque de encino, BQP= Bosque de encino-pino, BPQ= Bosque de pino-encino, BP= Bosque de pino. Los puntos representan el valor de diversidad para el tipo de vegetación dado, las líneas representan el intervalo de confianza con P=0,05.
Tabla 2 Número de individuos observados por especie y por tipo de vegetación en la Sierra de Quila: GAL= Bosque de galería, BTC= Bosque tropical caducifolio, BQ= Bosque de encino, BQP= Bosque de encino-pino, BPQ= Bosque de pino-encino, BP= Bosque de pino.
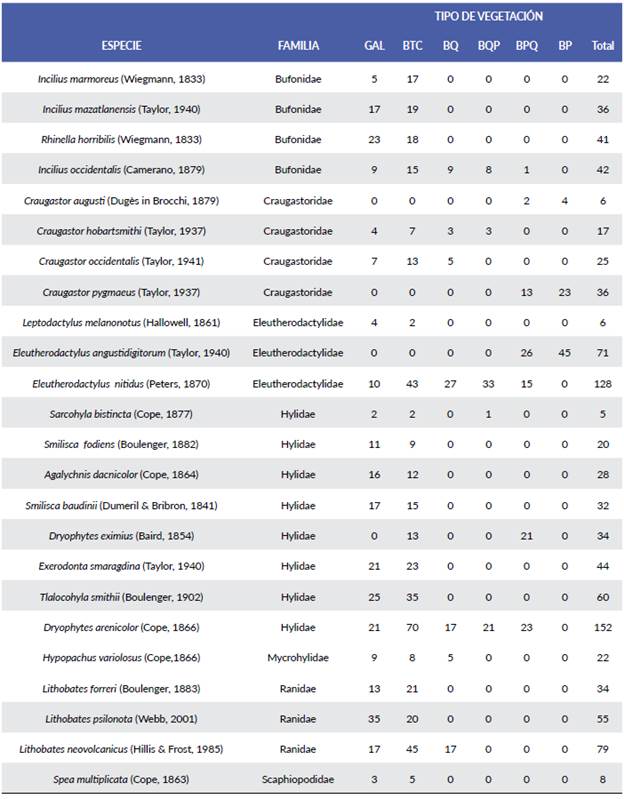
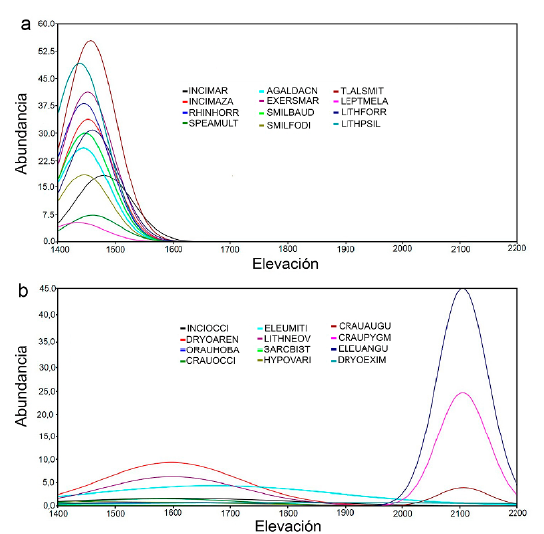
Figura 3 Distribución de las especies de anuros en el intervalo altitudinal de los sitios muestreados en la Sierra de Quila.
Tabla 3 Valores de semejanza entre los tipos de vegetación de la Sierra de Quila, con datos de abundancia de especies de anuros. En negritas están los dos pares de tipos de vegetación que mayor semejanza mostraron y el par de tipos de vegetación que menor semejanza mostró.
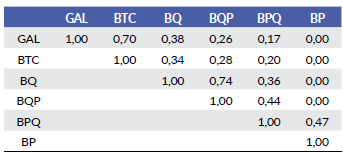
GAL= Bosque de galería, BTC= Bosque tropical caducifolio, BQ= Bosque de encino, BQP= Bosque de encino-pino, BPQ= Bosque de pino-encino, BP= Bosque de pino.
Riqueza y abundancia de especies por microhábitat
La comunidad de anuros hace uso de ocho tipos de micro-hábitats donde el suelo es uno de los más usados registrado en 16 especies, principalmente en las veredas y caminos de terracería dentro de los trayectos situados en cada tipo de comunidad vegetal. La abundancia de individuos también fue mayor en el suelo, seguido de pasto/agua, donde se localizaron nueve especies y 231 individuos; por otro lado, los espacios con menor número de especies fueron agua y hojarasca con cuatro especies en ambas (69 y 66 individuos respectivamente). Sin embargo, únicamente siete de las 24 especies exhibieron una distribución no aleatoria, es decir, su presencia en el microhábitat dado es mayor que la esperada por azar, de acuerdo con la prueba de bondad de ajuste de X2: Agalychnis dacnicolor, Exerodonta smaragdina y L. neovolcanicus en pasto/agua; Dryophytes arenicolor en suelo; Tlalocohyla smithii en planta herbácea; Eleutherodactylus nitidus en pasto y Lithobates forreri en agua (Tabla 4).
DISCUSIÓN
Riqueza, abundancia y diversidad de especies por tipo de vegetación
La riqueza total encontrada en el ensamble de anuros de la Sierra de Quila para el periodo de lluvias comprendido entre junio y septiembre fue de 24 especies, en contraste con el estudio de Santiago-Pérez et al. (2011), que reporta 22 especies, las dos especies adicionales en el presente trabajo son: Incilius mazatlanensis y Spea multiplicata, esta diferencia puede deberse a que los autores antes mencionados realizaron búsqueda directa de organismos como método, mientras que en el presente trabajo fue muestreo sistematizado con esfuerzo constante y mediante dos métodos: encuentro visual y auditivo. Con base en los estimadores de riqueza se infiere que el muestreo es representativo y a pesar de que existe una ligera diferencia entre los estimadores, ésta no es significativa, ya que en término de número de especies representa una sola especie. Sin embargo, se podría esperar la incidencia de otras especies en otras épocas del año.
El número de especies resulta importante para la zona, ya que se encuentran 24 de las 38 especies de anuros reportadas para Jalisco (Parra-Olea et al. 2014). Debido a que las comunidades de vegetación secundaria y áreas de cultivo al interior de la reserva no fueron consideradas para este estudio, cabe la posibilidad de encontrar otras especies, de hecho, nuestros muestreos fueron nocturnos, por lo que se esperaría que al realizar muestreos diurnos podría verse incrementada la lista de especies. Es importante señalar que se encontraron las especies Lithobates neovolcanicus, Plectrohyla bistincta, Exerodonta smaragdina, y Litho-bates forreri las cuales se encuentran en la lista de especies o poblaciones de flora y fauna silvestres en riesgo en la República Mexicana conocida como NOM 059-SEMAR-NAT-2010 (SEMARNAT c2010).
Los sitios con mayor riqueza y abundancia fueron el Bosque tropical caducifolio con 21 especies y 412 individuos, lo que concuerda con lo encontrado por Chávez-Ávila et al. (2015), quienes argumentan que en la revisión para el estado de Jalisco, es en el bosque tropical caducifolio donde se encuentra la mayor riqueza y abundancia; en seguida el bosque de galería (con 20 especies y 269 individuos), esto puede deberse a que , los hábitats riparios como el bosque de galería, son cruciales para los anfibios en los diferentes estados de su ciclo de vida Olson et al. (2007). De acuerdo con Parra Olea et al. (2014), las familias Craugastoridae y Eleutherodactylidae, son las únicas familias de ranas y sapos en México en las que algunas especies presentan desarrollo directo, de las 20 especies que se encuentran en el bosque tropical caducifolio y bosque de galería, solo 4 podrían ser hasta cierto punto independientes de las corrientes de agua ya que pertenecen a dichas familias, sin embargo, les es de vital importancia para otras actividades tales como esconderse de depredadores, conseguir pareja, etc. Por otro lado, las tres especies que se distribuyen en bosque de pino-encino y bosque de pino, pertenecen a estas mismas familias (Craugastor augusti, C. pygmaeus y Eleutherodactylus angustidigitorum), por lo que no se descarta la noción de que su dependencia a corrientes de agua sea menor, ya que de hecho se les registró en arroyos intermitentes.
Las especies difieren en cuanto a cómo utilizan los hábitats riparios y terrestres; por ejemplo, algunas ranas del género Pristimantis en Ecuador, ponen sus huevos en hábitat terrestres, mientras que todas las ranas centrolénidas y muchas hílidas requieren charcas para su reproducción y la mayoría de las especies son dependientes de ambientes acuáticos al menos en alguna etapa de su ciclo de vida; como resultado de esto, la diversidad y abundancia es con frecuencia mayor en áreas de vegetación riparia, lo que concuerda con nuestros resultados y refuerza lo encontrado por Jongsma et al. (2014), quienes encontraron también que de todos los tipos de hábitat estudiados, fueron los hábitats riparios los que presentaron mayor riqueza.
Por otra parte, la abundancia de los individuos no es homogénea entre las diferentes comunidades vegetales, ya que, entre los tropical caducifolio, bosques de galería y de pino-encino suman el 78 % de la abundancia total de las especies, esto es 782 individuos. El 22 % restante corresponde a las otras tres comunidades con un total de 221 individuos, otro hecho interesante, es que el bosque de pino es el tipo de vegetación con menor riqueza de especies (3), sin embargo, en este tipo de vegetación se encuentra Eleutherodactylus angustidigitorum que junto con Craugastor pygmaeus presentan la mayor abundancia solo después de Dryophytes arenicolor, esta última presente prácticamente en todo el intervalo altitudinal.
Riqueza, abundancia de especies y uso de microhábitat
Los anuros usualmente utilizan los microhábitats disponibles para llevar a cabo las diferentes actividades, como lo son cantar, reproducirse, cazar (Luna-Gómez et al. 2017), aunque tienen una fuerte dependencia del agua, sobre todo cuando existe actividad reproductiva de muchas especies (Duellman y Lizana 1994, Bevier 1997, Yanosky et al. 1997, Marsh 2000). De acuerdo con Santos-Barrera (2014), en el norte de México durante la noche, es posible encontrar individuos adultos de Incilius occidentalis adyacentes a manantiales permanentes o temporales y ríos bajos, comúnmente escondidos debajo de los arbustos y en las raíces; parece evitar estanques y charcas permanentes, en la temporada de lluvias (Julio a septiembre), se pueden observar agregaciones de sapos a lo largo de las orillas de los ríos, casi siempre en el suelo, debajo de rocas y troncos y/o excavación en agujeros en el suelo, lo que coincide con el presente trabajo ya que 16 individuos de esta especie fueron encontrados en suelo y ocho en hojarasca.
En el presente trabajo se observó que los microhábitats más utilizados son el suelo desnudo (16 especies), junto con agua/ pasto (nueve especies) y agua (seis especies), entre las que destaca Eleutherodactylus nitidus que utilizó cinco de los ocho microhábitats disponibles, con una marcada frecuencia en el pasto y el suelo, en contraparte se registraron 18 individuos de Dryophytes eximius en un solo microhábitat (pasto/agua), a este respecto, cabe mencionar que Hernández-Salinas et al. (2018), encontraron que el material vegetal consumido por las hembras y machos de esta especie era alto, lo que sugiere que este tipo de alimento es una parte intencional de su dieta, de igual manera aseveran que el desarrollo larvario ocurre durante el período de mayor precipitación (julio y septiembre), lo que podría explicar la frecuencia de la especie en este tipo de microhábitat. Por su parte Duellman (1988), apunta que incluso la mayoría de las ranas que se reproducen en hábitats terrestres ocurren en áreas húmedas, mientras que Landeiro et al. (2014), puntualizan que las especies con reproducción acuática responden fuertemente a condiciones ambientales, principalmente la distancia a la fuente de agua más cercana, lo que indica que los cambios en la disponibilidad de tales fuentes afectarán su ocupación del paisaje. Se observó también un mayor uso de ciertos microhábitats en otras ocho especies, tal como el caso reportado por Burbano-Yandi et al. (2015), quienes estudiaron cinco especies en Colombia para determinar la afinidad por el microhábitat, encontraron que Craugastor raniformis, Rhinella alata y Engystomops pustulosus, estuvieron asociadas a la hojarasca; Colostethus pratti, a zonas rocosas, mientras que Hypsiboas boans, a las hojas de hierbas y arbustos.
Del total de especies de anuros encontradas, 16 de ellas se localizaron sobre el suelo desnudo, similar a lo señalado por Muñoz-Guerrero et al. (2007), quienes afirman que es una característica del ensamblaje de ranas neotropicales de bajas altitudes como los bufónidos y leptodactílidos, que hacen uso del suelo para llevar a cabo varias de sus actividades, sin embargo, Dryophytes arenicolor fue la única especie que mostró valores significativos en la preferencia por el suelo. Hallazgos similares encontraron Beard et al. (2003) con Eleutherodactylus coqui en Puerto Rico.
Cabe señalar que, de las 24 especies, sólo siete mostraron distribución no aleatoria en los microhábitats, sin embargo, de las 17 restantes, solo en cuatro se obtuvieron los registros que requiere la prueba de bondad de ajuste y resultó no significativa; éste hecho podría indicar que la selección y uso de los microhábitats por estas cuatro especies, podría reflejar más eventos conductuales que fisiológicos y los cuales se manifiestan en los periodos de actividad. Esto también fue observado por Suazo-Ortuño et al. (2015). Es importante señalar que en el presente trabajo no se puede hablar de preferencias de microhábitat, ya que no se evaluó la disponibilidad de éstos para las especies. Finalmente, este es el primer trabajo en su tipo para el área de estudio, y hace evidente la necesidad de evaluar la disponibilidad de los microhabitats para conocer su preferencia por parte de las especies de anuros, así como continuar con un registro sistemático permanente y estudios de demografía de las poblaciones, sobre todo de aquellas catalogadas en alguna categoría de riesgo, con la finalidad de obtener información que permita en el mediano plazo establecer su estado de conservación así como sus riesgos.