INTRODUCCIÓN
El estudio de la variación temporal y espacial de las comunidades biológicas provee información primaria necesaria para entender los patrones de coexistencia e interacción de especies en una taxocenosis (Sandvik et al. 2002). Analizar y estimar la abundancia de especies es una tarea frecuente en el manejo y una perspectiva importante para la conservación de la vida silvestre, pues indica el estado de una población en un momento dado, permitiendo comparar con otras poblaciones y revelar fluctuaciones en el tiempo (Lips et al. 1999, Ponssa 2004).
La fenología individual de las especies desempeña un papel importante en los tiempos de reproducción y en la actividad estacional; en este sentido, la estacionalidad en un ambiente dado puede influir en los valores climáticos como, por ejemplo, la temperatura, humedad y precipitación, lo que repercute en los patrones de actividad y abundancia de las especies (Martori et al. 2005). En ese contexto, la distribución, abundancia y composición de los ensambles de especies en la comunidad, se ven condicionadas por factores ambientales, que inciden en la heterogeneidad del paisaje, vista como estructura vegetal, y disponibilidad de recursos como el alimento y los refugios que pueden usar las especies (Neave et al. 1996, Parris 2004).
Por otro lado, las diferencias en los periodos y modos reproductivos entre especies influyen en la dinámica de los ensambles debido a fluctuaciones temporales en la estructura de las poblaciones y consecuentemente en las abundancias de las especies (Prado et al. 2005, da Rosa et al. 2006). Estas variaciones estructurales determinan diferentes conformaciones en la composición de los ensambles, con diferentes grupos etarios o distintas proporciones de sexos de cada especie, interactuando y actuando sobre los recursos (Barbault 1991, Menin et al. 2008).
De este modo, la estructura y dinámica de los ensambles son el resultado de una serie de variables que pueden verse afectadas por cambios climáticos y condiciones microambientales de un determinado lugar (López et al. 2011, Zaracho y Lavilla 2015). Además, el conjunto de micro-hábitats utilizados por diferentes especies, o incluso por diferentes grupos etarios de una especie, son consecuencia de las necesidades fisiológicas de los animales y sus interacciones dentro del ecosistema (Zweimüller 1995). Todos estos aspectos hacen imprescindible el conocimiento y análisis de las relaciones entre las poblaciones de las especies y su dinámica poblacional, con respecto a las condiciones climáticas de los lugares que habitan.
Existen diversos estudios a nivel mundial sobre monitoreo y abundancia de anuros (Duellman 1995, Knutson et al. 1999, Donnelly et al. 2001, Gutiérrez-Lamus et al. 2004, Parris 2004, Cortez-Fernandez 2006, Moreira et al. 2008, Cáceres-Andrade y Urbina-Cardona 2009, Bardier et al. 2014, entre otros) y algunos han analizado las variaciones de abundancia en ensambles de anuros en Argentina (Sánchez et al. 2007, Bionda et al. 2011a, López et al. 2011). Como complemento de las investigaciones previas, para contribuir a la implementación de medidas de conservación en el Área Protegida Parque Natural Valle Fértil, y ante la necesidad de evaluar la respuesta de los anuros Chaqueños a factores abióticos en un escenario de cambio climático, este estudio plantea como objetivos: 1-Conocer la estructura espacio-temporal de un ensamble de anuros del Chaco Serrano en el centro-oeste de Argentina, y 2-Comparar parámetros demográficos entre dos periodos de estacionalidad e identificar la influencia de factores climáticos sobre estos parámetros.
MATERIALES Y MÉTODOS
Los muestreos se realizaron en Valle Fértil, San Juan, Argentina (30°42' Sur, 67°29' Oeste, 1020 m de altitud), Ecorregión del Chaco Serrano (Figs. 1a y b). La temperatura media anual histórica es de 19,5 °C. El mes más cálido es enero, con 26 °C, mientras que el más frío es julio, con 11 °C. El régimen de precipitaciones es estival, con medias anuales que superan los 400 mm. El área se caracteriza por un relieve quebrado debido a la presencia de cordones montañosos de la Sierra de Valle Fértil y de La Huerta (hasta 2600 m), subsistemas orográficos pertenecientes a las Sierras Pampeanas, con suelos rocoso-pedregosos, algunos sectores con sedimentos de origen fluvio-lacustres, formados por materiales finos. Hidrológicamente, el área posee una amplia red de cursos de agua temporales que en general se dirigen por las laderas de las sierras y otros semipermanentes en los valles, cuyos regímenes hídricos son de alimentación pluvial. Fitogeográficamente, el área se caracteriza por bosques y matorrales serranos con una gran diversidad de especies arbóreas, arbustivas y herbáceas características del Chaco Serrano y del Cardonal como: Schinopsis haenkeana (Engl.), Aspidosperma quebracho-blanco (Schltdl.), Prosopis alba (Griseb.), P. chi-lensis (Molina) Stuntz emend. Burkart, Celtis tala (Gillies ex Planch.), Acacia visco (Lorentz ex Griseb.), Trichoce-reus terscheckii (Parm. ex Pfeiff.) Britton & Rose, Tessaria absinthioides (Hook. et Arn.) DC, T. dodoenifolia (Hook. et Arn.) Cabrera, Eupatorium arnottianum (Griseb.) entre otras (Márquez 1999, Brown y Pacheco 2006, Dalmasso et al. 2007, Márquez et al. 2014).
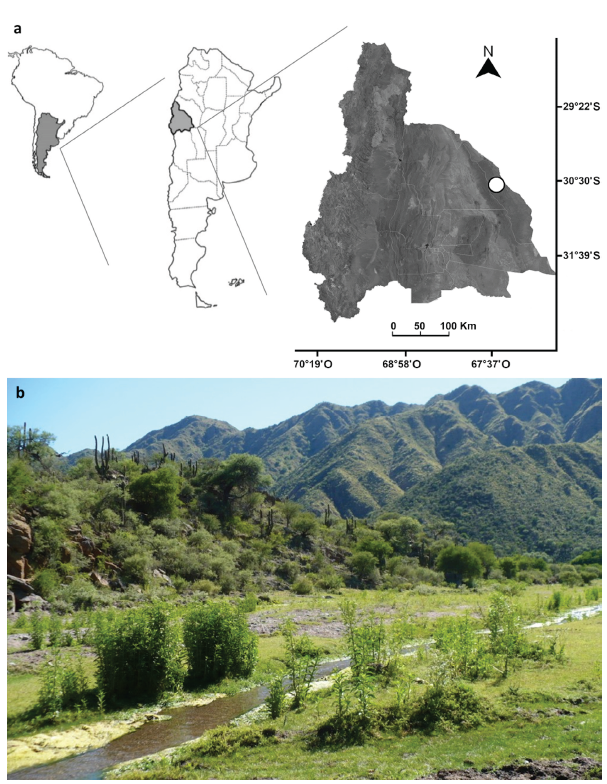
Figura 1 Área de estudio. a. Localización del sitio de estudio (círculo blanco) en San Juan, Argentina. b. Imagen del sitio de muestreo.
Para estimar la abundancia de especies de anfibios se llevaron a cabo 14 muestreos, de octubre de 2012 a febrero de 2015, considerando para ello los meses de mayor actividad de las especies (desde octubre hasta abril). Los muestreos fueron sistemáticos, estableciéndose 26 transectos de 50 m de largo x 5 m de ancho, separados por 200 metros cada uno para garantizar la independencia de las muestras. Los transectos se establecieron al azar sobre el lecho del río, a ambas márgenes del cauce o en zonas periféricas propensas a inundación. En cada muestreo, de dos noches, se realizaron caminatas en los transectos, respetando siempre la misma dirección y sentido evitando así registrar un individuo más de una vez, en un horario de las 21:00 a las 05:00 hrs, cubriendo las horas de actividad de los anuros. La técnica de relevamiento fue por encuentro visual, mediante capturas manuales, para contar y registrar los ejemplares (Heyer et al. 2001). Cada anuro fue identificado por su especie, sexo y grupo etario según caracteres sexuales y morfológicos externos como la longitud hocico cloaca (LHC), diferencias de coloración, entre otros rasgos distintivos (Cei 1980, Peltzer y Lajmanovich 2007, Rodriguez Muñoz et al. 2019) (Fig. 2). Las larvas y puestas halladas no fueron tenidas en cuenta en los registros.

Figura 2 Especies estudiadas del ensamble. a. Rhinella arenarum arenarum. b. Pleurodema tucumanum. c. Leptodactylus luctator. Arriba hembras, abajo machos.
Para establecer relaciones entre la abundancia de especies y las variables ambientales a lo largo del tiempo, se obtuvieron valores diarios de temperatura mínima, temperatura máxima, temperatura media, velocidad del viento, precipitación, presión atmosférica y humedad relativa, correspondientes al sitio exacto de muestreo. Los datos fueron obtenidos de la base de datos disponible en la página web de la NASA (http://power.larc.nasa.gov/) para el período comprendido entre octubre de 2012 y febrero de 2015.
Con el fin de comparar y determinar variaciones en la abundancia de especies, se establecieron dos periodos de análisis: estación Seca, desde octubre de 2012 a diciembre de 2013 y estación Lluviosa, a partir de febrero de 2014 a febrero de 2015. Las variaciones de la abundancia relativa se analizaron mediante un ANOVA factorial, donde los factores fueron la estación: seca o lluviosa, la especie: Rhinella arenarum arenarum (Hensel, 1867) (Fig. 2a), Pleurodema tucumanum (Parker, 1927) (Fig. 2b) o Leptodactylus luctator (Steffen, 1815) (Fig. 2c); y el sexo: macho o hembra. Además, se realizaron pruebas de bondad de ajuste Chi Cuadrado con base en proporciones, para probar las siguientes hipótesis nulas: a) la frecuencia de ocurrencia de cada especie no cambia con el tiempo, b) la frecuencia de ocurrencia de machos no difiere de la de hembras en cada estación y c) la proporción relativa (porcentaje) de cada especie por muestra no difiere con respecto al resto del ensamble.
Para ordenar e identificar relaciones entre las variables ambientales, la abundancia relativa de las especies y las estaciones, se utilizó un análisis de redundancia (RDA), técnica de ordenamiento multivariada basada en matrices de correlación. En el análisis se probó la significancia de las variables ambientales en la explicación de la abundancia de las especies a través del procedimiento de Monte Carlo, con 1000 permutaciones. Las pruebas estadísticas se realizaron mediante el software R versión 3.3.3 (R Core team c2017), con un nivel de significancia de 0,05.
RESULTADOS
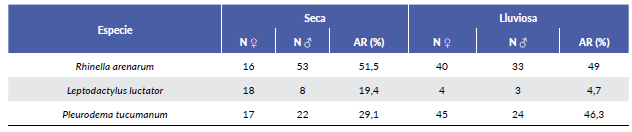
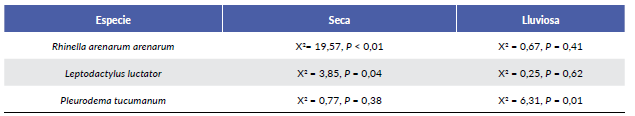
Las especies registradas fueron: Rhinella arenarum are-narum (Bufonidae), Leptodactylus luctator (Leptodac-tylidae) y Pleurodema tucumanum (Leptodactylidae) (Fig. 2). Durante ambas estaciones R. arenarum arenarum resultó la especie más abundante del ensamble, seguida por P. tucumanum y L. luctator, respectivamente (Tabla 1, Fig. 3). Se detectaron diferencias en la abundancia de las especies en ambas estaciones, así como entre machos y hembras de cada especie durante las dos estaciones, existiendo interacciones significativas entre estos factores (F = 5,24; P = 0,005) (Fig. 4). R. arenarum arenarum mantuvo una abundancia alta en ambas estaciones, P. tucumanum aumentó su abundancia en la estación lluviosa y L. luctator presentó una abundancia baja, disminuyendo aún más durante la estación lluviosa (Tabla 1, Fig. 3). Las proporciones de cada especie respecto a las otras mostraron diferencias en ambas estaciones de estudio (Seca: X2 = 21,62; GL = 2; P < 0,001; Lluviosa: X2 = 54,78; GL = 2; P < 0,001). Por otro lado, en la estación seca R. arenarum arenarum y L. luctator presentaron diferencias significativas en las proporciones de sexos (Fig. 5a, Tabla 2), mientras que en la estación lluviosa sólo P. tucumanum mostró diferentes frecuencias entre sexos (Fig. 5b, Tabla 2). El análisis de proporciones de sexos entre las especies del ensamble arrojó diferencias significativas en ambas estaciones (Seca: X2 = 56,09; GL = 5; P < 0,001; Lluviosa: X2 = 64,60; GL = 5; P < 0,001). La estación seca se caracterizó por una mayor abundancia de machos mientras que durante la estación lluviosa hubo una mayor abundancia de hembras de las tres especies.
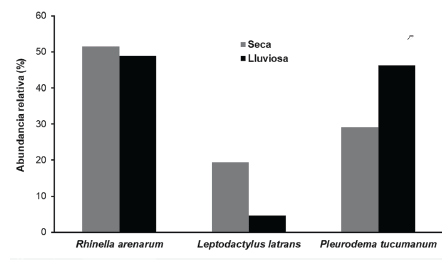
Figura 3 Abundancia relativa de las especies - del ensamble de anuros del Chaco Serrano de Argentina, durante las dos estaciones.
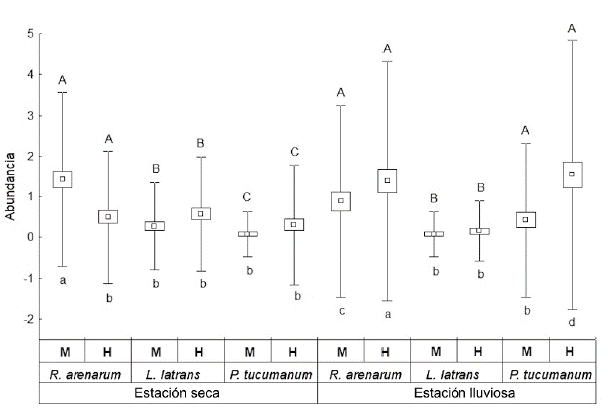
Figura 4 Variaciones en la abundancia del ensamble del Chaco Serrano de Argentina, por especie, sexo y estación (Media ± ES; bigotes: máximos y mínimos). Letras mayúsculas distintas indican diferencias significativas entre especies. Letras minúsculas distintas indican diferencias significativas entre sexos. H= hembras, M= machos.
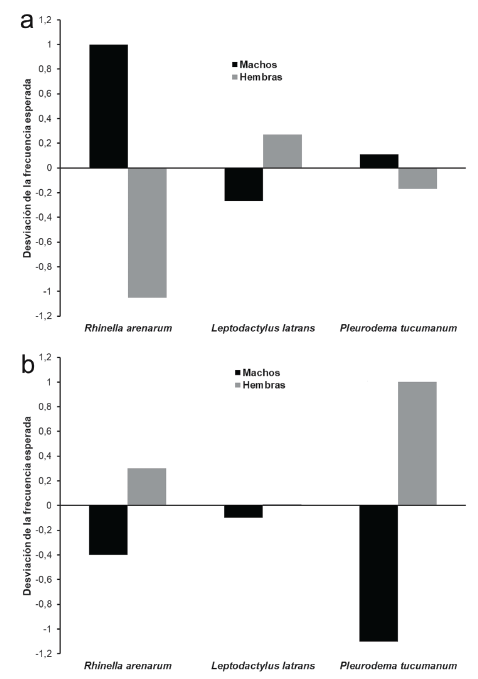
Figura 5 Desviación de las frecuencias de ocurrencia para ambos sexos de cada especie de anuro del Chaco Serrano de Argentina. a. Estación seca. b. Estación lluviosa.
Tabla 1 Cantidad de individuos por estación y sexo y abundancia relativa (AR) de cada una de las especies del ensamble.
En cuanto a las variables climáticas, el análisis de RDA mostró que la temperatura mínima (Media = 15,7 °C; P = 0,001; Autovalores: RDAl: 0,75; RDA2: 0,11) y las precipitaciones (total acumulado en el periodo de estudio: 299,3 mm; máximo diario registrado: 48,6 mm; P = 0,004; Autovalores: RDA1: 0,32; RDA2: -0,37) mostraron diferencias entre especies, explicando el modelo el 59 % de la varianza. La temperatura mínima y la precipitación resultaron ser influyentes solo en la abundancia de Pleurodema tucumanum. Las abundancias de Rhinella arenarum arenarum y de Leptodactylus luctator no reflejaron relación con ninguna de las variables climáticas. Asimismo, no se pudieron observar relaciones claras entre las estaciones de estudio y la abundancia de especies (Fig. 6).
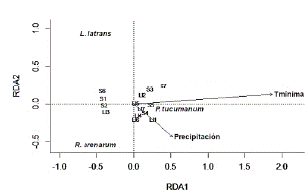
Figura 6 Diagrama de ordenación del análisis de redundancia RDA basado en la abundancia de especies del ensamble de anuros del Chaco Serrano de Argentina explicada por variables ambientales y estaciones de estudio (S= seca, Ll= lluviosa, números del 1 al 7 corresponden al número de muestreo). Los vectores indican las variables ambientales influyentes.
DISCUSIÓN
Las fluctuaciones estacionales en la actividad de las especies y la estructura de la comunidad es una característica reconocida de los ensambles de anfibios (Bertoluci 1998, Canavero et al. 2009, Sánchez et al. 2009). El mayor número de individuos y nivel de actividad del ensamble desde la primavera tardía hasta el final del verano reflejan la mayor actividad asociada al período reproductivo, que en gran parte de los anuros de zonas templadas se extiende desde fines de agosto hasta mediados de abril (Peltzer y Lajmanovich 2007). Esto indica que los patrones de actividad y ciclos reproductivos juegan un papel importante en la estructura temporal de ensambles (Martori et al. 2005).
La alta y constante abundancia de Rhinella arenarum are-narum durante ambas estaciones y su amplio patrón de distribución en Argentina y Sudamérica (Frost 2020) son consecuencia de su exitoso modo reproductivo, que exhibe un ciclo prolongado y continuo, alta fecundidad y sobrevivencia de huevos y larvas (Bionda et al. 2011b, Quiroga y Sanabria 2012, Hidalgo 2016). En esta especie fue notable la inversión de las proporciones de sexos, siendo más abundantes los machos durante la estación seca, y las hembras en la estación lluviosa. Por otro lado, Leptodactylus luctator fue escasa y fluctuante en este ambiente Chaqueño, resultados que difieren de lo registrado en un humedal del tramo inferior del río Paraná, donde L. luctator estuvo presente todo el año y representó el 69,42 % de abundancia relativa de la comunidad de anuros (Sánchez et al. 2007, López et al. 2011). Estas discrepancias pueden deberse a que se trata de ecorregiones distintas, presentando la última una estacionalidad menos marcada en cuanto a temperatura ambiental y mayor disponibilidad de recursos.
La modificación del hábitat debido a eventos catastróficos puede ser uno de los factores que influye sobre la abundancia relativa de las especies (Bustamante et al. 2005). En este sentido, las variaciones detectadas en nuestro estudio podrían relacionarse con los eventos climatológicos sucedidos en febrero de 2014 (estación lluviosa), que presentaron altas precipitaciones (185,9 mm mensuales) y consecuentemente crecidas del caudal del río que arrasaron y modificaron considerablemente el hábitat. Este hecho, en consecuencia, afectó la abundancia y distribución de los anuros del ensamble, sobre todo a L. luctator que utiliza mayormente ambientes acuáticos (Nieva Cocilio et al. 2020) y luego de estos eventos solo se hallaron siete individuos. No obstante, también es posible que las disminuciones en abundancia entre dos periodos sólo se deban a fluctuaciones corrientes de las poblaciones, sin implicar necesariamente una declinación poblacional a futuro (Pechmann y Wilbur 1994, Bustamante et al. 2005).
Tabla 2 Pruebas de Chi cuadrado, para cada contraste de proporciones de sexo por especie y por estación. GL=1 para todos los casos.
La temperatura mínima como variable ambiental significativa en la actividad de Pleurodema tucumanum reviste importancia biológica dado que la mayoría de los anfibios tienen una tendencia termoconfomista, es decir que su temperatura corporal se correlaciona fuertemente con la temperatura del aire o del sustrato (Lambrinos y Kleier 2003). En este sentido, la temperatura mínima estaría regulando la actividad de esta especie. En el campo pudimos observar que P. tucumanum inició su actividad a fines de octubre principios de noviembre, cerca del comienzo del verano, cuando la temperatura ambiental era más cálida. A diferencia de las otras especies la actividad de P. tucumanum disminuía en noches frías, cuando la temperatura del aire descendía por debajo de los 15 °C. Además, se ha registrado que esta especie ocupa cuerpos de agua de manera oportunista para reproducirse, pero refleja una preferencia específica por sitios con suelo desnudo, que presentan menor inercia térmica que otros sustratos y por consiguiente su temperatura desciende con mayor rapidez durante la noche (Nieva Cocilio et al. 2020). Por otro lado, Zug et al. (2001) propusieron que individuos de pequeño tamaño o en estadios tempranos de desarrollo deben tener una temperatura corporal mayor que individuos más grandes, otra explicación congruente con nuestros resultados ya que P. tucumanum es la especie más pequeña del ensamble y los adultos poseen un tamaño corporal que no supera los 45 mm (Nieva Cocilio et al. 2020). Los resultados de nuestro estudio concuerdan con Hamann y Kehr (1998), Boone y Krohn (2000), Oseen y Wassersug (2002), Parris (2004), Martori et al. (2005), Iturra-Cid et al. (2014), Rodriguez Muñoz (2016) y Duarte-Ballesteros et al. (2021), en cuanto a que la temperatura influye significativamente en la distribución, abundancia y ciclos reproductivos de especies de anuros.
La influencia de las precipitaciones sobre P. tucumanum coincide con su aumento significativo de abundancia durante la estación de lluvias. Por el contrario, periodos prolongados de sequía o combinaciones extremas de alta temperatura y baja precipitación, podrían causar fuertes impactos en la fauna de anfibios (Merino-Viteri 2001, Ron et al. 2003), como se observó en esta especie durante la estación seca. Por otro lado, el aumento en la abundancia de P. tucumanum durante la estación lluviosa concuerda con el patrón de reproducción explosivo reportado por Rodriguez Muñoz et al. (2019), asociado al aumento en la disponibilidad de sitios de oviposición y condiciones ambientales apropiadas (Valetti et al. 2014, Schalk y Saenz 2015). Se ha observado que la permanencia de los sitios de canto y oviposición utilizados por los anuros también puede influir en sus respuestas a factores abióticos. Es así que las precipitaciones tienden a influir en especies que utilizan cuerpos de agua temporales, ya que su actividad depende de ese recurso efímero (Saenz et al. 2006, Steen et al. 2013). P. tucumanum utiliza cuerpos de agua temporales para armar su nido de espuma y se ha reportado que las hembras seleccionan los sitios de oviposición en función de factores como la profundidad del agua (Rodríguez et al. 2019), motivo por el cual las lluvias pueden estar asociadas significativamente con la actividad de la especie. Diversos autores hallaron asociaciones similares entre variables ambientales como la precipitación y la actividad de las especies de anuros (Toledo et al. 2003, Kopp y Eterovick 2006, Gomes dos Santos et al. 2007, Bionda et al. 2011a, Schalk y Saenz 2015).
Aunque las demás variables incluidas en el análisis no tuvieron asociaciones, el modelo resultó adecuado, debido a que con dos variables explicó el 59 % de la varianza. Al igual que en este estudio, otros trabajos hallaron diferencias interespecíficas en las respuestas a factores abióticos, revelando en algunas especies asociaciones significativas con determinadas variables ambientales y en otras no (Gottsberger y Gruber 2004, Shalk y Saenz 2015, Rodriguez Muñoz 2016). Por otro lado, algunos autores no encontraron relación entre la riqueza y abundancia de especies y las variables ambientales (Sánchez et al. 2007, Moreira et al. 2008).
Las respuestas de anuros a diferentes condiciones climáticas pueden ser flexibles cada año (Oseen y Wassersug 2002) exhibiendo diferencias entre épocas secas y húmedas (Marsh 2000). Por ende, consideramos importante aumentar la información sobre relaciones entre ensambles de especies y variables ambientales que tengan significado biológico, para poder así entender los patrones respuesta de las especies y las posibles implicancias sobre la conservación de la biodiversidad de anfibios.















