Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales
Print version ISSN 0370-3908
Rev. acad. colomb. cienc. exact. fis. nat. vol.35 no.134 Bogotá Jan./Mar. 2011
BIOQUÍMICA
1Grupo de Investigación Biología de Nutrientes, Línea Fauna Silvestre, Departamento de Biología, Universidad del Atlántico, Km. 7 Antigua Vía Puerto Colombia, Barranquilla, Colombia. Correo electrónico: edouglas09@hotmail.com
2Profesor-Becario Universidad del Tolima, Altos de Santa Helena, Ibagué, Colombia; Doutorando em Ciências Veterinárias, Programa de Pós-Graduação em Ciências Veterinárias, Universidade Federal de Lavras, Caixa Postal 3037-CEP 37200-000, Lavras, MG, Brasil.
Resumen
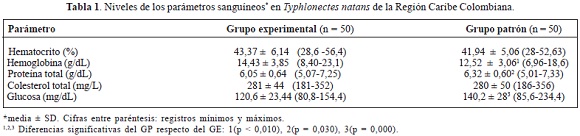
Se hacen los primeros reportes de la bioquímica sanguínea de T. natans para Colombia, relacionados con estrés fisiológico por contaminantes. Fue determinado el hematocrito por método convencional en el Grupo Patrón (GP): 41,94 ± 5,06%; y Grupo Experimental (GE): 43.37 ± 6,14% y por espectrofotometría la hemoglobina (GP: 12,52 ± 3,06 g/dL; GE: 14,43 ± 3,85 g/dL), proteínas totales (GP:6,32 ± 0,60 g/dL; GE: 6,05 ± 0,64 g/dL), colesterol tota (GP:280 ± 50 mg/dL; GE: 281 ± 44 mg/dL) y glucosa (GP: 140,25 ± 27,96 mg/dL; GE: 120,6 ± 23,44 mg/dL, ± SD). Los datos sugieren estrés por contaminantes en sinergia con otros factores como cambios térmicos.
Palabras clave: T. natans, bioquímica sanguínea, estrés fisiológico, Colombia.
Abstract
We report the first records of the blood parameters of T. natans for Colombia. The hematocrit was determined in standard group (GP): 41,94 ± 5,06% and experimental group (GE): 43.37 ± 6,14% by conventional method, and hemoglobin (GP:12,52 ± 3,06 g/dL; GE: 14,43 ± 3,85 g/dL), total proteins (GP:6,16 ± 0,60 g/dL; GE: 6,05 ± 6,36 g/dL), total cholesterol (GP:280 ± 50 mg/dL; GE: 281 ± 44 mg/ dL) and glucose (GP: 140,25 ± 27,96 mg/dL; GE: 120,56 ± 23,44 mg/dL, ± SD) by spectrophotometry. Our data suggest stress by pollutant agents in synergy with other factors as thermal changes.
Key words: T. natans, blood biochemistry, physiological stress, Colombia.
Introducción
La mayoría de las poblaciones en Colombia vierten sus desperdicios a los cuerpos de agua sin tratamiento alguno (Rueda-Almonacid et al., 2004). Salvo algunas excepciones, este es también el contexto en la región caribe, donde un caso representativo de dicha circunstancia es el complejo lagunar de Malambo, Atlántico, y en particular la ciénaga La Bahía. En este humedal son vertidos desechos sólidos y aguas residuales de origen industrial y doméstico provenientes de los municipios de Soledad y Malambo (PDMS, 2008). Estos vertimientos pueden afectar negativamente las diferentes formas de vida de este ecosistema.
En este sentido, entre los taxones sensibles a dicha contaminación están los anfibios, debido a que absorben por la piel algunas sustancias tóxicas (Willens et al., 2006), cuyos efectos pueden verse reflejados en los niveles de algún parámetro sanguíneo.
Concretamente, en el Orden Gymnophiona se conocen especies amenazadas por modificaciones en su ambiente (Wake, 1993). No obstante, en muchos de estos taxones faltan estudios puntuales que así lo señalen, tal es el caso de Typhlonectes natans. ésta es una cecilia acuática (Jared et al., 1999) y fosorial que se distribuye en los humedales de la cuenca del Río Magdalena y en los drenajes fluviales que llegan al Lago de Maracaibo (Hernández-Cuadrado & Vargas, 2007; Hernández-Cuadrado et al., 2008).
Por su parte, se sabe que los cambios ambientales pueden afectar la historia de vida de los anfibios y otros ectotermos (Maurer, 1994), asociados con la oferta de nutrientes y el nivel de los cuerpos de agua donde habitan. Así, existen reportes hematológicos de algunos cecílidos como T. compressicaudus (Towens & Macintyre, 1978), Siphonops annulatus (Jared et al., 1999) y Boulengerula taitanus (Wood et al., 1975). Pero en T. natans no se han estimado los niveles de los parámetros sanguíneos.
Es de indicar que en estudios previos ha sido estudiada la química sanguínea en peces y reptiles en relación con su ambiente (Farrel et al., 2004; El-Deib, 2005). Por ejemplo, en el caribe colombiano De la Rosa & Movilla (2003) hallaron cambios en la glucosa y colesterol sanguíneos de crocodilianos en cautiverio con una dieta a base de pescado. En este sentido, la carne de tilapia (Oreochromis niloticus), por su alto porcentaje de proteína, grasa y ceniza INPA (1996), es un alimento de calidad para la especie que lo consuma. Así, su carne en incluso sus vísceras sería una alternativa para la alimentación de T. natans en condiciones de cautiverio, aunque es necesaria la toma de datos experimentales al respecto en este anfibio.
El conocimiento de los indicadores de bioquímica sanguínea en T. natans es relevante para una mejor comprensión de su biología. En particular es trascendente entender los efectos del ambiente sobre su fisiología, ya sean en el medio natural o en confinamiento. Desde esta perspectiva la UICN (2001) plantea que los estudios de laboratorio son importantes porque las exposiciones de agentes químicos a corto plazo podrían tener un marcado efecto en los anfibios y pueden ser comparados con datos de campo. El propósito de esta investigación fue la valoración de los niveles sanguíneos de hematocrito, hemoglobina, proteínas totales, colesterol total y glucosa en ejemplares adultos de T. natans en su hábitat natural y en cautiverio, relacionados con la dieta y la contaminación en diferentes sectores de la ciénaga La Bahía, Atlántico, Colombia.
Materiales y métodos
Se capturaron 100 ejemplares adultos de T. natans en la ciénaga La Bahía, Complejo Lagunar de Malambo, Atlántico, Colombia, por el método de "camas de eichornia" propuesto por Hernández-Cuadrado & Rodríguez (2006). Este humedal se caracteriza por la abundancia Echornia crassipes y Echornia azurea o taruya (Arciniegas, 2003). Fueron ubicadas cinco estaciones (E) en el área de estudio (figura 1), teniendo en cuenta las características particulares y vertimientos en cada una.
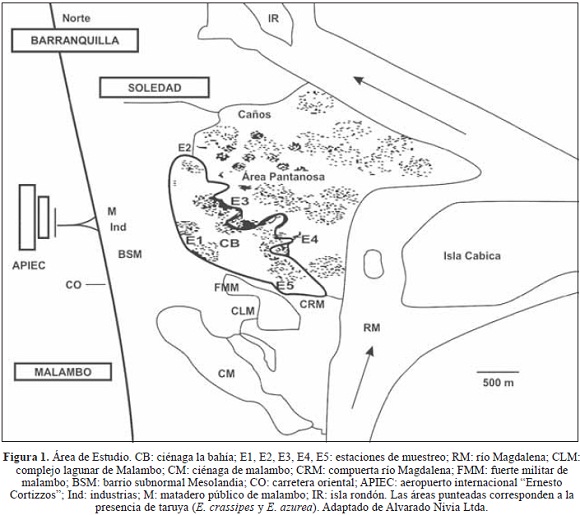
Estación uno (E1). Ubicada en la parte occidental de la ciénaga la Bahía, recibe desechos del aeropuerto internacional "Ernesto Cortissoz", el matadero del municipio de Malambo, industrias avícola y papelera y del barrio subnormal de Mesolandia. Es la parte de mayor cobertura vegetal en su ribera, de escasa concentración de plantas acuáticas.
Estación dos (E2). Al norte de la ciénaga, influenciada por el caño de Soledad que descarga aguas servidas provenientes del sector industrial y del municipio de Soledad. La vegetación acuática y ribereña es más escasa que en la estación 1.
Estación tres (E3). En la margen oriental del área de estudio, llegan las aguas negras del arroyo Manuela Beltrán. Predominan grandes conglomerados de taruya y enea (Typhla sp.).
Estación cuatro (E4). Parte suroriental del humedal, sin vertimientos de ningún arroyo o caño en forma directa. Presenta matorrales en sus orillas y gran cantidad de plantas acuáticas. Cercana a la compuerta que regula la entrada de agua del río Magdalena a la ciénaga.
Estación cinco (E5). Influenciada por el agua del río (compuerta) y el caño de Malambo. Recibe los vertimientos del barrio subnormal de Mesolandia y de las instalaciones del fuerte militar de Malambo. Hay altas concentraciones de taruya y enea.
Los animales fueron pesados, medidos y sexados mediante la metodología SOP (Hernández-Cuadrado & Vargas, 2007). Se capturó un grupo experimental (GE), de diez animales por estación, alimentado con carne de tilapia ad libitum durante 32 semanas (Abril-Diciembre de 2005) y mantenido en tanques de plástico de 75 cms de diámetro y 1,00 m de altura con abundante taruya; y un grupo patrón (GP) capturado en diciembre de 2005, de igual cantidad y sin tratamiento en cautividad. Ambos grupos fueron llevados simultáneamente al Laboratorio de Bioquímica de la Universidad del Atlántico para la extracción las muestras sanguíneas.
Por observaciones previas, los animales tienden a permanecer en las orillas y en los conglomerados de taruya por períodos relativamente largos (hasta seis semanas). Lo anterior evita sesgos en las comparaciones del caso.
Toma y procesamiento de muestras
Las muestras de sangre de cada animal fueron extraídas mediante punción en la región ventral, a la altura del tercer surco corporal, y colectada en tubos de ensayo que contenían 20 µL de heparina para la obtención de la sangre total y del plasma respectivamente en centrifuga (DYNAC-Centrifugue 297°C, Clay Adams, USA) a 3500 rpm. Los indicadores se determinaron por adaptación de los siguientes métodos: Hematocrito por técnica convencional utilizando tubos capilares, hemocentrífuga (Readcrit Centrifugue, Clay Adams, USA), cinta métrica y expresando los valores en porcentaje (%). La hemoglobina (g/dL) y proteína total (g/L), por colorimetría mediante uso de kit comercial (Biosystems S.A.) determinando la absorbancia a 540 nm; igualmente para la glucosa (mg/dL), pero midiendo la absorbancia a 500 nm. El colesterol total (mg/dL) por método enzimático colorimétrico utilizando kit comercial (Wiener Lab.), midiendo la absorbancia a 505 nm.
El tratamiento estadístico comprendió análisis descriptivo de cada variable para su caracterización general. Las comparaciones de las medias generales de los parámetros sanguíneos entre los dos grupos (GE y GP) se realizaron por test-t, al igual que entre cada una de las estaciones del GE y las estaciones correspondientes del GP. A su vez, las comparaciones dentro de cada grupo por estaciones de colecta se hicieron mediante análisis varianza (ANOVA). Se llevó a cabo análisis de correlación entre las variables y coeficiente de contingencia para relacionar la variable nominal sexo con los demás parámetros. Fueron usados los programas estadísticos Statgraphics 5.1 Plus y SPSS 11.5.
Resultados
En la tabla 1 se registra la media general de cada parámetro sanguíneo medido en los grupos de animales utilizados. Se puede observar que los animales del GE presentaron niveles semejantes en hematocrito (P = 0,194) y colesterol total (P > 0,05), pero mayores en hemoglobina (P = 0,010) y menores en proteínas totales (P = 0,03) y en glucosa sanguínea (P=0,000), cuando se comparan con los valores del grupo GP.
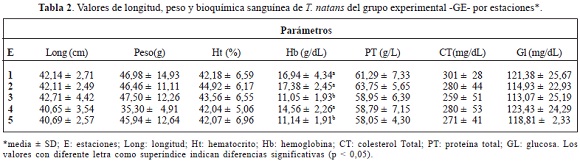
Al interior del GE hubo diferencias en los niveles de hemoglobina (p < 0,05), donde los animales de las estaciones E1 y E2 presentaron mayor concentración de esta proteína en relación con los animales de las demás estaciones (Tabla 2). Así mismo, hubo diferencias al ser comparadas las estaciones 1, 2 y 5 del GE con las correspondientes estaciones del GP (P < 0,001), siendo mayores los niveles en las estaciones 1 y 2 del GE y en la estación 5 del GP (Tablas 2 y 3). Los valores de la hemoglobina en el GP presentaron un orden creciente por estaciones, así: E1, E2, E4, E3 y E5 (tabla 3), con diferencias significativas entre E1 y E2 (p < 0,003) en relación con las otras tres estaciones, siendo iguales al comparar E3 y E4 (p > 0,05). Así mismo, las medias del porcentaje de hematocrito fueron iguales en el GE (tabla 2) y diferentes entre las estaciones al interior del GP (P = 0,0278), particularmente entre E1, E2 y E5, siendo ligeramente mayor en la estación 2 (tabla 3).
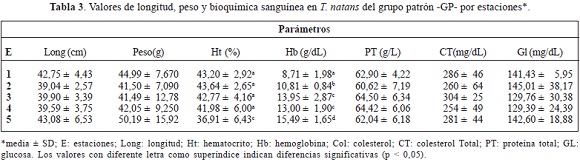
Los otros tres parámetros determinados en este estudio tuvieron un comportamiento diferencial. Así, los niveles de proteínas totales no presentaron cambios significativos al interior de los GE y GP (P > 0,05). Pero se encontraron diferencias en los niveles de colesterol total al comparar la estación 3 del GE con la estación correspondiente en el GP (P = 0,033), siendo mayor en el GP. Además, al comparar cada estación del GE con su correspondiente en el GP, se encontraron diferencias en la glucosa sanguínea en E2 (p = 0,04) y E5 (P = 0,022) (tablas 2 y 3). Aunque al interior de cada grupo no hubo diferencias (P > 0,05).
En todos los casos la talla y el peso fueron semejantes entre GE y GP, así como dentro de los grupos de animales por estaciones (ANOVA, t-test, P > 0,05). También se halló una correlación significativa para estas dos variables (r = 0,64, p = 0,0000 y r = 0,85, p = 0,000) en GE y GP, respectivamente. Por último, no hubo una asociación directa entre el sexo y los parámetros hematológicos medidos.
Discusión
El porcentaje de hematocrito y la hemoglobina en T. natans están correlacionados. Es decir, a mayor porcentaje de hematíes, mayor cantidad de hemoglobina. Esto ha sido observado en estudios previos realizados en ranas mugidoras y algunos lagartos (NRC, 2002). Los valores en el porcentaje de hematocrito del cecílido estudiado fueron similares entre los GE y GP y estuvieron en promedio por encima de 40%, con valor máximo de 52%. Este incremento en los niveles de hemoglobina con el aumento del hematocrito se explica debido a que la hemoglobina puede representar cerca del 95% de sustancias sólidas en el hematíe (Fontalvo, 1993). En consecuencia, la igualdad de los valores de hematocrito en la media general de los GE y GP (tabla 1), corresponde a un hecho esperado desde los puntos de vista metabólico y ambiental. Esto es, a temperaturas por debajo de 37°C la unión del oxígeno con la hemoglobina es más firme (Rokosky, 1997) que sobre este valor y, precisamente, en la época de captura de los animales la temperatura estuvo por debajo de este registro en la ciénaga La Bahía (Tatis, 2005). Sin embargo, las diferencias observadas en la hemoglobina entre los GE y GP y por estaciones dentro de los grupos, pueden estar indicando algún grado de afectación fisiológica en T. natans en el área de estudio. Por ello, es necesario llevar a cabo estudios complementarios sobre este aspecto.
En particular la contaminación puede alterar el pH del agua, por lo que valores bajos o elevados de éste pueden ocasionar graves trastornos en los procesos de intercambio a través de las membranas biológicas, como podría estar ocurriendo en el anfibio estudiado. Además, se sabe que una disminución en el pH se asocia con una mayor demanda de oxígeno (Tresguerres, 1999). Pero debido a que los valores de éste en el humedal fueron predominantemente alcalinos (Tatis, 2005), es probable que los requerimientos de oxígeno no incrementaran en T. natans. En este sentido, Kowalski (1999) ha sugerido que en cautiverio este Gymnophiona debe alojarse en agua con un pH alcalino (8,0). No obstante, probablemente en el medio natural los niveles de hemoglobina sean fisiológicamente adecuados, pues esta proteína respiratoria al encontrarse en el interior de los glóbulos rojos permite establecer una correlación entre el contenido de ésta en sangre y el hematocrito (NRC, 2002), teniendo en cuenta la concentración de H+ en el agua. Este efecto (efecto Bohr) también ha sido estudiado en otros vertebrados ectotermos como los reptiles (Berenbrink, 2006). Igualmente, se ha encontrado que en T. compressicaudus las concentraciones de hemoglobina en sangre son más altas que en otros anfibios (Towes & Macintyre, 1978). Por ello, es recomendable abordar el mayor número de variables ambientales posibles cuando se estudien parámetros hematológicos en estos ectotermos. Por ejemplo, la oferta alimentaria en su hábitat o en cautiverio, pues los niveles de hemoglobina pueden ser usados para evaluar respuestas frente a la disponibilidad de nutrientes (Nkrumah et al., 2011).
Estudios en T. natans llevados a cabo por Gardner (1996) y Boyle (1996) evidencian el papel preponderante de la hemoglobina en su respuesta ventilatoria, debido a que este animal depende en un alto grado de la respiración cutánea. Así mismo, hay que tener en cuenta que los pigmentos respiratorios han evolucionado independientemente en los diversos grupos de vertebrados y están relacionados con los hábitats y biotopos en que reside el animal más que con el tipo de proteína respiratoria (Scheer, 1969). Este autor plantea que los animales de movimientos lentos y los que habitan en lugares pobres en oxígeno suelen tener proteínas respiratorias de alta afinidad por este elemento. Es decir, hay una estrecha relación entre estilos de vida y adaptación bioquímica y/o hematológica (Tamburrini et al., 1997).
Partiendo de estas premisas, los movimientos relativamente rápidos de T. natans indicarían una baja afinidad de su hemoglobina por el oxígeno. Este planteamiento puede ser erróneo si se tienen en cuenta las diferencias en las tasas de producción de CO2 en dos cecílidos filogenéticamente relacionados con T. natans como T. compressicaudus y Dermophis mexicanus (Stiffler & Talbot, 2000). En T. compressicaudus el O2 es de gran afinidad por la hemoglobina. No obstante, los porcentajes de hematocrito para estas dos especies Gymnophiona son superiores a los manejados por los Chelonia que son de 20% a 35% (NRC, 2002); porcentajes que tampoco corresponden al hematocrito calculado para la mayoría de ectotermos e inferiores a la media del hematocrito de T. natans.
También se ha encontrado que la viscosidad sanguínea, y por tanto el hematocrito, se mantiene más o menos constante en algunos mamíferos comparados con anuros sometidos a un amplio rango de temperaturas entre 3°C y 38°C (Palenske & Saunders, 2002). Esta circunstancia puede estar influida por la ontogenia y el reducido tamaño de los glóbulos rojos de algunos Gymnophiona (Jared et al., 1999), así como por su historia térmica. Por ejemplo, en reptiles como Sceloporus occidentalis el porcentaje de hematocrito es mayor a bajas temperaturas (15°C) que a elevados registros (30°C), así como en individuos de mayor tamaño (Dunlap, 2006), por ejemplo adultos. En Kinosternon subrubrum la tasa metabólica estándar sufre un mayor incremento a 30°C que a 20°C (Litzgus & Hopkins, 2003). En este sentido, se plantea que la temperatura óptima para T. natans puede estar alrededor de los 30°C y que los niveles de hematocrito determinados podrían ser los más elevados de su desarrollo ontogénico.
La circunstancia antes mencionada podría ser extensiva a cualquiera de los parámetros medidos en T. natans y en cualquier otro grupo de animales, de acuerdo con Spicer & Burggren (2003). Esto demanda mayor comprobación experimental en la cecilia aquí estudiada, especialmente en lo relativo a posibles alteraciones proteicas. Así, la mayor tolerancia térmica de T. natans respecto de algunos reptiles como S. occidentalis, puede asociarse con un porcentaje de hematocrito mayor y un requerimiento de oxígeno más elevado de este cecílido; es de indicar que la historia térmica juega un papel trascendental en dicha tolerancia, lo cual ha sido planteado para otros anfibios (Hernández- Cuadrado, 2009).
Palenske & Saunders (2003) plantean que el porcentaje de hematíes no presenta cambios sustanciales en Lithobates catesbeianaus durante la hibernación. Esto se debe a que los ectotermos de zonas templadas presentan mayor capacidad de ajuste metabólico frente a grandes variaciones térmicas (Hernández-Cuadrado, 2009), si se comparan con animales tropicales como T. natans. Es importante tener en cuenta que la evidente contaminación de la Ciénaga la Bahía puede estar actuando sinérgicamente con la temperatura y otros factores, acentuándose los posibles efectos adversos para las T. natans. Dicha contaminación es mayor en E1, E2, E3 y E5 del área de estudio y, posiblemente debido a esto, en dichas zonas hubo mayor variabilidad en los parámetros sanguíneos al comparar los grupos (GE y GP). En la estación 4, por el contario, esa variación entre los grupos fue relativamente reducida. Es de resaltar que en E4 no hay vertimiento directo de aguas servidas.
El efecto de contaminantes ambientales sobre anuros y peces ha sido reportado en estudios previos (Pettersson et al., 2006; Monteiro et al., 2006). Por ejemplo, se han encontrado cambios hematológicos en peces canadienses al realizar pruebas con aguas residuales en grupos experimentales y en condiciones naturales (McPherson et al., 2004; Farrel et al., 2004). No obstante, es necesario un mayor número de estudios que permitan arrojar más claridad sobre este asunto. Es de subrayar que si bien se ha estimado el volumen de eritrocitos en Aves, Squamatas y Chelonia, el presente estudio es el primero al respecto en T. natans.
Las proteínas plasmáticas de algunos anfibios son similares en sus propiedades a la de los humanos, especialmente la albúmina (Besbee et al., 1977; Moskaitis et al., 1989). Este dato se corresponde con los hallazgos del presente estudio en cuanto a los valores manejados por T. natans (ver tablas 1, 2 y 3), los cuales reciben la influencia de las condiciones donde habita esta cecilia. Los mayores niveles para este indicador sanguíneo en el GP pueden ser atribuidos a la mayor variedad en la oferta alimentaria que el animal encuentra en la ciénaga. Además, esto puede ser relacionado con el hecho de que los animales fueron colectados en el período de lluvias en el que las aguas de la ciénaga La Bahía aumentan ligeramente el pH y el oxígeno disuelto, alcanzando una temperatura promedio de 29,88°C (Tatis, 2005), esto es, se daban las condiciones ambientales favorables para esta especie.
Los resultados sugieren que en los ejemplares de T. natans estudiados no hubo obtención de energía teniendo como sustrato las proteínas, como se ha señalado para otros ectotermos (Oliveira & Da Silva, 1997). Adicionalmente, se plantea la posibilidad de que la carne de tilapia sea un alimento adecuado para este Gymnophiona bajo condiciones de confinamiento. Del mismo modo, se debe tener presente que la temperatura del agua en cautiverio fue de 29,9°C, es decir, igual a la del medio, pero con ligeras variaciones de pH y OD (Tatis, 2005). Esta última circunstancia pudo generar las diferencias significativas en la media general de proteína total entre los GE y GP, sin desconocer la incidencia de otros factores no tenidos en cuenta en esta investigación y que precisan ser abordados para una visión ecofisiológica más integral.
En este orden de ideas, hay que tener presente que en el GE sólo se utilizó la carne de tilapia como fuente de nutrientes. Pero de forma general el menor valor de la proteína total en este grupo no puede ser interpretado como señal de malnutrición, pues estos especímenes presentaron valores parecidos de peso y talla dentro del grupo y una apariencia saludable. Además, entre las estaciones de un mismo grupo no hubo diferencias en esta variable (P>0,05), a pesar de la palpable contaminación de varios sectores de la Ciénaga la Bahía. Por ello, es necesario profundizar sobre el particular en investigaciones posteriores.
Por otro lado, los niveles de colesterol total en el plasma fueron iguales al comparar entre si las estaciones correspondientes entre el GE y el GP, excepto para la estación 3. Esto puede deberse, entre otras cosas, a la alta estabilidad de los lípidos frente a los cambios ambientales como sucede en la especie Caiman crocodilus fuscus (De la Rosa & Movilla, 2003) y al aporte de lípidos de la carne de tilapia que contiene un 5% de este nutriente (INPA, 1996). Sin embargo, en el medio natural la oferta de alimentos para esta especie es variada (Hernández-Cuadrado et al., 2008) de lo cual podría derivarse el mayor nivel de este parámetro en la estación citada del GP. También es posible que ante el estrés metabólico al que pueden estar sometidos los animales, debido a las aguas contaminadas de este sector, deban movilizar mayor cantidad de energía. Esta Energía pudo ser obtenida de los lípidos circulantes o de depósito por acción hormonal (cortisol, por ejemplo), así como del perfil de ácidos grasos hepáticos que también está influido por factores como la polución y la dieta (Justia et al., 2003).
Lo anterior se sustenta en el hecho de que el colesterol es uno de los parámetros sanguíneos que tiene un gran impacto sobre el metabolismo (Mayes, 1992). De igual modo, aunque la glucosa es la molécula energética de uso corriente por los vertebrados, los ácidos grasos de cadena impar (AGCI) también pueden transformarse a glucosa a través de la gluconeogénesis. Este es un proceso especialmente importante para el sistema nervioso central y los hematíes que necesitan de un continuo suministro de dicho azúcar (Rokosky, 1997). El proceso es de gran importancia en aguas con elevados niveles de contaminación como sucede en la estación 3, pues ya se ha probado que pesticidas como el herbicida oxifluorfen pueden causar alteraciones metabólico-enzimáticas en peces (Peixoto et al., 2006). La contaminación por agentes químicos podría ser una explicación a los recientes hallazgos de Price et al., (2011), quienes reportaron una estrecha relación entre la disminución de anfibios y su proximidad a zonas urbanizadas. Los resultados del presente estudio así lo evidencian para las poblaciones de T. natans en la ciénaga La Bahía, aunque se requieren datos experimentales adicionales.
También se sabe que temperaturas en cautiverio superiores a 33°C pueden ocasionar alteraciones en el metabolismo e incluso la muerte de estas cecilias (Kowalski, 1999; Hernández-Cuadrado & Vargas, 2005). Ello es sustentado por Schmidt-Nielsen (1988) quien señala la existencia de una menor tolerancia térmica de los animales acuáticos respecto de los terrestres, debido a que muchos mueren cuando los cuerpos de agua están en la franja de los 30°C a 35°C. Tatis (2005) registró una temperatura máxima de 36,5°C en la Ciénaga la Bahía, lo que permite suponer que en algunas épocas del año T. natans puede estar expuesta a estrés calórico en esta área. Por lo tanto, de persistir la intervención antrópica en este humedal podrían acentuarse algunos factores estresantes y generar un grado de amenaza mayor tanto para el taxón estudiado como para muchas especies de este ecosistema.
Adicionalmente, T. natans por poseer una masa hepática de gran tamaño (Hernández-Cuadrado & Vargas, 2007), hace suponer que puede metabolizar cantidades relativamente altas de grasas y almacenar glucógeno en cantidades importantes para requerimientos posteriores. En este sentido, se conoce que para el transporte y almacenamiento tisular de lípidos endógenos, la lipoproteína de alta densidad (HDL) juega un papel principal en el pez Dicentrarchus labrax (Santulli et al., 1997) y en la gran mayoría de vertebrados. Este aparte no fue evaluado en la presente investigación.
Por otra parte, es probable que los mayores niveles de glucosa en el GP se deban al elevado requerimiento energético en el hábitat natural. Este gasto puede estar relacionado con la disponibilidad de espacio y posiblemente porque el proceso gluconeogénico puede ser más acentuado, particularmente teniendo como sustrato los lípidos, dado que T. natans es una especie carnívora (Hernández- Cuadrado & Vargas, 2007). Esto concuerda con lo planteado por De la Rosa & Movilla (2003) acerca de la utilización de lípidos y aminoácidos en Caiman crocodilus fuscus para mantener el nivel glicémico óptimo.
Tietz (1992) señala que la glicólisis muestra gran sensibilidad a la variación térmica. De este modo pudieron verse afectados los niveles de glucosa en T. natans, lo que también pueden ser atribuido a las diferencias interespecíficas en la actividad glicolítica como se ha reportado en anuros (Mendiola et al., 1991). Sin embargo, las diferencias estadísticas (p < 0,05) en una variable biológica no necesariamente reflejan la realidad ecofisiológica de un animal. O sea, es posible que fisiológicamente estos niveles de glucosa (o de cualquier otro parámetro, sanguíneo o no) puedan fluctuar en un rango considerablemente amplio, sin incurrir por ello en deficiencias glicémicas. Por ejemplo, en determinada circunstancia podría aumentarse la capacidad hepática para tomar glucosa sanguínea, como sucede en Bufo calamita (Mendiola et al., 1991).
De este modo, los resultados permiten suponer una afectación directa por contaminación del medio sobre algunos parámetros sanguíneos de T. natans. Se ha comprobado que agentes contaminantes como el naftaleno pueden afectar los niveles plasmáticos de glucosa de algunos peces como Oncorhynchus mykiss en estadios iniciales de desarrollo (Tintos et al., 2006). Por ello se sugiere profundizar al respecto en estudios subsiguientes en la especie aquí estudiada. Por otra parte, la falta de correlación encontrada en este estudio entre el sexo y los parámetros sanguíneos contrasta con la tendencia general entre los vertebrados donde es común que los machos presenten niveles ligeramente superiores respecto de las hembras (NRC, 2002).
En síntesis, las poblaciones de T. natans en el Complejo Lagunar de Malambo pueden estar expuestas a un grado considerable de estrés fisiológico, toda vez que en la mayoría de las estaciones de colecta es palpable, por simple inspección, una fuerte y progresiva contaminación por vertimientos de múltiples orígenes. Nuestros datos indican que la acción de agentes contaminantes, en sinergia con otros factores, especialmente las variaciones térmicas, son una de las causas del declive de la clase Amphibia, particularmente del Orden Gymnophiona. Ello es sustentado por los cambios observados en varios de los parámetros sanguíneos determinados en T. natans en la ciénaga La Bahía.
Agradecimientos
A la Universidad del Atlántico por permitir el uso del Laboratorio de Bioquímica para la realización de esta investigación. A la Universidad del Tolima por el apoyo logístico recibido durante la preparación final del manuscrito. Al Profesor Jhon D. Lynch por incentivar el estudio de las cecilias colombianas a través de su artículo de 1999. Al profesor Rafael Borja Acuña por plantear la necesidad del estudio del Orden Gymnophiona en el Caribe Colombiano. Igualmente a Jhony Molina por su apoyo en las sesiones de laboratorio y a Sandra Lozano por sus comentarios al documento. Agradecimientos a Germán Rojas por el diseño y adaptación del mapa del área de estudio.
Bibliografía
Arciniegas, T.H. 2003. Monitoreo de la Fauna Silvestre en el Municipio de Soledad, Atlántico. [ Links ]
Berenbrink, M. 2006. Evolution of vertebrate haemoglobins: Histidine side chains, specific buffer value and Bohr effect. Respiratory Physiology & Neurobiology 154:165-184. [ Links ]
Bisbee, C.A., Baker, M.A., Wilson, A.C., Haji-Azimi, I., Fischberg, M. 1977. Albumin phylogeny for clawed frogs (Xenopus). Science 195:785-787. [ Links ]
Boyle, S.S.P. 1996. Effects of body temperature and hydrostatic pressure on pulmonary surfactant o fan apodan amphibian, Typhlonectes natans (M.Sc. Thesis). The University of Texas at Arlington. [ Links ]
De La Rosa, D., Movilla, S. 2003. Determinación de la Influencia de la Dieta en los Parámetros Sanguíneos (colesterol, glucosa, ácido úrico) del Caimán crocodilus fuscus en cautiverio (Trabajo de grado). Barranquilla: Departamento de Biología, Facultad de Ciencias Básicas, Universidad del Atlántico. [ Links ]
Dunlap, K.D. 2006. Ontogeny and scaling of hematocrit and blood viscosity in western fence lizards, Sceloporus occidentalis. Copeia 3:535-358. [ Links ]
El-Deib, S. 2005. Seasonal changes of water, electrolytes and aldosterone levels in blood serum, brai and kidney of the Egyptian cobra "Naja haje haje". Journal of thermal biology 30:503-510. [ Links ]
Farrel, A.P., Kennedy, C.J., Kolok, A. 2004. Effects of wastewater from an oil-sand-refining operation survival, hematology, gill histology, and swimming of fathead minnows. Canadian journal of zoology 82:1519-1527. [ Links ]
Fontalvo, M. 1993. Manual de Laboratorio de Fisiología. Barranquilla: Departamento de Biología, Facultad de Ciencias Básicas, Universidad del Atlántico. [ Links ]
Gardner, M. N. 1996. Ventilatory responses in Typhlonectes natans to changing aerial and aquatics gas tensions (M.Sc. Thesis). The University of Texas at Arlington. [ Links ]
Hernández-Cuadrado, E. 2009. Sensibilidad Térmica del Desempeño Locomotor en Anuros de un Gradiente Altitudinal en los Andes Colombianos (Trabajo de grado para optar al título de Magíster en Ciencias Biológicas). Universidad del Tolima, Colombia. [ Links ]
_____., Vargas Zapata, C., Hernández-Vélez, D. 2008. Historia de Vida de Typhlonectes natans (Amphibia: Gymnophiona) en América del Sur: Aplicaciones Potenciales. Revista Colombiana de Ciencia Animal 1(1):50-57, ISSN 2027-1840. [ Links ]
_____ ., Vargas, C. 2007. Rasgos Morfológicos y sexaje en Typhlonectes natans (Amphibia: Gymnophiona). Revista Tumbaga 2:25-39. [ Links ]
_____ ., Rodríguez, A. 2006. Parámetros sanguíneos de Typhlonectes natans (Amphibia: Gymnophiona: Typhlonectinae) mantenidos en cautiverio en relación con ejemplares del medio natural durante el período lluvioso de 2005 (Trabajo de grado). Barranquilla: Departamento de Biología, Facultad de Ciencias básicas, Universidad del Atlántico. [ Links ]
_____ ., Vargas C. 2005. Algunos Aspectos Comportamentales y Morfología Interna de Typhlonectes natans (Amphibia: Gymnophiona). Revista Asociación Colombiana de Ciencias Biológicas 17:47. [ Links ]
INPA. 1996. Fundamentos de Nutrición y Alimentación en Acuicultura. Bogotá, Colombia. [ Links ]
Jared, C., Navas, C.A., Toledo, R.C. 1999. An appreciation of the physiology and morphology of the caecilians (Amphibia: Gymnophiona). Comparative biochemistry and physiology part A 123:313-328. [ Links ]
Justia, K.C., Hayashib, C., Visentainera, J.V., Souza, N.E., Matsushitaa, M. 2003. The influence of feed supply time on the fatty acid prowl of Nile tilapia (Oreochromis niloticus) fed on a diet enriched with n-3 fatty acids, Food Chem. 80:489-493. [ Links ]
Kowalski, E. 1999. Typhlonectes natans, cuidados y mantenimiento en cautividad de la cecilia del Río Cauca. Reptilia 30:57-60. [ Links ]
Litzgus, J.D., Hopkins, W,A. 2003. Effect of temperature on metabolic rate of the mudturtle (Kinosternon subrubrum). Journal of Thermal Biology 28:595-600. [ Links ]
Maurer, E.F. 1994. Environment change: Consequences for life history, morpholgy, and behavior (Ph.D Dissertation). University of Kansas, USA. [ Links ]
Mayes, R. 1992. Bioquímica. 14a edición; editorial Manual Moderno. [ Links ]
McPherson, TD., Mirza, RS., Pyle, G.G. 2004. Responses of wild fishes to alarm chemicals in pristine and metal-contaminated lakes. Canadian Journal of zoology 82:694-700. [ Links ]
Mendiola, P., Molina, R., De Costa, J. 1991. Comparative study in glycolytic capacity in Anuran amphibians Comp. Biochem. Physiol. 98B(2/3):209-213. [ Links ]
Monteiro, D.A., Alves, DE., Almeida, J., Rantin, F.T., Kalinin, L. 2006. Oxidative stress biomarkers in the freshwater characid fish, Brycon cephalus, exposed to organophosphorus insecticide Folisuper 600 (methyl parathion). Comparative biochemistry and physiology part C 143: 141-149. [ Links ]
Moskaitis, J.E., Sargent, T.D., Smith, Jr, L.H., Pastori, R.l., Schoenberg, D.R. 1989. Xenopus laevis serum albumin: sequence of the complementary deoxyribonucleic acids encoding the 68- and 74-kDa peptides and the regulation of albumin gene expression by thyroid hormone during development. Mol. Endocrinol. 3:464-473. [ Links ]
Nkrumah, B., Nguah, S.B., Sarpong, N., Dekker, D., Idriss, A., May, J., Adu-Sarkodie, Y. 2011. Hemoglobin estimation by the HemoCue® portable hemoglobin photometer in a resource poor setting. BMC Clinical Pathology 11:1-6. [ Links ]
NRC (National Research Council of Canada). 2002. Variación Temporal, Poblacional y Sexual del Hematócrito en las Tortugas de Desierto. 80(3). Ottawa. [ Links ]
Oliveira, GT., Da Silva, R.S.M. 1997. Gluconeogenesis in hepatopancreas of Chasmagnathus granulata crabs maintened on high-protein or carbohydrate-rich diets. Comparative biochemistry and physiology part A: physiology 118(4):1429-1435. [ Links ]
Palenske, N.M., Saunders, D.K. 2003. Blood viscosity and hematology of american bullfrogs (Rana catesbeiana) at low temperatura. Journal of thermal biology 28:271-277. [ Links ]
_____., Saunders, DK. 2002. Comparisons of blood viscosity between amphibians and mammals at 3°C and 38°C. Journal of thermal biology 27:479-484. [ Links ]
PDMS (Plan de desarrollo del municipio de Soledad, Atlántico, Colombia, 2008-2011). 2008. Diagnóstico sobre el desarrollo sostenible municipal. Diagnóstico ambiental. 368 págs. [ Links ]
Peixoto, F., Alves-Fernandes, D., Santos, D., Fontaínhas- Fernandes, A. 2006. Toxicological effects of oxyfluorfen on oxidative stress enzymes in tilapia Oreochromis niloticus. Pesticide Biochemistry and Physiology 85:91-96. [ Links ]
Pettersson, I., Arukw, A., Lundstedt-Enke, K., Mortensen, A.S., Berg, C. 2006. Persistent sex-reversal and oviducal agenesis in adult Xenopus (Silurana) tropicalis frogs following larval exposure to the environmental pollutant ethynylestradiol. Aquatic toxicology 79:356-365. [ Links ]
Price, S.T., Cecala, K.K., Browne, R.A., Dorcas, M.A. 2011. Effects of urbanization on occupancy of stream salamanders. Conservation Biology 25(3):547-555. [ Links ]
Rokosky, J.R. 1997. Bioquímica. 1a edición. Mc Graw Hill Interamericana. [ Links ]
Rueda-Almonacid J.V., Lynch, J.D., Amézquita, A. 2004. editores. Libro Rojo de los anfibios de Colombia. Serie Libros Rojos de Especies Amenazadas de Colombia. Conservación Internacional Colombia, Instituto de Ciencias Naturales -Universidad Nacional de Colombia y Ministerio del Medio Ambiente. Bogota, Colombia. [ Links ]
Santulli, A, Messina, C.M., D'Amelio, V. 1997. Variations of lipid and apolipoprotein content in lipoproteins during fasting in european sea bass (Dicentrarchus labrax L.). Comparative biochemistry and physiology part A: physiology 118(4):1233- 1239. [ Links ]
Scheer, B. 1969. Fisiología Animal. Ediciones Omega S.A. Barcelona. [ Links ]
Schmidt-Nielsen, R. 1988. Fisiología Animal, Ciencias Naturales. 1a edición. Duke University. UTEHA, México. [ Links ]
Spicer, J.I., Burggren, WW. 2003. Development of physiological regulatory systems: altering the timing of crucial events. Zoology 106:91-99. [ Links ]
Stiffler, D.F., Talbot, C.R. 2000. Exchanges of Oxigen, carbón dioxide, nitrogen, and water in the caecilian Dermophis mexicanus. Journal comp. physiology B 170:505-509. [ Links ]
Tamburrini, M., D'avino, R., Carratore, V., Kunzmann, A., Di Prisco, G. 1997. The haemoglobin system of Pleuragramma antarcticu: correlation of haematological and biochemical adaptations with life style. Comparative biochemistry and Physisology, part A: Physiology 118:1037-1044. [ Links ]
Tatis, R. 2005. Producción Primaria Fitoplanctónica de un Sistema Pulsante Neotropical: Complejo Lagunar de Malambo (Departamento del Atlántico) (Trabajo de grado). Barranquilla: Departamento de Biología, Facultad de Ciencias, Universidad del Atlántico. [ Links ]
The World Conservation Union (UICN)/ Species Survival Comisión (SSC). 2001. Newsletter of the declining amphibian populations task force, Number 48. [ Links ]
Tietz, N. 1992. Química Medica Moderna. 1a edición. México. [ Links ]
Tintos, A., Gesto, M., Alvarez, R., Míguez, J.M., Soengas, J.L. 2006. Interactive effects of naphthalene treatment and the onset of vitellogenesis on energy metabolism in liver and gonad, and plasma steroid hormones of rainbown trout Oncorhynchus mikiss. Comparative biochemistry and Physisology, part C 144:155-165. [ Links ]
Towes, D., Macintyre, D. 1978. Respiration and circulation in apodan amphibians. Canadian journal zoology 56:998-1004. [ Links ]
Tresguerres, J.A. 1999. Fisiología Humana. Segunda Edición, Mc Graw Hill Interamericana. México. [ Links ]
Wake, M.H. 1993. Non-traditional characters in the assessment of caecilians Phylogenetic relationships. Herpetol. Monogr 7:42- 55. [ Links ]
Willens, S., Stoskopf, M.K., Baynes, R.E., Lewbart, G.A., Taylor, S.K., Kennedy-Stoskopf, S. 2006. Percutaneous malathion absorption in the harvested perfused anuran pelvis limb. Environmental toxicology and pharmacology 22:263-267. [ Links ]
Wood, S., Weber, R., Maloiy, G.M., Johansen, K. 1975. Oxygen uptake and blood respiratory properties of the caecilian Boulenegerula taitanus. Resp. physiol. 24:355-363. [ Links ]
Recibido: febrero 18 de 2008.
Aceptado para su publicación: diciembre 18 de 2010.













