Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales
Print version ISSN 0370-3908
Rev. acad. colomb. cienc. exact. fis. nat. vol.35 no.134 Bogotá Jan./Mar. 2011
ECOLOGÍA
1 Geoingeniería, Bogotá, Colombia. Correo electrónico: rene.sanchez@geoingeniería.com
2 Universidad del Tolima, Departamento de Biología. Fac. de Ciencias, A.A. 546, Ibagué-Colombia. Correo electrónico: mcastro@ut.edu.co
3 Universidad Nacional de Colombia, Departamento de Biología, Centro de Estudios en Ciencias del Mar - CECIMAR; INVEMAR, Cerro Punta de Betín, Apartado 10-16, Santa Marta, Colombia. Correo electrónico: szea@invemar.org.co
Resumen
En la Ciénaga Grande de Santa Marta (CGSM) Caribe colombiano se han registrado altos valores de producción primaria (PP) respecto a otros sistemas acuáticos del mundo. Como el N parece ser el elemento limitante de la PP debido a su baja concentración relativa respecto al P, se desarrollaron experimentos de adición de nutrientes para evaluar la respuesta de la comunidad pelágica en términos de su uso o liberación y de la PP en la boca del río Sevilla, área representativa de la alta actividad biológica observada en esta laguna costera tropical. Para esto, se determinaron los cambios netos de concentración de los diferentes iones y la evolución del oxígeno disuelto en períodos de 4 horas. En general se presentó una liberación neta leve de N y P en controles sin adición de nutrientes y una tendencia al consumo en los experimentos con adición. La PP neta sólo se incrementó significativamente cuando se adicionó amonio o nitrato+fósforo a baja concentración. Los resultados mostraron que subsidios adicionales de N y P pueden ser aprovechados rápidamente por la comunidad planctónica aunque éstos no conllevaron a aumentos inmediatos en la PP, la que al parecer descendió en altas concentraciones de nutrientes, posiblemente por efecto de inhibición y/o competencia entre procesos fisiológicos.
Palabras clave: Cambios Netos de Nutrientes, Producción Fitoplanctónica, Bioensayos, Ciénaga Grande de Santa Marta.
Abstract
At the Ciénaga Grande de Santa Marta (CGSM) in the Colombian Caribbean, high primary production (PP) values in comparison to other aquatic ecosystems of the world has been registered. As N appears to be the limiting element to PP, owing to its relatively low concentration with respect to P, nutrient addition experiments were carried out to evaluate the response of the pelagic community in terms of its use or release and of primary production in the mouth of Sevilla river, a representative area of high biological activity observed in this tropical coastal lagoon. The concentration's net changes of the various ions and the evolution of dissolved oxygen were determined after 4 hrs. In general, there was slight net release of N and P in controls without nutrient additions and a trend for consumption in the experiments with additions. Net primary production increased significantly only when ammonium or nitrate plus phosphorous were added at low concentration. These results show that additional subsidies of N and P may be quickly used by the planktonic community although this was not accompanied by immediate increases in primary production, the latter of which could even decrease at high concentrations of nutrients, possibly by the effect of inhibition and/or competition between physiological processes.
Key words: Nutrients Net Changes, Nutrients, Phytoplankton Production, Bioassays, Ciénaga Grande de Santa Marta.
Introducción
Las concentraciones instantáneas de nutrientes inorgánicos disueltos en los sistemas acuáticos están reguladas por una serie de procesos físicos, químicos y biológicos (p.e. intercambio con otros sistemas, reciclamiento bentónico y reciclamiento pelágico interno), que pueden condicionar sus proporciones relativas y por ende su disponibilidad. La disponibilidad de estos compuestos puede limitar y regular la producción primaria si las proporciones relativas de Nitrógeno inorgánico disuelto (NID) y Fósforo inorgánico disuelto (PID) no se encuentran dentro de los requerimientos de los productores primarios (Parsons et al., 1984; Howart, 1988), que debería ser 16:1 molar para las poblaciones fitoplanctónicas marinas. En general, las lagunas costeras son ambientes altamente productivos y sistemas ecológicamente complejos en donde la productividad primaria puede estar dominada por el fitoplancton, por algas macro-micro bentónicas, por macrófitas o, en algunos casos, por una combinación de éstas (Harrison, 1983; Knoppers, 1994). En la laguna costera Ciénaga Grande de Santa Marta (CGSM) en el Caribe colombiano, se han registrado valores de producción primaria fitoplanctónica en un intervalo de 1149.8 y 1554.9 g C/m2.año (Hernández y Gocke, 1990; Hernández y Márquez. 1991, Gocke et al. 2003), cifras muy altas en comparación con otros sistemas acuáticos. La CGSM se ha caracterizado por su gran heterogeneidad espacial y temporal en las concentraciones de ortofosfatos y nutrientes nitrogenados disueltos. Entre 1996-1997 se reportó una tendencia al incremento del fósforo, y una relación directa y positiva entre la cantidad de nutrientes inorgánicos disueltos en la columna de agua y la producción primaria en el área cercana a la desembocadura del Rio Sevilla (Sánchez y Zea, 2000) la cual fue estimada en ~912.5 g C/m2.año (Gocke et al., 2003 a). Al respecto, los autores sugirieron que aunque el NID sería el nutriente limitante en relación con el PID, que siempre está en exceso, lograba mantener alta la producción primaria y solo deficiencias ocasionales de NID en el medio requerirían de ser compensadas a través del uso de reservas o procesos de reciclaje (Sánchez y Zea, 2000). Sin embargo, estudios que se han venido desarrollando en la CGSM desde 1999, después de la apertura de los canales cerca al área costera, muestran que el sistema lagunar en general, presenta una tendencia a la disminución de las concentraciones de nutrientes inorgánicos (INVEMAR, 2003, 2004, 2005, 2006). De ahí la importancia de analizar el efecto que tendría la adición de nutrientes sobre la producción primaria en este tipo de ecosistemas. Para esto han sido usados bioensayos de tiempo corto en los cuales se adicionan nutrientes a cultivos puros de algas para medir con C14 su crecimiento o tasas de incorporación, como también se ha usado la adición de nutrientes a botellas de agua que contienen la comunidad planctónica natural para medir el efecto de éstos sobre el crecimiento o producción a través del incremento en biomasa, clorofila o asimilación de C14 (Howarth, 1988). Aunque este tipo de ensayos se ha realizado en períodos de unos pocos días a una semana, son varios los estudios que muestran que luego de la adición de un nutriente limitante, se puede observar un incremento rápido en la tasa fotosintética en períodos de 4 a 6 horas (Lean y Pick, 1981).
Asimismo, se ha planteado que el estudio experimental de cambios netos de concentración de nutrientes inorgánicos disueltos, tales como nitrógeno y fósforo durante el proceso de producción primaria, pueden ser una aproximación útil para definir la tendencia de variación de estos compuestos en la columna de agua en un sistema dado y contribuir al entendimiento de mecanismos funcionales del ecosistema (Doering et al., 1995). En la CGSM el comportamiento temporal y espacial de las concentraciones instantáneas de NID y PID y de su metabolismo son muy heterogéneos; no se evidencia ningún patrón sistemático de consumo o liberación, con excepción de una tendencia general al consumo neto del nitrato y a la liberación neta de fósforo, éste último particularmente en la noche (Sánchez, 1998; Sánchez y Zea, 2000). La posible explicación a esta gran variabilidad es que los cambios netos de concentración involucran una serie de procesos que realizan los diferentes componentes biológicos del sistema y que, además, estos organismos se encuentran enmarcados dentro de un entorno con características fisicoquímicas espacial y temporalmente heterogéneas. Por esto, suponemos que adiciones experimentales de nutrientes en el sistema podrían dar indicios de la existencia de algún tipo de limitación para la producción primaria, y darían luces sobre la existencia de una relación cercana entre el consumo y la demanda para la producción primaria. Para ello se desarrollaron incubaciones experimentales de corta duración, con muestras de agua de la CGSM a las cuales se adicionaron nutrientes para medir sus cambios netos y su efecto sobre la producción primaria fitoplanctónica.
Área de experimentación
La Ciénaga Grande de Santa Marta (CGSM), Colombia, tiene un área aproximada de 450 km2 y se extiende entre los 10°40'- 10°59' latitud norte y 74°26'- 74°38' longitud oeste. Se considera una laguna costera que hace parte del delta exterior del río Magdalena y cuenta con un sistema adyacente de caños, ciénagas y pantanos de manglar. Presenta influencia marina en el sector de la Boca de la Barra y recibe agua de los ríos Aracataca, Sevilla y Fundación provenientes de la Sierra Nevada de Santa Marta. Para la realización de los bioensayos, se recolectaron durante tres días contínuos durante la época seca (Febrero-Marzo) 3 litros de agua superficial que se transportó al laboratorio inmediatamente para realizar los bioensayos. El agua se tomó cerca a la desembocadura del Río Sevilla (Figura 1) el segundo río más grande que desemboca en la CGSM y donde se han reportado condiciones físico-químicas y biológicas similares a las observadas en el área central de la CGSM.
Materiales y métodos
Los ensayos consistieron en la adición de NaNO3, NH4Cl, K2PO4 y NaNO3 - K2PO4 (solos o en combinación) a sistemas experimentales con 500 mL de agua proveniente de la CGSM. Se adicionó 50 y 125 mmolL-1 en tres repeticiones de cada adición en días separados y con aguas separadas. Se obtuvo un total de 24 sistemas experimentales independientes. Cada uno contó con tres réplicas y con sus respectivos controles, a los cuales no se les adicionó ningún nutriente. Los sistemas experimentales consistían de botellas ISO de 500 mL, prelavadas con HCl (10 %), enjuagadas con agua des ionizada y adaptadas para que no se formaran burbujas, las cuales se colocaron en acuarios de vidrio instalados a cielo abierto, regulando la temperatura por adición continua de agua, en un periodo de incubación de 4 horas. Las incubaciones se realizaron entre las 10:00 y 16:00 horas.
Las concentraciones de nitrato (NO3 -1), nitrito (NO2 -1), amonio (NH4 +) y ortofosfatos (PO4 -3) fueron determinadas utilizando la metodología estándar de la APHA-AWWAWPCF (1975), siguiendo las modificaciones propuestas por Gocke (1987). Para determinar las concentraciones iniciales de estos compuestos, al inicio de las incubaciones se filtraron 50ml de las muestras de agua de cada ensayo por membranas de 0,45µ de tamaño de poro y se congelaron a -20°C para el posterior análisis de nutrientes por colorimetría. Asimismo, al terminar el periodo de incubación, se determinaron las concentraciones de estos compuestos en cada una de las botellas utilizadas. Los cambios netos de cada compuesto se estimaron restando de la concentración al final de la incubación (Ct1) la concentración inicial (Ct), dividido por el tiempo de experimentación en horas (DC=(Ct1- Ct)/t). Por otro lado, la producción fitoplanctónica se estimó utilizando la técnica de "evolución de oxígeno en botellas claras y oscuras" modificada; para lo cual se midió la concentración de oxígeno en las mismas botellas empleadas para los análisis de nutrientes y se adicionaron botellas oscuras para medir la respiración planctónica. Las concentraciones de oxígeno disuelto se determinaron con el método de Winkler y la conversión del oxígeno (O2) liberado en carbono (C) fijado se realizó aplicando el cociente fotosintético 0,85 considerando que 1 mg de O2 liberado equivale aproximadamente a 0,313 mg de C fijado de acuerdo con Parsons et al., (1984). Para determinar diferencias significativas en los cambios netos de los iones de N y P y en la producción primaria neta (PPN) durante las incubaciones con la adición extra de iones, se realizaron por separado análisis en un ANOVA mixto para cada ion, la PPN y cada concentración adicionada (50 mmolL-1 y 125 mmolL-1), tomando como factores principales Tratamiento (fijo) y Ensayo (como bloques aleatorios de repetición de experimentos), cuyos cuadrados medios esperados siguieron el siguiente modelo (obtenidos de la orden "random", opción "/test" del módulo GLM del programa SAS, siendo tratados como aleatorios los ensayos y la interacción).

Siendo Var la varianza aleatoria y Q la varianza aditiva debida al tratamiento. Con ello, los valores de F para los factores principales fueron calculados usando como denominador los cuadrados medios de la interacción. En la mayoría de los casos la variable cambio neto de concentración no cumplió con los supuestos de homogeneidad de varianzas entre celdas (tratamiento*ensayo), ni de normalidad de los residuos del modelo, ni siquiera después de realizar transformaciones Box-Cox. Al no haber una prueba no-paramétrica para este diseño complejo, se optó por incluir estos resultados tomándolos como tentativos. La PPN sí cumplió con los supuestos de homogeneidad de varianzas y normalidad de residuos.
Resultados
Las características físicas y químicas, y posiblemente las biológicas, del agua utilizada para los ensayos variaron entre los diferentes experimentos, debido a que su toma se realizó en días diferentes. El pH del agua fue ligeramente básico (7,99 ± 0,22, n=12), con salinidad intermedia (18,56 ± 2,14, n=12) debido a la influencia de las aguas del río Sevilla. La intensidad lumínica en cada día de ensayo fue variable, con un intervalo de 252 - 1110 *50000 LUX (812.06 ± 271,00 *50000 LUX, n=30) y la temperatura del sistema de incubación varió entre 28 y 35.2 °C (32.74 ± 1.92 °C, n=30). Las concentraciones iniciales en los sistemas control para los diferentes iones fueron: 1.037 ± 0.533 mmolN L-1 de nitrato (n= 13), 0,036 ± 0.030 mmolN L-1 de nitrito (n=13), 2,37 ± 1.069 mmolN L-1 de amonio (n=13) y 2.791 ± 0.718 mmolP L-1 de ortofosfatos (n=13). Estas concentraciones representan los nutrientes inorgánicos disueltos disponibles para la comunidad planctónica al inicio de las incubaciones, los cuales se encontraban en una proporción de N respecto al P de 1.251± 0.301.
La concentración inicial de NO3 -1 en los tratamientos con adición de 50 mmol L-1 y 125 mmol L-1 de NaNO3 fue de 6.562 ± 4.069 y 17.176 ± 8.074 mmol N L-1, respectivamente. La concentración inicial de NH4 +1 para los ensayos con adición de NH4Cl fue de 2.972 ± 0.750 mmol N L-1 para adición de 50 mmol L-1 y 19.880 ± 2.886 mmol N L-1 para adición de 125 mmol L-1. Respecto a los tratamientos con adición de 50 y 125 mmol L-1 de K2PO4, se obtuvieron concentraciones iniciales de PO4 -3 de 20.162 ± 6.116 y 35.075 ± 10.221 mmol P L-1, respectivamente. En los experimentos en los que se adicionó una mezcla de NaNO3 + K2PO4, la concentración inicial de NO3 -1 en los ensayos fue de 24.474 ± 6.912 y 28.260 ± 12.077 mmol N L-1 en la adición de 50 y 125 mmol L-1 respectivamente, mientras que para el PO4 -3 la concentración fue de 9.487 ± 4.126 mmol P L-1. De los datos anteriores se hace evidente que hubo gran variabilidad en las concentraciones iniciales en los diferentes sistemas de incubación, y son muy disímiles a lo que se esperaría teóricamente al adicionar una solución con una concentración determinada a un volumen definido. Por esto, fue muy importante, la medición de la concentración inicial para tener el valor real con el cual se empezaron las incubaciones.
Los cambios netos promedio de concentración para NO3 -1, NO2 -1, NH4 + y PO4 -3 en los controles tuvieron una tendencia a ser positivos, o sea de liberación neta (Figura 2), siendo los promedio más altos los del ión NO3 -1 con valores de 0,233 ± 0,327 mmolNL-1h-1. Cambios netos promedio negativos, de utilización neta, sólo se presentaron en algunos controles para PO4 -3 (-0,031 ± 0,086 mmolPL-1h-1). Respecto a los sistemas experimentales con adición de nutrientes se encontró gran heterogeneidad en los cambios netos de concentración, aunque se observó una tendencia a que cuando se adicionó un nutriente, los cambios de concentración promedio fueron negativos para el ión adicionado, indicando utilización neta (Figura 2). Al respecto, sólo se presentaron diferencias significativas con los controles cuando se añadió NaNO3+K2PO4 en una concentración de 50 mmolL-1, en donde hubo una absorción significativa de NO3 - (-1,292 ± 1,448 mmolNL-1h-1 vs. 0,137 ± 0,327 mmolNL-1h-1 del control). Cuando se añadió K2PO4, solo (50 mmolL-1) o combinado con NaNO3 (125 mmolL-1), hubo absorción neta de PO4 -3 (-0,868 ± 0,530 mmolPL-1h-1 vs. -0,031 ± 0,085 mmolPL- 1h-1 del control). Para que hubiera absorción neta significativa de amonio hubo que añadirse 125 mmolL-1 de NH4Cl (-2.991 ± 1.935 mmolNL-1h-1 vs. 0,169 ± 0,563 mmolNL-1h-1 del control). Para el resto de ensayos no hubo diferencias significativas con los controles.
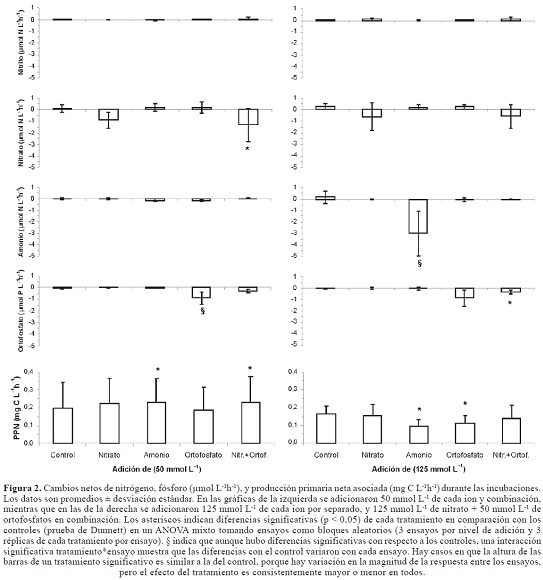
Con relación a la PPN promedio se encontró en los controles un intervalo de 0,054 ± 0,015 y 0,368 ± 0,020 mgCL-1h-1. En los ensayos con adición de nutrientes la PPN se comportó muy similar a los controles y sólo en algunos casos se presentaron diferencias estadísticamente significativas (Figura 2). La PPN se vio aumentada solamente al añadir cantidades moderadas (50 mmolL-1) de NH4Cl (0,229 ± 0,132 mgCL-1h-1 vs. 0,199 ± 0,141 mgCL-1h-1 de los controles) y NaNO3+K2PO4 (0,233 ± 0,140 mgCL-1h-1 vs. 0,199 ± 0,141 mgCL-1h-1 de los controles). En cambio la PPN descendió cuando se añadieron en mayor cantidad (125 mmolL-1) NH4Cl (0,094 ±0,036 mgCL-1h-1 vs. 0.164 ± 0,044 mgCL-1h-1 del control) y K2PO4 (0.113 ± 0,042 vs. 0.164 ± 0,044 mgCL-1h-1 del control).
Discusión
La CGSM es un ecosistema complejo, heterogéneo y dinámico, cuyas características físicas, químicas y biológicas presentan gran variabilidad espacial y temporal. Debido a esta condición, es presumible pensar que los diferentes procesos metabólicos que realizan los organismos que habitan en la columna de agua se encuentren estrechamente relacionados con las condiciones preponderantes en un momento dado. Es así como la variabilidad observada, sumada a las condiciones atmosféricas presentes durante los días de experimentación, se ven reflejadas en las características de los sistemas de incubación (p.e. salinidad, pH, intensidad lumínica, abundancia y composición del plancton, T°, etc.) y en las respuestas metabólicas obtenidas en cada uno de los ensayos.
Los cambios netos de concentración de nutrientes inorgánicos disueltos, medidos como la diferencia entre las concentraciones finales e iniciales de un ion determinado en cada uno de los sistemas de incubación, son el resultado de esa interacción de procesos que realizan cada uno de los componentes del plancton. En general, los cambios netos negativos, en los ensayos en que se observa disminución en las concentraciones iniciales, indican que en el intervalo de tiempo analizado, los procesos de toma de nutrientes predominaron sobre los procesos de producción. Por el contrario, los cambios positivos estarían indicando que los procesos de generación (p.e. excreción, remineralización, etc.) predominan sobre los de toma. Así mismo, si no se encuentra ningún cambio en la concentración al final de la incubación, podría indicar que existe un balance entre las salidas y entradas al stock de nutrientes o que no pasó nada dentro del margen detectable por la metodología implementada durante el período del experimento. Además, cabe señalar que cada uno de los nutrientes se ven involucrados en procesos que realizan cierto grupo de organismos. Por ejemplo, los cambios de concentración de amonio dependen de procesos de remineralización bacteriana, exudación por el fitoplancton, pastoreo y excreción por parte del zooplancton que aportan este nutriente y por procesos de toma por parte de fitoplancton y bacterias que lo consumen (Corner y Biddanda, 2002); de la misma forma, respecto a los cambios de concentración de nitrato, estos dependen de procesos de nitrificación de nitrito, que aporta nitrato al sistema y por procesos de toma llevado a cabo por bacterias y fitoplancton (Howarth, 1988, Paerl y Pinckney, 1996).
A pesar que el NID se encuentra en bajas concentraciones y en proporciones muy bajas respecto al PID, no se aprovechó al máximo el N suministrado en diferentes formas, al menos dentro de las 4 horas posteriores a su adición. También se observó gran variabilidad en los cambios netos de los diferentes iones analizados ya que al adicionar N en forma de NH4 + o NO3 -, principalmente para concentraciones altas de amonio (125 mmolL-1 de NH4Cl) y bajas de nitrato (50 mmolL-1NaNO3) se observó una tendencia a la disminución significativa de concentraciones al final de los experimentos. En algunos de estos sistemas en donde se adicionó amonio, gran parte del nutriente agregado fue consumido durante el periodo de incubación, registrándose cambios netos negativos que se pueden considerar elevados (p.e -4.702 mmolNL-1h-1). Es factible pensar que cada uno de los organismos que conforman la comunidad planctónica al encontrarse con deficiencia de NID, con relación al PID disponible, aproveche cualquier suministro de este nutriente con el fin de optimizar sus procesos metabólicos y fisiológicos. Asimismo, este consumo elevado en un periodo de tiempo corto, puede ser atribuible a que se ha reportado que células menores de 3 mm son más rápidas para tomar y asimilar nutrientes que células de mayor tamaño (Brenfang y Takahashi, 1983). De hecho, se ha reportado que la comunidad planctónica de la desembocadura del río Sevilla al igual que el centro de la CGSM está dominada por células bacterianas con una abundancia de entre 20-50 x 106cel/ml (Gocke et al., 2003b) y fitoplancton (de 0.2-2mm) principalmente cianofitas (Gocke et al., 2003a), las cuales a su vez incrementan su abundancia en la época seca entre marzo-abril a ˜415x 106 cel/ml (De la Hoz, 2004). Si bien, este alto consumo de N puede ser atribuible principalmente al fitoplancton, no podemos descartar que las bacterias nitrificantes puedan estar oxidando amonio a nitrato y aunque dicha actividad puede ser inhibida por la luz, se ha descrito que tal efecto es menor en ambientes estuarinos (Ward, 2000). Estos resultados, también dan indicios de que la producción de "amonio regenerado" a través de procesos heterotróficos, no alcanza a satisfacer los requerimientos fisiológicos del fitoplancton y quizá de las bacterias nitrificantes, a pesar que se han reportado las más altas tasas de producción secundaria (37.5 µgC/l/h) y de respiración bacteriana (49% de la respiración de la comunidad planctónica) en la desembocadura del Rio Sevilla en época seca (Gocke et al. 2003b). Sin embargo, se deben tener en cuenta los efectos de realizar experimentos en botellas, lo cual puede determinar cambios en los sustratos disponibles y perturbar los flujos de nutrientes para la comunidad planctónica, respecto de lo que se espera observar in situ.
Aparentemente, en las condiciones mostradas al inicio de las incubaciones, la comunidad planctónica de la CGSM prefiere tomar amonio más que nitrato. Cuando se adicionó este último ion a los sistemas experimentales, los cambios netos en las concentraciones se diferenciaron significativamente respecto a los tratamientos control solo cuando se adicionaron nitratos a baja concentración junto con ortofosfatos; no obstante, sus cambios netos fueron de menor magnitud que los registrados con el amonio. Este suceso podría explicarse al relacionar varios aspectos. Primero, aunque los organismos planctónicos pueden utilizar diferentes compuestos inorgánicos disueltos nitrogenados, el amonio, al ser una forma reducida, confiere ventajas energéticas a los organismos, al no gastar energía en la biosíntesis de enzimas que reducen formas oxidadas en metabolitos aprovechables como si se hace con el nitrato (Eppley et al., 1969). Segundo, las tasas de toma de cada uno de estos iones pueden ser diferentes debido a que el amonio entra a las células por medio de difusión o transporte activo secundario, mientras que el nitrato por transporte activo primario (Wheeler, 1983). Tercero, en algunos trabajos se ha determinado que células fitoplanctónicas de mayor tamaño tienen preferencia por toma de nitrato (Harrison, 1983) y en la CGSM la abundancia relativa de fitoplancton de mayor tamaño, p.e. diatomeas y dinoflagelados, es reducida respecto a las cianófitas las cuales abarcan >90% de la abundancia en la CGSM (De la Hoz, 2002, De la Hoz, 2004). Y cuarto, algunos trabajos realizados en áreas costeras reportan efecto de inhibición sobre la comunidad planctónica en experimentos de adición de nitrato (Smith, 2006), así como inhibición de la actividad fotosíntética del fitoplancton ante la adición de nutrientes, como fue también observado en la Ciénaga de Pajaral y rio Fundación, atribuido posiblemente a estrés fisiológico. (Vega, 2002).
Es así como el amonio se puede considerar como un ion importante para el sostenimiento de la producción primaria en la CGSM, dado que se observó un leve incremento en la PPN con su adición. Resultados similares han sido observados recientemente en el Complejo Pajarales, el cual hace parte de la CGSM, donde se reporta que aumentos significativos en la producción primaria neta fueron impulsados principalmente por el amonio (Rodríguez-Chila et al., 2009). Sin embargo, los resultados también sugieren que los procesos de nitrificación probablemente estén jugando un papel importante dentro de la utilización del amonio y producción de nitrato lo que explicaría en parte las mayores tasas de consumo observadas en la columna de agua ante la adición de altas concentraciones de amonio más que de nitrato, este último al parecer, es poco requerido por el fitoplancton dominante y por las bacterias heterotróficas. Por lo tanto, la adición de uno u otro nutriente no se refleja directamente en una alta PPN.
La CGSM es un ecosistema que se ha caracterizado por presentar en la columna de agua bajas proporciones N:P inorgánico disuelto, con notables variaciones inter e intraanuales (INVEMAR, 2006) muy por debajo de los requerimientos planteados por Redfield de 16:1 molar para los organismos fitoplanctónicos. Debido a que estos iones son las formas principales en que los productores primarios asimilan sus demandas nutricionales y que el NID en este ecosistema se encuentra en bajas concentraciones relativas a las del fósforo, y que además se ha presentado una tendencia a la baja de los nutrientes inorgánicos disueltos en la última década para el área de estudio, sobre todo en los niveles de nitratos y de fosfatos que pasaron de entre 33-64mgNL-1(1996-1997) a 5-20mgNL-1 (2006) y de 68-264mgPL-1 (1996-1997) a 10-100mgPL-1(2006) respectivamente, y en menor medida del amonio que paso de 21- 43mgNL-1(1996-1997) a 10-100mgNL-1 (2006), lo que hace pensar que la producción primaria fitoplanctónica podría estar siendo limitada por nitrógeno inorgánico. En este sentido, se ha propuesto que si un nutriente determinado es adicionado en la columna de agua y la PPN se incrementa, el sistema es considerado como limitado por este nutriente. Gran parte de modelos empíricos en donde se ha relacionado la biomasa fitoplanctónica y productividad en ecosistemas marinos han mostrado una fuerte correlación entre producción primaria y disponibilidad de nitrógeno (Smith, 2006). Aunque sólo en uno de los experimentos llevados a cabo con suministro de NID se observó incrementos significativos en las tasas de PPN, existe una tendencia a que la adición de NID incrementa la absorción neta de los iones adicionados. Respecto a la disminución en las tasas de PPN, Lean y Pick (1981) plantean que después de la adición de un nutriente que se encuentra en concentraciones muy bajas, puede haber competencia por ATP y agentes reductores entre la toma de nutrientes y la fotosíntesis. Asimismo, se ha demostrado que el metabolismo está dirigido primero hacia la toma de nutrientes y asimilación y luego a la conversión de carbón almacenado en constituyentes necesarios para sostener el incremento en el crecimiento (Healey, 1979) y que factores como la sucesión de tipos de fitoplancton adaptados a diferentes necesidades nutricionales y el control de la biomasa del fitoplancton por la herbivoría pueden incidir en la falta de correlación entre adición de nutrientes e incremento en la PPN (Zea et al., 1998). Aunque se ha propuesto que la escala de tiempo fisiológico para la utilización de N por parte del fitoplancton es del orden de minutos o menos (Harrison, 1983), es posible que, en este tipo de experimentos, el tiempo de incubación se deba prolongar para poder obtener resultados en las respuestas fotosintéticas por parte de estos organismos. Por lo tanto, debido a que las mediciones se realizaron después de 4 horas de la adición de nutrientes, las reducciones o ningún cambio significativo de PPN en algunos experimentos con suministro de N, pueden atribuirse a estos factores que producen disminuciones y retrasos en el incremento de las tasas fotosintéticas por lo cual se debe optimizar el tiempo del análisis y reducir las variables ambientales para poder analizar la respuesta de los organismos fitoplanctónicos en este tipo de ensayos.
En síntesis, se puede decir que el análisis de los cambios netos de concentración de nutrientes inorgánicos disueltos, nitrógeno y fósforo, fueron una herramienta útil para analizar la variación de dichos compuestos en la columna de agua. Para este caso, se trabajó con la comunidad planctónica de la desembocadura del Rio Sevilla, un área que comparte muchas características físico-químicas (salinidad, alcalinidad, % saturación de oxígeno, pH) y biológicas (concentración de Clorofila a, composición fitoplanctónica, respiración planctónica y actividad heterotrófica) con el área central de la CGSM (Gocke et al., 2003a, Gocke et al., 2003b, De la Hoz, 2004), lo cual nos permite extrapolar en parte, nuestros resultados al complejo lagunar, sin embargo, debemos tener en cuenta la alta variabilidad intra e interanual que se observa en esta laguna y la complejidad de interacción entre los componentes bióticos y abióticos y entre los procesos metabólicos que se ven involucrados, lo que determina que los resultados encontrados presenten gran variabilidad y que no se pueda establecer un patrón definido, además que, corresponden a unas características específicas encontradas en un momento dado. No obstante, los resultados indican que la tendencia de los organismos que constituyen el plancton en esta área de la CGSM es la de aprovechar cualquier suministro de nutrientes inorgánicos presente en la columna de agua, lo cual se ve reflejado por el incremento significativo en los cambios netos negativos, en este caso, principalmente para la toma del amonio, aunque no se refleje siempre de inmediato en un aumento de la producción primaria. Además, hay que tener en cuenta que probablemente tal comportamiento se mantiene en diferentes áreas de la CGSM años después de la apertura de los canales, dado que se ha reportado recientemente que el NID podría estar limitando la PP en la columna de agua del complejo Pajarales (Rodríguez-Chila, 2009), sin embargo, para poder establecer una tendencia en el comportamiento de la comunidad planctónica sería necesario realizar un monitoreo continuo que tenga en cuenta la variabilidad espacio-temporal de los factores físico-químicos y biológicos que inciden directamente en los procesos metabólicos de la comunidad autotrófica y heterotrófica, así como en su acoplamiento en esta laguna costera tropical.
Agradecimientos
Este trabajo hace parte del proyecto "Procesos Reguladores de la Producción Biológica en Lagunas Costeras Tropicales", financiado por el Fondo Colombiano para el Desarrollo de la Ciencia y Tecnología â COLCIENCIAS (Cod. 1101-09-031-93), por la Universidad Nacional de Colombia (CINDEC) y por el Instituto de Investigaciones Marinas y Costeras â INVEMAR. Sinceros agradecimientos a los profesores Néstor Campos y Gabriel Guillot por su contribución y apoyo y a los demás investigadores del proyecto.
Bibliografía
Brenfang, P.K. y M. Takahashi. 1983. Ultraplankton growth rates in a subtropical ecosystem. Mar. Biol., 76: 213-218. [ Links ]
Corner, J.B. y B.A. Biddanda. 2002. Small players, large role: microbial influence on biogeochemical in pelagic aquatic ecosystems. Ecosystems, 5: 105-121. [ Links ]
De la Hoz, M.V. 2002. Estructura de la comunidad fitoplanctónica de la Ciénaga Grande de Santa Marta para el año 1996-1997. Informe final, Instituto de Investigaciones Marinas y Costeras. Santa Marta. 86 Págs. [ Links ]
_____, M.V. 2004. Dinámica del fitoplancton de la Ciénaga Grande de Santa Marta, Caribe Colombiano. Bol. Invest. Mar. Cost 33:159-179. [ Links ]
Doering, P.H., C.A. Oviatt, B.L. Nowicki, E.G. Klos y L.W. Reed. 1995. Phosphorous and nitrogen limitation of primary production in a simulated estuarine gradient. Mar. Ecol. Prog. Ser 124: 271-287 [ Links ]
Eppley, R.V., J.L. Coatworth y L. Solorzano. 1969. Studies of nitrate reductase in marine phytoplankton. Limnol. Oceanogr 24: 495-509. [ Links ]
Gocke, K. 1987. Manual para determinar los procesos de producción y degradación en biotopos marinos, especialmente en lagunas costeras y manglares. Mimeógrafo en la biblioteca del Instituto de Investigaciones Marinas y Costeras INVEMAR. Santa Marta, Colombia. 56 pp. [ Links ]
Gocke, K., J.E. Mancera-Pineda, L.A. Vidal y D. Fonseca. 2003a. Planktonic primary production and community respiration in several coastal lagoons of the outer delta of the rio Magdalena, Colombia. Bol. Invest. Mar. Cost 32:125-144. [ Links ]
_____ y A.Vallejo. 2003b. Heterotrophic microbial activity and organic matter degradation in coastal lagoons of Colombia. Rev.Biol.Trop 51(1):85-98. [ Links ]
Harrison, W.G. 1983. The time-course of uptake of inorganic and organic nitrogen compounds by phytoplankton from the Eastern Canadian Arctic: A comparison with temperate and tropical populations. Limnol. Oceanogr 28 (6): 1231-1237. [ Links ]
Healey, F.P. 1979. Short-term responses of nutrient deficient algae to nutrient addition. J. Phycol 15: 289-299. [ Links ]
Hernández, C.A. y K. Gocke. 1990. Productividad primaria en la Ciénaga Grande de Santa Marta, Colombia. An. Inst. Invest. Mar. Punta de Betín 19-20: 101-119. [ Links ]
_____ y G.E. Márquez. 1991. Producción primaria en el ecosistema Ciénaga Grande de Santa Marta, laguna costera del caribe colombiano. Trianea 4: 385-407. [ Links ]
Howart, R.W. 1988. Nutrient limitation of net primary production in marine ecosystems. Ann. Rev. Ecol 19: 89-110. [ Links ]
INVEMAR. 2003, Monitoreo de las condiciones ambientales y los cambios estructurales de las comunidades vegetales y de los recursos pesqueros durante la rehabilitación de la Ciénaga Grande de Santa Marta. Informe Técnico final 2003. INVEMAR, Santa Marta, Colombia, 73 p. [ Links ]
_____. 2004. Monitoreo de las condiciones ambientales y los cambios estructurales y funcionales de las comunidades vegetales y de recursos pesqueros durante la rehabilitación de la Ciénaga Grande de Santa Marta. Informe 2004. INVEMAR, Santa Marta, Colombia. 106 p. [ Links ]
_____. 2005. Monitoreo de las condiciones ambientales y los cambios estructurales y funcionales de las comunidades vegetales y de recursos pesqueros durante la rehabilitación de la Ciénaga Grande de Santa Marta. Informe Final 2005. INVEMAR, Santa Marta, Colombia. 108 p. [ Links ]
_____. 2006. Monitoreo de las condiciones ambientales y los cambios estructurales y funcionales de las comunidades vegetales y de recursos pesqueros durante la rehabilitación de la Ciénaga Grande de Santa Marta. Informe Final 2006. INVEMAR, Santa Marta, Colombia. 103 p. [ Links ]
Knoppers, B. 1994. Aquatic primary production in coastal lagoons. En: Kjerfve, B. (Ed.). Coastal lagoon processes. Elsevier Science Publishers, Amsterdam. Pág. 243-286. [ Links ]
Lean, D.R.S. y F.R. Pick. 1981. Photosynthetic response of lake plankton to nutrient enrichment: A test for nutrient limitation. Limnol. Oceanogr 26(6): 1001-1019. [ Links ]
Paerl, H.W. y J.L.Pinckney. 1996. A mini-review of microbial consortia: their roles in aquatic production and biogeochemical cycling. Microb. Ecol 31: 225-247. [ Links ]
Parsons, T.R., M.Takahashi y B.Hargrave. 1984. Biological oceanographic processes. Pergamon Press, Oxford 330 pp. [ Links ]
Rodríguez-Chila, JD., J.E. Mancera-Pineda y H.J. López- Salgado. 2009. Efectos de la recomunicación del Río Magdalena con su antigua Delta: cambios en la producción primaria fitoplanctónica y respiración en el complejo Pajarales, 1989 A 2005. Bol. Invest. Mar. Cost 38(2):119-144. [ Links ]
Sánchez, R.M. 1998. Metabolismo del nitrógeno y fósforo en la columna de agua y su relación con la producción fitoplanctónica en una laguna costera tropical (Ciénaga Grande de Santa Marta, Caribe colombiano). Tesis de grado Magister Scientiae en Biología. Universidad Nacional de Colombia-INVEMAR. Bogotá, 95 pp. [ Links ]
_____ y S. Zea. 2000. Metabolismo de nitrógeno y fósforo inorgánicos disueltos en la columna de Agua en una Laguna Costera Tropical (Caribe Colombiano). Carib. J. Sci 36(1-2): 127-140. [ Links ]
Smith, V.H. 2006. Responses of estuarine and coastal marine phytoplankton to nitrogen and phosphorus enrichment. Limnol. Oceanogr 51(1, part 2): 377-384. [ Links ]
Vega, D. 2002. Efectos del enriquecimiento con nitrógeno y fósforo sobre el metabolismo de la comunidad fitoplanctónica en la Ciénaga de Pajarales y Río Fundación, Caribe Colombiano. Tesis Biología. Universidad del Magdalena, Santa Marta, 60 p. [ Links ]
Ward, B. 2000. Nitrification and the marine nitrogen cycle. En Kirchman D.L. (Eds). Microbial ecology of the oceans. Pp: 427-449. [ Links ]
Wheeler, P.A. 1983. Phytoplankton nitrogen metabolism. En Carpenter E.J. y D.G Capone. (Eds.). Nitrogen in the marine environment. Academic press, INC. New York. pp: 309-346. [ Links ]
_____ y D.L. Kirchman. 1986. Utilization of inorganic and organic nitrogen by bacteria in marine systems. Limnol. Oceanogr 31(5): 998-1009. [ Links ]
Zea, S., R. Giraldo H., J.E. Mancera y J. Martínez-C. 1998. Relaciones contemporáneas y rezagadas entre variables físicoquímicas y biológicas en la Ciénaga Grande de Santa Marta, Caribe Colombiano. Bol. Invest. Mar. Cost 27: 67-85. [ Links ]
Recibido: febrero 9 de 2010. Aceptado para su publicación: febrero 28 de 2011.













