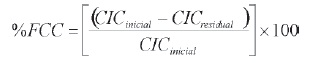Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales
versão impressa ISSN 0370-3908
Rev. acad. colomb. cienc. exact. fis. nat. vol.35 no.136 Bogotá jul./set. 2011
CATÁLISIS
* Autor de correspondencia: jcarriazog@unal.edu.co
1 Estado Sólido y Catálisis Ambiental (ESCA), Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia. Carrera 30 Núm. 45-03, Bogotá, D. C.
Resumen
En el presente trabajo se muestra la pilarización de una arcilla colombiana tipo bentonita con los sistemas Al-Fe y Al-Cu, y la evaluación de su actividad fotocatalítica en la eliminación de fenol en medio acuoso diluido. Los sólidos obtenidos se caracterizaron por difracción de rayos X (DRX) y capacidad de intercambio catiónico (CIC), mostrando la efectiva modificación vía pilarización. La evaluación de la actividad catalítica de los sólidos revela el potencial de aplicación de éstos en la degradación de compuestos orgánicos contaminantes en medio acuoso mediante procesos fotoasistidos con radiación UV. Los resultados evidencian una mayor actividad fotocatalítica para la arcilla modificada con hierro y una mayor selectividad de la arcilla modificada con cobre hacia la formación de CO2 y H2O.
Palabras clave: arcilla pilarizada, fotocatálisis, oxidación de fenol, proceso foto-fenton.
Abstract
In this work the pillaring of a Colombian natural clay (bentonite) with the Al-Fe and Al-Cu systems, and the assessment of their photocatalytic activity in the phenol elimination in aqueous solution are shown. The obtained solids were characterized by X-ray diffraction analyses and cationic exchange capacity, showing the effective modification via pillaring. The catalytic activity assessment of the solids confirms the potential application of these catalysts on the organic pollutants degradation in aqueous medium by means of catalytic processes photo-assisted with UV radiation. The results show a higher photocatalytic activity for the Al-Fe-pillared clay and a higher selectivity for the Al-Cu-pillared clay towards the formation of CO2 and H2O.
Key words: pillared clay, photocatalysis, phenol oxidation, photo-fenton process.
1. Introducción
La contaminación ambiental se ha convertido en uno de los problemas más importantes de la sociedad actual; en especial la contaminación del agua es uno de los aspectos de mayor trascendencia por sus implicaciones directas sobre la vida en el planeta (Busca et al., 2008; Daza et al. 2004). por tal motivo, el control de contaminantes en el aire, el suelo y en las aguas, ha conducido a la formulación de reglamentaciones ambientales cada vez más severas (Ministerio de Salud-Colombia, 1984). El fenol, en particular, es uno de los contaminantes ambientales peligrosos y frecuentes en aguas residuales de industrias (químicas, petroquímicas y agroalimentarias), debido a su toxicidad, bioacumulación, poca biodegradabilidad y a su carácter cancerígeno (Garrido et al. 2010; Busca et al. 2008; Suárez et al. 2008; Fortuny et al. 1998;). Entre las tecnologías avanzadas de oxidación, el proceso Fenton, (Fe2+-Fe3+)/ H2O2, y en especial el proceso foto-Fenton, (Fe2+-Fe3+)/ H2O2/UV), han generado gran interés en los últimos años debido a su eficiencia para degradar una gran variedad de contaminantes orgánicos (Liotta et al., 2009; Andreozzi, et al. 1999).
De otro lado, la implementación de arcillas pilarizadas con diversos sistemas de óxidos metálicos constituye, en la actualidad, un campo de amplia investigación (Garrido et al. 2010; Carriazo et al. 2010; Ksontini et al. 2008; Gil et al. 2000) debido a las enormes posibilidades en el control de la microporosidad, la eficiencia catalítica y la selectividad de estos sólidos en las reacciones de interés. Recientemente, en el grupo ESCA (Estado Sólido y Catálisis Ambiental) del departamento de química de la Universidad Nacional de Colombia, se desarrolló la síntesis de arcillas pilarizadas con los sistemas Al-Fe y Al-Fe-Ce para la oxidación catalítica de fenol en medio acuoso diluido, logrando resultados exitosos mediante la generación de un sistema tipo Fenton modificado (Carriazo et al. 2005). Además, Daza et al. (2004) y Carriazo et al. (2003), evaluaron arcillas modificadas con Al – Cu en esta misma reacción (sin asistencia de radiación), mostrando la potencialidad catalítica de estos sólidos. Teniendo en cuenta dichos resultados, y considerando que, tanto el Fe3+ como el Cu2+ presentan valores de energía de “band-gap” inferiores (mayor longitud de onda) al valor correspondiente para el semiconductor más conocido y utilizado en fotocatálisis, TiO2 (anatasa, band-gap ≈380nm), se concibió la idea de evaluar arcillas pilarizadas con Al-Fe y Al-Cu (provenientes de un mineral colombiano con explotación real) en procesos fotocatalíticos heterogéneos con potencial aplicación en la remoción de contaminantes orgánicos típicos de aguas residuales de industrias. De esta manera, en el presente trabajo se evalúan las arcillas pilarizadas con los sistemas Al-Fe y Al-Cu en la reacción catalítica de oxidación total de fenol en medio acuoso, asistida con radiación UV. Los sólidos pilarizados se sintetizan a partir de una bentonita colombiana explotada en el Valle del Cauca y comercializada a gran escala en Colombia.
Por otra parte, aunque en literatura se encuentran algunos trabajos sobre evaluación fotocatalítica de arcillas pilarizadas o modificadas con especies de hierro, en la reacción general de oxidación de contaminantes orgánicos en medio acuoso (Iurascu, et al., 2009; De León et al. 2008; Cheng et al. 2008), el empleo de arcillas de diferente procedencia puede modificar las características finales del sólido, debido a factores geoquímicos de los minerales (origen y transformación), lo cual en algunos casos favorece y en otros reduce la eficiencia de los catalizadores sintetizados. En tal sentido, la evaluación de la actividad fotocatalítica de arcillas pilarizadas preparadas a partir de la bentonita del Valle del Cauca constituye un avance en lo referente a los procesos de valorización y posible aplicación tecnológica de este mineral de interés nacional.
2. Materiales y métodos
2.1. Síntesis de los catalizadores
2.1.1. Material de partida: Las arcillas pilarizadas estudiadas en el presente trabajo se prepararon mediante la modificación de una bentonita sódica, proveniente del Valle del Cauca-Colombia, utilizada en procesos anteriores (Carriazo et al. 2007; 2005). Esta bentonita tiene como componente principal un mineral dioctaédrico (montmorillonita) y la siguiente composición química: 9,8% Al, 22,3%Si, 6,0% Fe, 2,2% Na, 1,5% Mg, 0,4% Ca, 0,52% Ti, 38 ppm de Ce y 93 ppm de Cu (Carriazo et al. 2007). La arcilla natural fue triturada y tamizada (malla # 60 ASTM), para ser sometida posteriormente a separación por tamaño de partícula en suspensión acuosa (empleando la ley de Stokes) y recoger la fracción = 2 µm. Luego se secó la fracción recogida, a 60ºC, se trituró y se tamizó (malla # 80, ASTM).
2.1.2. Preparación de las soluciones polioxocatiónicas intercalantes: Para llevar a cabo el proceso de intercalación-pilarización con el sistema Al-Cu, se empleó una solución acuosa preparada a partir de sales de aluminio y de cobre (AlCl3·6H2O y CuCl2, reactivos Merck 99%). Se partió de una solución 0,2M de Al3+ con la cantidad apropiada de Cu2+, con el fin de obtener un porcentaje molar de Cu del 10%: [Cu]/[Cu + Al] x 100 = 10. Luego se adicionó a la mezcla el volumen necesario de una solución de NaOH 0,2M, en forma lenta y con agitación vigorosa, hasta alcanzar una relación molar OH/(Cu+Al) igual a 2,4. Esta solución se dejó envejecer a una temperatura de 60ºC por 2 horas, con el fin de favorecer la formación de especies policatiónicas de tamaño adecuado. De la misma forma se llevó a cabo la preparación de la solución polioxocatiónica para sintetizar la arcilla pilarizada con aluminio - hierro, empleando sales de aluminio y de hierro (FeCl3·6H2O - Merck 99%), conservando el mismo porcentaje molar que en el caso anterior (10%): [Fe]/[Fe + Al] * 100 = 10.
2.1.3. Intercalación-pilarización de la arcilla: La bentonita natural (fracción = 2 µm) se homoionizó mediante intercambio catiónico con una solución de cloruro de sodio 1N. Luego, la arcilla se hidrató por 24 horas y posteriormente se sometió a intercambio iónico con las soluciones polioxocatiónicas de Al-Cu o de Al-Fe previamente envejecidas. El proceso se realizó adicionando lentamente, y con agitación constante, la solución polioxocatiónica a una suspensión de arcilla al 2% (p/v) en agua, a temperatura ambiente. Después de culminada la adición, la suspensión se dejó envejecer por 3 horas a temperatura ambiente. Finalmente, el material obtenido se separó por centrifugación, se lavó hasta que la conductividad de la solución fuera cercana a la del agua destilada, se secó a 60ºC y se calcinó a 400ºC con rampa de calentamiento. Los sólidos obtenidos fueron triturados y tamizados en malla # 80-ASTM. En adelante, la arcilla pilarizada con aluminio – cobre se denominará B-AlCu y la arcilla pilarizada con aluminio – hierro B-AlFe.
2.2. Caracterización
2.2.1. Capacidad de intercambio catiónico (CIC): La determinación de la CIC de los sólidos se realizó sometiendo éstos a intercambio catiónico con una solución de acetato de amonio 2M (suspensión 1% p/v). La reacción de intercambio catiónico se realizó a temperatura ambiente, con agitación constante durante 24 horas y renovando la solución de acetato de amonio a las 12 horas. Luego, los sólidos fueron lavados por centrifugación hasta fin de acetatos, para posteriormente determinar el contenido de amonio mediante análisis micro-Kjeldahl.
2.2.2. Difracción de rayos X (DRX): La DRX se hizo con el propósito de determinar el incremento en el espaciado basal d001 de los sólidos como consecuencia del proceso de pilarización. Estos análisis se realizaron en un difractómetro X Pert Pro MPD PAnalitical (radiación Kα de Cu, λ=1,5406 Å), con geometría 2θ y configuración Bragg- Brentano. Los difractogramas se tomaron a temperatura ambiente, empleando la técnica de placa orientada.
2.2.3. Actinometría química: La actinometría química, empleada para calibrar la lámpara comercial de radiación UV (4 watts de potencia nominal) utilizada en los ensayos catalíticos, se realizó de manera convencional con el complejo ferrioxalato de potasio, K3[Fe(C2O4)3], como se indica en literatura (Goldstein y Rabani, 2008; Jankowki et al. 1999). Los ensayos de actinometría indicaron que la lámpara de trabajo tiene una potencia real igual a 10% de la potencia nominal, es decir 0,4 watts.
2.3. Evaluación catalítica: reacción de oxidación de fenol en fase acuosa: La reacción de oxidación total de fenol se llevó a cabo en dos tipos de reactores: un reactor tipo semi-batch con lámpara (UV) inmersa (Figura 1a), y otro acoplado a una lámpara (UV) externa, como se indica en la Figura 1b. Los dos reactores son termostatados a 25ºC, equipados con agitación constate y un electrodo para controlar las variaciones de pH del medio de reacción (pHmetro Metrohm 744). Una bomba peristáltica permite la adición continua de la solución de peróxido de hidrógeno (0,1M). Para cada ensayo los reactores fueron cargados con 100mL de fenol (5x10-4M) y 0,5 g de catalizador. La solución de peróxido de hidrógeno (0,1M) fue adicionada a 2m L/h durante 4 horas. El pH fue ajustado a 3,7 en los ensayos de evaluación catalítica del sólido B-AlFe y 5,5 en el caso del sólido B-AlCu. Adicionalmente, en el reactor se burbujeó aire constantemente a razón de 2L/hora.
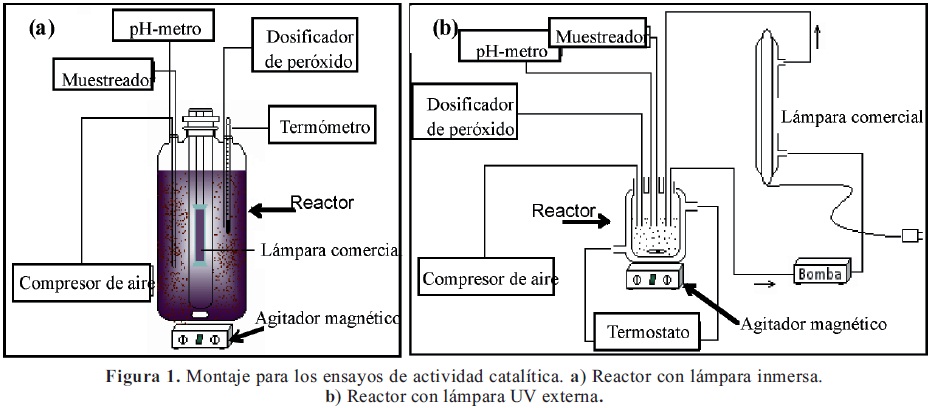
El flujo de recirculación del medio reaccionante a través de la lámpara externa (Figura 1b) fue de 2,5 mL/minuto. En ambos reactores se emplea una lámpara comercial (de mercurio) de 0,4 watts con longitud de onda no monocromática y un rango de máxima intensidad entre 330 y 390 nm. Para seguir el curso de la conversión de fenol y la aparición de subproductos de la reacción, se empleó la cromatografía líquida de alta resolución (HPLC). Cada muestra es previamente filtrada con filtros milipore de 0,45µm, y luego analizada en un equipo Hitachi D-7000 (LaChrom) con detector de UV-Vis y una columna Lichrosphere 60 Select B (RP8). Adicionalmente se evaluó la conversión de carbono orgánico total (COT) en un equipo automatizado AnaTOC, con el objeto de observar la degradación total de fenol hasta CO2 y agua. En todos los ensayos se estimó un error relativo hasta de 4% para la oxidación de fenol a 60 minutos y para la eliminación de COT a los 120 minutos; en tiempos de reacción superiores a los indicados el error es menor.
3. Resultados y discusión
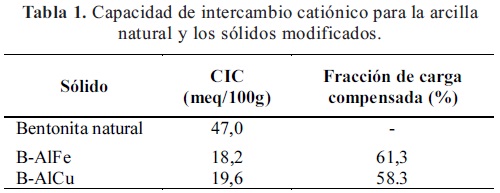
3.1. Capacidad de Intercambio Catiónico (CIC): La tabla 1 resume los valores de CIC de los sólidos y la fracción de carga compensada como consecuencia del proceso de pilarización. La capacidad de intercambio catiónico de la arcilla disminuye luego de la pilarización, lo que indica que el intercambio iónico con las soluciones polioxocatiónicas fue exitoso, confirmando la incorporación de estas especies dentro de la estructura del mineral mediante interacción fuerte con las láminas de la arcilla, lo que hace que se dificulte el intercambio final de las especies por el ion amonio. La fracción de carga compensada se determinó empleando la siguiente relación:
donde CICinicial corresponde al valor obtenido para la bentonita de partida y CICresidual indica el valor de CIC para cada sólido pilarizado.
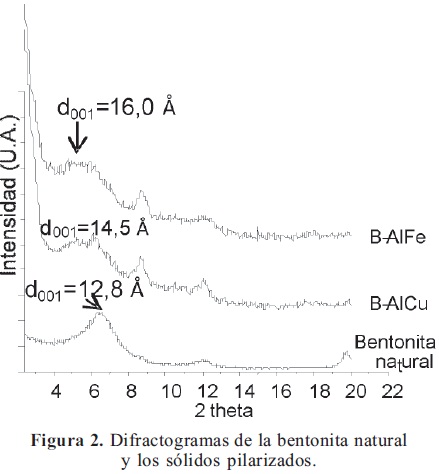
3.2. Difracción De Rayos X (DRX): La Figura 2 muestra los perfiles de difracción para la bentonita natural y para los sólidos pilarizados. Evidentemente se observa un desplazamiento de la señal correspondiente al espaciado basal del material de partida (d001=12,8 Å) hacia valores más altos (16,0 Å para el sistema B-AlFe y 14,5 Å para el sistema B-AlCu), evidenciando la incorporación de pilares en los espacios interlaminares del mineral. Adicionalmente se observa que, la señal correspondiente al d001 de las arcillas pilarizadas es más ancha y amorfa, indicando una distribución heterogénea de los pilares incorporados en el mineral. Finalmente, la señal situada en 2θ=8,7° (d=10,2 Å), en los sólidos modificados, revela una pequeña fracción no pilarizada en los materiales.
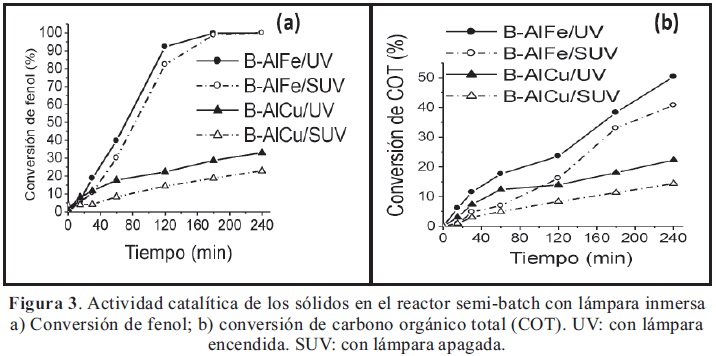
3.3. Evaluación catalítica: La Figura 3 muestra los resultados de actividad catalítica para los sólidos B-AlFe y B-AlCu en el reactor tipo semi-batch con lámpara inmersa, en presencia o en ausencia de luz UV, durante 4 horas de reacción. En cada tipo de reactor se realizaron ensayos “blanco”, para observar el efecto de la lámpara UV sobre la reacción en ausencia de catalizador, encontrando conversiones de fenol despreciables en el tiempo de reacción evaluado. Los ensayos “blanco” demuestran que, en las condiciones de trabajo, el peróxido de hidrógeno (diluido) en ausencia de catalizador no es activado por los niveles (bajos) de radiación de la lámpara empleada. El aumento en la conversión de fenol (Figura 3a) en presencia de los catalizadores indica que, tanto la bentonita pilarizada con Al-Fe como la arcilla pilarizada con Al-Cu presentan actividad fotocatalítica en la reacción de oxidación de fenol. Dichos resultados se confirman con el incremento en las conversiones de COT (Figura 3b). Además, es necesario destacar que, los ensayos del presente estudio se realizaron con una lámpara UV de potencia muy baja (0,4 watts), en comparación con los valores de potencia reportados comúnmente en literatura, los cuales van desde 50 watts hasta 400 watts (Cheng et al. 2008; Martínez et al. 2007; Song et al. 2006; Crittenden et al. 1997) y con arreglos experimentales que incluyen más de una lámpara (De León et al. 2008). Esto revela una muy buena actividad fotocatalítica de los sólidos, los cuales responden con el incremento en la actividad catalítica bajo niveles menores de irradiación. En ambos casos, tanto en la conversión de fenol como en la conversión de COT, se observa un mejor desempeño catalítico de la arcilla pilarizada con el sistema Al-Fe. Además, las curvas de COT para este sólido (Figura 3b) no alcanzan la forma de “meseta” (con pendiente cero) observada en la Figura 3a para la conversión de fenol, lo que indica que las conversiones podrían continuar aumentando con el tiempo y alcanzar niveles superiores.
La Figura 4 muestra los resultados de actividad catalítica del sólido más activo (B-AlFe) empleando el reactor de lámpara externa. En este sistema, nuevamente se verifica el incremento en las conversiones de fenol y de COT como consecuencia de la irradiación del catalizador con luz UV a baja potencia. Sin embargo, se observa que los niveles de conversión son menores que los obtenidos en el sistema de lámpara inmersa, lo que puede explicarse teniendo en cuenta que en éste último, la irradiación sobre el medio de reacción es constante, mientras que en el sistema de lámpara externa la irradiación es parcial y depende del flujo de recirculación del medio de reacción.
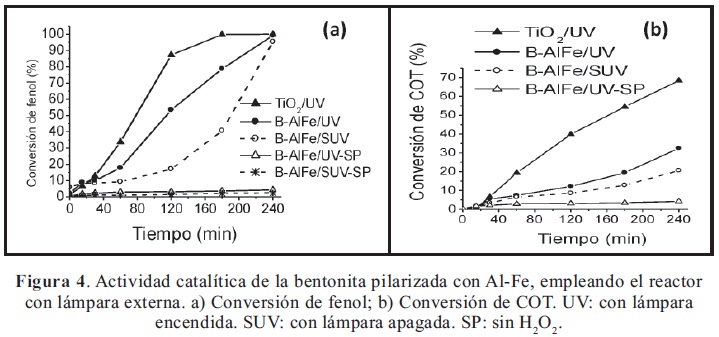
Adicionalmente, en el sistema dinámico (reactor con lámpara externa) existen mayores limitaciones de cinética física, asociadas a las dificultades en el transporte de partículas sólidas a través de todo el sistema. No obstante, los resultados de la Figura 4 indican que el catalizador es útil en un sistema dinámico, con posibilidades de optimización para ser empleado en situaciones realmente funcionales para eliminar compuestos orgánicos en efluentes acuosos residuales provenientes de industrias. Igualmente, la Figura 4 muestra la actividad fotocatalítica del TiO2 (Degussa), un catalizador comercial altamente activo con propiedades reconocidas, tomado como referencia para verificar la eficiencia en el funcionamiento del sistema dinámico de reacción y comparar el comportamiento fotocatalítico del catalizador B-AlFe. Al respecto, se observan mayores diferencias en las conversiones de COT, lo que indica que el catalizador B-AlFe probablemente presenta mayores dificultades en la oxidación de subproductos de la reacción, es decir en etapas posteriores a la conversión de fenol. También es claro que, el catalizador B-AlFe muestra períodos de inducción mayores que el TiO2, lo que revela mayores dificultades difusionales en la arcilla, máxime teniendo en cuenta que el TiO2, a diferencia de la arcilla pilarizada, forma suspensiones más homogéneas y con menor tamaño de partícula. Además, la Figura 4 muestra el papel del peróxido de hidrógeno diluido en presencia del catalizador y de radiación UV, verificando la existencia de un sistema de reacción foto-Fenton modificado: Sólido-Fe(III)/H2O2/UV.
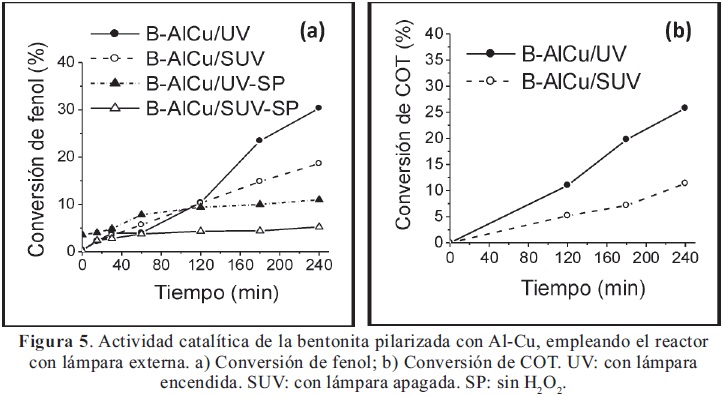
por otra parte, el catalizador B-AlCu muestra resultados importantes de actividad fotocatalítica en el sistema de reacción con lámpara externa (Figura 5). De nuevo se observa el incremento de las conversiones como respuesta a la irradiación del sólido con luz UV de baja potencia. Además, se verifica nuevamente el requerimiento del peróxido de hidrógeno en presencia del sólido y de radiación UV, lo cual evidencia el desarrollo de un sistema tipo foto-Fenton modificado: sólido-Cu(II)/H2O2/UV.
Los ensayos realizados en fase homogénea, con sales de Fe(III) o Cu(II) en concentración 3 ppm en el medio de reacción (Figura 6), verifican el efecto positivo de la radiación UV sobre el sistema Fenton (Fe(III)/H2O2), generando el proceso denominado foto–Fenton (Fe(III)/H2O2/UV). Transcurrido el tiempo de reacción (4 horas), la conversión de fenol es del 99% con una conversión de COT del 24%; mientras que en la reacción Fenton (Fe(III)/H2O2) (sin UV) la conversión de fenol no supera el 33%. De este modo, en el proceso foto–Fenton la eficiencia en la degradación del compuesto orgánico (fenol) mejora considerablemente debido a la regeneración de Fe(II) vía foto-reducción de Fe(III), con la consecuente producción adicional de radicales hidroxilos que conllevan a la oxidación de la molécula orgánica (Iurascu et al. 2009; De León et al. 2008; Ciesla et al. 2004; Andreozzi et al. 1999).
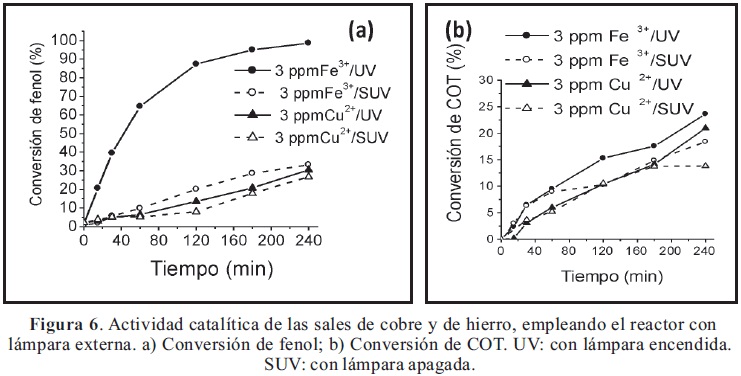
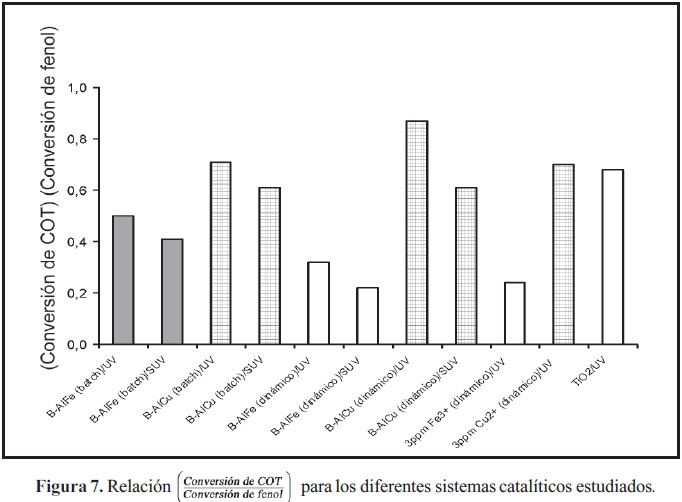
Por último, los resultados de actividad catalítica en medio homogéneo evidencian la mayor fotosensibilidad del hierro, en comparación con el cobre (Figura 6), permitiendo elevar de manera muy significativa los niveles de degradación de fenol. Estos resultados ratifican la mayor potencialidad del sistema B-AlFe, para ser empleado como catalizador en la eliminación de fenol mediante procesos fotoasistidos con radiación UV. Sin embargo, el sistema catalítico a base de cobre (B-AlCu o Cu(II)-homogéneo) muestra un efecto favorable de selectividad, hacia la formación de CO2 y agua. Dicho efecto se pone de manifiesto con las mayores relaciones (Conversión de COT/Conversión de fenol) en todos los ensayos catalíticos (Figura 7), lo cual constituye una observación de gran interés teniendo en cuenta que revela la posibilidad de diseñar sistemas catalíticos heterogéneos mixtos a base de hierrocobre (arcillas con pilares mixtos), con elevada potencialidad en cuanto a actividad catalítica y selectividad hacia CO2 y agua en la reacción de oxidación total de fenol fotoasistida y en medio acuoso diluido. Adicionalmente, la figura 7 muestra que la irradiación con luz UV incrementa la relación (Conversión de COT/Conversión de fenol), favoreciendo la tendencia de la reacción hacia la formación de CO2.
4. Conclusiones
En general, el estudio de actividad catalítica evidencia el incremento en la eficiencia de los catalizadores B-AlFe y B-AlCu mediante la asistencia con luz UV a baja potencia, indicando claramente que la bentonita del Valle del Cauca pilarizada con Al-Fe o Al-Cu presenta importante actividad fotocatalítica en la reacción de oxidación de fenol en medio acuoso diluido, bajo condiciones suaves de temperatura y presión (25°C y presión atmosférica). Los sistemas B-AlFe y B-AlCu fotoasistidos permiten elevar los niveles de COT. Sin embargo, el catalizador B-AlFe muestra mayor actividad en la conversión de fenol que en la conversión de COT, mientras que el sólido B-AlCu presenta niveles próximos de conversión de COT y conversión de fenol.
Agradecimientos
A la Universidad Nacional de Colombia, por su financiamiento a través del proyecto “Estudio de la relación entre la estructura y las propiedades de catalizadores obtenidos a partir de minerales arcillosos” (Quipú 202010012015 de la).
Referencias
Andreozzi R., Caprio V., Insola A., Marotta, R. 1999. Advanced oxidation processes (AOP) for water purification and recovery. Catalysis Today 53:51-59. [ Links ]
Busca G., Berardinelli S., Resini C., Arrighi L. 2008. Technologies for the removal of phenol from fluid streams: A short review of recent developments. Journal of Hazardous Materials 160:265-288. [ Links ]
Carriazo J. G., Moreno-Forero M., Molina R. A., Moreno S. 2010. Incorporation of titanium and titanium-iron species inside a smectite-type mineral for photocatalysis. Applied Clay Science 50:401-408. [ Links ]
Carriazo J., Molina R., Moreno S. 2007. Caracterización estructural y textural de una bentonita colombiana. Revista Colombiana de Química 36:213-225. [ Links ]
_____., Guélou E., Barrault J., Tatibouët J-M., Molina R., Moreno S. 2005. Catalytic wet peroxide oxidation of phenol by pillared clays containing Al-Ce-Fe., Water Research, 39:3891-3899. [ Links ]
_____., Guélou E., Barrault J., Tatibouet J. M., Moreno S. 2003. Catalytic wet peroxide oxidation of phenol over Al- Cu or Al-Fe modified clays. Applied Clay Science 22:303-308. [ Links ]
Cheng M., Song W., Ma W., Chen C., Zhao J., Lin J., Zhu H. 2008. Catalytic activity of iron species in layered clays for photodegradation of organic dyes under visible irradiation. Applied Catalysis B 77:355-363. [ Links ]
Ciesla P., Kocot P., Mytych P., Stasicka Z. 2004. Homogeneous photocatalysis by transition metal complexes in the environment. Journal of Molecular Catalysis A, 224:17-33. [ Links ]
Crittenden J. C., Liu J., Hand D. W., Perram D. L. 1997. Photocatalytic oxidation of chlorinated hydrocarbons in water. Water Research 31:429-438. [ Links ]
Daza C.E., Moreno S., Molina R. 2004. Bentonita Colombiana modificada con Al-Cu para la oxidación de fenol en medio acuoso diluido. Scientia et technica 37:265-270. [ Links ]
De León M., Castiglioni J., Bussi J., Sergio M. 2008. Catalytic activity of an iron-pillared montmorillonitic clay mineral in heterogeneous photo-Fenton process. Catalysis Today 133- 135, 600-605. [ Links ]
Fortuny A., Font J., Fabregat A. 1998. Wet air oxidation of phenol using active carbon as catalyst. Applied Catalysis B 19:165- 173. [ Links ]
Garrido-Ramirez E.G., Theng B.K.G, Mora M.L. 2010. Clays and oxide minerals as catalysts and nanocatalysts in Fenton-like reactions-A review. Applied Clay Science 47:182-192. [ Links ]
Gil A., Gandía L., Vicente M. A. 2000. Recent advances in the synthesis and catalytic applications of pillared clays. Catalysis Reviews-Science and Engineering 42:145-212. [ Links ]
Goldstein S., Rabani J. 2008. The ferrioxalate and iodide actinometers in the UV region. Journal of Photochemistry and Photobiology A 193:50-55. [ Links ]
Iurascu B., Siminiceanu I., Vione D., Vicente M. A., Gil A. 2009. Phenol degradation in water through a heterogeneous photo-Fenton process catalyzed by Fe-treated laponite. Water Research 43:1313-1322. [ Links ]
Jankowski J., Kieber D., Mopper K. 1999. Nitrate and nitrite ultraviolet actinometers. Photochemistry and Photobiology 70:319-328. [ Links ]
Ksontini N., Najjar W., Ghorbel A. 2008. Al-Fe pillared clays: Synthesis, characterization and catalytic wet air oxidation activity. Journal of Physics and Chemistry of Solids 69:1112- 1115. [ Links ]
Liotta L. F., Gruttadauria M., Di Carlo G., Perrini G., Librando V. 2009. Heterogeneous catalitic degradation of phenolic substrates: Catalysts activity. Journal of Hazardous Materials 162:588-606. [ Links ]
Martínez F., Callejas G., Melero J. A., Molina R. 2007. Iron species incorporated over different silica supports for the heterogeneous Photo-Fenton oxidation of phenol. Applied Catalysis B 70:452-460. [ Links ]
Ministerio de Salud. Colombia, Decreto 1594: Normas de aguas de vertimientos. Bogotá, 26 de junio de 1984. [ Links ]
Song W., Cheng M., Ma J., Ma W., Chen C., Zhao J. 2006. Decomposition of hydrogen peroxide driven by photochemical cycling of iron species in clay, Environmental and Science Technology 40:4782-4787. [ Links ]
Suárez-Ojeda M.E., Carrera J., Metcalfe I.S., Font J. 2008. Wet air oxidation (WAO) as a precursor to biological treatment of substituted phenols: Refractory nature of the WAO intermediates. Chemical Engineering Journal 144:205-212. [ Links ]
Recibido: julio 5 de 2011. Aceptado para su publicación: agosto 30 de 2011.