Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales
versión impresa ISSN 0370-3908
Rev. acad. colomb. cienc. exact. fis. nat. vol.35 no.136 Bogotá jul./set. 2011
QUÍMICA AMBIENTAL
Laura Emilia Cerón Rincón1, Eduardo Ramírez Valencia2
2 Director Departamento de Ciencias Básicas Universidad EAN. Correo electrónico: eramirez@ean.edu.co
Resumen
Las cuencas hidrográficas en Bogotá D.C. son complejos sistemas ambientales que han sufrido graves alteraciones dadas por la urbanización, la actividad agrícola y ganadera y actividades industriales. El objetivo de este estudio fue comparar el estado de dos cuencas urbanas en Bogotá D. C. en el sistema Córdoba - Juan Amarillo, a través de algunos indicadores de salud y calidad de suelos, las actividades enzimáticas: deshidrogenasa, fosfatasa alcalina, fosfatasa ácida y o-difenol oxidasa y las fracciones de carbono activo, para evaluar su condición. Se recomienda el uso de dichas actividades como parámetro de evaluación en programas de manejo ambiental para el sistema.
Palabras clave: humedales, contaminación, fosfatasa ácida, fosfatasa alcalina, deshidrogenasa, o-difenol oxidasa y carbono activo.
Abstract
The river basins of Bogotá D.C. are environmentaly complex systems which have suffered serious alterations by urbanization, agricultural, livestock and industrial activities. The purpose of this study was to compare the status of two urban river basins in Bogotá D.C. for the Córdoba - Juan Amarillo system, through soil health and quality index, the enzymatic activities (dehydrogenase, alkaline phosphatase, acid phosphatase, and o-diphenoloxidase) and active carbon fractions. The use of such activities as evaluation parameters for the environmental management program for the system is recommended.
Key words: wetland, pollution, acid phosphatase, alkaline phosphatase, dehydrogenase, o-diphenoloxidase and active carbon.
Introducción
Los humedales son ecosistemas intermedios entre el medio acuático y el terrestre, caracterizados por porciones húmedas, semi-húmedas y secas de gran importancia, dado que retienen el agua que en épocas de lluvias, reservándola para las temporadas secas, regulando así los efectos perjudiciales de las crecientes de los ríos y de las inundaciones. Aún cuando los humedales ocupan sólo entre 4- 6% de la superficie terrestre, ellos poseen un papel importante en el ciclo de carbono (Hernández, 2010) y de otros nutrientes en el planeta.
El sistema hídrico de Bogotá D.C. está formado por más de 200 cuerpos de agua, entre humedales, quebradas y canales, que hacen parte del sistema de drenaje pluvial de la ciudad. El Acuerdo 6 de 1990, el acuerdo 19 del 1994 y el acuerdo 27 de 1995 designan los humedales de Bogotá (DAMA, 2006) como Áreas Protegidas y Reservas Naturales. Los humedales están incluidos dentro de la categoría de ecosistemas estratégicos al igual que las áreas verdes que están dentro del perímetro urbano. Sin embargo, el crecimiento poblacional de la ciudad ha determinado una progresiva la intervención del territorio, colocando sus aguas al servicio del crecimiento urbano y aun no existe claridad frente al tipo de manejo que se les darán (Palacio et al. 2003) ya que, prevalecen aspectos que les dan una integración más urbana que ecológica. El carácter de Áreas Protegidas que tienen los humedales y el hecho de pertenecer a la Estructura Ecológica Principal del Distrito, deberían ser razones suficientes (Castaño, 2002) para evitar convertirlos en parques urbanos y que se continúe utilizándolos como parte del sistema de alcantarillado de la ciudad. En la localidad de Suba se encuentran algunos de los ecosistemas más importantes de la ciudad, como son los humedales de La Conejera, Juan Amarillo, Córdoba y Guaymaral. Este trabajo se desarrolló en el Sistema Córdoba - Juan Amarillo (Figura 1) el humedal de Córdoba está funcionalmente relacionado con el Humedal Juan Amarillo (DAMA, 2010) dado que hace parte del mismo sistema biofísico. El humedal Córdoba en al actualidad se encuentra fragmentado en 3 partes, está conectado con el "Parque Urbano Canal Córdoba" y "Parque Metropolitano Canal de los Molinos", continúa al occidente con el lago del Club Choquenzá, Los Lagartos y el Humedal Juan Amarillo o Tibabuyes, formando el Sistema Córdoba - Juan Amarillo. El humedal de Juan Amarillo, también llamado Laguna de Tibabuyes está dentro del área inundable de los ríos Bogotá y Juan Amarillo, los que junto con el humedal forman parte de la estructura primaria del sistema hídrico de la ciudad, fue declarado como Parque Ecológico Distrital de Humedal en 2004 y es el humedal más grande que tiene la capital del país. Su principal función es de amortiguación, que consiste en la retención de gran parte de los sedimentos de la sub-cuenca del Humedal de Córdoba, que hace parte de la cuenca del Río Juan Amarillo.
Con el desarrollo de la civilización los factores antropogénicos han tomado el papel principal en los cambios que pueden sufrir los ecosistemas, por ello se requiere definir cómo y en qué intensidad los afectan, las investigaciones en torno al tema hacen parte de los esfuerzos para enmarcar un manejo sostenible de los recursos (Cerón & Melgarejo, 2005) que asegure su conservación. Recientemente (Kang & Stanley, 2005) se le ha prestado atención a la conservación de las planicies inundables a lo largo de los ríos, dada su importancia en el mejoramiento de la calidad del agua y por la biodiversidad que soportan, dichas planicies y los suelos en general constituyen el hábitat de muchos organismos que colectivamente contribuyen a una gran variedad de bienes y servicios ambientales (Kibblewhite et al. 2008) resultado de funciones tan importantes como filtrar, amortiguar y transformar la materia, para proteger el ambiente y los nacimientos de agua de la contaminación (Doran, 2002; Doran & Zeiss, 2000). Son pocos los estudios a nivel global y nacional en torno a la canalización de ríos y humedales y su impacto en los procesos de los ecosistemas y degradación de los recursos naturales, las principales causas de degradación y reducción de la productividad de los suelos están relacionadas directamente con manejos inadecuados y la contaminación accidental o deliberada (Gianfreda et al. 2005) con desechos domésticos e industriales. Para evaluar el impacto de los contaminantes y el potencial remediador del ecosistema, se hace necesario contar con medidas relacionadas con el estado metabólico de la comunidad que lo habita. Las actividades enzimáticas del suelo se han sugerido como potenciales dentro de un conjunto de indicadores de salud y calidad, debido a su relación con la biología del suelo, ya que su presencia depende directamente de su continua liberación al ambiente, llevada a cabo principalmente (Caldwell, 2005; Burns, 1982) por la actividad microbiana, son sensibles a los cambios generados por contaminación y están relacionadas directamente con la remediación de contaminantes y con otros factores (Dick &Tabatabai, 1992) biológicos, químicos y físicos.
La actividad fosfatasa cataliza la hidrólisis de esteres de fosfato, liberando los grupos fosfato que estén en enlazados a sustratos más complejos como la materia orgánica del suelo, siendo así las responsables de la mineralización del fósforo orgánico en forma de fósforo inorgánico el cual queda disponible para los requerimientos de microorganismos y plantas. Esta actividad se clasifica en acida (pH 6.5) o alcalina (pH 11) según su pH óptimo. Las fosfatasas ácidas se derivan tanto de plantas como de microorganismos, mientras que las alcalinas se derivan principalmente de microorganismos. La actividad deshidrogenasa refleja el trabajo de un grupo de enzimas intracelulares que están presentes en la microbiota del suelo, estas hacen parte de las reacciones metabólicas involucradas en la transferencia oxidativa de energía y son consideradas un buen indicador de la actividad microbiana además de ser sensibles a la degradación del suelo también se ven afectadas por los cambios estacionales. Existen evidencias (Doi & Ranamukhaarachchi, 2009) para considerar la actividad deshidrogena como indicador de la condición de los de suelos (degradación o rehabilitación) y de cambios estacionales de lluvias/sequias. Se ha demostrado (Perucci et al. 2000) la importancia de los productos ácidos y fenólicos liberados durante la hidrólisis microbiológica de sustancias que están presentes en los suelos naturalmente como residuos vegetales y orgánicos y de compuestos sintéticos como residuos industriales y plaguicidas, en la formación de las sustancias húmicas. Los productos fenólicos son generalmente inestables y están sujetos a la conversión oxidativa mediante reacciones abióticas o catalizadas por enzimas oxidativas, a quinonas las cuales polimerizan a macromoléculas semejantes al humus. Los compuestos fenólicos en el suelo se transforman por procesos oxidativos principalmente catalizados por fenolosas y peroxidasas que provienen de la microbiota presente en el suelo. El carbono orgánico del suelo (COS) naturalmente varía a través del paisaje, los tipos del suelo y zonas climáticas. Se caracteriza por altos niveles de C en formas recalcitrantes o humificadas. Pequeños cambios en el COS como resultado de manejo de los suelos son difíciles de medir, pero pueden tener efectos pronunciados sobre el comportamiento del suelo y los procesos microbianos. Sin embargo la detección de cambios en la fracción pequeña y relativamente lábil de COS, proporciona un indicador de una posible degradación o mejoramiento como consecuencia de prácticas de manejo. Dicha fracción es el combustible de la cadena alimenticia entonces posee una gran influencia en los ciclos de los nutrientes y en muchas de las propiedades biológicas de los suelos, por lo que se denomina una fracción activa a diferencia del carbono orgánico total el cual es fuente de un carbono pasivo o altamente recalcitrante. La fracción activa de carbono sirve como indicador de calidad sensible a los cambios inducidos por el manejo, incluye: el carbono microbiano, la materia orgánica particulada y los carbohidratos del suelo.
Dado lo anterior se propone comparar en términos de indicadores de salud y calidad de suelos y sedimentos del Sistema Córdoba - Juan Amarillo (Figura 1) ubicado en la localidad de Suba Bogotá D. C; que permitan estimar el estado de las cuencas, su contribución a la salud ambiental de la ciudad y que puedan servir para el monitoreo de los recursos.
Materiales y métodos
Lugar de estudio. El humedal Córdoba (Figura 1) se encuentra localizado entre las calles 116 y 127 y entre las avenidas Córdoba y Boyacá. Como se mencionó se encuentra fragmentado en tres partes, el primer cuerpo fue separado por la Avenida 127 y se encuentra al norte de esta. El segundo cuerpo está separado por las avenidas 127 y Suba. El tercero se localiza entre las avenidas Suba y Boyacá. Según el plan de manejo del Humedal Córdoba (DAMA, 2008) la problemática ambiental del Parque Ecológico Distrital humedal Córdoba se resume así: Compromiso de la Calidad de agua afectada por aportes de aguas residuales, existen cuatro vertimientos directos de aguas negras en el sector medio del humedal, ubicados frente al sector del barrio Niza Antigua y otros cuatro ubicados frente al barrio pontevedra hacia la avenida Suba. Estructuras hidráulicas deficientes originando restricciones al flujo de agua, desconexión hídrica y ecológica del humedal con la Estructura Ecológica Principal y acumulación de basuras y escombros en zonas del humedal. Pastoreo de animales, presencia de animales domésticos y otros depredadores. Desarrollo de usos no compatibles o permitidos al interior de la Zona de Manejo y Preservación Ambiental del humedal. Incompatibilidad de algunas actividades urbanas contiguas, respecto a las expectativas de conservación y manejo del humedal. Depredación de la fauna silvestre por parte de perros y gatos (callejeros y domésticos) que atacan las aves, especialmente a las tinguas. podas inadecuadas en las zonas de ronda, que generan pérdida de cobertura vegetal. Dado lo anterior en el marco del conflicto ambiental generado en torno a las intervenciones para la recuperación del humedal, se presentó una Acción popular (No. 254 de 2000) dentro de la cual actualmente (DAMA, 2008) se realiza un ejercicio de concertación pública, entre el Distrito y la comunidad y existe una Resolución Defensorial (No. 018 de 2003) con lo que mejoraron algunas de las problemáticas del Humedal.
En el Río Juan Amarillo (Figura 1) el humedal se comporta como una trampa de sedimentos entrando 3400 mg/l de sólidos totales, de los cuales se han detectado a la salida 1320 mg/l, lo que quiere decir que en alguna parte del cauce o derivado de lo que rebosa del humedal, se están quedando 2170 mg/l, que equivalen al 62,2% de los sólidos transportados por el río. Adicionalmente las descargas de aguas de origen doméstico provenientes del barrio el Rosal de Suba, que llegan al caño Juan Amarillo en el sector Aures. Entre los años 60 y 70 se desvió del cauce del Río Juan Amarillo, mediante la construcción de un jarillón, lo cual contribuyó a su desecación y reducción de volumen de agua y a la reducción de la superficie del humedal, asociada al relleno y desecación del humedal para construcción de vivienda y vías. Todas las aguas negras de esta gran cuenca, que se inicia en los Cerros Orientales y de sus alrededores, van a parar al Juan Amarillo (DAMA, 2010). Muchos de los asentamientos subnormales, se muestran carentes de servicios de alcantarillado, evacuando sus aguas residuales directamente sobre el humedal. El sector del barrio Lisboa se encuentra por debajo del nivel de las aguas del humedal y bombea sus aguas negras hacia el humedal, permaneciendo los pozos sépticos a cielo abierto y convirtiéndose en la causa de que afectan principalmente a la población infantil.
Toma de muestras: Se definieron dos lugares de estudio donde se tomaron muestras de suelos y sedimentos en marzo de 2011, época en la que se tubo la mayor precipitación 180 mm registrada hasta el momento en Bogotá, D.C. En el Humedal de Córdoba (4° 42' 13.4" N, 74° 3' 59.7" W) se tomaron muestras en el segundo y tercer sector del humedal (Figura 1) para un total de 5 puntos de muestreo, 3 puntos en el segundo sector paralelos a la Avenida Córdoba entre calles 116 y 124 y en el tercer sector del humedal pasando la avenida suba, paralelos a la calle 117 se tomaron 2 puntos entre las Carreras 70C y 70F. Para el Río Juan Amarillo (4° 43' 49.79" N, 74° 6' 34.9" W) se tomaron muestras a la altura del Humedal Juan Amarillo en 2 puntos de muestreo (Figura 1) paralelo a la calle 98 entre las carreras 91 y 94L.
Las muestras de suelos se tomaron a una profundidad entre 5 y 10 cm y las de sedimentos se tomaron superficiales entre 0 a 5 cm, en cada lugar de muestreo se tomaron nueve muestras en un esquema en W. Las muestras transportaron en bolsas y refrigeradas hasta el laboratorio, donde se reunieron al azar en tres grupos, para obtener tres replicas (muestras compuestas) por cada punto de muestreo. Las muestras compuestas de suelos y sedimentos se homogeneizaron y pasaron por tamiz (2 mm) para disgregarlas, enseguida se almacenaron a -20°C. Se realizó determinación del contenido de agua de cada una de las muestras compuestas, por diferencia de peso antes y después de secarlas en horno a 72°C por 48 horas.
Determinación del pH de agua y suelos. Se realizó una sola determinación por lugar de muestreo usando método potenciométrico, para suelos por suspensión del suelo en agua destilada en una relación (p:v) 1:2.5; las muestras de agua se tomaron superficiales.
Determinación de actividades enzimáticas y fracciones de carbono activo. Se determinaron las actividades deshidrogenasa (EC 1.1.1.1), fosfatasa alcalina (EC 3.1.3.1) y fosfatasa ácida (EC 3.1.3.2) en los suelos y sedimentos, la actividad difenol oxidasa (EC 1.10.3.1) se determinó en los suelos y las fracciones de carbono activo se determinaron en los suelos y sedimentos; todas las medidas se realizaron por duplicado, a cada una de las tres replicas (muestras compuestas) obtenidas por lugar de muestreo, desarrollando los métodos que se describen a continuación:
Actividad deshidrogenasa (EC 1.1.1.1). Se determinó de acuerdo al método de Casida et al. (1964) el ensayo enzimático se basa en la determinación de trifenil formazan TPF formado por la actividad a partir de la reducción cloruro de trifenil tetrazolio TTC, este último sirve como aceptor de electrones para varias deshidrogenasas. La muestra de suelo se incubó en buffer Tris-HCl 100 mM pH 7,8 con el sustrato, por 24 horas a 30°C en agitación, el trifenil formazán producto de la actividad se extrajo en acetona y se determinó colorimétricamente a 546 nm, la actividad se expresó en µg de TPF/g suelo seco*h.
Actividades fosfatasa alcalina (EC 3.1.3.1) y ácida (EC 3.1.3.2) se determinaron por el método reportado por Eivazi & Tabatabai (1977) y modificado por Tabatabai (1982) el ensayo enzimático, se basa en la determinación de ρ- nitrofenol liberado por la enzima a partir de sustrato ρ- nitrofenilfosfato, el sustrato se incubó con la muestra de suelo 1 h a 37°C en buffer de trabajo pH 6,5 para determinar fosfatasa ácida y en buffer de trabajo pH 11 para determinar fosfatasa alcalina. El ρ-nitrofenol liberado por actividad se extrajo en medio alcalino y se determinó colorimétricamente a 400 nm. Las sustancias húmicas disueltas incrementan en medio alcalino y pueden interferir con la determinación de ρ-nitrofenol; por ello, se adicionó cloruro de calcio a las muestras para evitar dispersión de minerales de arcilla. La actividad se expresó en µmol de ρ-nitrofenol/g suelo seco*h.
Actividad o-difenol oxidasa (EC 1.10.3.1) se determinó por el método reportado por Perucci et al. (2000) el problema más importante en el estudio de la oxidación de los compuestos fenólicos en los suelos, es la baja disponibilidad del sustrato oxidado causado por la sorción de los componentes de suelo en la interface con la catálisis enzimática, dado que se dan reacciones inmediatamente después del contacto del catecol con el suelo. Las quinonas formadas por la oxidación de compuestos fenólicos son altamente reactivas y capaces de formar varios productos de condensación, especialmente en presencia de compuestos con grupos amino libres, este método se basa en la formación de dichos compuestos, a través de la desarrollo de la oxidación enzimática del catecol y posterior reacción con la prolina, usando la determinación colorimétrica a 525 nm. Los reactivos se disolvieron en buffer fosfatos 0.1M pH 6.5, se agitaron vigorosamente por 3 minutos para su oxigenación y que se incubaron con la muestra de suelo por 10 minutos a 30°C. La actividad se expresó en µmol catecol oxidado/g suelo seco*h.
Fracciones de carbono activo: se determinó por el método de Blair et al. (1995) modificado por Weil et al. (2003) que se basa en la determinación del carbono oxidable en presencia de permanganato de potasio (KMnO4), la muestra de suelo se suspendió en solución de KMnO4 0.2M en CaCl2 1M (pH 7.2), se agitó por 5 minutos a temperatura ambiente, se midió absorbancia a 565 nm. La pérdida de color del reactivo es proporcional es proporcional a la cantidad de carbono oxidable en los suelos. La cantidad de carbono activo se expresó en mg C/Kg suelo seco.
Análisis estadísticos. Se realizaron pruebas de análisis de varianza de una vía (p < 0,05) para comparar en efecto sobre las actividades enzimáticas y fracciones activas de carbono, por los diferentes lugares de muestreo. Para los análisis que resultaron significativos, se determinaron las diferencias entre las medias por mínima diferencia significativa. Los análisis se realizaron utilizando el sofware estadístico SPSS 17.0.
Resultados y discusión
pH de suelos y aguas. Se observó que a medida que el sistema está más intervenido incrementa el pH (Tabla 1) tanto en suelos y aguas. En el segundo sector del Humedal Córdoba se encuentra mas diversidad de vegetación acuática y terrestre, particularmente en los suelos aledaños al humedal a la altura de la calles 124-117 se encuentran arbustos de pino cuyas hojas en el suelo forman una capa de mantillo de agujas de pino, mientras que en el tercer sector (Cr 70-70F) donde se realizaron los muestreos se encuentran algunos arboles rodeados principalmente por los pastos "grama gruesa" (Pennisetum clandestinum). El pH determinado en las aguas y suelos aledaños al río Juan Amarillo (Cr 91-94L) evidencia las problemáticas dadas por una parte a la modificación hidráulica del rio por la construcción de jarillones y por otra, a la contaminación que sufre el rio por la adición de vertimientos domésticos e industriales, relacionadas con la alta densidad de ocupación y producción urbana y otras fuentes de contaminación como el pastoreo de animales.
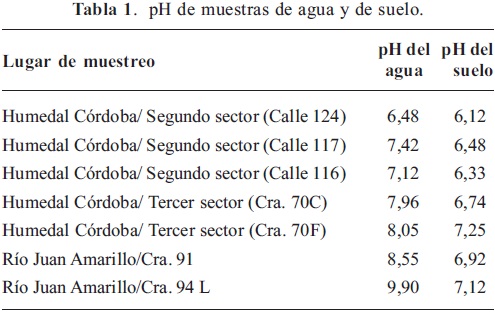
Actividad deshidrogenasa. La medida de esta actividad enzimática en el suelos y sedimentos comprende distintos sistemas deshidrogenasas y su origen está en la oxidación biológica, mediante procesos de deshidrogenación de diferentes compuestos orgánicos, que se ligan a una cadena de transporte de electrones acoplados a la síntesis de ATP, la cual tiene bajo condiciones aeróbicas al oxígeno como aceptor final, por lo que se considera (Casida et al. 1964) una medida in situ de actividad microbiana. La variación de la actividad deshidrogenasa refleja el estatus de degradación/ rehabilitación de los terrenos, se ha encontrado (Doi & Ranamukhaarachchi, 2009; García et al. 1997) correlación significativa con la disminución de la densidad y el aumento de la capacidad de campo, siendo un criterio para medir dicho estatus en los suelos. La actividad deshidrogenas se considera además una técnica superior (Soares et al. 2006) a las que involucran un umbral de observación, como por ejemplo los recuentos de un grupo microbiano objetivo por número más probable, también responde a gradientes ambientales, sirviendo como una medida integrativa de la calidad. Dado lo anterior, es ampliamente aplicada (Maliszewska-Kordybuch & Smreczek, 2003) en pruebas ecotoxicológicas en suelos.
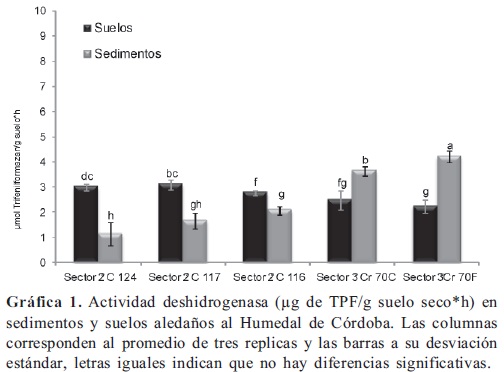
Se encontró que la actividad deshidrogenasa (Gráfica 1) fue significativamente mayor (p < 0,05) en los sedimentos tomados en el tercer sector del Humedal Córdoba (Cra. 70C-70F) en relación con la misma, evaluada en los sedimentos tomados en el segundo sector (Calle 124-116). En general no hubo diferencias significativas entre las actividades evaluadas en los suelos aledaños al Humedal. En el segundo sector los suelos presentaron una actividad significativamente mayor (p < 0,05) en relación a la evaluada en los sedimentos tomados en el mismo lugar, mientras que en el tercer sector se observó lo contrario. No se encontraron diferencias significativas entre las actividades de suelos y sedimentos colectados del rio Juan Amarillo (Gráfica 2), pero en promedio fue alrededor del doble frente a la misma determinación para el Humedal Córdoba, lo que se puede relacionar directamente con las problemáticas de manejo y contaminación que presenta el rio Juan Amarillo. La actividad deshidrogenasa puede responder (Jezierska-Tys & Fr c, 2009) a incrementos en la concentración de amonio NH4+ y del pH, debidos a la aplicación diaria de diferentes dosis de lodos residuales ricos en carbono y nitrógeno. Se ha encontrado (Weaver et al. 2011) más del doble de la actividad en humedales construidos frente a humedales naturales no disturbados, acompañada de una disminución en la diversidad microbiana y un descenso en las poblaciones de hongos e incrementos en bacterias gran-positivas; también es un indicador sensible para medir toxicidad por metales pesados y contaminantes orgánicos (Gianfreda et al. 2005; Zhou et al. 2005; Wu et al., 2008; Peruzzi et al. 2011) junto con la actividad fosfatasa, así como otros parámetros como bacterias totales y respiración. La incorporación de lodos de aguas residuales urbanas tiene efecto sobre la actividad microbiana por el incremento de nutrimentos, ellos contienen niveles apreciables de nitrógeno (amonio, nitritos nitratos), fósforo y micronutrientes como Fe, Cu y Zn, que pueden ser eliminados al ser irrigados controladamente (Brzeziñska et al. 2001) ya que, el suelo puede actuar como una especie de filtro natural (Chen et al. 2008); sin embargo, altas dosis de dichos residuos también inhiben la actividad microbiana (Singh & Agrawal, 2008) por la presencia de metales pesados y sustancias tóxicas, que deben ser considerados prioridad para su biorremediación, la presencia de dichas sustancias en el ambiente lleva a las poblaciones que lo habitan a estrés, evidenciado también (Vieira et al. 2003) por el incremento de la tazas metabólicas de (qCO2). En planicies inundables del ríos se ha observado (Carreira et al. 2008) inhibición de las actividades deshidrogenasa y fosfatasa ácida, en respuesta a la contaminación con metales pesados y su recuperación después de restauración de la vegetación.
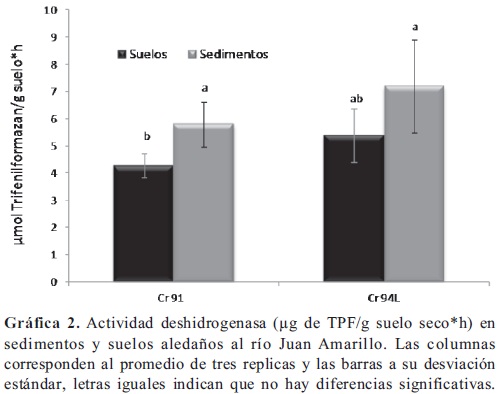
Actividad fosfatasa alcalina. Se encontró que la actividad fosfatasa alcalina fue significativamente mayor (p < 0,05) en los sedimentos tomados en el tercer sector del Humedal Córdoba (Gráfica 3), en relación con la misma evaluada en los sedimentos y suelos tomados en el segundo sector. En general no hubo diferencias significativas la actividad evaluada en los suelos aledaños al Humedal, solamente para las muestras de suelos tomadas en el en el tercer sector (Cra. 70C) donde la actividad fue significativamente mayor (p < 0,05), frente a la evaluada en los suelos del segundo sector (C 116). En el río Juan Amarillo (Gráfica 4), la actividad de los sedimentos tomados a la altura de la carrera 94L fue significativamente menor (p < 0,05), frente a las demás fosfatasas alcalinas evaluadas en este lugar. Aunque el pH es uno de los factores determinantes (Güsewell & Freeman, 2005; Acosta-Martínez & Tabatabai, 2000; Canet et al. 2000; Kang & Freeman, 1999) en la actividad microbiana, únicamente se observó que puede tener relación con el incremento de la actividad evaluada en los sedimentos en el tercer sector del humedal. Las modificaciones que la urbanización han dado a los ecosistemas del sistema Córdoba-Juan Amarillo como la fragmentación y la disminución de vegetación en el tercer sector en el humedal; la construcción del jarillón en el rio Juan Amarillo y la contaminación, se pueden relacionar con el incremento en las actividades fosfatasa y deshidrogenasa. La construcción de diques y jarillones trae consigo modificaciones hidrológicas, cambios en la composición vegetal, en la disponibilidad de agua, en la química de los suelos inundables y por tanto, cambios en la dinámica de la materia orgánica; factores que se han relacionado anteriormente (Kang & Stanley, 2005) con incrementos significativos en las actividades deshidrogenasa, fosfatasa y glucosidasa.
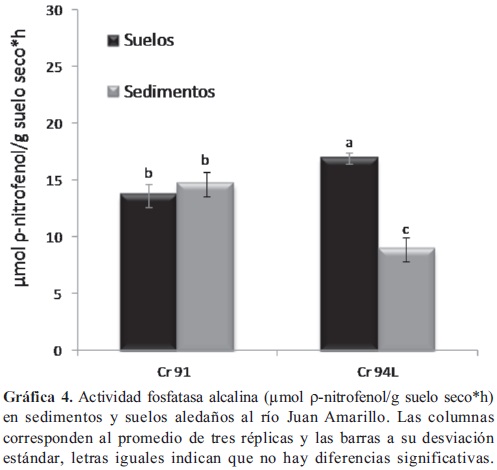
Actividad Fosfatasa ácida. La actividad en los sedimentos tomados en el segundo sector del Humedal Córdoba (Gráfica 5) a la altura de las calle 124-117, fue significativamente mayor (p < 0,05) frente a la actividad evaluada en los sedimentos tomados en tercer sector del humedal. por el contrario, la actividad de los suelos del segundo sector del humedal (C 124 y 117), presentaron una actividad significativamente menor (p < 0,05), frente a la de los demás suelos tomados en el humedal. No hubo diferencias significativas entre las fosfatasas ácidas de los sedimentos y suelos del río Juan Amarillo (Gráfica 6) y dicha actividad fue similar a la encontrada en el tercer sector del humedal.
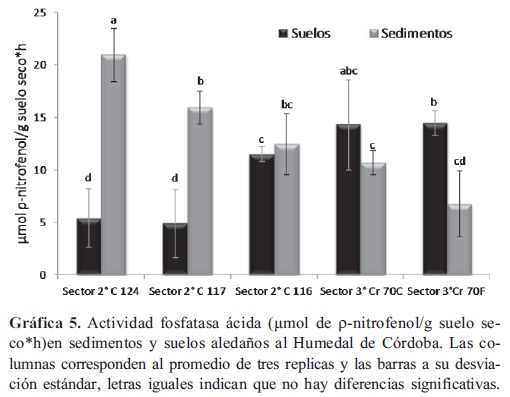
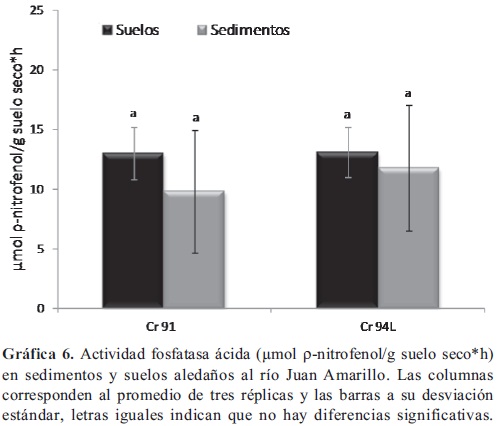
La actividad fosfatasa en suelos esta dada principalmente por las enzimas microbianas (fosfatasa alcalina) y la enzimas excretadas por la raíces de las plantas (fosfatasa ácida), dicha actividad puede ser estimulada por el sustrato (Gressel & McColl, 2003) compuestos orgánicos de fósforo, aunque no se ha observado (Güsewell & Freeman, 2005) una relación directa con la limitación de fosforo. El comportamiento de la actividad fosfatasa ácida evaluada en el sistema Córdoba-Juan Amarillo se puede atribuir a que, por una parte, en segundo sector se encuentra diversidad de vegetación acuática, que disminuye considerablemente el tercer sector, debido a la fragmentación del humedal y por otra en el rio Juan amarillo encontramos la mayor afectación del sistema, por las problemáticas mencionadas anteriormente. Se ha reportado en humedales construidos y su interacción con los contaminantes (Gagnon et al. 2007; Yang et al. 2008) que el tipo de vegetación puede incrementar la actividades fosfatasas, al evaluar la posible producción de estas enzimas por especies macrófitas, se encontró una mayor densidad y actividad microbiana en presencia de dichas plantas, siendo posible relacionar la actividad microbiana, el crecimiento vegetal y las tasas de remoción de materia orgánica; dado que, en las superficies radiculares están presentes gran diversidad de bacterias aerobias y facultativas envueltas en biopelículas. Se recomienda (Peruzzi et al. 2011) introducir diferentes especies de macrófitas acuáticas, para incrementar la actividad microbiana y estudiar el efecto de la especie vegetal sobre la misma, por ejemplo para incrementar la eficiencia en humedales construidos para el tratamiento de lodos de aguas residuales y contaminación por metales pesados.
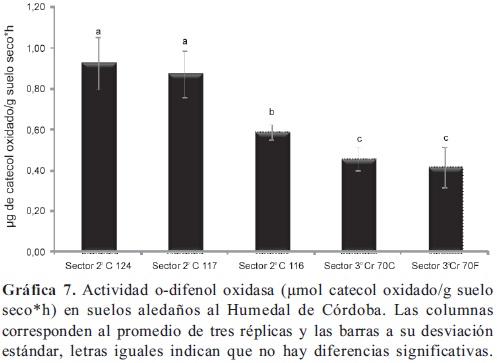
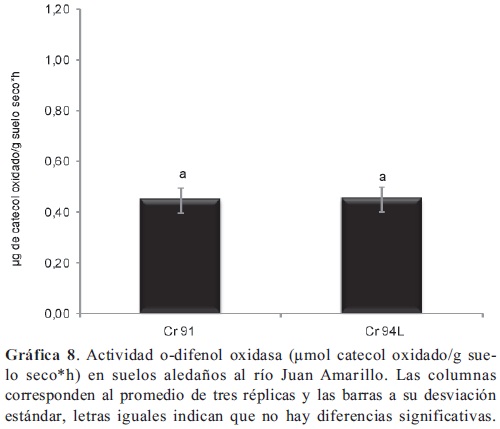
Actividad o-difenol oxidasa. La actividad determinada en las muestras de suelo colectadas en el segundo sector del humedal (Gráfica 7) a la altura de las calles 124 y 117, fueron significativamente mayores (p < 0,05) a las demás o-difenol oxidasas evaluadas en el humedal. En el río Juan amarillo (Gráfica 8) la actividad fue similar a la encontrada en los suelos del tercer sector del humedal. Como ya se mencionó, en los suelos del segundo sector del humedal (C 124 y 117) se encuentran un matillo de agujas de pino, este material vegetal resulta recalcitrante, debido su contenido de compuestos fenólicos. La o-difenol oxidasa cataliza la oxidación de compuestos fenólicos a catecol (Perucci et al. 2000), proporcionando una medida de la capacidad de la microbiota para degradar materiales potencialmente recalcitrantes. Los polifenoles, el catecol y el metil catecol son compuestos tóxicos inclusive para los microorganismos (Ramos-Cormenzana et al. 1996; Capasso et al. 1995) y poseen en general efecto inhibitorio sobre otras enzimas (Freeman et al. 2004), dicho efecto que se pudo observar en este estudio sobre la actividad fosfatasa, pero no se observó sobre la deshidrogenasa. Se ha observado (Benítez et al. 2004) incrementos en la actividad deshidrogenasa y en la o-difenol oxidasa, en respuesta al la adición de residuos compostados de la industria de la oliva ricos en polifenoles, la disponibilidad de oxígeno también incrementa la actividad (Kang et al. 2009) dado que este participa en la reacción, así como el pH (6-7) y el contenido de fenoles disueltos (Toberman et al. 2010) son cruciales en su regulación; ya que la actividad deshidrogenasa está relacionada con el estado metabólico de las poblaciones microbianas (García et al. 1997; Casida et al. 1964) la relación entre actividades deshidrogenasa y odifenol oxidasa, proporciona información acerca de respuesta de las comunidades microbianas a la presencia de estos compuestos fenólicos, lo que indica que hay un proceso de degradación y por tanto una dinámica de la materia orgánica en el mantillo, localizado en el segundo sector del humedal Córdoba. La actividad o-difenol oxidasa está relacionada con la taza degradación vegetal en el mantillo, por lo que está influenciada directamente por el tipo de vegetación y su expresión está ligada a la disponibilidad de nutrientes; se ha observado (Monkiedje et al. 2006) que el incremento de nutrientes (nitrógeno y fósforo) por efecto de diferentes prácticas agrícolas, tienen efectos negativos sobre la actividad, así como, el incremento de nutrientes y la disminución de la diversidad vegetal en ecosistemas acuáticos naturales, tienen influencia negativa (Penton & Newman, 2008) sobre esta actividad. Se puede postular, que la diminución de la actividad o-difenol oxidasa en tercer sector del humedal y en el río Juan Amarillo, puede estar relacionada con la disminución de la diversidad vegetal y la introducción de residuos urbanos al sistema; las tres enzimas determinadas en este estudio pueden responder a la fragmentación del Humedal Córdoba, que trae como consecuencia la reducción del espejo de agua, la reducción en la diversidad de la vegetación y el aumento del pH de aguas y suelos, entre el segundo y tercer sector. La actividad deshidrogenasa fue el indicador que mejor respondió a la afectación de los diferentes puntos de muestreo que se tomaron el sistema Córdoba Juan Amarillo, actividad que anteriormente se pudo establecer (Cerón & Ramírez, 2011) como indicador relacionado con el gradiente de contaminación presente en la cuenca alta de rio Arzobispo en Bogotá D.C.; la actividad deshidrogenasa encontrada en el río Juan Amarillo puede tener relación con aumento del las descargas de residuos urbanos, disminución en la diversidad de la vegetación y actividades como el pastoreo de animales.
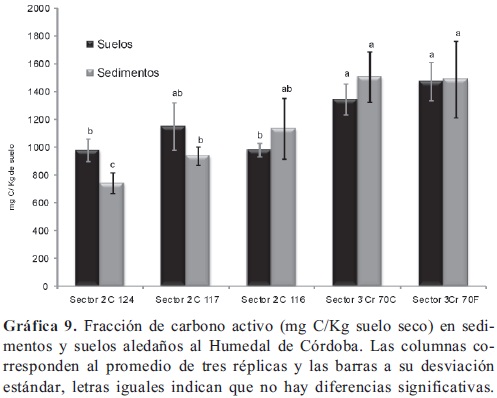
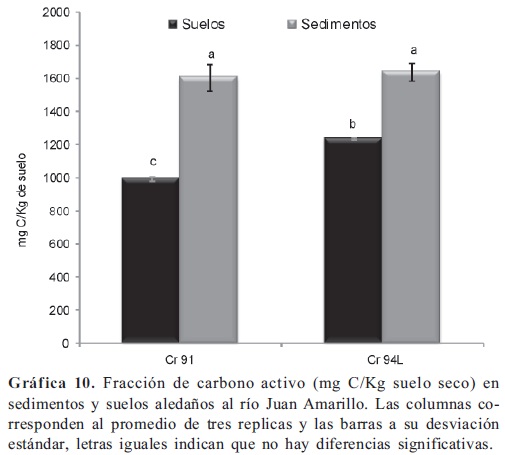
Fracción de Carbono activo. Esta determinación se trata de una fracción pequeña y relativamente variable de carbono orgánico lábil, es el combustible de la cadena alimenticia, posee una gran influencia en los ciclos de los nutrientes y en muchas de las propiedades biológicas de los suelos, por lo que se denomina una fracción activa a diferencia del carbono orgánico total, el cual es fuente de un carbono pasivo o altamente recalcitrante. La fracción activa de carbono sirve como indicador de calidad dado que, es sensible a los cambios inducidos por el manejo. El carbono activo incluye el carbono microbiano, la materia orgánica particulada y los carbohidratos presente en el suelo. Se encontró una cantidad de carbono activo significativamente mayor (p < 0,05) en los sedimentos y suelos del tercer sector del humedal (Gráfica 9), frente de los suelos y sedimentos en el segundo del segundo sector solo para el punto C 124; no hubo diferencias significativas entre el carbono activo evaluado en tercer sector del humedal, el de los suelos colectados a la altura de la calle 117 (segundo sector) y el de los sedimentos colectados a la altura de la calle 116 (segundo sector), aunque fueron menores en promedio. En general no hay diferencias en el carbono activo evaluado entre suelos y sedimentos tomados en un mismo punto del humedal, por el contrario en el rio Juan Amarillo (Gráfica 10) se encontraron contenidos de carbono activo significativamente mayores (p < 0,05) en los sedimentos frente a los encontrados en los suelos. Los contenidos de carbono activo en los suelos y sedimentos del río Juan Amarillo son similares a los encontrados en el tercer sector del humedal. posiblemente existe relación entre la actividad deshidrogenasa y los contenidos de carbono activo evaluados en los sedimentos del humedal Córdoba; pero dicha relación no se pudo observar para el rio Juan Amarillo y para los suelos del Humedal, así como no hubo relación entre la actividades fosfatasas y los contenidos de carbono, a través del tramo donde se realizó el estudio, anteriormente se ha visto (Shackle et al. 2000) que dichas enzimas no se incrementan por la adición de carbono presentes en suelos de humedales construidos. La introducción de materiales orgánicos derivados de residuos urbanos trae consigo aumento en los contenidos de carbono y así como aumento en las actividades fosfatasa y deshidrogenasa (Peruzzi et al. 2011; Jezierska-Tys & Fr c, 2009; Singh & Agrawal, 2008; Monkiedje et al. 2006; Caravaca et al. 2005; Gianfreda et al. 2005) actividades que también en humedales responden (Hill et al. 2006) a gradientes por contaminación de residuos urbanos.
Los humedales proporcionan muchas funciones criticas en los ecosistemas urbanos, que incluyen habitad de fauna y mejoramiento de la calidad del agua. Existe interés en restaurar o construir humedales para incrementar dichas funciones, dada la extendida pérdida a escala global de estos y los problemas de calidad de agua debido a la urbanización. Las características físicas, químicas y biológicas de los humedales cambian constantemente en función de los disturbios, por lo que se genera gran interés en definir el umbral al cual un efecto significativo que ponga en peligro la integridad biológica o de la calidad del agua. Recientemente y desde casi una década, se han reportado estudios (Cerón & Ramírez, 2011; Weaver et al. 2011; Gagnon et al. 2007; Yang et al. 2008; Penton & Newman, 2008; Hill et al. 2006; Kang & Stanley, 2005; Giafreda et al. 2005; Shackle et al. 2000) sobre de la utilidad de las enzimas para obtener información acerca del impacto de la modificación y contaminación, sobre las funciones de ecosistemas acuáticos y de el efecto de la restauración de los mismos por la introducción de especies vegetales (Peruzzi et al. 2011; Carreira et al. 2008), se ha postulado (Beare et al. 1995) que al incrementarse la diversidad comunidad vegetal se puede contribuir al enriquecimiento de la fertilidad del suelo y de su estructura ecológica. por otra parte, no existe un consenso claro acerca de los indicadores apropiados de las condición ecológica ni un "gold standard" (Brown et al. 2010) a la hora de medir la contaminación de los sedimentos y su efecto biológico, dado que es necesario establecer que factores tienen influencia directa en la actividad microbiana, esencial para los procesos de biodegradación, adsorción y para evitar la acumulación de materia orgánica e inorgánica.
Conclusiones
Dada la intervención del crecimiento urbano, el sistema Córdoba- Juan Amarillo ha sufrido varias modificaciones que comprometen principalmente la calidad del agua y su conservación. El comportamiento de las actividades deshidrogenasa, fosfatasa alcalina y ácida y odifenol oxidasa evaluadas en este estudio entre el segundo y tercer sector del humedal Córdoba, pueden responder a dicha fragmentación, que trae como consecuencia la reducción del espejo de agua, la reducción en la diversidad de la vegetación y el aumento del pH de aguas y suelos; la presencia de un mantillo de agujas de pino en los suelo del segundo sector del humedal estimuló la actividad o-difenol oxidasa y puede tener un efecto negativo sobre las fosfatasas, pero no sobre la actividad deshidrogenasa, lo que indica un proceso de degradación activo y por tanto una dinámica de la materia orgánica, en el mantillo localizado en el segundo sector del humedal Córdoba. La diminución de la actividad o-difenol oxidasa en tercer sector del humedal y en el río Juan Amarillo, puede estar relacionada con la disminución de la diversidad vegetal y la introducción de residuos urbanos al sistema. A medida que el sistema está más intervenido se encontró incremento del pH tanto en suelos y aguas, el pH determinado en las aguas y suelos del río Juan Amarillo evidencia las problemáticas del sector, por un lado, la modificación hidráulica del río por la construcción de jarillones y por otra, a la contaminación que sufre el río por la adición de vertimientos domésticos e industriales. La actividad deshidrogenasa fue el indicador que mejor respondió a la afectación de los diferentes puntos de muestreo que se tomaron en el sistema Córdoba Juan Amarillo, la alta actividad deshidrogenasa encontrada en el río Juan Amarillo puede tener relación con aumento de las descargas de residuos urbanos, disminución en la diversidad de la vegetación y actividades como el pastoreo de animales. Con este estudio fue posible postular como la actividad microbiana presente en suelos y sedimentos, puede responder a la intervención y contaminación que sufre el sistema Córdoba-Juan Amarillo, por lo que se recomienda el uso de dichas actividades como parámetro de evaluación de programas de manejo ambiental para el sistema.
Agradecimientos
Los autores expresan sus agradecimientos a la Vicerrectoría de Investigaciones de la Universidad EAN por la financiación del presente estudio.
Referencias bibliográficas
Acosta-Martínez, V. & Tabatabai, M.A. 2000. Enzyme activities in a limed agricultural soil. Biology and Fertily of Soils 31:85-91. [ Links ]
Benítez, E., Melgar, R. & Nogales, R. 2004. Estimating soil resilience to a toxic organic waste by measuring enzyme activities. Soil Biology and Biochemistry 36:1615-1623. [ Links ]
Blair, G.J., Lefroy, R.D.B. & Lisle, L. 1995. Soil carbon fraction based in their degree of oxidation and the development of a carbon management index for agricultural systems. Australian Journal of Agricultural Research 46:1459-1466. [ Links ]
Brown, J.S., Sutula, M., Stransky, C., Rudolph, J. & Byron, E. 2010. Sediment Contaminant Chemistry and Toxicity of Freshwater Urban Wetlands in Southern California. Journal of the American Water Resources Association 46:367-385. [ Links ]
Brzeziñska, M., Stêpniewska, Z. & Stêpniewski, W. 2001. Dehydrogenase and Catalase Activity of Soil Irrigated with Municipal Wastewater. Polish Journal of Environmental Studies. 10:307-311. [ Links ]
Beare, M.H., Coleman, D.C., Crossley, D.A., Hendrix, P.F. & Odum, E.P. 1995. A hierarchical approach to evaluating the significance of soil biodivesity to biogeochemical cycling. Plant and Soil 170:5-22. [ Links ]
Burns, R.G. 1982. Enzyme activity in soil: location and a possible role in microbial ecology. Soil Biology and Biochemistry 14: 423-427. [ Links ]
Caldwell, B.A. 2005. Enzyme activities as a component of soil biodiversity: A review. Pedobiologia 49:637-644. [ Links ]
Canet, R., Albiach, R. & pomares, F. 2000. Indexes of Biological Activity as Tools for Diagnosing Soil Fertility In Organic Farming. In: Garcia C, Hernández T, editores. Research and Perspectives of Soil Enzymology in Spain. Murcia, Spain 7 Cebas-CSIC; p. 27-39. [ Links ]
Capasso, R., Evidente, A., Schivo, L., Orru, G., Marcialis, M.A. & Cristinzio, G. 1995. Antibacterial polyphenols from olive oil mill waste waters. Journal of Applied Bacteriology 79:393- 398. [ Links ]
Carreira, J.A., Viñegla, B., García-Ruiz, R., Ochoa, V. & Hinojosa, M.B. 2008. Recovery of biochemical functionality in polluted flood-plain soils: The role of microhabitat differentiation through revegetation and rehabilitation of the river dynamics. Soil Biology and Biochemistry 40:2088-2097. [ Links ]
Caravaca, F., Alguacil, M.M., Torres, P. & Roldán, A. 2005. Plant type mediates rhizospheric microbial activities and soil aggregation in a semiarid Mediterranean salt marsh. Geoderma 124:375-382. [ Links ]
Casida, L.E.Jr., Klein, D.A. & Santoro, T. 1964. Soil Dehydrogenase Activity. Soil Science 98:371-376. [ Links ]
Castaño, M. 2002. Verdades sobre el Humedal de Córdoba. Entre Juncos Boletín de la Red de Humedales de la Sabana de Bogotá. No. 5. p.p 3 [ Links ]
Cerón Rincón, L.E. & Melgarejo, L.M. 2005. Enzimas de suelo: indicadores de salud y calidad. Acta Biológica Colombiana. 10:5-17. [ Links ]
_____, L.E., & Ramírez, E. 2011. Actividad microbiana en el río Arzobispo. Agronomía Colombiana. (En prensa). [ Links ]
Chen, W. , Wu, L., Frankenberger, W.T.Jr. & Chang, A.C. 2008. Soil Enzyme Activities of Long-Term Reclaimed Wastewater-Irrigated Soils. Journal of Environmental Quality 37:S-36-S-42. [ Links ]
DAMA Departamento Administrativo del Medio Ambiente. 2006. política de Humedales. ©Alcaldía Mayor de Bogotá [ Links ].
_____. 2008. Plan de Manejo del Humedal Córdoba. ©Alcaldía Mayor de Bogotá [ Links ].
_____. 2010. Plan de Manejo del Humedal Juan Amarillo. ©Alcaldía Mayor de Bogotá [ Links ].
Dick A. & Tabatabai, M.A. 1992. Significance and potential Use of Soil Enzymes. En: Meeting, FJB (Ed.). Soil Microbial Ecology: Applications in Agriculture and Environmental Management. Marcel Deckker, NY, USA. pp. 95-127. [ Links ]
Doi, R. & Ranamukhaarachchi, S.L. 2009. Soil dehydrogenase in a land degradation-rehabilitation gradient: observations from a savanna site with a wet/dry seasonal cycle. Revista de Biología Tropical 57:223-234. [ Links ]
Doran J.W. 2002. Soil Health and Global Sustainability Translating Science into Practice. Agriculture Ecosystems Environment. 88:119-127. [ Links ]
_____ & Zeiss, M.R. 2000. Soil Health and Sustaninability: Managing the Biotic Component of Soil Quality. Applied Soil Ecology 15:3-11. [ Links ]
Eivazi, F. & Tabatabai, M.A. 1977. Phosphatases in soils. Soil Biology & Biochemistry 9:167-172. [ Links ]
Freeman, C., Ostle, N.J., Fenner, N. & Kang, H. 2004. A regulatory role for phenol oxidase during decomposition in peatlands. Soil Biology and Biochemistry 36:1663-1667. [ Links ]
Gagnon, V., Chazarenc, F., Comeau, Y. & Brisson, J. 2007. Influence of macrophyte species on microbial density and activity in constructed wetlands. Water Science and Technology 56:249-254. [ Links ]
García, C., Hernández, T., Costa, F. 1997. potencial use of dehydrogenase activity as an index of microbial activity in degraded soils. Communications in Soil Science and Plant Analyses 28:123-134. [ Links ]
Gianfreda, L., Rao, M.A., Piotrowska, A., Palumbob, G. & Colombob, C. 2005. Soil enzyme activities as affected by anthropogenic alterations: intensive agricultural practices and organic pollution. Science of the Total Environment 341:265- 279. [ Links ]
Gressel, N. & McColl, J.G. 2003. Phosphorus mineralization and organic matter decomposition: a critical review. Driven by Nature: Plant Litter Quality and Decomposition (eds G.Cadisch & K.E.Giller), CAB International, Wallingford, UK. pp. 297-309. [ Links ]
Güsewell, S. & Freeman, C. 2005. Nutrient limitation and enzyme activities during litter decomposition of nine wetland species in relation to litter N:P ratios. Functional Ecology 19:582-593. [ Links ]
Hernández, M.E. 2010. Suelos de Humedales Como Sumideros De Carbono y Fuentes de Metano. Terra Latinoamericana 28:139- 147. [ Links ]
Hill, B.H., Elonen, C.M., Jicha, T.M., Cotter, A.M., Trebitz, A.S. & Danz, N.P. 2006. Sediment microbial enzyme activity as an indicator of nutrient limitation in Great Lakes coastal wetlands. Freshwater Biology 51:1670-1683. [ Links ]
Jezierska-Tys, S. & Fr c, M. 2009. Impact of dairy sewage sludge on enzymatic activity and inorganic nitrogen concentrations in the soils. International Agrophysics 23:31-37. [ Links ]
Kang, H., Lee, S.H., Lee, S.M. & Jung, S. 2009. positive relationships between phenol oxidase activity and extractable phenolics in estuarine soils. Chemistry and Ecology 25:99- 106. [ Links ]
& Stanley, E.H. 2005. Effects of levees on soil microbial activity in a large river floodplain. River Research and Applications 21:19-25. [ Links ]
Kang, H. & Freeman, C. 1999. Phosphatase and arylsulphatase activities in wetland soils: annual variation and controlling factors. Soil Biology and Biochemistry 31:449-454. [ Links ]
Kibblewhite, M.G., Ritz, K. & Swift, J. 2008. Soil health in agricultural systems. Philosophical Transactions of the Royal Society B 363:685-701. [ Links ]
Maliszewska-Kordybuch, B. & Smreczek, B. 2003. Habitat function of agricultural soils as affected by heavy metals and polycyclic aromatic hydrocarbons contamination. Environment International 28:719-728. [ Links ]
Monkiedje, A., Spiteller, M., Fotio, D. & Sukul, P. 2006. The effect of land use on soil health indicators in peri-urban agriculture in the humid forest zone of southern Cameroon. Journal of Environmental Quality 35:2402-2409. [ Links ]
Palacio, D., Hurtado, R. & Garavito, L. 2003. Redes Socio-ambientales en tensión: El caso de la gestión ambiental de los humedales de Bogotá. REDES- Revista hispana para el análisis de redes sociales 4:1-31. [ Links ]
Penton, C.R., & Newman, S. 2008. Enzyme-based resource allocated decomposition and landscape heterogeneity in the Florida everglades. Journal of Environmental Quality 37:972-976. [ Links ]
Peruzzi, E. Masciandaro, G., Macci, C., Doni, S., Mora Ravelo, S.G., Peruzzi, P. & Ceccanti, B. 2011. Heavy metal fractionation and organic matter stabilization in sewage sludge treatment wetlands. Ecological Engineering 37:771-778. [ Links ]
Perucci, P., Casucci, C. & Dumontet, S. 2000. An improved method to evaluate the o-diphenol oxidase activity of soil. Soil Biology and Biochemistry 32:387-399. [ Links ]
Ramos-Cormenzana, A., Juarez-Jiménez, B. & Garcia-Pareja, M.P. 1996. Antimicrobial activity of olive mill wastewaters (alpechin) and biotransformed olive oil mill wastewater. International Biodeterioration and Biodegradation 38:283-290. [ Links ]
Shackle, V.J., Freeman, C. & Reynolds, B. 2000. Carbon supply and the regulation of enzyme activity in constructed wetlands. Soil Biology and Biochemistry 32:1935-1940. [ Links ]
Singh, R.P. & Agrawal, M. 2008. potential benefits and risks of land application of sewage sludge. Waste Management 28:347- 358. [ Links ]
Soares, R.A., Roesch, L.F.W., Zanatta, G., Camargo F.A. & Passaglia, L.M.P. 2006. Occurrence and distribution of nitrogen fixing bacterial community associated with oat (Avena sativa) assessed by molecular and microbiological techniques. Applied Soil Ecology 33:221-234. [ Links ]
Toberman, H., Laiho, R., Evans, C.D., Artz, R.R.E., Fenner, N., Strakov, P. & Freeman, C. 2010. Long-term drainage for forestry inhibits extracellular phenol oxidase activity in Finnish boreal mire peat. European Journal of Soil Science 61:950- 957. [ Links ]
Vieira, R.F., & Silva, C.M. 2003. Soil amendment with sewage sludge and its impact on soil microflora. Brazilian Journal of Microbiology 34(Suppl.1):56-58. [ Links ]
Weaver, M.A., Zablotowicz, R., Larry, K., Martin, L. & Charles, B. 2011. Microbial and vegetative changes associated with development of a constructed wetland. Ecological Indicator. En prensa. [ Links ]
Weil, R.R., Islam, K.R., Stine, M.A., Gruver, J.B. & Samson- Liebig, S.E. 2003. Estimating active carbon for soil quality assessment: A simplified method for laboratory and field use. American Journal of Alternative Agriculture 18:3-17. [ Links ]
Wu, Y., Tam, N.F.Y. & Wong, M.H. 2008. Effects of salinity on treatment of municipal wastewater by constructed mangrove wetland microcosms. Marine pollution Bulletin 57:727-734. [ Links ]
Yang, Q., Tam, N.F.Y., Wong, Y.S., Luan, T.G., Su, W.S., Lan, C.Y., Shin, P.K.S. & Cheung, S.G. 2008. potential use of mangroves as constructed wetland for municipal sewage treatment in Futian, Shenzhen, China. Marine pollution Bulletin 57:735-743. [ Links ]
Zhou, Q.H., Wu, Z.B., Cheng, S.P., He, F. & Fu, G.P. 2005. Enzymatic activities in constructedwetlands and di-n-butyl phthalate (DBP) biodegradation. Soil Biology and Biochemistry 37:1454-1459. [ Links ]
Recibido: agosto 5 de 2011. Aceptado para su publicación: agosto 30 de 2011.













