Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales
Print version ISSN 0370-3908
Rev. acad. colomb. cienc. exact. fis. nat. vol.35 no.137 Bogotá Oct./Dec. 2011
FITOPATOLOGÍA
1 Magíster en Fitopatología. Programa de Maestría en Fitopatología. Facultad de Ciencias Agropecuarias, Universidad de Caldas. Correo electrónico: ammogollon@hotmail.com
2 Ph.D. Profesor Titular, Facultad de Ciencias Agropecuarias, Universidad de Caldas. Correo electrónico: jairo.castano_z@ucaldas.edu.co
Resumen
Se evaluó los inductores de resistencia: ácido salicílico, Acibenzolar-S-metil, ácido 2,6- dicloroisonicotinico, ácido 3-aminobutanoico y Fosfito de potasio, y los fungicidas Propiconazol y Clorotalonil en plántulas de Dominico-Hartón sobre Mycosphaerella fijiensis y M. musicola. El experimento consistió de ocho tratamientos y 20 repeticiones, en un diseño completamente aleatorizado. Los tratamientos se aplicaron al suelo a los 30, 60 y 75 días después de la siembra. Se evaluó altura de plántulas (cm), índice de severidad (%), grado de evolución de síntomas y tasa de desarrollo (r). Fosfito de potasio fue el mejor inductor porque las plántulas presentaron una altura promedio de 36,6 cm comparada con las del testigo con 29 cm; dos días de retardo en aparición de síntomas; menor tasa de desarrollo de las sigatokas (r = 0,04) y valores más bajos de evolución de los síntomas e índice de severidad, que fueron 1,4 y 6,23%, respectivamente, mientras que el testigo registró r = 0,05, 3,4 y 33,02%, respectivamente. Fosfito de potasio no presentó diferencia significativa con respecto a Propiconazol. A excepción del ácido salicílico y 2,6- dicloroisonicotinico, los otros inductores demostraron que el control de las sigatokas fue producto de la activación de los mecanismos de defensa de las plantas.
Palabras clave: musáceas, fosfito de potasio, defensa, fungicidas, hongos, manejo.
Abstract
It was evaluated the effect of the inductors of resistance: salicylic acid, Acibenzolar-S-methyl, 2, 6-dicloroisonicotinic acid, 3-butanoic acid and potassium phosphite, as well as the fungicides Propiconazole and Clorothalonil in seedlings of Dominico-Hartón against Mycosphaerella fijiensis and M. musicola. The experiment consisted of eight treatments and twenty replications per treatment in a completely randomized design. The treatments were applied to the soil at 30, 60 and 75 days after sowing. It was evaluated: seedlings height (cm), index of severity (%), grade of evolution of the sigatokas and rate of disease development (r). Potassium phosphite was the best treatment because the seedlings had a height of 36.6 cm compared to the control which recorded 29 cm, two days of symptoms appearance delay, lower rate of disease development (r = 0.04) and lower values of grade of evolution of symptoms and severity index, which were 1.4 and 6.23%, respectively, while the control showed r = 0.05, 3.4 and 33.02%, respectively. Potassium phosphite was not statistically different from Propiconazole. Except the salicylic and 2,6-dicloroisonicotinic acids, the other inductors of resistance demonstrated that the control of the sigatokas, was the result of the activation of the defense mechanisms of the plants.
Key words: musaceous, potassium phosphite, defense, fungicides, fungi, management.
Introducción
Los problemas fitosanitarios causados por hongos generan impacto económico en la producción de plátano y banano a nivel mundial (Marín et al., 2003). Mycosphaerella fijiensis Morelet, anamorfo Paracercospora fijiensis (Morelet) Deigthon, agente causante de la Sigatoka negra y Mycosphaerella musicola Leach, anamorfo Pseudocercospora musae (Zimm.) Deighton, agente causante de la Sigatoka amarilla, son considerados la principal amenaza en el cultivo del plátano alrededor del mundo, debido a que causan las mayores pérdidas económicas debido a la reducción de la capacidad fotosintética, dando como resultado disminución en el rendimiento del cultivo y calidad del fruto (Arzanlou et al., 2007).
El tratamiento de plantas con inductores de resistencia es una alternativa que se ha venido implementando frente al control de enfermedades en otros patosistemas pero de manera limitada en el cultivo del plátano contra Mycosphaerella spp. A este mecanismo se le ha denominado Resistencia Adquirida Sistémica (RSA) y consiste en la expresión de respuestas por parte de la planta luego de la infección por un patógeno o de manera similar por el tratamiento con inductores de resistencia (Sticher et al., 1997). Estas respuestas consisten en el incremento del entrecruzamiento de las microfibrillas de celulosa, incrustadas en una matriz compuesta de pectina y hemicelulosa, dando como resultado el aumento de la lignificación de las paredes celulares (Greenberg, 1997); síntesis de novo de fitoalexinas (Dixon, 2001; Kuc, 1995); síntesis de proteínas relacionadas con patogénesis (PR) (Boller, 1992) y respuesta de hipersensibilidad (Mehrotra & Aggarwal, 2006).
Algunos trabajos han reportado que el Acibenzolar-Smetil (ASM) actúa como inductor de resistencia en plántulas de plátano Dominico-Hartón contra Mycosphaerella spp. (Márquez & Castaño-Zapata, 2007; Patiño, 2002). De la misma manera, Lema (2009), considera el Fosfito de potasio como un inductor de resistencia en plantas de Dominico-Hartón contra M. fijiensis, sin embargo, en la actualidad no se tienen trabajos publicados con respecto a la efectividad de otras moléculas inductoras de resistencia como los ácidos salicílico (AS), 2,6-dicloroisonicotinico (INA) y 3-aminobutanoico (BABA), aplicados hacia el manejo de las sigatokas amarilla y negra. Por consiguiente, debido a la importancia del cultivo de plátano en Colombia, al alto riesgo de desarrollo de resistencia de los patógenos a las moléculas químicas utilizadas en el control de las enfermedades que causan y a las pérdidas ocasionadas por las sigatokas, esta investigación tuvo como objetivo evaluar el efecto de los inductores de resistencia mencionados contra M. fijiensis y M. musicola en plántulas de Dominico-Hartón.
Materiales y métodos
El experimento se realizó en la granja Montelindo, ubicada en la vereda Santagueda, municipio de Palestina, departamento de Caldas, con una altitud de 1.010 m, temperatura promedio anual de 22,8°C, precipitación anual de 2.100 mm y humedad relativa de 76%. Se utilizaron 160 cormos de plátano cultivariedad Dominico-Hartón y suelo, obtenidos de una plantación de plátano en la misma granja. Con el fin de garantizar la erradicación de nematodos fitoparásitos al momento de la siembra, los cormos fueron sumergidos en una solución de Aldicarb a una concentración de 10 g L-1 de agua por 60 min. Transcurrido este tiempo, se retiraron de la solución, se dejaron secar y posteriormente se sembraron en bolsas de plástico con capacidad de 5 Kg. Los tratamientos fueron: 1. Ácido salicílico, 5mM, 2. Acibenzolar-S-metil 0,01 mL L-1, 3. Ácido 2,6- dicloroisonicotinico, 5 mM, 4. Ácido 3-aminobutanoico, 8 mM, 5. Fosfito de potasio, 27 mL L-1, 6. Propiconazol, 0,4 L ha-1, 7. Clorotalonil, 2 L ha-1 y 8. Testigo absoluto. La aplicación de los tratamientos fue realizada al suelo, en un volumen de 250 mL de solución por plántula a partir de los 30 días después de la siembra (DDS), momento en que el 100% de los cormos habían brotado, las demás aplicaciones se realizaron a 60 y 75 DDS.
Teniendo en cuenta las variables de respuesta a evaluar se plantearon dos tipos de diseños estadísticos: el primero, consistió en un diseño completamente aleatorizado a una vía para determinar si existían diferencias significativas entre los tratamientos con respecto a la altura de las plántulas; el segundo diseño, fue completamente aleatorizado a dos vías. Se estableció con el fin determinar el efecto del tratamiento y la edad de las hojas, sobre las variables de respuesta grado de evolución de los síntomas e índice de severidad de las sigatokas.
Altura de plántulas (cm). El registro de altura de las plántulas fue realizado cada 15 días hasta finalizar el experimento, se utilizó una cinta métrica como instrumento de medición.
Evaluación de las sigatokas. Se realizaron dos lecturas por semana una vez apareció el primer síntoma visual de las sigatokas, con el fin de estimar el grado de evolución de los síntomas, empleando la escala de Aranzazu et al. (2002) y la severidad de las sigatokas en las hojas dos, tres, cuatro y cinco, utilizando los diagramas estándares de Stover modificados por Gauhl (Carlier, 2002).
Tasa de desarrollo (r) de las enfermedades. Se tomaron los valores promedio de severidad semanal y se transformaron a proporción. También se tuvo en cuenta la diferencia de días transcurridos desde la primera evaluación y la última (Castaño-Zapata, 2002), para lo cual se utilizó la siguiente fórmula:
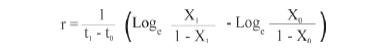
t1: Tiempo final de evaluación; t0: Tiempo inicial de evaluación; X1: Severidad final y X0: Severidad inicial.
Para el análisis de los datos generados se usó el programa estadístico Statgraphics centurión XV, realizando el análisis de varianza y la prueba de comparación de medias de Tukey al 5%.
Resultados y discusión
Altura de plántulas
Los análisis de varianza indicaron diferencias altamente significativas entre las evaluaciones realizadas a los 50, 64, 77, 91, 105 y 112 días después de la siembra (DDS) (P < 0,01)) a excepción de la evaluación realizada 35 DDS (P = 0,0588). Las principales diferencias se observaron 112 DDS. A partir de la evaluación realizada a los 64 DDS, la mayor altura se registró con la aplicación de los inductores de resistencia, seguido por el valor promedio de las plántulas del testigo, en comparación con Propiconazol, Clorotalonil y el INA que registraron los valores más bajos durante las evaluaciones (Tabla 1). Después de 112 DDS, el Fosfito de potasio se destacó por mostrar mayor altura con 36,6 cm, a diferencia de los demás inductores de resistencia cuyos valores promedio oscilaron entre 30 y 31,2 cm, sin diferencias significativas entre ellos, pero sí con respecto al INA, Propiconazol, Clorotalonil y el testigo con 2,1; 23; 24,6 y 29 cm, respectivamente (Tabla 1).
Las plántulas tratadas con INA presentaron síntomas de fitotoxicidad después de la primera aplicación, manifestada en la reducción del tamaño de las plántulas, deformidad de las hojas y, en muchos casos, muerte de las plántulas. Estos resultados coinciden con los obtenidos por Friedrich et al. (1996), quienes consideran que el INA es un inductor potente de resistencia, pero genera problemas de fitotoxicidad. Por esta razón, las plántulas tratadas con el INA no fueron tenidas en consideración para las evaluaciones del grado de evolución de los síntomas, índice de severidad y tasa de desarrollo de las sigatokas.
La mayor altura en las plántulas tratadas con Fosfito de potasio se atribuye a que este producto activa el sistema de defensa de las plantas y al mismo tiempo metaboliza el fosfito a fosfato para utilizarlo como nutriente, desempeñando un papel importante en el crecimiento y desarrollo de las plantas (EDA, 2008).
Grado de evolución de los síntomas e índice de severidad
El análisis de varianza del grado de evolución de síntomas (P < 0,01) e índice de severidad de las sigatokas (P < 0,01) indicó diferencias altamente significativas entre tratamientos, edad de las hojas (P < 0,01) y la interacción tratamientos*hoja (P < 0,01) 112 DDS. Las plántulas tratadas con Fosfito de potasio y Propiconazol redujeron significativamente el tamaño de las lesiones con valores promedio menores de 2 en el grado de evolución de los síntomas (lesiones entre 2 y 3 mm), a diferencia de los demás tratamientos cuyo grado alcanzó valores superiores a 2 (lesiones > 3 mm). De igual manera, los valores promedios más bajos en el índice de severidad de las sigatokas se presentaron para los mismos tratamientos con valores de 6,2 y 10,2%, respectivamente, en comparación con los demás tratamientos cuyos valores oscilaron entre 13 y 33% (Tabla 2).
El tratamiento con Fosfito de potasio presentó los valores más bajos en el grado de evolución de los síntomas e índice severidad producto de la inducción de resistencia en plántulas de Dominico-Hartón, resultados que coinciden con el reporte de Orober et al. (2002), quienes en plantas de pepino tratadas con sales de potasio, demostraron un aumento local y sistémico del Ácido salicílico (AS), lo cual está relacionado con la activación de la Resistencia Sistémica Adquirida. Cohen & Coffey (1986), atribuyen el modo de acción indirecto de Fosfito de potasio sobre los patógenos por acumulación de fitoalexinas. En trabajos más recientes dirigidos al control de la Sigatoka negra en plátano Dominico-Hartón, Lema (2009), demostró que el tratamiento con Fosfito de potasio (0,7 y 1,0 L ha-1) mantuvo los grados de la evolución de los síntomas de la sigatokas entre 0 y 1, en comparación con el testigo que presentó mayor frecuencia de los grados 1, 2 y 3, lo que lleva a considerar este producto como un activador de la inducción de resistencia en plátano para el control de M. fijiensis. En contraste con estos reportes, el control de las sigatokas en las plántulas de Dominico-Hartón tratadas con Propiconazol fueron resultado del efecto directo sobre el patógeno como lo demostraron Mogollón-Ortiz & Castaño-Zapata (2011, sin publicar) y Koller (1992), quien además indica que Propiconazol actúa sobre el hongo por inhibición de la demetilación del C-14 del lanosterol, un precursor del ergosterol de la membrana celular del patógeno.
Por su parte, el BABA y ASM sobresalieron en el grado de evolución de los síntomas después del Fosfito de potasio, con valores de 2,4 y 2,5, respectivamente, los cuales fueron significativamente diferentes de los tratamientos con Clorotalonil (3,1), AS (3,3), y el testigo (3,4) Esta misma tendencia se presentó en el índice de severidad, en donde BABA y ASM presentaron valores de 13,65 y 18,56%, respectivamente, mientras que los valores promedios más altos se presentaron con los tratamientos que incluyeron a Clorotalonil (20,63%), AS (31,88%) y el testigo (33,02%). Resultados similares fueron reportados por Siegrist et al. (2000), quienes demostraron que plantas de tabaco asperjadas con 10 mM de BABA presentaron lesiones significativamente más pequeñas después de la inoculación con Tobacco mosaic virus (TMV), reducción atribuida a la activación de la Resistencia Sistémica Adquirida. En otro estudio, plantas de girasol tratadas con BABA desarrollaron pocas pústulas de la roya causada por Puccinia helianthi Schwein comparado con el testigo (Amzalek & Cohen, 2007).
El efecto de ASM como inductor de resistencia ha sido reportado en diversos trabajos. Faize et al. (2004), demostraron que el tratamiento con ASM (100 μg mL-1) en peral contra Venturia nashicola Tanaka & Yamamoto, redujo la severidad de la roña con respecto al control, con una eficacia de control de 42% tres semanas después de la inoculación y 30% un mes después de la inoculación; la protección proporcionada por ASM en las plantas estuvo relacionada con la producción de proteínas PR, es decir, la activación de la Resistencia Sistémica Adquirida. Patiño (2002), indica que ASM es capaz de activar los genes encargados de la inducción de resistencia en el cultivar de banano Gran Enano, altamente susceptible a la Sigatoka negra, observándose que los niveles de defensa de dicho cultivar se asemejan a los de FHIA-23 luego del tratamiento con ASM. Más recientemente se ha reportado que el tratamiento de semilla de plátano Dominico-Hartón con ASM a una concentración de 0,005 mL L-1 de agua, mostró un índice de severidad bajo y un tamaño de lesiones inferior a 1 mm de longitud con respecto al testigo, manifestando un efecto fitoactivador de la inducción de Resistencia Sistémica Adquirida contra Mycosphaerella spp. (Márquez & Castaño- Zapata, 2007).
El tratamiento de plántulas de Dominico-Hartón con BABA y ASM produjo lesiones típicas de la respuesta de hipersensibilidad 35 días después de la primera aplicación de los productos. Las lesiones se caracterizaron por ser pequeñas, oscuras, visibles tanto por la haz como por el envés de la hoja; lo anterior coincide con Latunde & Lucas (2001), quienes indican que ASM actúa bloqueando el desarrollo de Colletotrichum destructivum O'Gara en plantas de fríjol Pinto a través de una respuesta de hipersensibilidad, luego del tratamiento con el inductor. Así mismo, Siegrist et al. (2000), reportaron que plantas de tabaco expresaron lesiones foliares macroscópicas y necróticas atribuidas a la respuesta de hipersensibilidad después del tratamiento con BABA, este inductor activó la Resistencia Sistémica Adquirida, similar a cuando ocurre una infección por TMV.
El tratamiento con Fosfito de potasio y ASM causó mayor rigidez en las hojas, lo que coincide con Márquez & Castaño-Zapata (2007) en plántulas de Dominico-Hartón tratadas con ASM. Greenberg (1997) atribuye a los inductores de resistencia la capacidad de incrementar el entrecruzamiento de los componentes de la pared celular, aumentando la lignificación y formación callosa de la misma, creando una barrera física contra los patógenos. Las plántulas de Dominico-Hartón tratadas con AS no mostraron inducción de resistencia en comparación con las tratadas con ASM y BABA, análogos funcionales del AS; este comportamiento puede ser explicado por la poca solubilidad de los cristales de AS en agua (Angiolani, 1960).
El análisis de varianza para el grado de evolución de los síntomas índice de severidad indicó diferencias altamente significativas (P < 0,01) con respecto a la posición de la hoja 112 DDS, revelando un incremento sobre dichas variables a medida que aumentó la edad de la hoja. En las plántulas del testigo, los valores promedio para el grado de evolución de los síntomas fueron de 0,40; 1,94; 3,51; 4,48 y para el índice de severidad de 0,77; 7,43; 25,41 y 43,08% para las hojas 2, 3, 4 y 5, respectivamente (Tabla 2).
Se realizó un análisis del índice de severidad de las sigatokas en la hoja 4, debido a que el periodo de incubación de Mycosphaerella spp., en la cultivariedad Dominico Hartón, bajo las condiciones de la granja Montelido, vereda Santagueda, es de aproximadamente 28 días y la emisión de hojas es semanal (Márquez & Castaño-Zapata, 2007). Fosfito de potasio y ASM retrasaron la aparición de los síntomas en la hoja 4 hasta los 66 DDS, mientras que AS, BABA, Propiconazol, Clorotalonil y el testigo absoluto mostraron los primeros síntomas dos días más temprano (Tabla 3). En el testigo absoluto la severidad a los 64 días mostró un valor promedio de 7,8% hasta llegar a 53,4% 112 DDS; mientras que para Fosfito de potasio y ASM los valores promedio para dicha variable a los 66 DDS, fueron de 1 y 2,5 %, respectivamente y al cabo de los 112 DDS de 7,7 y 17,4%, respectivamente (Tabla 3). Resultados similares en relación al retardo de la aparición de los síntomas de la Sigatoka negra en plantas tratadas con Fosfito de potasio fueron reportados por Lema (2009), quien demostró que el tratamiento de plantas de Dominico-Hartón con este producto en dosis de 0,7 y 1 L ha-1 retarda la aparición de la hoja más joven enferma (hoja 4) comparado con el testigo donde fue la hoja 3. El retardo de la aparición de los síntomas de las sigatokas en plántulas de Dominico-Hartón tratadas con ASM en este estudio coincide con los resultados obtenidos por Márquez & Castaño-Zapata (2007) quienes, a través del tratamiento de semilla de plátano Dominico-Hartón con ASM a concentraciones de 0,03; 0,01 y 0,005 mL L-1, retrasaron la aparición de los síntomas 62, 59 y 59 DDS, respectivamente, en comparación con el testigo cuyos síntomas aparecieron a los 45 DDS.
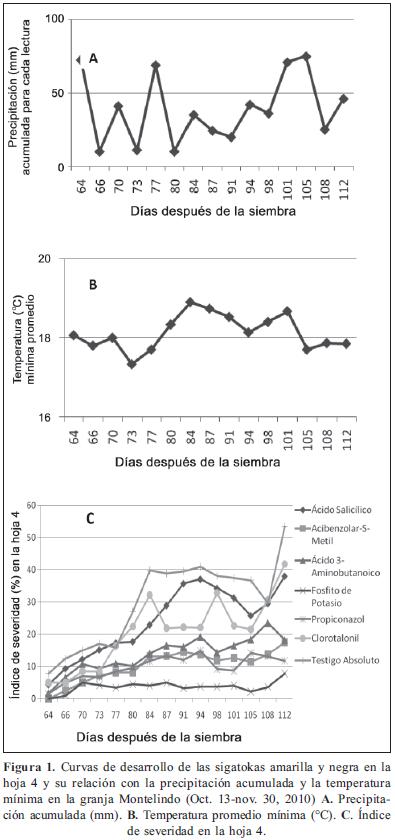
Curvas de desarrollo de las sigatokas amarilla y negra y su relación con la temperatura mínima y la precipitación acumulada
Los primeros síntomas de las sigatokas aparecieron en el testigo absoluto, Clorotalonil, AS, Propiconazol y BABA, que coinciden con los valores de precipitación acumulada (73 mm) y temperatura mínima promedio (18°C) en la zona de Santagueda. Desde la aparición de los síntomas hasta el final del experimento los valores de temperatura mínima oscilaron entre 17,7 y 18,6°C, rangos favorables para el desarrollo de Mycosphaerella spp. Según Belalcázar et al. (1996), temperaturas entre 15,6 y 27°C favorecen el desarrollo de los agentes causantes de las sigatokas. Porras & Pérez (1997) indican que la temperatura mínima requerida para el crecimiento de M. fijiensis es de 12°C, óptima de 27°C y máxima de 36°C, mientras que M. musicola presenta mejor adaptación a temperaturas menores de 15°C. La precipitación varió entre 10 y 75 mm. Al respecto, Molina & Castaño-Zapata (2003) y Belalcázar et al. (1996) indican que al aumentar el volumen de lluvia acumulado semanalmente se favorece el desarrollo de los hongos y con ello la severidad de las sigatokas amarilla y negra.
Los resultados demuestran que las plántulas tratadas con Fosfito de potasio sobresalen con los valores más bajos en el índice de severidad de las sigatokas 112 DDS a pesar de las condiciones favorables para el desarrollo de las sigatokas, destacándose la efectividad de este producto con respecto a los demás tratamientos (Figura 1). Efecto muy similar al obtenido con Propiconazol, fungicida altamente efectivo contra las sigatokas amarilla y negra.
En la Figura 2 se observa que la velocidad a la que se desarrollaron las sigatokas bajo las condiciones del estudio fue menor en las plántulas tratadas con Fosfito de potasio (r = 0,04).
Los resultados obtenidos en la reducción del grado de evolución de los síntomas, índice de severidad y tasa de desarrollo de las sigatokas amarilla y negra, bajo las condiciones favorables para el desarrollo de estas enfermedades en el lugar del experimento y la susceptibilidad del hospedante a los agentes causantes de estas enfermedades, confirman que la aplicación de inductores de resistencia, especialmente de Fosfito de potasio, activan el sistema de defensa de las plantas, con la ventaja sobre los fungicidas sistémicos de no tener riesgo hasta el momento de causar resistencia de los patógenos a los inductores, los cuales pueden considerarse como una estrategia eficaz de manejo de las sigatokas, bajo un enfoque de manejo integrado.
Conclusiones
La aplicación de inductores de resistencia al suelo en plántulas de Dominico-Hartón, especialmente de Fosfito de potasio, redujo el grado de evolución de los síntomas y el índice de severidad de las sigatokas de manera similar que el fungicida sistémico Propiconazol; sin embargo, el inductor y fungicida actúan sobre sistemas diferentes, el primero activando el sistema de defensa de las plántulas, mientras que el fungicida afectando directamente al patógeno.
Después de Fosfito de potasio y Propiconazol, el tratamiento de plántulas con Ácido 3-aminobutanoico y Acibenzolar-S-metil, sobresalieron en el control de las sigatokas amarilla y negra, presentando mejores resultados en comparación con Clorotalonil y el testigo absoluto, con un riesgo mínimo de desarrollo de resistencia del patógeno a los inductores aplicados.
El Fosfito de potasio se consideró como el mejor tratamiento debido a que las plántulas tratadas con este producto mostraron mayor altura y reducción en el grado de evolución de los síntomas, índice de severidad y tasa de desarrollo de las sigatokas, además fue más notorio el retardo del momento de aparición de los síntomas de las sigatokas amarilla y negra.
Bibliografía
Amzalek E. & Y. Cohen. 2007. Comparative efficacy of systemic acquired resistance inducing compounds against rust infection in sunflower plants. Phytopathology 97:179-186. [ Links ]
Angiolani A. 1960. Introducción a la química industrial. Fundamentos Químicos y Tecnológicos. Editorial Andrés Bello, Santiago de Chile. 697 p. [ Links ]
Aranzazu F., J. Valencia, M. Arcila, C. Castrillón, M. Bolaños & P. Castellanos. 2002. El cultivo de plátano. Manual técnico. CORPOICA, Manizales, Colombia. 114 p. [ Links ]
Arzanlou M., E. Abeln, G. Kema, C. Waalwijk, J. Carlier, I. de Vries, M. Guzmán & P. Crous. 2007. Molecular diagnostics for the Sigatoka disease complex of banana. Phytopathology 97:1112-1118. [ Links ]
Belalcázar S., F. Salazar, J. Valencia, C. Silva, M. Arcila & R. Jaramillo. 1996. Reacción de variedades mejoradas al ataque de la Sigatoka negra (Mycosphaerella fijiensis Morelet). Sigatoka negra y variedades mejoradas de plátano. En: Boletín de Sanidad Vegetal No. 12, Instituto Colombiano Agropecuario (ICA). [ Links ]
Boller T. 1992. Biochemical analysis of chitinases and b-1,3 glucanases. Practical Methods. pp. 23-30. In: Bowles D., S. Gurr. (eds.). Molecular Plant Pathology. Oxford. [ Links ]
Carlier J., D. de Waele & J. Escalant. 2002. Evaluación global de la resistencia de los bananos al marchitamiento por Fusarium, enfermedades de las manchas foliares causadas por Mycosphaerella y nematodos. En: Vézina, A., C. Picq. (eds.). Guías técnicas INIBAP 6. Red Internacional para el Mejoramiento del Banano y el Plátano. Montpellier, Francia. 68 p. [ Links ]
Castaño-Zapata, J. 2002. Principios básicos de fitoepidemiología. 1ª edición. Universidad de Caldas, Manizales, Colombia. 398 p. [ Links ] Cohen Y. & M. Coffey. 1986. Systemic fungicides and the control of Oomycetes. Annual Review of Phytopathology 24:311-338. [ Links ] Dixon R. 2001. Natural products and plant disease resistance. Nature 411:843-847. [ Links ]
Entretenimiento y Desarrollo de Agricultores (EDA). 2008. El uso de ácido salicílico y fosfonatos (fosfitos) para activación del sistema de resistencia adquirida de la planta. En: Boletín Técnico de Producción. Implementado por Fintrac Inc., Fundación Hondureña de Investigación Agrícola y la Escuela Agrícola Panamericana. Honduras, http://www.mcahonduras.hn/documentos/PublicacionesEDA/Manuales%20de%20produccion/EDA_Produccion_Uso_de_Acido_Salicilico_Y_Fosfitos_01_08.pdf 3 p.; consultada: enero. 2011. [ Links ]
Faize M., L. Faize, N. Koike, M. Ishizaka & H. Ishii. 2004. Acibenzolar- S-methyl induced resistance to Japanese pear scab is associated with potentiation of multiple defense responses. Phytopathology 94:604-612. [ Links ]
Friedrich L., K. Lawton, W. Ruess, P. Masner, N. Specker, M. Gut, B. Mejer, S. Dincher, T. Staub, S. Uknes, J. Métraux, H. Kessmann & J. Ryals. 1996. A benzothidiazole derívate induces systemic acquired resistance in tobacco. The Plant Journal 10(1):61-70. [ Links ]
Greenber J. 1997. Programmed cell death in plant-pathogen interactions. Annual Review of Plant Physiology and Plant Molecular Biology 48:525-545. [ Links ]
Köller W. 1992. Antifungal agents with target sites in sterol functions and biosynthesis. pp.119-206. In: Köller, W. (ed.). Target Sites of Fungicide Action. CRC Press. Boca Raton, Florida. 328 p. [ Links ]
Kuc J. 1995. Phytoalexins, stress metabolism, and disease resistance in plants. Annual Review of Phytopathology 33:275-297. [ Links ]
Latunde A. & J. Lucas. 2001. The plant defense activator Acibenzolar- S-Methyl primes cowpea [Vigna unguiculata (L.) Walp.] seedlings for rapid induction of resistance. Physiological and Molecular Plant Pathology 58:199-208. [ Links ]
Lema M. C. 2009. Evaluación del Fosfito de Potasio (Foscrop PK®) como inductor de resistencia en plátano (Musa AAB) para el control de Sigatoka negra (Mycosphaerella fijiensis Morelet) en lotes comerciales del departamento del Quindío. Armenia, Colombia. Trabajo de Grado Bióloga. Universidad del Quindío. 72 p. [ Links ]
Marín D., R. Romero, M. Guzmán & T. Sutton. 2003. Black Sigatoka: en increasing threat to banana cultivation. Plant Disease 87(3):208-222. [ Links ]
Márquez L. & J. Castaño-Zapata. 2007. Inducción de resistencia a sigatokas en plántulas de plátano Dominico-Hartón. Agronomía 15(2):49-57. [ Links ]
Mehrotra R. & A. Aggarwal. 2006. Plant pathology. Second edition. Tata McGraw-Hill, New Delhi. 847 p. [ Links ]
Mogollón-Ortiz A. M. & J. Castaño-Zapata. 2011. Evaluación in vitro de inductores de resistencia sobre Mycosphaerella fijiensis Morelet. Revista Facultad Nacional de Agronomía (En revisión). [ Links ]
Molina O. & J. Castaño-Zapata. 2003. Resistencia en los FHIA híbridos a Mycosphaerella spp. Info Musa 12(2):25-27. [ Links ]
Orober M., J. Siegrist & H. Buchenauer. 2002. Mechanisms of phosphate-induced disease resistance in cucumber. European Journal of Plant Pathology 108:345-353. [ Links ]
Patiño L. F. 2002. Efecto de una fuente de energía, tres inductores de resistencia y un sustrato foliar sobre Sigatoka negra en banano. pp. 135-142. En: Acorbat. Memorias XV reunión. Asociación de Bananeros de Colombia AUGURA. Cartagena de Indias. [ Links ]
Porras A. & L. Pérez. 1997. The role of temperature in the growth of the germ tubes of ascospores of Mycosphaerella spp., responsible for leaf spot diseases of banana. Infu Musa 6(2):27-32. [ Links ]
Siegrist J., M. Orober & H. Buchenauer. 2000. Beta-aminobutyric acid mediated enhancement of resistance in tobacco to Tobacco mosaic virus depends on the accumulation of salicylic acid. Physiological and Molecular Plant Pathology 56:95-106. [ Links ]
Sticher L., B. Mauch-Mani & J. Metraux. 1997. Systemic acquired resistance. Annual Review of Phytopathology 35:235-270. [ Links ]
Recibido: junio 20 de 2011. Aceptado para su publicación: diciembre 2 de 2011.













