Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales
versão impressa ISSN 0370-3908
Rev. acad. colomb. cienc. exact. fis. nat. vol.36 no.138 Bogotá jan./mar. 2012
FITOPATOLOGÍA
*M.Sc. Universidad de Caldas. Facultad de Ciencias Agropecuarias. Programa de Maestría en Fitopatología. Email: oscar.guzman@ucaldas.edu.co,
**Ph.D. Universidad de Caldas. Facultad de Ciencias Agropecuarias. Programa de Maestría en Fitopatología. Email: jairo.castano_z@ucaldas.edu.co,
***M.Sc. Universidad de Caldas. Facultad de Ciencias Agropecuarias. Programa de Maestría en Fitopatología. Email: bernardo.villegas@ucaldas.edu.co
Resumen
El objetivo fue evaluar la efectividad de varias prácticas sanitarias aplicadas a cormos de plátano Dominico Hartón, sobre nematodos fitoparásitos y rendimiento. En la granja Montelindo de la Universidad de Caldas, se asignaron tres tratamientos, cada uno con cinco repeticiones, en un diseño experimental de bloques completos al azar, así: 1) Cormos con limpieza sanitaria "pelado" + carbofuran + gallinaza + Paecilomyces lilacinus; 2) Cormos tradicionales + 2 kg de gallinaza y 3) Cormos tradicionales sin gallinaza. Las plantas del primer tratamiento tuvieron mayor peso de racimo con 18,6 kg y 3% de plantas caídas, prevaleciendo el fitonematodo Meloidogyne, siendo estadísticamente diferentes a las del segundo y tercer tratamiento que tuvieron peso de racimo de 13,6 y 13,3 kg, respectivamente, con 25 y 39% de plantas caídas, respectivamente, predominando Radopholus similis.
Palabras clave: Radopholus similis, Meloidogyne spp., limpieza sanitaria.
Abstract
The objective was to evaluate the effectiveness of various sanitary practices applied to corms of Dominico Hartón plantain, on plant parasitic nematodes and yield. At the Montelindo farm of the Universidad de Caldas, three treatments in a complete block design were assigned, with five replications per treatment. The treatments were: 1) Corms with sanitary cleanness "peeled" + carbofuran + chicken manure + Paecilomyces lilacinus, 2) Traditional corms + 2 kg of chicken manure, and 3) Traditional corms without chicken manure. The plants from corms with sanitation had the highest obunches's weight with 18.6 kg and 3% of dropped plants, prevailing Meloidogyne, being statistically different from that obtained of traditional corms with and without chicken manure, which had a weight of 13.6 and 13.3 kg, respectively, besides 25 and 39% of dropped plants, respectively, prevailing Radopholus similis.
Key words: Radopholus similis, Meloidogyne spp., sanitary cleanness.
Introducción
En Colombia, hay sembradas aproximadamente 348.510 ha en el cultivo del plátano con una producción de 2.247.487 t, convirtiéndose en un producto de gran importancia socioeconómica en el sector tradicional de economía campesina, generando 0,75 empleos ha año-1, que corresponden a 261.383 empleos permanentes anualmente (Rodríguez & Rodríguez, 2001; Espinel et al., 2006; Agronet, 2009). El plátano ha sido utilizado fundamentalmente como sombrío del café, participando con el 6,8% del total de la producción agrícola nacional y ocupa el quinto lugar después del café, caña de azúcar, banano y flores (Espinel et al., 2006).
Dado que la reproducción de las musáceas se realiza mediante propagación vegetativa (cormos, rizomas o hijuelos) existen muchos problemas fitosanitarios como los nematodos fitoparásitos que son limitantes para el normal desarrollo del cultivo (Aguas & Martínez, 2003; Coyne et al., 2005; Tenkouano et al., 2006; Díaz et al., 2007; Hauser, 2007). Las principales estrategias de manejo de los nematodos fitoparásitos en musáceas están determinadas por varios factores agronómicos como son: evitar ingresar al campo antes de establecer un cultivo, promover la sanidad y el vigor de las raíces de las plantas, reducir o evitar que penetren a las raíces y cormos, y mantener el material de siembra libre de plagas y enfermedades (Loos & Loos; 1960; Blake, 1961; Daneel et al., 1998; Robinson et al., 1998; Sarah, 2000; Guzmán & Castaño- Zapata; 2004; Araya, 2003; Gowen et al., 2005; Price, 2006; Hauser, 2007).
Existen varias prácticas para el manejo de nematodos en semillas de plátano como la sumersión de cormos en agua caliente a 52°C 20 min-1 (Colbran, 1967), el tratamiento de los cormos con pelado sanitario que consiste en la eliminación de las raíces, remoción de aproximadamente 5 mm de la capa más externa del cormo y todo el tejido necrótico e inmersión en agua hirviendo por 30 seg a 100°C (Hauser, 2007; Tenkouano et al., 2006); al igual que el tratamiento químico de los cormos con productos de acción nematicida e insecticida como el oxamilo (Vydate®) en dosis de 1,3 mL de p.c./L de agua por un tiempo mínimo de 20 min (Díaz et al., 2007).
Debido a que las semillas de higuerilla (Ricinus communis L.) son toxicas por la presencia de metabolitos secundarios como albúminas, ricina y alcaloides, y ricinina, se utiliza como nematicida e insecticida para el control de plagas en diversos cultivos (Topping et al., 1982; Moshkin, 1986; Holfelder et al., 1998; Acacio- Bigi et al., 1998; Corpoica, 2008).
Los compuestos tóxicos, alcaloides, fenoles, terpenoides, entre otros, y las lectinas, tales como la ricina y la ricinus-aglutinina, son tóxicos a los nematodos fitoparásitos como los formadores de nudos o agallas en el sistema radical (Meloidogyne spp. Goeldi), debido a su capacidad de adherirse fuertemente a los anfidios y modificar así su comportamiento quimiotáctico (Marbán et al., 1987; Rich et al., 1989). Rodríguez (2005), encontró que la torta deshidratada de higuerilla incorporada al suelo en concentraciones de 1,5, 2,0 y 3,0% en plántulas de café de 60 días de edad, redujo las poblaciones de Pratylenchus coffeae Sher & Allen en 61, 70 y 76%, respectivamente; mientras que carbofuran disminuyó la población en 54%, con relación al testigo. Así mismo, encontró que la higuerilla afecta a otros fitonematodos como Aphelenchus avenae Bastian, Hoplolaimus indicus Sher, Pratylenchus delattrei Luc, Tylenchorhynchus brassicae Cobb, Helicotylenchus dihystera (Cobb) Sher., y Rotylenchus reniformis Lindford & Oliveira.
En Colombia, la mayoría de cultivos de plátano Dominico Hartón son establecidos tradicionalmente con cormos sin tratar provenientes del mismo cultivo. Consecuentemente, los cormos usados llevan consigo nematodos y otros patógenos y plagas habitantes del suelo, resultando en la contaminación de los cultivos nuevos. Debido a que uno de los métodos más sencillo y económico para el manejo de los nematodos fitoparásitos consiste en realizar limpieza sanitaria de los cormos "pelado" para remover el tejido lesionado, el objetivo de éste trabajo fue evaluar el efecto de varias prácticas sanitarias aplicadas a los cormos de plátano Dominico Hartón, sobre el rendimiento y la cantidad de nematodos fitoparásitos.
Materiales y métodos
La investigación se realizó en la granja Montelindo de la Universidad de Caldas, ubicada en la vereda Santágueda del municipio de Palestina, Caldas, Colombia, a 5° 05'N y 75° 40'W, altitud de 1050 msnm, temperatura media de 22,5°C, humedad relativa del 76%, precipitación anual de 2100mm y brillo solar anual de 2010 h. El suelo es originado a partir de cenizas volcánicas andesíticas de grano fino, clasificado como Tipic dystrandept con buena fertilidad natural y textura franco arenosa (Salazar & Duque, 1994). Al momento del establecimiento del experimento, al suelo se le determinó la cantidad inicial de nematodos fitoparásitos, cuyo procedimiento se describe adelante. Los cormos de plátano fueron sembrados a 3m entre surcos y 1m entre plantas, en las calles de un lote de higuerilla con las variedades Nordestina y Energía. La higuerilla estuvo asociada con las plantas de plátano hasta los 10 meses después de la siembra.
El material vegetal utilizado fue cormos de plátano Dominico Hartón con un peso promedio de 1.400g, de ellos se utilizaron dos tipos de cormos: el tradicional a los cuales se les retiraban las raíces solamente, y con limpieza sanitaria "pelado" (Figura 1).

La limpieza sanitaria consistió en hacer cortes "pelado" con un cuchillo del tejido necrótico de los cormos afectados por nematodos fitoparásitos y picudos para eliminarlos, de tal manera que se obtenían cormos de color crema claro (Figura 1). La realización de cortes de tejido necrosado al cormo también permitía la eliminación de tejido sano que funciona como fuente de nutrimentos. La práctica de limpieza sanitaria, en algunos cormos, se realizó máximo hasta 5cm antes de la zona donde se forman las raíces (región estelar central "mangin"). Los cormos que tenían daño severo y que además, involucraba profundizar hasta la región de mangin fueron desechados. Después de realizar ésta práctica, los cormos quedaron con un peso promedio de 800g, lo que indica que el tejido eliminado fue de 43%.
La limpieza sanitaria se realizó sobre una mesa construida con guadua y esterilla a 1m de altura del suelo, para permitir realizar los cortes y que el tejido contaminado cayera al suelo; así mismo, los cormos tratados fueron colocados en la misma mesa para evitar que el contacto con partículas de suelo o raíces los volviera a infectar. Para conocer la cantidad inicial de nematodos de los remanentes del pelado, se recolectaron 2 kg de suelo y raíces en bolsas de plástico debidamente identificadas y se trasladaron al laboratorio de Fitopatología del departamento de Producción Agropecuaria de la Universidad de Caldas, donde se realizó la extracción de los nematodos basados en el principio de flotación de los nematodos en azúcar (Meredith, 1973; Araya et al., 1995) como se describe a continuación:
El procedimiento se realizó de la siguiente manera: las raíces se lavaron con agua corriente, después de dejarlas secar a temperatura ambiente, se pesaron 30 g de ellas en una balanza Analytical Plus, marca Ohaus, y con la ayuda de tijeras se cortaron transversalmente trozos de raíces de 1 cm, que luego se homogenizaron. Estos trozos se colocaron dentro del vaso de una licuadora Osterizer®, modelo 565-15, conteniendo 300 mL de agua y luego se licuaron dos veces a alta velocidad por 15 seg. La solución del licuado fue depositada en un tamiz de 250 µm, el cual estaba colocado sobre un tamiz de 106 µm, y éste sobre otro de 25 µm. La muestra se lavó con agua a presión para que hubiera desprendimiento de los nematodos, y del material que quedaba en el tamiz de 25 µm, luego se depositó todo su contenido en tubos de centrifugación de 30 mL de capacidad. Posteriormente, se centrifugó a 3.800 rpm durante 5 min.
Como consecuencia de la centrifugación hubo sedimentación de las partículas pesadas en el fondo del tubo y se procedió a eliminar el sobrenadante. Seguidamente, los tubos fueron llenados nuevamente con solución de sacarosa al 50% y sometidos a centrifugación a 3.800 rpm durante 5 min con el propósito de que los nematodos quedaran flotando en la solución de sacarosa por densidad diferencial y fueran separados de las partículas más pesadas. Luego el sobrenadante se depositó en el tamiz de 25 µm para lavar la sacarosa con agua corriente a presión baja y evitar que los nematodos fueran afectados por ésta. Finalmente se recogieron 20 mL de agua con nematodos en una caja de Petri.
La identificación de los nematodos fitoparásitos se realizó con base en las ilustraciones de Guzmán & Castaño- Zapata (2004) y las claves taxonómicas de Thorne (1961), Maggenti et al. (1987), Mai et al. (1996) y Siddiqi (2000).
Para conocer el efecto de la limpieza sanitaria de los cormos "pelado" sobre el rendimiento del plátano Dominico Hartón (Musa AAB) asociado con higuerilla (R. communis) y su relación con los nematodos fitoparásitos, se utilizaron 405 cormos; cada uno como unidad experimental. El experimento se estableció el 28 de abril de 2010 y estuvo conformado de tres tratamientos, cada uno en total con 135 cormos, sembrados en hoyos de 20X20X30cm de largo, ancho y profundo, respectivamente, y distribuidos al azar en cinco parcelas de 27 plantas (tres surcos, cada uno con nueve plantas), a una distancia de 3 X 2,5m y con bordes de Dominico Hartón a igual distancia.
Los tratamientos fueron: 1) Cormos con limpieza sanitaria "pelado" a los cuales se les realizó sumersión en solución de carbofuran al 1% (Furadan® 3SC) durante 1h. Ocho días antes de la siembra se incorporó por sitio, 2kg de gallinaza, y el día de la siembra, con una aspersora de espalda de 20L de capacidad, se aplicó alrededor de cada sitio 50mL de una suspensión de Paecilomyces lilacinus (Paecilotrópico®, dosis de 4g.L-1 de agua); 2) Cormos tradicionales sembrados en hoyos con 2kg de gallinaza; 3) Cormos tradicionales sembrados en hoyos sin gallinaza.
Se utilizó un diseño experimental en bloques completos al azar con tres tratamientos, cinco repeticiones por tratamiento, cada una con 27 unidades experimentales.
Durante el primer año del experimento se realizaron tres fertilizaciones: la primera, se realizó el 26 de mayo (28 días después de la siembra, DDS) con Rafos®, abocol (12-24-12-2; N, P, K y Ca, respectivamente) y ese mismo día se realizó la segunda aplicación de P. lilacinus (Paecilotrópico®, dosis de 4g.L-1) a las plántulas provenientes de los cormos con limpieza sanitaria; la segunda, se efectuó el 14 de julio (106 DDS) con Agrocafé® (17-6-18-2; N, P, K y Mg, respectivamente); y la tercera, se hizo el 20 de octubre (202 DDS), con Agrocafé®. En la primera y segunda fertilización, se aplicaron 100g por planta, y en la tercera fertilización 150g.
Se realizó deshoje sanitario y desyerbas manuales en el plato de las plantas al momento de cada fertilización; igualmente se hizo deshierba con guadaña cada 4 meses en las calles.
La evaluación del daño ocasionado por los nematodos fitoparásitos a las raíces, se realizó utilizando los diagramas de severidad establecidos por Carlier et al. (2003). Se realizaron dos muestreos destructivos: el primero, fue un muestreo destructivo de cinco plantas por tratamiento y repetición a las 12 semanas después de los tratamientos; y el segundo, a los 20 días después de la floración "belloteo" (aproximadamente a los 12 meses después de la siembra). Éste último consistió en recolectar las raíces a través de una excavación estándar de 20 x 20 x 20cm la cual se extendía desde el cormo de la planta madre.
Posteriormente, se dividieron las raíces recolectadas en dos categorías: raíces muertas (RM), y raíces funcionales (RF), y se contaba la cantidad de raíces en cada categoría. Luego, se seleccionaron al azar cinco raíces primarias funcionales, de mínimo 10cm de largo, después se observó la condición sanitaria general de las raíces secundarias y terciarias o raíces alimentadoras. Luego, se redujo el largo de las cinco raíces funcionales seleccionadas a 10cm y se les hicieron cortes longitudinales en rebanadas.
La evaluación de la severidad consistió en marcar la mitad de cada una de las cinco raíces respecto al porcentaje de corteza radical con necrosis. El máximo de necrosis radical para la mitad de las raíces podía ser de 20%, y por ende la necrosis radical máxima sería de 100% para las cinco mitades de raíces juntas. Posteriormente, se registró la necrosis de cada raíz (NR1 a NR5) y la sumatoria fue la necrosis radical total de la muestra (NRT). Con este dato, se calculó la tasa de desarrollo (r) del daño causado por los nematodos fitoparásitos empleando la siguiente fórmula:
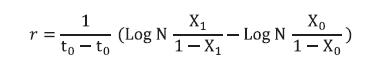
Dónde: r = Tasa de desarrollo de la enfermedad, t0 = Tiempo inicial, t1 = Tiempo final, X0 = Severidad inicial y X1 = Severidad final (Castaño-Zapata, 2002).
Las variables de respuesta fueron peso de racimo (kg), al igual que la cantidad y géneros de nematodos fitoparásitos en 100g de suelo y de raíces; las variables complementarias fueron el porcentaje de brotación (plántulas efectivas/cormos sembrados), volcamiento (número de plantas caídas a cosecha), y tiempo (meses) a floración y cosecha.
Para el análisis de los datos, se determinaron los promedios y coeficiente de variación para la variable de respuesta y para las complementarias; además se realizó análisis de varianza al 5% de probabilidad para las variables evaluadas de acuerdo con el diseño en bloques completos al azar. Así mismo, se aplicó la prueba de comparación múltiple de Tukey al 5% para establecer la diferencia entre los promedios de los tratamientos, utilizando el programa estadístico SAS, versión 9,0.
Resultados y discusión
Brotación (%). Se obtuvo una excelente brotación de los cormos en todos los tratamientos, la cual osciló entre 90 y 100%. Esta última se obtuvo en los cormos con limpieza sanitaria "pelado" tratados con carbofuran, y asociados con gallinaza y P. lilacinus.
Población inicial de nematodos fitoparásitos en suelo y raíces. En el suelo donde se estableció el experimento se encontraron 503 nematodos del género Helicotylenchus, 366 de Pratylenchus y 366 de Meloidogyne, con base en 100g de suelo. En las raíces de la higuerilla se encontraron 94 individuos de Helicotylenchus, 17 de Pratylenchus y 9 de Meloidogyne, también en 100g. Estos resultados indicaron que en éste lote no se encontraba el nematodo Barrenador, R. similis que es la principal especie fitoparásita de las musáceas. Según Sarah et al. (1996) y Gowen et al. (2005), R. similis no se encuentra en suelos sin uso agrícola o vírgenes, por consiguiente, se debe evitar su ingreso a ellos antes de la siembra; y para lograrlo, es esencial utilizar material de siembra libre de fitonematodos.
Población de nematodos fitoparásitos después de los tratamientos. A las 12 semanas de sembrados los cormos, se encontró que los tratamientos con la cantidad menor de nematodos fitoparásitos se obtuvo de los cormos provenientes de limpieza "sanitaria" y en cormos tradicionales asociados con gallinaza; obteniéndose valores mayores en raíces que en suelo (Figura 2). En el primer tratamiento, predominó Meloidogyne con valores entre 144 y 2.740 nematodos/ 100g de suelo y raíces, respectivamente, y en el segundo, predominó el género R. similis con 1.363 nematodos/100g de raíces, indicando que la mayor cantidad de este nematodo provenía de la semilla tradicional contaminada. Los cormos tradicionales sembrados sin gallinaza tuvieron las mayores cantidades de fitonematodos, destacándose Meloidogyne con 5.197 nematodos, R. similis y Helicotylenchus con 385 nematodos/100g de raíces (Figura 2).
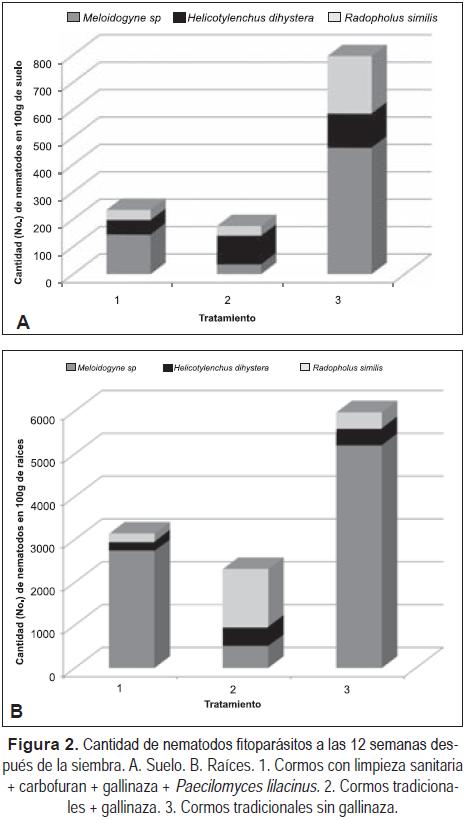
Estos resultados confirman lo encontrado Loos (1962), Blake (1969), Sarah et al. (1996), Gowen et al. (2005), ya que como el banano y el plátano han sido tradicionalmente propagados por semilla asexual mediante colinos "cormos" o cepas "rizomas", y a que R. similis se caracteriza por ingresar y movilizarse dentro de las células de raíces y los cormos, esto ha permitido que el intercambio de material de siembra infectado sea el principal medio de su diseminación.
En floración, nuevamente se encontró que las plantas provenientes de cormos con limpieza sanitaria + carbofuran + gallinaza + P. lilacinus, tenían las cantidades mayores de nematodos fitoparásitos, destacándose el género Meloidogyne con valores de 3.684 y 7.888/100g de raíces y suelo, respectivamente (Figura 3). Esto posiblemente ocurrió debido a que ante la cantidad menor de R. similis que barrena las células y compite por espacio, facilitó la colonización de Meloidogyne, tal como lo indican Moens (2004) y Torrado & Castaño-Zapata (2009), quienes observaron un efecto supresor entre estos dos géneros en las raíces de Musa dependiendo de cuál de los dos penetra primero.
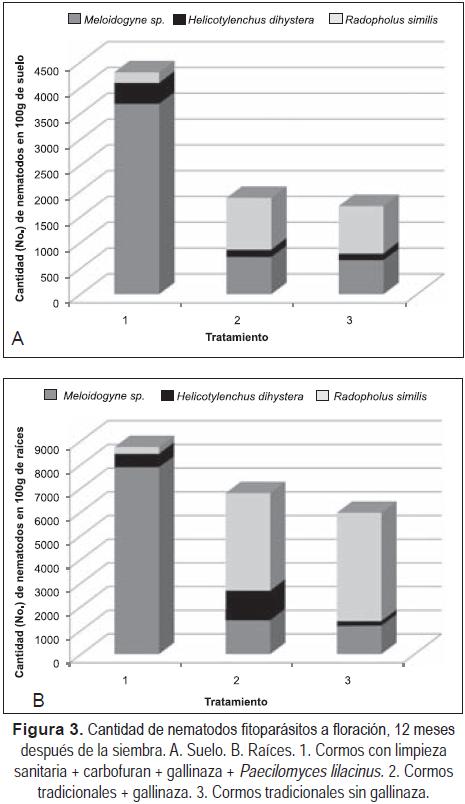
Resultados opuestos se encontraron en el suelo y raíces de las plantas provenientes de cormos tradicionales con y sin gallinaza, donde se destacó R. similis con un valor promedio de 4.340 nematodos/100g de raíces, siendo 78% superior a la cantidad hallada en el suelo. Los valores de los demás fitonematodos fueron inferiores a los de R. similis con valores por debajo de 1.430 nematodos/100g de suelo y raíces (Figura 3). Esto también posiblemente ocurrió debido a la cantidad mayor de R. similis dentro de los cormos y raíces de plátano, el cual barrena las células y compite por espacio, impidió la colonización de Meloidogyne, tal como se indicó previamente.
Al momento de realizar los muestreos destructivos, se encontró que a las 12 semanas todas las raíces de las plantas provenientes de cormos con limpieza sanitaria + carbofuran + gallinaza + Paecilomyces lilacinus eran funcionales, mientras que las raíces de las plantas provenientes de cormos tradicionales + gallinaza, tenían 24 y 13 raíces funcionales y muertas, respectivamente, muy similar a las de los cormos tradicionales sin gallinaza con 25 y 19, raíces funcionales y muertas, respectivamente.
Al momento de floración, en los cormos con limpieza sanitaria se encontraron 18 raíces funcionales y 3 muertas; mientras que en los cormos tradicionales con y sin gallinaza fueron 10 y 4; y 9 y 4, respectivamente; lo que indica que la cantidad mayor de raíces no funcionales ocurrió en los cormos tradicionales, donde se encontraba R. similis, el cual al alimentarse de las células del cilindro cortical, modifica la anatomía de las raíces, y reduce la absorción de agua y nutrientes (Blake, 1961; Thorne, 1961; Fogain & Gowen, 1997; Valette et al., 1998; Oramas & Román, 2006).
No obstante los reportes positivos de varios autores como Marbán et al. (1987), Rich et al. (1989), Rodríguez (2005) y Arboleda et al. (2011), acerca del efecto toxico de diferentes tejidos de higuerilla sobre los nematodos fitoparásitos, en éste estudio no se evidenció efecto de la asociación de la higuerilla con plátano Dominico Hartón en la supresión de nematodos, posiblemente debido a que los compuestos fitotóxicos producidos por la higuerilla no estaban en cantidad suficiente para afectarlos como ocurre en in vitro.
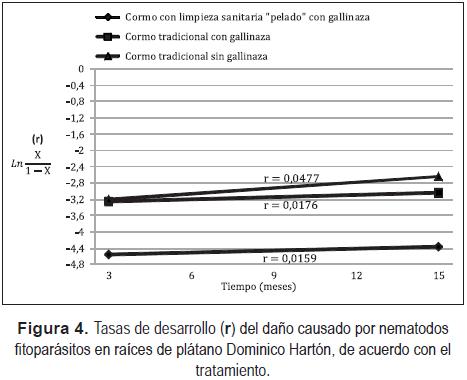
La velocidad a la que se desarrolló el daño de los nematodos fitoparásitos en las raíces fue notablemente superior en los cormos tradicionales sin gallinaza, observándose una tasa de desarrollo de r = 0,0477, seguida de los cormos tradiciones con gallinaza con r = 0,0176 (Figura 4). Estas tasas fueron muy superiores a la obtenida en los cormos con limpieza sanitaria "pelada" cuyo valor fue de 0,0159, inferior en 0,02 y 0,04, respectivamente (Figura 4).
Tiempos a floración y cosecha (meses). El tiempo desde la siembra hasta la floración y cosecha fue menor en las plantas que provenían de cormos con limpieza sanitaria, inferior en un mes en comparación con las plantas provenientes de cormos tradicionales (Tabla 1). Debido a las poblaciones altas de nematodos, principalmente R. similis, en las plantas provenientes de cormos tradicionales, se alargó el ciclo del cultivo. Adicionalmente, hubo alargamiento del ciclo del cultivo en dos meses en las plantas provenientes de cormos con limpieza sanitaria en comparación con la duración del ciclo normal de Dominico Hartón en el mismo sitio experimental, el cual oscila entre 13,5 y 14,7 meses (Aristizábal, 2010), retardo atribuido al sombrío que le proporcionó la higuerilla al plátano en los primeros meses de crecimiento de las plantas.
Producción. Las plantas provenientes de cormos sanos tuvieron un peso promedio de racimo de 18,6 kg y un rendimiento de 23.959 t ha-1, superiores en 28,5% y 46,3%, respectivamente, en comparación con las plantas provenientes de cormos tradicionales (Tabla 1). Estos resultados demuestran que las pérdidas ocasionadas por R. similis se reflejan en una disminución del peso de los racimos y por consiguiente en un incremento de las pérdidas en el rendimiento, el cual es aumentado por el volcamiento de las plantas. En esta investigación, las parcelas provenientes de cormos tradicionales con y sin gallinaza, tuvieron el menor número de plantas a cosecha con valores de 75% y 61%, respectivamente, por efecto del volcamiento ocasionado por R. similis, expresado en menor rendimiento (Tabla 1). La pérdida de anclaje de las plantas ocurre por el deterioro del sistema radical, y puede ocurrir en plantas jóvenes y adultas, pero principalmente entre la época de floración y cosecha, debido al peso del racimo, particularmente durante vientos y lluvias fuertes, lo que causa pérdidas económicas altas (Loos & Loos, 1960; Sarah et al., 1996; Sarah, 2000; Montiel et al, 1997; Araya, 2003; Brooks, 2008).
El mayor peso de racimo obtenido en las plantas provenientes de cormos con limpieza sanitaria se atribuye al efecto del pelado, a través el cual se eliminó el tejido necrótico parasitado por R. similis, quien al alimentarse de las células del cilindro cortical, modifican la anatomía de las raíces, interfiriendo con la absorción de agua y nutrientes (Blake, 1961; Thorne, 1961; Blake, 1966; Fogain & Gowen, 1997; Valette et al., 1998; Oramas & Román, 2006).
Fogain (2000), en un estudio realizado en Camerún con plátano (Musa AAB) cultivar French Sombre, encontró un mayor número de plantas caídas (18,3 y 52,5%, en la primera y segunda cosecha, respectivamente) en áreas infestadas sin tratar con nematicidas, y un menor número de plantas caídas (2,5 y 7,5%, en la primera y segunda cosecha, respectivamente) en las áreas tratadas, lo que representó una disminución en rendimiento (t ha-1) del 60 y 52% en la primera y segunda cosecha, respectivamente, en comparación con las plantas tratadas.
En plantaciones infectadas por R. similis con control deficiente, las pérdidas en rendimiento pueden oscilar entre 44 y 50% (Loos & Loos, 1960). En suelos deficientes en nutrientes y erosionados, las pérdidas acumulativas durante tres ciclos de producción pueden alcanzar hasta 75%, debido a la reducción en el peso del racimo y a la caída de las plantas como ha ocurrido en Costa de Marfil (Sarah et al., 1996). En América Central (Costa Rica y Panamá) y en América del Sur (Colombia y Ecuador), las pérdidas causadas por el volcamiento de plantas fluctúan entre 12 y 18%, mientras que en el Valle de Sula en Honduras, éstas tienden a ser menores (alrededor del 5%) (Araya, 2003). Así mismo, el autor principal de esta investigación ha observado en el primer ciclo de producción de Dominico Hartón en la granja Montelindo de la Universidad de Caldas, Colombia, pérdidas del 70% ocasionadas por R. similis, principalmente por efecto del volcamiento,
En este estudio se encontró que las plantas provenientes de cormos tradicionales severamente atacados por R. similis fueron de menor tamaño y vigor, con hojas más pequeñas, diferentes a las de las plantas procedentes de cormos sanos (Figura 5). Resultados similares obtuvieron Jenkins & Taylor (1967) y Sarah et al. (1996).

En general, el daño causado por R. similis, se reflejó en un menor número y tamaño de las hojas, menor peso del racimo, incremento del tiempo desde siembra a floración, de floración a cosecha, entre floraciones y entre cosechas (Tabla 1, Figuras 5, 6), lo cual coincide con los estudios de Sarah et al. (1996), Araya (2003) y Gowen et al. (2005).

Finalmente, es importante tener presente que en plantas de la misma edad, se puede apreciar que las severamente atacadas por R. similis carecen de raíces absorbentes y las raíces de anclaje son necróticas, de menor tamaño y cantidad, contrario a lo que ocurre en el sistema radical de plantas libres de éste nematodo (Figuras 5, 6), lo cual concuerda con los resultados obtenidos por otros investigadores como Loos & Loos (1960) y Araya (2003).
Conclusiones
La limpieza sanitaria de cormos "pelado" de plátano Dominico Hartón disminuyó al nematodo Barrenador R. similis y aumentó el nematodo formador de nudos Meloidogyne spp., lo cual redujo el volcamiento y aumentó significativamente el rendimiento del cultivo.
En Colombia, la práctica de limpieza sanitaria de cormos puede ser fácilmente adoptada por los agricultores de plátano y banano, es eficaz para el manejo de plagas como los nematodos fitoparásitos y picudos, económica y no contamina el medio ambiente, convirtiéndose en una estrategia dentro del manejo integrado de éstos problemas sanitarios.
Bibliografía
Acacio-Bigi M. J. A., O. C. Hebling., F. C. Bueno. & M. Pagnocca. 1998. Toxicidade de extratos foliares de Ricinus communis L. para operarias de Atta sexdens rubropilosa Forel. Rev. Bras. Ent. (Brazil). 41(2-4): 239-243. [ Links ]
Aguas A. & M. Martinez. 2003. Técnicas rápidas para la multiplicación de semillas de plátano. Boletines Divulgativos Ecorregión Caribe (COL), (69), 7p. [ Links ]
AGRONET. Boletines estadísticos. Encuesta Nacional Agropecuaria. 2009. (Consultado 01 de octubre de 2010). http://www.agronet.gov.co/agronetweb/Boletines/tabid/75/Default.aspx [ Links ]
Araya M., M. Centeno. & W. Carrillo. 1995. Densidad poblacional y frecuencia de los nematodos parásitos de banano (Musa AAA) en nueve cantones de Costa Rica. CORBANA (Costa Rica). 20(43): 6-11. [ Links ]
Araya M. & T. Moens. 2003. Parasitic nematodes on Musa AAA (Cavendish subgroup cvs 'Grande naine' 'Valery' and 'Williams'). pp: 201-223. En: Turner, D., & Rosales, F. Banana Root System: Toward a Better Understanding for Its Productive Management. San José, Costa Rica, 3-5 November. INIBAP. Montpellier, France. [ Links ]
Arboleda F., O. Guzmán. & J. Restrepo. 2010. Efecto in vitro de extractos acuosos de higuerilla (Ricinus communis Linneo) sobre el nematodo Barrenador [Radopholus similis (Cobb) Thorne]. Revista Agronomia 18 (2): 25 – 36. [ Links ]
Aristizábal M. 2010. Efecto de la frecuencia de fertilización con nitrógeno y potasio sobre el crecimiento, producción y severidad de las Sigatokas del plátano (Musa AAB) Dominico Hartón. Revista Agronomía 18 (1): 19 – 28. [ Links ]
Blake C. D. 1961. Root rot of bananas caused by Radopholus similis (Cobb) and its control in New South Wales. Nematologica 6: 295-310. [ Links ]
Brooks F. E. 2008. Burrowing Nematode. The Plant Health Instructor. APSnet. Obtenido el 15 de agosto de 2011, desde http://www.apsnet.org/edcenter/intropp/lessons/Nematodes/Pages/Burrowingnematode.aspx [ Links ]
Carlier J., D. De Waele. & J.V. Escalant. 2003 Evaluación global de la resistencia de los bananos al marchitamiento por Fusarium, enfermedades de las manchas foliares causadas por Mycosphaerella y nematodos. Evaluación de comportamiento (A. Vézina y C. Picq, eds). Guías técnicas INIBAP 7. Red Internacional para el Mejoramiento del Banano y el Plátano, Montpellier, Francia. [ Links ]
Castaño-Zapata J. 2002. Principios básicos de fitoepidemiología. Manizales: Centro Editorial Universidad de Caldas. 396p. [ Links ]
Colbran R.C. 1967. Hot Water Tank for Treatment of Banana Planting Material. Advisory leaflet No. 924. Division of Plant Industry, Queensland. [ Links ]
Corporación Colombiana de Investigación Agropecuaria, CORPOICA. Centro de investigaciones La Selva. 2008. Higuerilla: Alternativa productiva, energética y agroindustrial para Colombia. 1 ed. Rionegro, Antioquia (Colombia). Centro de Investigaciones La Selva-Corpoica. 38 p. [ Links ]
Coyne D., C. Kajumba. & F. Kagoda. 2003. Nematode management at the International Institute of Tropical Agriculture. p.141-148. In: G. Blomme, C. Gold and E. Karamura (eds.), Farmer- Participatory Testing of Banana Integrated Pest Management Options for Sustainable Banana Production in Eastern Africa, Proc. Workshop on Farmer-participatory testing of IPM options for sustainable banana production in Eastern Africa, held in Seeta, Uganda, 8-9 December 2003, INIBAP, Montpellier, France. http://bananas.bioversityinternational.org/files/files/pdf/publications/farmerparticipatory.pdf [ Links ]
Daneel M., K. De Jager. & Z. De Beer. 1998. IPM for nematodes on bananas in South Africa. pp: 247-257. En: Mobilizing IPM for Sustainable Banana Production in Africa Proceedings of a Workshop on Banana IPM Held in Nelspruit, South Africa — 23-28 November 1998. E.A. Frison, C.S. Gold, E.B. Karamura and R.A. Sikora, editors. INIBAP. [ Links ]
Díaz M. J., M. Rivera. & L Durán. 2007. Como proteger de las plagas del suelo los Cormos-Semilla de Plátano y Banano. 1a ed. La Lima, Cortés, Honduras: FHIA, Departamento de Protección Vegetal. 18 p. [ Links ]
Espinel C., H. Martinez. & Y. Peña. 2006. La cadena del plátano en Colombia. Ministerio de Agricultura y Desarrollo Rural. Documento de trabajo N0. 12. [ Links ]
Fogain R. & S.R. Gowen. 1997. Damage to roots of Musa cultivars by Radopholus similis with and without protection of nematicides. Nematropica 27(1): 27-32. [ Links ]
Fogain R. 2000. Effect of Radopholus similis on plant growth and yield of plantain (Musa AAB). Nematology, 2, 129-133. [ Links ]
Gowen S., P. Quénéhervé. & R. Fogain. 2005. Chapter 16: Nematodes parasites of bananas and plantains. pp: 611-643. En: Plant Parasitic Nematodes in Subtropical and Tropical Agriculture. Edited by: Luc, M., J. Sikora. y J, Bridge. 2005. [ Links ]
Hauser S. 2007. Plantain (Musa spp. AAB) bunch yield and root health response to combinations of physical, thermal and chemical sucker sanitation measures. African Plant Protection 13: 1–15. [ Links ]
Guzmán P. O. & J. Castaño-Zapata. 2004. Reconocimiento de nematodos fitopatógenos en Dominico Hartón (Musa AAB Simmonds) África, FHIA 20 y FHIA 21 en la granja Montelindo, municipio de palestina (Caldas), Colombia. Revista colombiana de ciencia, 38(107) Pp 295-301. [ Links ]
Holfelder M.G.A., M. Steck., E. Komor. & Seifert, K. 1998. Ricinine in phloem sap of Ricinus communis. Phytochemistry. v.47, n.8, p.1461-1463. [ Links ]
Jenkins W. R. & D. P. Taylor. 1967. Plant nematology. New York: Reinhold Publ. Corp. 270p. [ Links ]
Loos C. A. & S. Loos. 1960. Preparing nematode-free banana "seed". Phytopathology. 50. pp: 383-386. [ Links ]
Loos C. A. 1962. Studies on the life-history and habits of the burrowing nematode, Radopholus similis, the cause of blackhead disease of bananas. Proc. Helminthol. Soc. Wash., 29, 43-56. [ Links ]
Maggenti A., M. Luc., D. Raski., R. Fortuner. & E. Geraert. 1987. A Reappraisal of Tylenchina (Nemata). 2. Classification of the suborder Tylenchina (Nemata: Diplogasteria). Revue Nématol. 10 (2): 135 -142. [ Links ]
Mai W., P. Mullin., H. Lyon. & K. Loeffler. 1996. Plant parasitic nematodes. A pictorical key to genera. Fifth edition. Comstock Publishing Associates A Division of Cornell University Press. 277p. [ Links ]
Marbán N., Jeyaprakash, A., Jansson, H. B., Damon JR. R. A. & Zuckerman, B. M. 1987. Control of root-knot nematodes on tomato by lectins. Journal of Nematology 19:331-335. [ Links ]
Meredith J. 1973. Algunos métodos de campo y laboratorio para trabajar con nematodos. Maracaibo (Venezuela). P. 44.pp. [ Links ]
Moens t., M. Araya., R. swennen. & D. De Waele. 2004. Enhanced biodegradation of nematicides after repetitive applications and its effect on root and yield parameters in commercial banana plantations. Bio Fertil Soils 39: 407-414. [ Links ]
Moshkin V.A. 1986. Economic importance and regions of cultivation of castor. In: Moshkin, V. A. Editor. ed. Castor. Moscow. Kolos. p. 1–5. [ Links ]
Oramas D. & J. Román. 2006. Histopatología de los nematodos Radopholus similis, Pratylenchus coffeae, Rotylenchulus reniformis y Meloidogyne incognita en plátano (Musa acumulata X M. balbisiana, AAB). J. Agric. Univ. P.R. 90 (1-2): 83-97. [ Links ]
Price N. 2006. The banana burrowing nematode, Radopholus similis (Cobb) Thorne, in the Lake Victoria region of East Africa: its introduction, spread and impact. Nematology 8 (6): 801-817. [ Links ]
Rich, J. R., G. S. Rahi., C.H. Opperman. &. E. L. Davis. 1989. Influence of the castor bean (Ricinus communis) lectin (ricin) on motility of Meloidogyne incognita. Nematropica 19:99-103. [ Links ]
Robinson J.C., M. Daneel. & P.S. schoeman. 1998. Cultural practices in relation to integrated pest management in bananas. pp: 283-289. En: Mobilizing IPM for Sustainable Banana Production in Africa Proceedings of a Workshop on Banana IPM Held in Nelspruit, South Africa — 23-28 November 1998. E.A. Frison, C.S. Gold, E.B. Karamura and R.A. Sikora, editors. INIBAP. [ Links ]
Rodríguez J.L. & A. Rodríguez. 2001. Aspectos Socioeconómicos del cultivo de plátano en Colombia. En: INFOMUSA. Vol.10. no. 1, p. 4-9. [ Links ]
Rodríguez C. 2005. Plantas contra plagas 2 Epazote, hierba de la cucaracha, paraíso, higuerilla y sabadilla. 1 ed. Tlaxcala (México). RAPAL, RAPAM, SOMAS. Instituto Tecnológico del Altiplano de Tlaxcala, 209 p. [ Links ]
Salazar H. & S. Duque. 1994. Manejo cultural y químico de la pudrición acuosa del pseudotallo (Erwinia chrysantemi pv. paradisiaca) en Musa sp. Fitopatología Colombiana. 18 (1): 20-35. [ Links ]
Sarah J. L. 2000. Burrowing nematode. Pp:295-303. In D.R. Jones ed. Diseases of banana, Abacá and Enset. CABI Publishing. Wallingford, UK. [ Links ]
Sarah J. L., J. Pinochet. & J. Stanton. 1996. El nematodo Barrenador del banano Radopholus similis Cobb. Plagas de Musa - Hoja Divulgativa No. 1. (Diciembre, 1996). INIBAP, Francia. [ Links ]
Siddiqi M. R. 2000. Tylenchida: Parasites of plants and insects, 2nd Edition. CABI Bookshop. 834p. [ Links ]
Tenkouano, A., S. HAUSER., D. COYNE. & O. COULIBALE. 2006. Clean planting materials and management practices for sustained production of banana and plantain in Africa. Chronica Horticulturae 46:14–18. [ Links ]
Thorne G. 1961. Principles of nematology. New Cork, Mc Graw Hill, Book company. 553p. [ Links ]
Topping M. D., T.S. Henderson., C.M. Luczynska. & A. Woodmass. 1982. Castor bean allergy among workers in the felt industry. Allergy, 37, 603-608. [ Links ]
Torrado M. & J. Castaño-Zapata. 2009. Incidencia de nematodos en plátano en distintos estados fenológicos. Agronomiá Colombiana 27(2):239-246. [ Links ]
Valette C., C. Andary., J. P. Geiger., J. L. Sarah., & M. Nicole. 1998. Histochemical and cytochemical investigations of phenols in roots of banana infected by the burrowing nematode Radopholus similis. Phytopathology 88, 1141-1148. [ Links ]
Recibido: Noviembre 28 de 2011.
Aceptado para su publicación: Marzo 2 de 2012.













