Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales
Print version ISSN 0370-3908
Rev. acad. colomb. cienc. exact. fis. nat. vol.36 no.140 Bogotá July/Sept. 2012
BIOQUÍMICA
* Centro de Cromatografía y Espectrometría de Masas, CROM-MASS, CIBIMOL, CENIVAM, Universidad Industrial de Santander. Carrera 27, Calle 9, Bucaramanga, Colombia. elena@tucan.uis.edu.co
RESUMEN
Se obtuvieron extractos de hojas y tallos de salvia (Salvia officinalis, Fam. Labiatae) y romero (Rosmarinus officinalis, Fam. Labiatae) y de hojas de guayaba (Psidium guajava Fam. Myrtaceae), empleando CO2 en estado supercrítico. Se obtuvieron modelos polinómicos para relacionar el rendimiento de extractos con las condiciones de su obtención. La composición de la fracción volátil de los extractos se determinó por medio de GC-MS. Se midieron la capacidad antioxidante (ORAC) de los extractos y el grado de protección que ofrecen al agregarse a una base cosmética sometida a oxidación lipídica por acción de la radiación UV. El extracto de romero mostró el mayor porcentaje de inhibición de la oxidación lipídica (88%), seguido por el de salvia (76%) y el de hojas de guayaba (43%). Los extractos de romero y salvia exhibieron una capacidad antioxidante alta (1,9 µmol Trolox®/mg), similar a la del BHT y la vitamina E (2,8 y 3,0 µmol Trolox®/mg), mayor que la del extracto de hojas de guayaba (0,7 µmol Trolox®/mg).
Palabras clave: Salvia officinalis; Rosmarinus officinalis; Psidium guajava; fluido supercrítico; antioxidante; ORAC; peroxidación lipídica; hexanal.
ABSTRACT
Extracts from stems and leaves of sage (Salvia officinalis, Labiatae Fam.) and rosemary (Rosmarinus officinalis, Labiatae Fam.) and from guava leaves (Psidium guajava, Myrtaceae Fam.), were obtained using supercritical CO2. Polynomic models were formulated to relate yield with extraction conditions. The compositions of the volatile fractions of these extracts were determined using GC-MS. Their antioxidant capacity (ORAC) and the protection resultant from their addition to a cosmetic base subjected to lipid peroxidation as a result of its exposure to UV radiation were also measured. The extract from rosemary imparted the highest lipid peroxidation inhibition (88%), followed by those obtained from sage (76%) and guava leaves (43%). Rosemary and sage extracts exhibited a high antioxidant capacity (1,9 µmol Trolox®/mg), similar to those of BHT and vitamin E (2,8 and 3,0 µmol Trolox®/mg), respectively, and higher than that of the guava leaves extract (0,7 µmol Trolox®/mg).
Key words: Salvia officinalis; Rosmarinus officinalis; Psidium guajava; supercritical; antioxidant; ORAC; lipid peroxidation; hexanal
1. Introducción
La búsqueda de productos de origen natural que permitan sustituir compuestos sintéticos, que actualmente se usan en las industrias alimenticia, de cosméticos, farmacológica y muchas otras, ha adquirido gran importancia. Esto se debe a los posibles efectos adversos y toxicidad reportada de los compuestos sintéticos. El butilhidroxianisol (BHA) y el butilhidroxitolueno (BHT) se han usado ampliamente como agentes antioxidantes, para conservar productos alimenticios (JECFA, 1996). El BHT ha extendido su uso en productos farmacéuticos, vitaminas liposolubles y cosméticos, puesto que les aumenta su estabilidad y tiempo de vida útil (FDA, 1981). La Agencia Internacional para la Investigación del Cáncer (IARC) evaluó el modo de acción del BHA, y encontró evidencia suficiente de acción carcinogénica de este compuesto en animales (IARC, 1986).
Las plantas romero (Rosmarinus officinalis, Fam. Labiatae), salvia (Salvia officinalis, Fam. Labiatae) y guayaba (Psidium guajava, Fam. Myrtaceae) se presentan como una fuente alternativa de compuestos que pueden ser sucedáneos de los antioxidantes de origen sintético. El romero y la salvia, poseen metabolitos secundarios con efectos medicinales reportados (Aim et al., 2005). La actividad antioxidante que se les atribuye, se debe principalmente a la presencia de los ácidos carnósico y rosmarínico (Ibañez et al., 2003; Bisio et al., 1997). Sin embargo, esta actividad biológica depende también de la presencia de compuestos activos, que incluyen terpenoides, flavonoides y ácidos fenólicos (Masaki et al., 1995). La guayaba, especie originaria de América tropical, ha sido objeto de varias investigaciones sobre actividad biológica, que han mostrado que tanto la fruta como la hoja son fuentes de flavonoides, polifenoles y otras sustancias bioactivas (Pérez et al., 2008). Adicionalmente, en las hojas de guayaba se han encontrado ácidos fenólicos tales como el ferúlico, a los cuales se les atribuye su mayor capacidad antioxidante, en comparación con los compuestos presentes en la fruta (Chen et al., 2007).
Existen diferentes formas de extraer los compuestos bioactivos de las plantas. Para seleccionar alguna técnica es necesario tener en cuenta que los compuestos pueden degradarse con la temperatura u oxidarse en presencia de oxígeno y luz. La extracción con fluidos supercríticos es una técnica importante que aprovecha las características de densidad y viscosidad de las sustancias en estados más allá de su punto crítico. El CO2 es uno de los solventes más usados debido a que el extracto resultante se colecta libre de residuos de solvente, no tiene restricciones medioambientales, ni problemas de regulación en la salud pública (Meireles et al., 2005). El CO2 en estado supercrítico puede ser utilizado en productos nutracéuticos, funcionales y alimenticios, lo que actualmente es un tema de creciente interés (Sebastián et al., 1998; Martínez, 2008).
El objetivo de este trabajo fue encontrar modelos matemáticos para la predicción del rendimiento de la extracción de salvia, romero y guayaba (hojas) con CO2 en estado supercrítico. Para cada uno de los 3 extractos se determinaron la composición de su fracción volátil, la actividad antioxidante según el método ORAC, y su comportamiento como inhibidor de la peroxidación de una base cosmética.
2. Materiales y métodos
2.1. Extracción con CO2 supercrítico
Las hojas y tallos de romero y salvia, con un contenido de humedad entre 20 y 30%, fueron suministradas por la Asociación Municipal de Usuarios Campesinos el Retiro Veredas Aledañas Sucre Santander (ACRESS) en enero de 2011. La empresa Fharmavicola S.A. proporcionó las hojas de guayaba en condiciones de humedad similares. Antes de la extracción con CO2 se realizó un pretratamiento de reducción de tamaño de partícula y de secado. La reducción de tamaño se efectuó en un picador/triturador forrajero TRF 300 (Metalúrgica TRAPP Ltda. Jaraguá do sul, Brasil) acondicionado con un tamiz de 0,8 mm. Posteriormente, el material vegetal picado de cada especie se introdujo por lotes de 0,6 kg en un horno eléctrico de bandejas (INDUMEGAS, Bucaramanga, Colombia) durante 18 horas, para lograr un contenido de humedad menor de 10%. Todas las extracciones con CO2 supercrítico se realizaron en un equipo Thar modelo SFE-2000-2-FMC50 (Thar Instruments, Inc, Pittsburg, PA, EE.UU.). Su cámara de extracción tiene un volumen de 1,78x10-3 m3. El extractor está diseñado para condiciones máximas de presión, flujo de CO2 y temperatura, de 60 MPa, 12 kg/h y 120°C, respectivamente. El material vegetal se cargó al extractor con una densidad aparente de 370 kg/m3, lo que ocupó cerca del 83% de la cámara de extracción. Estos valores son similares a los utilizados por A. Meireles y colaboradores en los estudios cinéticos de la extracción con CO2 supercrítico de romero (Meireles et al., 2005). La temperatura de extracción se mantuvo constante en 50°C, teniendo en cuenta los datos de densidad del CO2 para presiones que se encuentran por encima de 30 MPa, con un valor máximo de 920 ± 39 kg/m3 a esta temperatura (Shi et al., 2009). Los niveles para la presión se seleccionaron con base en estudios sobre la solubilidad del ácido carnósico (compuesto presente en las tres especies) en CO2, los cuales indicaron que solo se observa un aumento significativo de esta propiedad cuando se opera a presiones superiores a 30 MPa (Rižnar et al., 2008).
2.2. Diseño experimental
La presión (P, 30; 40; 50 MPa), el tiempo de extracción (t, 0,5; 1,25; 2 h) y el flujo de CO2 (F, 1,5; 2,25; 3 kg/h), se variaron sistemáticamente según un diseño experimental central compuesto, para evaluar sus efectos sobre el rendimiento de extracción de las tres especies vegetales. Los valores entre paréntesis corresponden a los niveles bajo (-1), medio (0) y alto (1) tomados por las variables. El diseño incluyó 8 experimentos en puntos factoriales, 6 en puntos axiales y 3 en puntos centrales (Tabla 1). Los tres experimentos del punto central (0,0,0) se utilizaron para evaluar el error experimental.
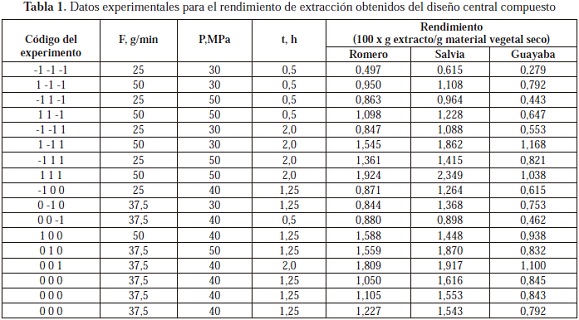
Los rendimientos de extracción observados para las 3 especies se muestran en la Tabla 1. Se utilizó una ecuación polinómica de segundo orden para modelar el rendimiento como una función de variables independientes, con base en el análisis de varianza. Se construyeron modelos en los que se conservaron únicamente los coeficientes que presentaran influencia estadísticamente significativa. Los modelos fueron refinados con el método de validación cruzada (dejando fuera un caso a la vez) aplicado a los 17 resultados experimentales.
2.3. Análisis cromatográfico: GC-MS y HPLC.
Los extractos se disolvieron en metanol, se les adicionó n-tetradecano como estándar interno y se analizaron en un cromatógrafo de gases GC Agilent Technologies 6890N Plus (AT, Palo Alto, California, EE.UU.), acoplado a un detector selectivo de masas AT MSD 5973, con un puerto de inyección split/splitless (relación split 1:30) e inyector automático AT 7863. Se usó una columna capilar de sílice fundida, DB-5MS de 60 m x 0,25 mm, D.I., recubierta con una fase estacionaria de 5%-fenil-poli(metilsiloxano) de 0,25 µm de grosor (df). La temperatura del horno se programó de 45°C (5 min) hasta 150°C (2 min) a 4°C min-1, luego, hasta 250°C (5 min) a 5°C min-1 y, finalmente, hasta 275°C a 10°C/min, temperatura a la cual permaneció constante durante 15 min.
Para su análisis por cromatografía líquida, los extractos se disolvieron en metanol: ácido acético (0,5%) (1:1). Se utilizó un cromatógrafo líquido AT 1200 con un detector UV-Vis de arreglo de diodos, DAD G1315B y columna KINETICS 2.6u C18 (100 mm x 4,6 mm). La temperatura de la columna se mantuvo en 35 °C y el volumen de muestra inyectada fue de 20 µL. Las fases móviles A y B fueron ácido acético (0.3%) y acetonitrilo, respectivamente. Las condiciones cromatográficas fueron: 0-13 min, 4.5% B; 14-17 min, 15% B; 20-28 min, 22% B, 30-33 min, 100% B; 34-45 min, 4.5% B. Se utilizó un flujo de fase móvil de 1,0 mL/min.
2.4. Preparación de las muestras para la evaluación de su capacidad antioxidante
Cada uno de los extractos de romero, salvia y hojas de guayaba, se diluyó en metanol, seguido de agitación mecánica (vórtice, 30 s) y por ultrasonidos (30 min) y centrifugación (3500 rpm, 15 min). Se tomó el líquido sobrenadante y se filtró sobre vidrio poroso (0,22 µm).
2.5. Análisis de la capacidad antirradicalaria
La determinación de la capacidad antirradicalaria de los extractos se realizó mediante el ensayo ORAC descrito por Ou y colaboradores (Ou et al. 2001). éste se llevó a cabo en un espectrofotómetro Modulus™ II, microplate reader, 645 N de Turner Biosystems, (North Mary Avenue, Sunnyvale, CA, EE.UU.) en un rango de longitud de onda de 490-570 nm; las mediciones se realizaron en microplacas de 96 pozos.
2.6. Determinación de la capacidad antioxidante in-vitro
La microextracción en fase sólida (SPME) con derivación simultánea sobre la fibra (Stashenko et al., 2000, 2002) se utilizó para medir la inhibición ejercida por los extractos, sobre la peroxidación lipidica de una base cosmética O/W, inducida por radiación UV-A. Mezclas homogéneas de las sustancias de análisis (0,5% en peso) y la base cosmética O/W (Laboratorios MyN Bogotá, Colombia) fueron expuestas durante 12 h a radiación ultravioleta, en un fotorreactor, con el fin de inducir la peroxidación lipídica de la crema cosmética. El avance de la peroxidación se supervisó a través de la cuantificación del hexanal liberado, ya que éste es un producto secundario final de la oxidación de ácidos grasos insaturados, principalmente, el ácido linoleico.
La fibra (PDMS/DVB) de SPME se saturó previamente por exposición a la fase vapor de una solución acuosa de pentafluorofenilhidracina (PFPH); la fibra así preparada, se expuso al espacio de cabeza de la mezcla (base cosmética con extracto SFE), para capturar y derivatizar aldehídos resultantes de su peroxidación, inducida por radiación UV. Las hidrazonas formadas por la reacción entre PFPH y los compuestos carbonílicos presentes en la fase vapor (Stashenko et al., 2002), fueron desorbidas térmicamente por inserción directa de la fibra en el puerto de inyección de un cromatógrafo de gases HP-5890 Series II acoplado a un detector de captura de electrones (ECD, 63Ni).
3. Resultados y discusión
3.1. Efecto de los parámetros de extracción.
El análisis de la varianza de las mediciones de los experimentos de extracción SFE de romero (tallos y hojas), salvia (tallos y hojas) y guayaba (hojas) mostró que en todos los casos, la presión, el flujo de CO2 y el tiempo de extracción, afectaron significativamente el rendimiento de la extracción. Por medio de la regresión lineal múltiple se hallaron los coeficientes de modelos polinómicos de 2° orden para relacionar el rendimiento de extracción con estas 3 variables. En procesos de validación cruzada con exclusión de un término a la vez, se utilizaron el error cuadrado medio de la predicción del rendimiento y el coeficiente de determinación ajustado (R2aj) como criterios de refinamiento de los modelos. La Figura 1 presenta los gráficos de comparación de los valores de rendimiento de extracción (Y), experimental y predicho, para las 3 especies estudiadas, con los modelos refinados (Ecuaciones 1 - 3).
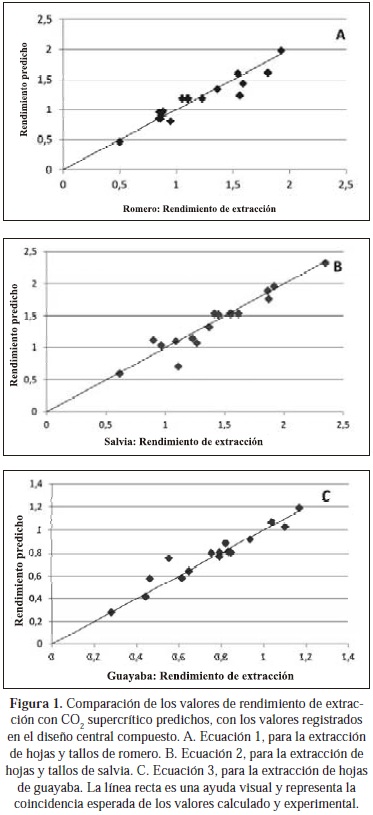

Los valores utilizados para las variables F, P y t en estos modelos fueron los resultantes del escalamiento según los niveles bajo (-1) y alto (1) empleados en los experimentos (Tabla 1). En las etapas de la validación cruzada (17 experimentos), el error de ajuste del modelo (ecuación 4) se calculó como la diferencia entre el error experimental total (con base en la varianza de las m réplicas Xi) y la suma de los errores en la predicción (Ŷi) del experimento excluido. En la Tabla 2 aparecen los valores del error cuadrado medio (RMSE), el error de ajuste registrado en la validación cruzada (ecuación 4) y el coeficiente de determinación de los modelos 1 - 3. El modelo con mejor ajuste fue el obtenido para la predicción del rendimiento de extracción de hojas de guayaba.
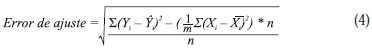
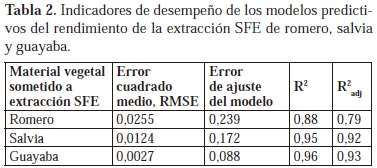
Para los 3 modelos, el rendimiento de extracción fue directamente proporcional a las 3 variables estudiadas, aunque su crecimiento no fue monótono, debido a la presencia de términos cuadráticos y de interacción binaria. Las Figuras 2, 3 y 4 contienen gráficos de contorno para estos 3 modelos, en los que se predicen los valores más altos de rendimiento de extracción para condiciones experimentales externas a la región explorada con el diseño central compuesto. Algunas condiciones de presión y flujo correspondientes a las regiones de mayor rendimiento de extracción predicho no son accesibles experimentalmente (P > 100 MPa, F > 10 kg/h).



Los mayores rendimientos de extracción experimentales se registraron cuando se utilizaron los niveles altos de F, P y t en la extracción de romero o salvia. En el caso de la extracción de hojas de guayaba, este valor se obtuvo con los niveles altos de F y t y el nivel bajo de P. Según la extrapolación hecha en los gráficos de contorno (Figuras 2, 3 y 4), para obtener los rendimientos óptimos, se requerirían tiempos de extracción 4, 5 y 6 veces más largos que el nivel superior empleado en los experimentos de extracción de romero, salvia y guayaba, respectivamente. Esta dependencia del rendimiento de extracción coincide en general con la encontrada en varios modelos para la extracción SFE de semillas de cilantro (Magoulas et al., 2000). Con base en estos gráficos de contorno, para lograr rendimientos de extracción altos (> 1%) se puede formular la recomendación de usar niveles altos de F, P y t en las extracciones de romero y salvia y niveles altos de F y T y un nivel bajo de P, en la extracción de hojas de guayaba.
3.2 Composición de los extractos, actividad antioxidante e inhibición de la lipoxidación.
Por disolución o arrastre por el CO2 en estado supercrítico, sustancias de baja masa molecular (mono- y sesquiterpenos), así como otros compuestos más pesados (triterpenos, polifenoles), son retirados del material vegetal y conforman la mezcla llamada extracto SFE. Para determinar su composición se recurre a la cromatografía de gases (para los componentes volátiles y semivolátiles) y a la cromatografía líquida (para las sustancias con baja presión de vapor, poco volátiles). En este trabajo, se utilizó la microextracción en fase sólida para tomar la muestra de las sustancias volátiles del extracto SFE (fracción volátil), a analizar por cromatografía de gases. La composición de la fracción volátil de los extractos SFE aislada por medio de la microextracción en fase sólida, se describe en las Tablas 3, 4 y 5, en las que se incluyen los índices de retención experimental y reportado en la literatura científica (Adams, 2004) para cada compuesto. El extracto de romero se caracterizó por contener mayoritariamente alcanfor (13,4 %) y 1,8-cineol (10,1%), lo cual coincide con lo determinado en otras investigaciones (Carvalho et al., 2005). De igual forma, se encuentran presentes ciertos terpenos que han sido identificados en el aceite esencial de romero. Verbenona (5,3 %), α-pineno (2,5 %), canfeno (2,8 %) y borneol (0,7 %) resultaron ser característicos de la fracción volátil del extracto; tal como lo describieron Reverchon y colaboradores, quienes reportaron que los compuestos presentes en el extracto SFE, resultan ser los mismos presentes en el aceite esencial, pero con diferentes cantidades relativas (Reverchon et al., 1992).
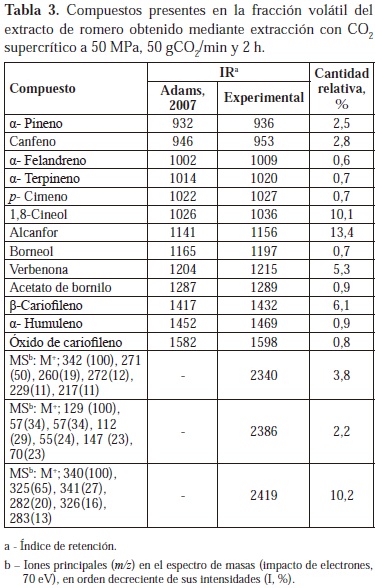
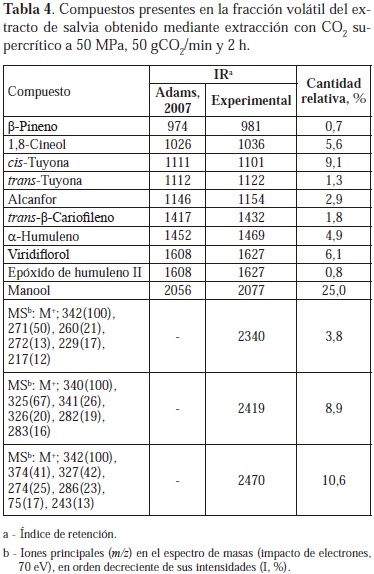
Existe una amplia variación en la composición de los aceites esenciales y extractos de S. officinalis de diferentes orígenes. Sin embargo, en la mayoría de los casos se observan 4 compuestos mayoritarios (alcanfor, 1,8-cineol, a- y b-tuyonas), cuyas proporciones relativas dan lugar a 5 tipos de aceite esencial de salvia (Mockuté et al., 2003). En esta investigación también se hallaron estos 4 compuestos mayoritarios en la fracción volátil del extracto SFE de salvia. El diterpeno manool (25%) fue el componente mayoritario de esta fracción volátil, cuya composición fue similar a la reportada por Glisik et al. (2010) para extractos de salvia cultivada en Serbia.
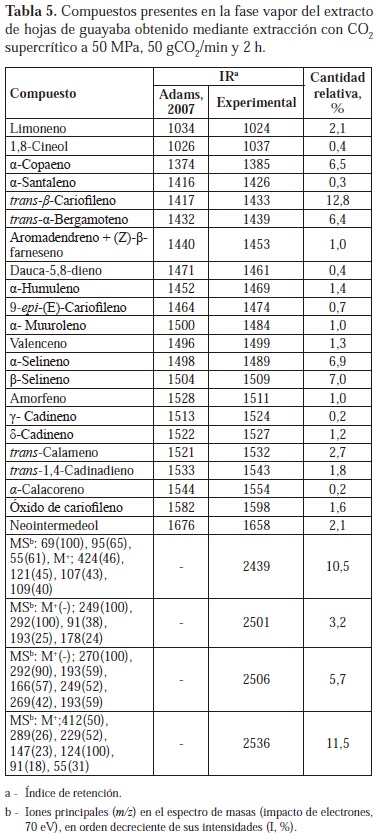
En el extracto de hojas de guayaba se encontró mayoritariamente el trans-β-cariofileno (12.8 %), seguido de α- y β-selinenos (7.0 % y 6.9 %). Hasta la fecha, solamente se encuentran en la literatura científica 2 reportes sobre composición de extractos SFE de hojas de guayaba. En esos casos no se realizó el muestreo de la fase vapor con SPME, sino que se inyectó la solución de extracto directamente en el cromatógrafo de gases. Las composiciones reportadas son similares a la encontrada en el presente trabajo, aunque hay varias diferencias cualitativas. En el primer caso, los 2 componentes más abundantes fueron b- y a-selinenos (21,3 y 19,3%, respectivamente), seguidos del globulol (18,5%) y del b-cariofileno (15%) (Moura et al., 2011). En el segundo caso, los 3 componentes más abundantes fueron a-selineno (23,7%), b-cariofileno (18,8%) y d-selineno (18,3%) (Sagrero-Nieves et al., 1994). Distinto a lo hallado en el caso del romero, las composiciones reportadas para los aceites esenciales obtenidos de hojas de guayaba difirieron notoriamente de las de los extractos SFE. En el aceite extraído de material vegetal de Nigeria, el limoneno (42,1%) y el b-cariofileno (21,3%) fueron los componentes más abundantes (Ogunwande et al., 2003). En el aceite de hojas de guayaba recolectadas en la Polinesia Francesa, el componente mayoritario fue el b-cariofileno (18,3%) y los sesquiterpenos oxigenados más abundantes fueron selin-11-en-4a-ol (6,9%), a-cadinol (3,6%) y (E)-nerolidol (3,2%) (Adam et al., 2011). Para mostrar la amplitud de las diferentes composiciones encontradas alrededor del mundo, se resalta el caso del aceite obtenido de P. guajava cultivada en Brasil, cuyos componentes mayoritarios fueron a-pineno (23,9%), 1,8-cineol (21,4%) y b-bisabolol (9,2%) (da Silva et al., 2003). Mediante cromatografía líquida se detectó la presencia del ácido carnósico en todos los extractos de las tres especies vegetales. Este diterpeno fenólico, que es el más abundante en los extractos de romero (Cavero et al., 2005) y que ha sido relacionado directamente con la actividad antioxidante del romero y de la salvia (Cuvelier et al., 1996; Wellwood, 2004), se encontró en mayor proporción en el extracto de romero (22,3 mg de ácido carnósico/g de extracto); seguido del extracto de salvia (2,8 mg de ácido carnósico/g de extracto) y el de hojas de guayaba (1,1 mg de ácido carnósico/g de extracto). Tanto en el análisis cromatográfico del compuesto patrón como en el de los extractos, se observó la presencia de picos diferentes al correspondiente al ácido carnósico, lo que permite suponer la posible degradación del compuesto, a productos como el carnosol (Moura et al., 2005), especialmente, al estar disuelto en metanol (Schwarz et al., 1992).
Se ha establecido que los aldehídos de baja masa molecular son productos finales de la peroxidación de los lípidos (Halliwell et al., 1993). Su volatilidad facilita el seguimiento de procesos de peroxidación, por medio del análisis de la fase vapor sobre la muestra, lo cual es aun más sencillo con el uso de la SPME como técnica de muestreo. Varios investigadores han desarrollado métodos analíticos para seguir la peroxidación lipídica con base en la cuantificación de los aldehídos liberados en el proceso (Frankel et al., 1989; Luo et al., 1995) y en este trabajo se utilizó el muestreo por SPME con derivación simultánea de los aldehídos (Stashenko et al., 2002). Se evaluó la disminución del área del hexanal derivado in-situ sobre la fibra, como parámetro indicador del efecto protector de la lipoxidación por parte de los extractos. La Figura 5 muestra el decrecimiento del área del hexanal detectado en la fase vapor sobre la base cosmética luego de adicionar los extractos de romero, salvia o guayaba, y someterla a condiciones de peroxidación. En la Tabla 6 se encuentra reportado el correspondiente efecto protector de los extractos y las sustancias antioxidantes de referencia. La protección impartida por los extractos varió entre 43 y 88%; los extractos de romero y salvia presentaron el grado de protección más alto, logrando superar el 63% determinado para la vitamina E. Extractos acuosos de las hojas de guayaba han demostrado inhibir la oxidación del ácido linoleico en un 94- 96% (Chen et al., 2007); de forma similar, se han reportado niveles de inhibición de la peroxidación del 87% para extractos de romero (Gawlik-Dzik et al., 2007), valor muy similar al que se halló en esta investigación.

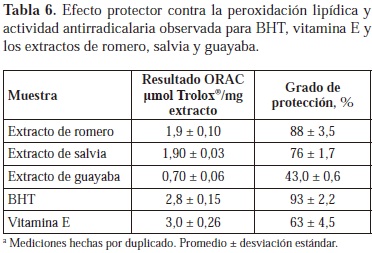
La actividad antirradicalaria de los extractos de romero y salvia en los que se obtuvo el mayor rendimiento de extracción, resultaron tener el mismo valor de 1.9 µmol Trolox®/mg extracto (Tabla 6), contrario a otros análisis en los cuales la actividad antioxidante del romero fue más alta que la de salvia (IvanoviÄ et al., 2009); por otro lado, los valores para los antioxidantes sintéticos BHT y vitamina E, fueron un poco superiores a los valores de los extractos. El ensayo ORAC examina la capacidad de la sustancia bajo ensayo para aniquilar radicales, en medio acuoso. El ensayo de determinación de hexanal se puede implementar tanto en medio acuoso como hidrofóbico y evalúa la capacidad para inhibir la peroxidación lipídica con base en sus resultados, sin distinguir el mecanismo. Debido a que el uso buscado para los extractos de romero, salvia y guayaba es el de agentes antioxidantes para productos cosméticos, este ensayo, por utilizar como sustrato una base cosmética, se constituye en una prueba de desempeño real de estos extractos en la aplicación deseada.
El mejor desempeño del extracto de romero en la inhibición de la peroxidación, muestra que además del ácido carnósico, cuyo contenido es 10 veces mayor que el del extracto de salvia, existen otros componentes de carácter hidrofóbico que contribuyen a bloquear la peroxidación más eficientemente que los que están presentes en el extracto de salvia.
4. Conclusiones
El rendimiento de la extracción con CO2 supercrítico de romero, salvia y hojas de guayaba depende de la presión, el flujo y el tiempo de extracción. En los 3 casos se requieren flujos de CO2 altos (>3 kg h-1) y tiempos de extracción de varias horas para lograr rendimientos de extracción altos (< 1%). Mientras que para romero y salvia el incremento de la presión aumentó el rendimiento, en el caso de las hojas de guayaba, se obtuvieron mayores rendimientos al reducir la presión.
La fracción volátil de los extractos de romero, salvia y hojas de guayaba, se caracterizó por compuestos como alcanfor, 1,8-cineol, manool y trans-β-cariofileno, presentes en cantidades relativas menores del 25 %. El extracto de romero mostró los mejores resultados de actividad antioxidante, al inhibir el 88% de la peroxidación lipídica de los ácidos grasos presentes en una base cosmética analizada; igualmente, éste presentó el mayor contenido de ácido carnósico (22,3 µg de ácido carnósico/mg de extracto), lo que explica el alto porcentaje de inhibición de la peroxidación lipídica. Los extractos de salvia y hojas de guayaba con un 76 y 43% de inhibición de la peroxidación, pueden considerarse también como promisorios para reemplazar antioxidantes sintéticos comerciales en productos para el consumo humano.
Agradecimientos
Los autores agradecen la financiación del proyecto a la Gobernación de Santander (Convenio Neomundo-UIS 00001 2010), al Ministerio de Agricultura y Desarrollo Rural (contrato 2008V3781-3740) y a Colciencias (CENIVAM, contrato RC 245-2011). Así mismo, agradecen a ACRESS y Fharmavícola por la provisión del material vegetal y a Laboratorios MyN Ltda. por el suministro de la base cosmética.
Referencias
Adams, R. P. 2007. Identification of essential oil componentes by gas chromatography- mass spectrometry. 4a. Ed. Alluredbooks. Carol Stream, Illinois, EE.UU. [ Links ]
Adam, F., Vahirua-Lechat, I. Deslandes, E. Menut, C. 2011. Aromatic plants of French Polynesia. V. Chemical composition of essential oils of leaves of Psidium guajava L. and Psidium cattleyanum Sabine. J. Essent. Oil Res. 23(1):98-101. [ Links ]
Aleksovski S.A., Sovová, H. 2007. Supercritical CO2 extraction of Salvia officinalis L. J. Supercrit. Fluids. 40 (2):239-245. [ Links ]
Amin, A., Hamza A. A. 2005. Hepatoprotective effects of Hibiscus, Rosmarinus and Salvia on azathioprine'introduced toxicity in rats. Life Sci. 77(3):266-278. [ Links ]
Bisio, A. Romussi, G. Ciarallo, G. De Tommasi, N. 1997. Flavonoids and triterpenoids from Salvia blepharophylla. Pharmazie. 52:330-331. [ Links ]
Carvalho Jr., R.N., Lucinewton S., Moura, P, Rosa, T.V., Meireles, M.A.A. 2005. Supercritical fluid extraction from rosemary (Rosmarinus officinalis): Kinetic data, extract's global yield, composition, and antioxidant activity. J. Supercrit. Fluids. 35:197-204. [ Links ]
Cavero, S., Jaime, L., Martín-álvarez P.J., Señoráns, F.J., Reglero, G., Ibáñez, E. 2005. In vitro antioxidant analysis of SFE extracts from rosemary (Rosmarinus officinalis L.). Eur. Food Res. Technol. 221:478-486. [ Links ]
Chen, H.Y., Yen, G.C. 2007. Antioxidant activity and free radical-scavenging capacity of extracts from guava (Psidium guajava L.) leaves. Food Chem. 101:686-694. [ Links ]
Chen, H.-Y., Yen, G.-C. 2007. Antioxidant activity and free radical-scavenging capacity of extracts from guava (Psidium guajava L.) leaves. Food Chem. 101:686-694. [ Links ]
Cuvelier, M-E., Richard H., Berset C. 1996. Antioxidative activity and phenolic composition of pilot-plant and commercial extracts of sage and rosemary. J. Am. Oil. Chem. Soc. 73:645-652. [ Links ]
FDA. 1981. Number of Brand Name Products in Each Product Code, Cosmetic Product Formulation Data. In Division of Cosmetics Technology 33-34, Food and Drug Administration, Washington, DC. [ Links ]
Frankel, E. N., Hu, M. L., Tappel, A. L. 1989. Rapid headspace gas chromatography of hexanal as a measure of lipid peroxidation in biological samples. Lipids 24 (11):976-981. [ Links ]
Gawlik-Dziki, U., Swieca, M. 2007. Effect of various pH conditions simulated in vivo on the activity of lipophilic antioxidants isolated from selected spices. Pol. J. Food Nutr. Sci., 57 (3A):19-22. [ Links ]
Glisik, S., Ivanovic, J., Ristic, M., Skala, D. 2010. Extraction of sage (Salvia officinalis L.) by supercritical CO2: Kinetic data, chemical composition and selectivity of diterpenes. J. Supercrit. Fluids 52:62-70. [ Links ]
Halliwell, B., Chirico, S. 1993. Lipid peroxidation: Its mechanism, measurement, and significance. Am. J. Clin. Nutr. 57: 715S-725S. [ Links ]
IARC. 1986. IARC Monographs on the Evaluation of the Carcinogenic Risks of Chemicals to Humans. Some Naturally Occurring and Synthetic Food Components, Furocoumarins. [ Links ]
Ibañez, E., Kubátová, A., Señoráns, F.J., Cavero, S., Reglero, G., Hawthorne, S. B. 2003. Subcritical water extraction of antioxidant compounds from rosemary plants. J. Agric. Food Chem. 51:375-382. [ Links ]
Ivanovic, J., Ðilas, S., Jadranin, M., Vajs,V., Babovic, N., Petrovic, S., Izovic, I. 2009. Supercritical carbon dioxide extraction of antioxidants from rosemary (Rosmarinus officinalis L.) and sage (Salvia officinalis L.). J. Serb. Chem. Soc. 74 (7):717-732. [ Links ]
JECFA. 1996. Toxicological evaluation of certain food additives and contaminants in food. Who Food Additives Series 35:3-86. Joint FAO/ WHO Expert Committee on Food Additives, Geneva. [ Links ]
Luo, X. P., Yazdanpanah, M., Bhooi, N., Lehotay, D. C. 1995. Determination of aldehydes and other lipid peroxidation products in biological samples by gas chromatography-mass spectrometry. Anal. Biochem. 228: 294-298. [ Links ]
Magoulas, K., Louli, V., Papamichail, I. 2000. Supercritical fluid extraction of celery seed oil. J. Supercrit. Fluids 18:213-226. [ Links ]
Martínez, J. L. 2008. Supercritical Fluid Extraction of Nutraceuticals and Bioactive Compounds. CRC Press, Boca Ratón, Florida, EE.UU. [ Links ]
Masaki, H., Sakaki, S., Atsumi, T., Sakurai, H. 1995. Active-oxygen scavenging activity of plant extracts. Biol. Pharm. Bull. 18:162-166. [ Links ]
Mockuté, D., Nivinskiené, O., Bernotiené, G., Butkiené, R. 2003. The cis-thujone chemotype of Salvia officinalis L. essential oils. Chemija (Vilnius) 14(4):216-220. [ Links ]
Moura, P.M., Prado, G.H.C. Meireles, M.A.A, Pereira, C.G. 2012. Supercritical fluid extraction from guava (Psidium guajava) leaves: Global yield, composition and kinetic data. J. Supercrit. Fluids 62:116-122. [ Links ]
Ogunwande, I. A., Olawore, N. O., Adeleke, K. A., Ekundayo, O., Koenig, W, A. 2003. Chemical composition of the leaf volatile oil of Psidium guajava L. growing in Nigeria. Flavour Fragrance J. 18(2):136-138. [ Links ]
Ou, B., Hampsch-Woodill, M., Prior, R. 2001. Development and validation of an improved oxygen radical absorbance capacity assay using fluorescein as the fluorescent probe. J. Agric. Food Chem. 49:4619â4626. [ Links ]
Pérez, R. M., Mitchell, S., Vargas, R.. 2008. Psidium guajava: A review of its traditional uses, phytochemistry and pharmacology. J. Ethnopharmacol. 117:1-27. [ Links ]
Reverchon, E., Senatore, F. 1992. Isolation of rosemary oil: Comparison between hydrodistillation and supercritical CO2 extraction. Flavour Fragrance J. 7 (4):227-230. [ Links ]
Riznar, K., Celan, S., Skerget, M., Knez, Z. 2008. Solubility of carnosic acid and carnosol from rosemary extract in supercritical CO2. Acta Chim. Slov. 55:516-520. [ Links ]
Sagrero-Nieves, L., Bartley J.P. Provis-Schwede, A. 1994. Supercritical fluid extraction of the volatile components from the leaves of Psidium guajava L. (guava). Flavour Fragrance J. 9:135-137. [ Links ]
Schwarz, K.; Ternes, W. 1992. Antioxidative constituents of Rosmarinus officinalis and Salvia officinalis. II. Isolation of carnosic acid and formation of other phenolic diterpenes. Z. Lebensm.-Unters. Forsch. 195: 99â103. [ Links ]
Sebastián, S.L., Ramos, E., Ibáñez, E., Bueno, L., Ballester, J., Tabera, M., Reglero J.. 1998. Dearomatization of antioxidant rosemary extracts by treatment with supercritical carbon dioxide. J. Agric. Food Chem. 46(1):13-19. [ Links ]
Shi, J., Khatri, M., Xue, S. J., Mittal, G. S., Ma, Y., Li, D. 2008. Solubility of lycopene in supercritical CO2 fluid as affected by temperature and pressure. Sep. Purif. Technol. 66:322-328 [ Links ]
da Silva, D. J., Luz, A. I., da Silva, H. L. M., Andrade, E. H., Zoghbi, M. d. G. Maia, J. G. 2003. Essential oils of the leaves and stems of four Psidium spp. Flavour Fragrance J. 18(3):240-243. [ Links ]
Stashenko, E. E., Puertas, M. A., Salgar, W., Delgado, W., Martínez, J.R. 2000. Solid-phase microextraction with on-fibre derivatisation applied to the analysis of volatile carbonyl compounds. J. Chromatogr. A. 886:175-181. [ Links ]
Stashenko, E. E., Puertas, M. Martínez, J.R. 2002. SPME determination of volatile aldehydes for evaluation of in-vitro antioxidant activity. Anal. Bioanal. Chem. 373:70-74. [ Links ]
Thorsen, M. A., Hildebrandt, K. S. 2003. Quantitative determination of phenolic diterpenes in rosemary extracts: Aspects of accurate quantification. J. Chromatogr. A. 995 (1-2):119-125. [ Links ]
Wellwood, C. R. L. 2004. Rosemary A.C. relevance of carnosic acid concentrations to the selection of rosemary, Rosmarinus officinalis (L.) accessions for optimization of antioxidant yield. J. Agric. Food Chem. 52 (20):6101-6107. [ Links ]
Recibido: 28 de enero de 2012
Aceptado para publicación: 5 de septiembre de 2012













