Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales
Print version ISSN 0370-3908
Rev. acad. colomb. cienc. exact. fis. nat. vol.36 no.140 Bogotá July/Sept. 2012
GENÉTICA
CARACTERIZACIÓN GENÉTICA DE LA POBLACIÓN EX SITU DECROCODYLUS INTERMEDIUS PRESENTE EN COLOMBIA
* Universidad Nacional de Colombia, MSc. lccuervoa@unal.edu.co
** Profesora departamento de Biología de la Universidad Nacional de Colombia, MSc. mdburbanom@unal.edu.co
RESUMEN
Se realizó el estudio genético de la población ex situ de Crocodylus intermedius que se encuentra en la Estación de Biología Tropical Roberto Franco, con el fin de establecer su potencial genético y los cruces adecuados para su manejo. Se emplearon primers heterólogos para la amplificación de loci microsatélite, encontrándose tres sistemas monomórficos y seis polimórficos con 2 a 16 alelos. Los adultos difieren en el número de juveniles de los cuales son padres candidatos lo que indicaría diferencias en la reproducción; 121 juveniles no tienen padres potenciales en los adultos y se consideraron de origen externo. No hubo diferencias entre He y A entre los adultos y los juveniles lo que indica que no se ha presentado una pérdida de diversidad genética. Se diseñaron cruces entre pares de individuos con un coeficiente r=0 para aumentar la heterocigosidad; es importante que todos los individuos se reproduzcan para evitar la pérdida de diversidad alélica y una diferenciación de la población ex situ con respecto a la población silvestre.
Palabras clave: Crocodylus intermedius, población ex situ, riqueza alélica, heterocigosidad, cruces.
ABSTRACT
A genetic study of Crocodylus intermedius ex situ population was made. This population is located in the Estación de Biología Tropical Roberto Franco. The aim of this study is to establish the ex situ population genetic potential and propose mating pairs for its management. Heterologous primers were used for microsatellite loci amplification; three of them were monomorphic and six polymorphic with 2 to 16 alleles. Adults were parent candidates of a different number of juveniles, which suggest differences in reproduction. Also, 121 juveniles did not have adult parent candidates, for that reason they were considered from external origin. Between adults and juveniles there were not differences in He and A, which means that genetic diversity loss was not found. Mating pairs are proposed between individuals with a r=0 coefficient to increase heterozigosity. Every individual should reproduce to avoid allelic richness loss and genetic population differentiation from wild population.
Key Words: Crocodylus intermedius, ex situ population, allelic richness, heterozygosity, mating pairs.
1. Introducción
Muchas especies vegetales y animales alrededor del mundo están en peligro de extinción principalmente como resultado de actividades humanas tales como la sobreexplotación de recursos, la introducción de especies exóticas y la contaminación (Landweber y Dobson, 1999). En Colombia, una de las especies más perjudicadas por la actividad humana es Crocodylus intermedius, también conocido como caimán llanero o cocodrilo del Orinoco, cuya área de distribución natural comprende la cuenca del río Orinoco en Colombia y Venezuela. Desde 1920 y hasta 1948, esta especie estuvo sometida a una intensa caza comercial para satisfacer la demanda de pieles: Medem estimó que hacia la mitad de la década de 1930, período en el que la caza fue más intensa, se comercializaron entre 135200 y 254000 pieles (Ramírez Perilla, 2000).
Desde 1984, el caimán llanero se encuentra catalogado como una especie en peligro crítico por la UICN y desde 1975 se encuentra incluido en el apéndice I de la CITES. Por estas razones, se ha creado el Plan Nacional para la Conservación del Caimán Llanero, cuyo objetivo general es prevenir la extinción de C. intermedius y promover su recuperación en el área natural de distribución integrándolo a los sistemas económicos y culturales regionales (Ministerio del Medio Ambiente, 2002). Para este propósito, se necesita como estrategia de conservación el rescate de individuos del medio natural para su reproducción en cautiverio y finalmente el repoblamiento al hábitat natural para recuperar las poblaciones naturales (Ramírez-Perilla, 2000). Los esfuerzos por mantener individuos de C. intermedius en cautiverio han sido llevados a cabo por la Estación de Biología Tropical Roberto Franco (EBTRF) de la Universidad Nacional de Colombia (Ardila-Robayo et al., 2010; Ramírez-Perilla, 2000); esta población ex situ se originó en la década del 70 por decomisos llevados a cabo por el antiguo INDERENA y por la constitución de dos parejas de diverso origen y edades llevada a cabo por Federico Medem (Ardila-Robayo et al., 2010). Los primeros nacimientos se presentaron entre los años 1991-1996 y se reanudaron en el año 2000 hasta la actualidad (Ardila-Robayo et al., 2010).
Aunque los programas de reproducción en cautiverio intentan generar poblaciones de especies amenazadas auto-sostenibles a largo plazo (Tzika et al., 2008) de tal forma que actúan como un seguro contra la extinción en el medio silvestre (Frankham et al., 2002), pueden no ser exitosos si se ignoran ciertos factores genéticos (Frankham, 2003), tales como la endogamia, la adaptación genética al cautiverio y la pérdida de diversidad genética, procesos que se esperan en poblaciones cerradas en cautiverio (Frankham et al., 2002). Adicionalmente, hay que tener en cuenta que al establecerse una población en cautiverio, la población silvestre estará representada únicamente por el pool génico de los fundadores (Russello y Amatto, 2004); este efecto fundador combinado con deriva genética puede crear una situación donde la población en cautiverio se diferencia rápidamente de la población silvestre (Ruokonen et al., 2007), lo cual puede tener efectos prejudiciales en el momento de la reintroducción.
La contribución de la genética al manejo de las poblaciones en cautiverio consiste en el diseño de cruces que eviten la endogamia y la pérdida de diversidad genética (Frankham et al., 2002) para lo cual es esencial el conocimiento del parentesco (Haig, 1998). Sin embargo, puede que en las poblaciones en cautiverio no exista un registro adecuado del parentesco; en estos casos, los marcadores moleculares como los microsatélites son una herramienta útil y apropiada, ya que son altamente polimórficos, tienen una herencia codominante y son fácilmente amplificables por PCR (Selkoe y Toonen, 2006). Una de las desventajas de los microsatélites es el alto costo que implica el desarrollo de primers especie específicos; no obstante, pueden utilizarse primers heterólogos de especies estrechamente relacionadas (Selkoe y Toonen, 2006). Diversos estudios han demostrado que entre las especies del género Crocodylus hay un gran éxito en la amplificación cruzada de loci microsatélite; primers desarrollados para C. johnstoni (FitzSimmons et al., 2000) amplifican también en C. moreletii (Dever y Densmore, 2000; Mcvay et al., 2008), C. porosus (Isberg et al., 2004) y por último C. rhombifer y C. acutus (Weaver et al., 2008).
En el presente estudio, empleando nueve loci microsatélite provenientes de la especie C. johnstoni (FitzSimmons et al., 2000) y cuatro de la especie C. porosus (Miles et al., 2008), se llevó a cabo la caracterización genética de la población ex situ de C. intermedius con el objetivo de determinar las relaciones de parentesco entre los individuos, evaluar la diversidad genética existente y sugerir las parejas de apareamiento más adecuadas para aumentarla.
2. Materiales y Métodos
Se obtuvo el permiso de acceso a recursos genéticos de la población ex situ mediante resolución número 1767 del 1 de septiembre de 2011. Se tomaron muestras de músculo de los 53 adultos (26 hembras y 27 machos) y de escama de los 210 juveniles (29 hembras, 31 machos y 150 de sexo desconocido) que conforman la población ex situ de C. intermedius presente en la EBTRF; la identificación de los individuos que se encuentra en la presente investigación corresponde al sistema empleado por la EBTRF.
La extracción de ADN se llevó a cabo mediante el Kit Wizard Genomics de PROMEGA®, según el protocolo de extracción para tejido de cola de ratón. Se evaluaron seis parejas de primers provenientes de C. johnstoni y cuatro de C. porosus. Para cada pareja de primers se determinaron las condiciones óptimas de amplificación por PCR (Tabla 1); las muestras se amplificaron en un volumen final de reacción de 11µL con 0,25 U de GoTaq®Â DNAPolimerasa (Promega), 2,5µL de 5x GoTaq® Flexi Buffer (Promega), 1,25 µL de dNTPs 2mM (Promega), 0,21Mm ó 0,25 mM MgCl2 como concentración final según la pareja de primers (Tabla 1), 0,5 µL de cada primer 10 µM y 10ng de ADN. Las condiciones de amplificación en el termociclador fueron de la siguiente forma: una etapa preliminar de desnaturalización a 95°C por 5 minutos, seguida de 30 ciclos de desnaturalización a 95°C por 40 segundos, anillamiento a la temperatura estandarizada para cada sistema (Tabla 1) por 40 segundos y extensión a 72°C por 30 segundos, finalizando con una temperatura de 72°C por 5 minutos. Los productos de amplificación se corrieron en geles de poliacrilamida a una concentración del 8% durante 8 horas a 200V en una cámara de electroforesis Protean II de Biorad ®; como patrón de comparación se utilizó una escalera de peso molecular de 300pb en escala de 10pb. Para la visualización de las bandas se realizó una tinción con AgNO3; la determinación de los genotipos se llevó a cabo con el programa GenTools.
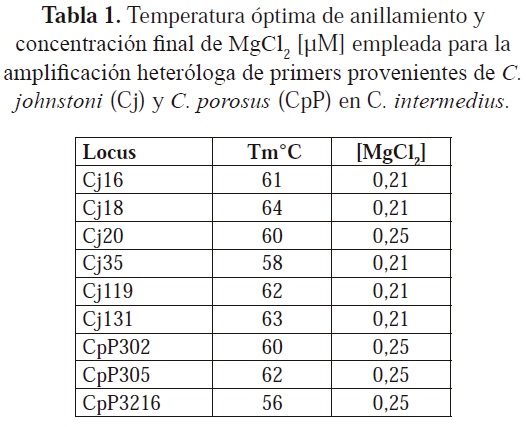
Para determinar la relación de parentesco entre adultos y juveniles, se empleó el programa Kinship 1.2 (Queller y Goodnight, 1989) contrastando las hipótesis primarias de madre-hijo y padre-hijo contra la hipótesis nula de no parentesco. Debido a que para varios juveniles no se pudieron excluir varios padres o madres candidatos, por medio del programa CERVUS 3.0.3 (Kalinowski et al., 2007) se determinó cual parental candidato tiene la mayor probabilidad de ser el parental verdadero del juvenil en cuestión.
Debido a que existe una brecha generacional marcada entre los individuos que conforman la población ex situ de C. intermedius y a la necesidad de establecer si ha habido un cambio en la diversidad genética entre las diferentes generaciones, los individuos de la Estación de Biología Tropical se dividieron en dos generaciones: adultos, correspondiente a los fundadores de la población ex situ, y juveniles. Esta última generación se dividió en dos grupos: juveniles RF, que son hijos de los adultos fundadores de la población ex situ, y juveniles NS, que son los juveniles que han sido recolectados del medio silvestre. Para cada uno de estos grupos, se calculó la riqueza alélica, la heterocigosidad observada y esperada y la frecuencia de cada alelo con el programa GenAlex 6 (Peakall y Smouse, 2006). Con el programa FSTAT 2.9.3 (Goudet, 2001) se determinó si existían diferencias significativas en la riqueza alélica y heterocigosidad esperada entre los grupos. Adicionalmente, ya que se considera que los juveniles RF y NS son representantes de la población en cautiverio y de la silvestre, respectivamente, se determinó si existía estructura poblacional por medio de los estadísticos FST y RSTcon el programa Genepop 1.2 (Raymond y Rousset, 1995).
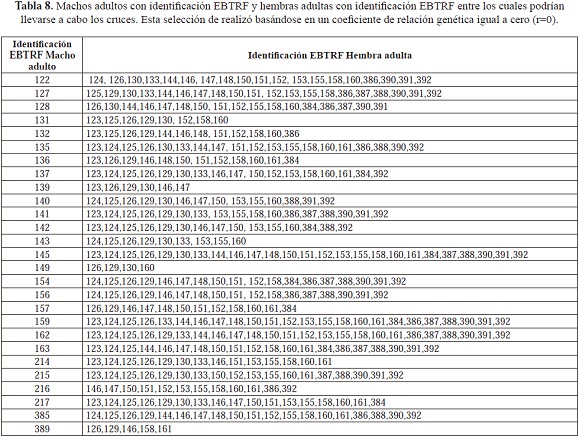
Para el establecimiento de los cruces adecuados entre pares de individuos adultos y pares de individuos juveniles, se utilizó el programa STORM 1.1 (Frasier, 2008) el cual establece los cruces adecuados entre pares de individuos con un coeficiente r=0, es decir que no comparten alelos, con el fin de aumentar la heterocigosidad y evitar los efectos de la endogamia.
3. Resultados y discusión
Debido al alto gasto tanto en tiempo como en materiales necesarios para llevar a cabo el aislamiento de primers especie específicos (Selkoe y Toonen, 2006) y a que se ha encontrado que dentro del género Crocodylus las pruebas de amplificación cruzada indican la presencia de loci microsatélite polimórficos que son homólogos entre las especies de este género (FitzSimmons et al., 2000; Miles et al., 2008), se decidió emplear los sistemas microsatélites desarrollados para las especies C. johnstoni y C. porosus para realizar el estudio genético de la población ex situ de C. intermedius.
Los sistemas Cj35, Cj119 y Cj131 fueron monomórficos al amplificarlos en C. intermedius; los seis loci restantes fueron polimórficos aunque su grado de polimorfismo fue diferente (Tablas 4, 5 y 6). Estos resultados concuerdan con el éxito reportado en la amplificación cruzada entre especies del género Crocodylus (Miles et al., 2008)
3.1 Análisis de parentesco
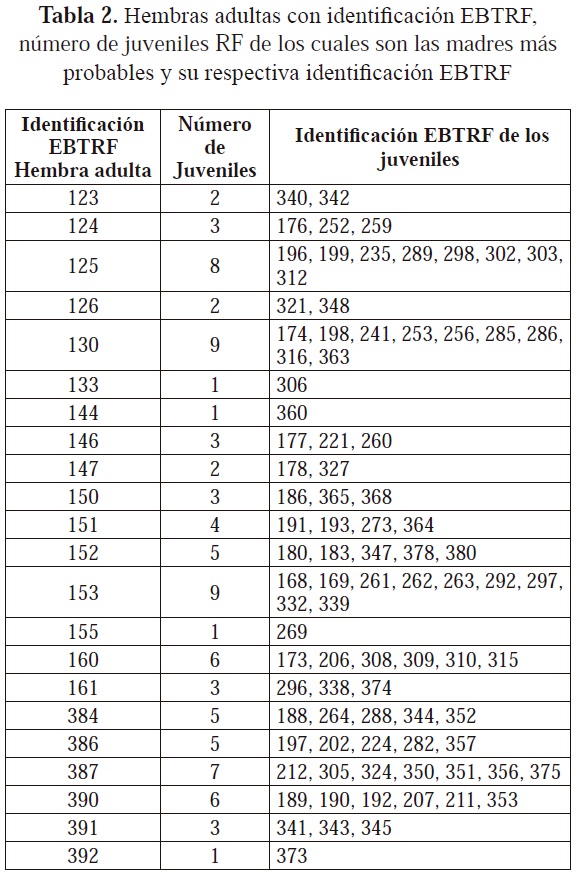
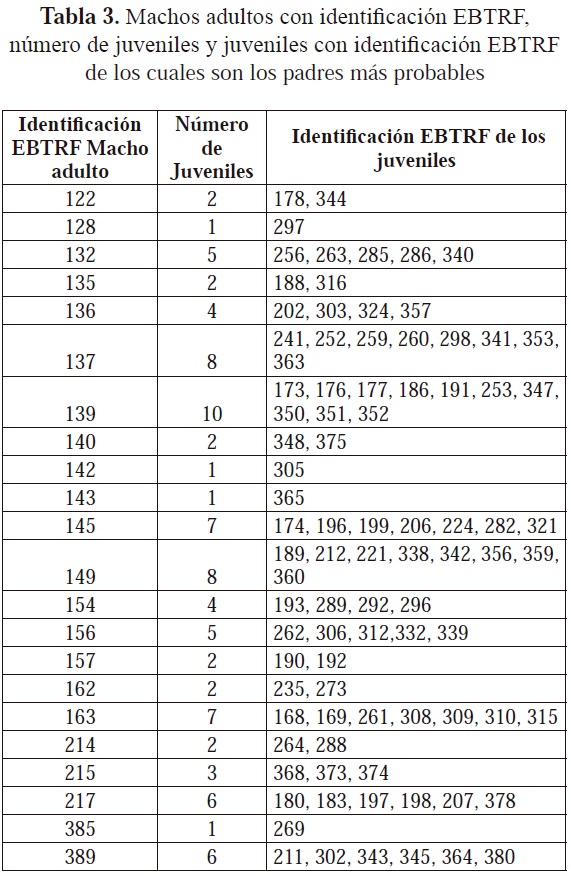
Se encontró que los seis loci polimórficos empleados para el análisis de parentesco presentaron una probabilidad de exclusión de 99,87%. De los 210 juveniles genotipificados, se encontró que 41 de ellos presentaron alelos nuevos no encontrados en los adultos y para 80 de ellos se excluyeron todos los adultos machos y hembras como posibles parentales; esto puede indicar que estos 121 juveniles tienen un origen externo a la estación y por ello se catalogaron como juveniles de nidada silvestre (NS). Para los 89 juveniles restantes, se encontró que tenían padres o madres potenciales entre los adultos fundadores de la población ex situ, razón por la cual se catalogaron como juveniles de la Estación Roberto Franco (RF). Sin embargo, se encontró que para algunos de estos juveniles existen varios padres y/o madres potenciales; no se pudo establecer con certeza una madre o padre ya que este tipo de análisis de parentesco tiene mayor poder si se conoce con seguridad el genotipo de uno de los padres (Kalinowski et al., 2007). Por tal razón, cuando no se conoce ninguno de los padres, es recomendable el uso de un mayor número de loci altamente polimórficos (Isberg et al., 2004). En el presente estudio, el bajo polimorfismo de cuatro de los seis loci pudo haber incidido en la presencia de varias madres y padres potenciales para un juvenil, lo que hizo necesario llevar a cabo una aproximación por verosimilitud para establecer la pareja de padres más probable para cada uno de estos 89 juveniles. Como resultado, se encontraron diferencias en el número de juveniles de los cuales las hembras y los machos serían los padres más probables (Tablas 2 y 3); además, se obtuvo como resultado que los machos con identificación EBTRF 127, 131, 141, 159 y 216 y las hembras con identificación EBTRF 129, 148, 158 y 388 no son padres potenciales de ningún juvenil y por ello no se encuentran en las Tablas 2 y 3.
Cabe resaltar que puede que el número de hembras y machos adultos que contribuyeron a la generación de juveniles sea menor, ya que para poder distinguir la categoría padrehijo de individuos no relacionados es recomendable el uso de mínimo diez loci altamente polimórficos (Blouin, 2003). Teniendo en cuenta que en el presente estudio se emplearon seis loci, este factor puede incidir en la sobrestimación de la relación padre/madre-hijo y por lo tanto en una aparente contribución de casi todos los adultos en la generación de juveniles.
3.2 Diversidad Genética
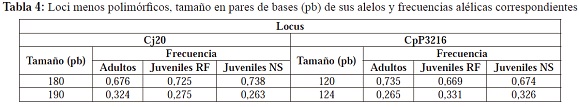
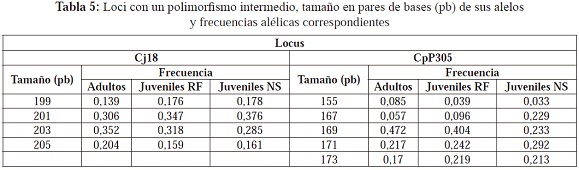
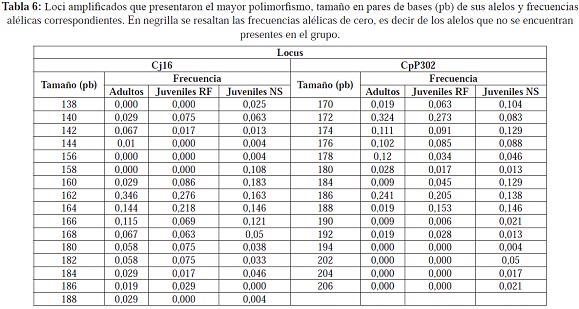
El grado de polimorfismo de los loci polimórficos fue diferente, ya que los sistemas Cj20 y CpP3216 presentaron el menor grado de polimorfismo con dos alelos cada uno (Tabla 4); los sistemas Cj18 y CpP305 presentaron un polimorfismo intermedio, con 4 y 5 alelos respectivamente (Tabla 5); y por último, los sistemas Cj16 y CpP302 presentaron 16 y 15 alelos respectivamente (Tabla 6).
En los dos sistemas más polimórficos, no todos los alelos se encontraron representados en los tres grupos: los alelos 138, 156 y 158 del sistema Cj16 son exclusivos de los juveniles NS y el alelo 186 del mismo sistema lo es para los adultos y los juveniles RF (Tabla 6); en el sistema CpP3216, los alelos 194, 202, 204 y 206 son exclusivos de los juveniles NS. Aunque no se presentaron diferencias estadísticamente significativas en la riqueza alélica (p=0,463) entre los adultos, juveniles RF y juveniles NS, la presencia de estos alelos nuevos provoca que haya una riqueza alélica mayor en este último grupo (Tabla 7); además, corrobora el posible origen diferente para los juveniles NS. También se puede apreciar que dos alelos del sistema Cj16, los alelos 144 y 188, se encuentran en los adultos pero no en los juveniles RF, lo que estaría indicando que los adultos portadores de esta variabilidad no se reprodujeron o sus crías no sobrevivieron y por esto no se encuentran representados en esa generación. Estos alelos se encuentran entre los que presentan frecuencias más bajas, y son estos alelos los que por deriva tienen mayor probabilidad de perderse en las poblaciones en cautiverio, sobretodo si no hay una contribución de todos los individuos a las siguientes generaciones. De esta manera, se puede presentar una pérdida significativa de la diversidad genética entre las generaciones (Hedrick, 2005).
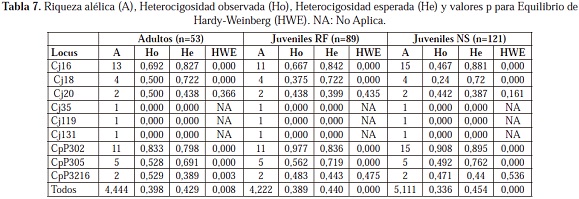
La riqueza alélica promedio (Tabla 7) fue similar a la encontrada en otras especies de Crocodylus en los que también se han empleado primers heterólogos (Dever y Densmore, 2000; Weaver et al., 2008; Isberg et al., 2008), sin embargo, hay que tener en cuenta que este patrón de comparación no es el ideal por tratarse de otras especies con una historia demográfica diferente a la de C. intermedius. Por lo tanto, para establecer la cantidad de riqueza alélica de la población silvestre que se encuentra representada en la población ex situ, es necesario el estudio de poblaciones silvestres para poder realizar una comparación más adecuada.
La heterocigosidad esperada obtenida tanto en adultos como en juveniles RF y NS (Tabla 7) es similar a la reportada para poblaciones silvestres de otras especies del género Crocodylus (McVay et al., 2008; Isberg et al., 2004). Esto demuestra que con la cantidad de individuos adultos empleados para el establecimiento de la población ex situ, se está representando una parte importante de la variabilidad en términos de heterocigosidad que se encuentra presente en las poblaciones silvestres, ya que según Hedrick (2005) con un número de fundadores de entre 20 y 30 individuos se está capturando el 98% de la heterocigosidad. Sin embargo, no sucede lo mismo con la riqueza alélica pues para capturar una gran parte de esta se requiere un mayor número de individuos: entre 25 y 50 fundadores (Hedrick, 2005). Teniendo en cuenta esto y los valores similares de riqueza alélica y heterocigosidad esperada que tiene la población ex situ de C. intermedius con otras especies de cocodrilos, se podría pensar que esta representa en gran medida la población silvestre; sin embargo, para afirmar esto hay que tener en cuenta que estos patrones de comparación no son los ideales por tratarse de otras especies con una historia demográfica diferente a la de C. intermedius.
Por lo tanto, para establecer la magnitud de la variabilidad genética presente en la población ex situ, es necesario el estudio de poblaciones silvestres para realizar una comparación más adecuada. Una aproximación a esta comparación puede darse con los juveniles NS para los cuales se asumió que tenían un origen silvestre: como la heterocigosidad esperada entre adultos, juveniles RF y juveniles NS no tuvo diferencias significativas (p=0,277), podría inferirse que los adultos estarían representando la heterocigosidad de la población silvestre; y aunque la riqueza alélica tampoco haya presentado diferencias significativas (p=0,463) vale recalcar que los juveniles NS son portadores de nuevos alelos lo que podría estar indicando que existe una variabilidad adicional en las poblaciones silvestres.
Los loci que se encontraron en equilibrio de Hardy-Weinberg fueron los menos polimórficos (Cj20 y CpP3216); los loci Cj16, Cj18 y CpP305 no se encuentran en equilibrio de Hardy-Weinberg debido a una deficiencia de heterocigosidad observada lo que indica que hay una mayor frecuencia de homocigotos. En general, al tener en cuenta todos los loci, para los tres grupos hay una desviación del equilibrio de Hardy-Weinberg por deficiencia de heterocigotos (Tabla 7). Entonces, en los adultos y juveniles NS, considerados ambos como representantes de la población silvestre, el exceso de homocigotos podría estar reflejando que en las poblaciones silvestres hay una condición de homocigosidad: debido a la ausencia de un muestreo estructurado, en el cual se fueron acogiendo individuos al azar con diversos orígenes, es poco probable que se colecten en su mayoría genotipos homocigotos a menos que estos tengan una alta frecuencia. De esta forma, es posible que en general la deficiencia de heterocigotos se deba a un reflejo de endogamia en la población silvestre.
En los adultos, se encontraron grandes diferencias en las frecuencias alélicas en un mismo sistema, con un alelo predominante cuya frecuencia se destaca entre los demás, como sucede con los sistemas Cj16, CpP302 y CpP305 (Figura 1) Esto puede ser evidencia de la falta de muestreo en el proceso de la fundación de la población en cautiverio, en el cual puede quedar por casualidad una alta y una baja frecuencia de alelos particulares (Hedrick, 2005).
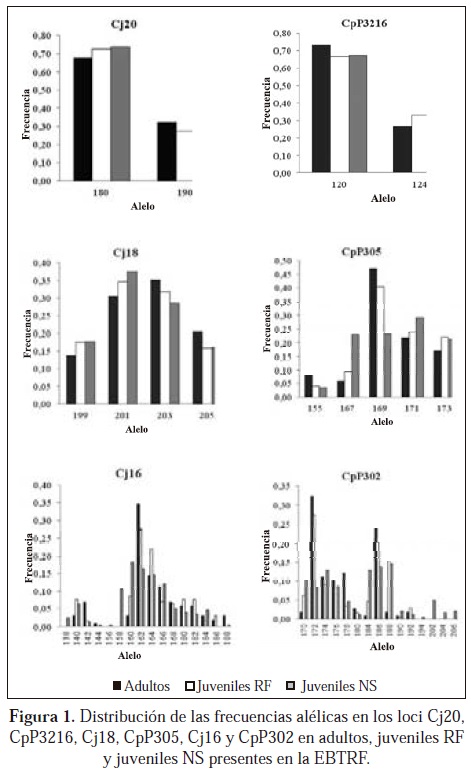
Entre adultos y juveniles RF hubo un cambio en las frecuencias alélicas, especialmente para los loci más polimórficos: en el sistema CpP302 el alelo 178 disminuyó considerablemente su frecuencia en los juveniles RF con respecto a los adultos, y los alelos 170, 184 y 188 aumentaron considerablemente su representación en los juveniles con respecto a los adultos. Algo similar ocurrió con el sistema Cj16 en el cual los alelos 140, 160 y 164 tienen una mayor frecuencia en los juveniles RF mientras que los alelos 142 y 166 tienen una frecuencia mucho menor en comparación con los adultos; incluso algunos alelos como el 144 y 188 no se encontraron en los juveniles RF (Figura 1).
Este cambio en las frecuencias alélicas entre estas dos generaciones se puede ser causado por deriva genética, en la cual los alelos transmitidos de padres a hijos son solo una muestra de la variación existente en los adultos (Hedrick, 2005). De esta forma, por azar, algunos alelos no pasan a la descendencia, mientras otros incrementan o disminuyen en frecuencia (Hedrick, 2005), como se aprecia entre los adultos y los juveniles RF. Por consiguiente, este fenómeno debe estar relacionado con las diferencias en la reproducción de los adultos como se aprecia en las Tablas 9 y 10, en la que las hembras con identificación EBTRF 125, 130 y 153 y los machos con identificación EBTRF 137, 139 y 149 son los padres más probables para un mayor número de juveniles, mientras que las hembras con identificación EBTRF 129, 148, 158 y 388 y los machos con identificación EBTRF 127, 131, 141, 159 y 216 no son padres potenciales de ningún juvenil. Cabe resaltar que aunque la deriva genética actúa sobre todos los loci, puede resultar difícil apreciar su efecto debido a las diferencias que pueden presentarse entre los loci, como el número de alelos y su frecuencia (Frankham et al., 2002); esto explicaría por qué en los loci menos polimórficos no hubo cambios notorios en las frecuencias alélicas.
Uno de los objetivos de un programa de reproducción en cautiverio es evitar que la población ex situ se diferencie de la silvestre. En el presente estudio se determinó la presencia de diferenciación poblacional entre los dos grupos de juveniles dado su origen diferente, encontrándose que entre los dos grupos existe estructura poblacional leve según la escala de Wright: Fst=0,0277 (p<0,05) y Rst=0,1771 (p<0,05), la cual se debe básicamente a la presencia de alelos exclusivos de cada grupo. La presencia de alelos nuevos en los juveniles NS indica que existe variabilidad adicional en el medio silvestre que no fue capturada con los individuos adultos; esto demuestra que en la medida de lo posible, también es necesaria la inclusión de individuos del medio silvestre para evitar la pérdida de diversidad y la consiguiente diferenciación poblacional entre la población en cautiverio y la silvestre, lo que puede perjudicar a los individuos que se reintroduzcan al medio natural.
3.3 Establecimiento de cruces
Los cruces propuestos están diseñados para evitar la endogamia ya que los individuos involucrados se seleccionaron con base a un coeficiente de relación genética de cero, lo que indica que los individuos no comparten alelos y por lo tanto la descendencia que generarán será heterocigota; la heterocigosidad es importante para la sobrevivencia inmediata de los individuos de la población (Allendorf, 1986). Los cruces propuestos involucran a todos los individuos adultos y a los 60 juveniles (incluyendo juveniles RF y NS) cuyo sexo se conoce. Se debe tener en cuenta que en la medida de lo posible se debe procurar que todos los individuos se reproduzcan para evitar pérdida o fijación de alelos y garantizar que la población siga conservando la variabilidad genética en términos de riqueza alélica con la cual se inició. Sin embargo, en el momento de llevar a cabo a la práctica los cruces, hay que tener en cuenta que factores como la edad de los individuos y el estado de salud pueden obstaculizar el proceso reproductivo; por esta razón, se presenta un amplio espectro de cruces posibles entre un individuo con otros del sexo opuesto, lo que ayuda a sobrepasar los obstáculos que se puedan presentar en un determinado cruce por el estado de un individuo.

4. Conclusiones
La mayoría de los primers provenientes de las especies C. johnstoni y C. porosus ensayados presentaron amplificación en C. intermedius, lo que permite deducir que entre las es-
pecies de este género las regiones de unión al primer están conservadas; esto es útil ya que permite la estimación de parámetros genético poblacionales para una especie como C. intermedius para la que no se han aislado microsatélites.
La tendencia de unos cuantos adultos a ser los padres más probables de un mayor número de juveniles RF es probablemente un reflejo de las diferencias en la contribución a la siguiente generación por parte de los adultos; no obstante, es necesario el uso de un mayor número de marcadores polimórficos para hacer la determinación del parentesco más confiable y precisa.
La riqueza alélica y la heterocigosidad esperada son similares a las encontradas en otras especies del género Crocodylus; esto sugiere que la población ex situ de C. intermedius posee una variabilidad valiosa que le brinda un gran potencial genético, aunque para afirmar esto es necesario el estudio genético de las poblaciones silvestres.
El hecho de no haber encontrado en los juveniles RF dos alelos presentes en los adultos, sugiere que es necesario un manejo adecuado de los cruces para evitar a largo plazo una pérdida sustancial de la riqueza alélica. Además, en las poblaciones silvestres puede haber nuevas fuentes de riqueza alélica, como lo demuestra el hecho de haber encontrado juveniles con alelos nuevos no presentes en los adultos, lo que indica que la población en cautiverio posiblemente no está capturando toda la variabilidad genética de la población silvestre. Adicionalmente, se debe tener en cuenta que ya que los juveniles NS provienen de nidadas silvestres, la presencia de una ligera estructura con los juveniles RF demuestra que si no se da un manejo adecuado a la población en cautiverio, en un futuro puede presentarse una diferenciación con respecto a las poblaciones del medio silvestre.
El exceso de homocigotos encontrado tanto en los adultos como en los juveniles NS, ambos considerados de origen silvestre, podría estar reflejando un exceso de homocigotos en el medio silvestre y por lo tanto una posible endogamia. Sin embargo, para afirmar esto, es necesario el estudio genético de las poblaciones silvestres de C. intermedius para determinar cuánta variabilidad se encuentra representada en la población en cautiverio; además, también es necesario para determinar el origen silvestre de la población en cautiverio y evitar el cruce de individuos de poblaciones estructuradas que pueda llevar a una depresión por exogamia o a un repoblamiento en el sitio incorrecto, lo que podría generar grandes dificultades en la sobrevivencia de los individuos al ser devueltos a su medio natural.
5. Agradecimientos
A la Universidad Nacional de Colombia, al Departamento de Biología, Laboratorio de Conservación Genética, por permitir el desarrollo del presente trabajo. A CORMACARENA, por la financiación del presente trabajo y a María Cristina Ardila Robayo, directora de la Estación de Biología Tropical Roberto Franco, por la recolección de las muestras de tejido y facilitar los datos relacionados con el sexo, estado de desarrollo de los individuos y el sistema de identificación de individuos manejado por la EBTRF.
Bibliografía
Ardila-Robayo, M.C., Martínez-Barreto, W., Suárez-Daza, R.M., Moreno-Torres, C.A. 2010. La Estación Roberto Franco (EBTRF) y el Cocodrilo del Orinoco en Colombia: contribución a su biología y conservación. Rev. Lat. Cons. 1(2): 120 130 [ Links ]
Allendorf, F. 1986. Genetic drift and the loss of alleles versus heterozygosity. Zoo Bio. 5:181-190 [ Links ]
Blouin, M.S. 2003. DNA-based methods for pedigree reconstruction and kinship analysis in natural populations. Trends Ecol Evol. 18:503-511 [ Links ]
Dever, J.A., Densmore, L.D. Microsatellites in Morelet's Crocodile (Crocodylus moreletii) and their Utility in Addressing Crocodilian Population Genetics Questions. 2000. J Herpetol. 35(3)541-544 [ Links ]
FitzSimmons, N., Tanksley, S., Forstner, M.R., Louis, E.E., Daglish, R., Gratten, J., Davis, S. 2000. Microsatellite markers for Crocodylus: new genetic tools for population genetics, mating system studies and forensics. En Grigg, G., Seebacher, F., Franklin, C.E.. Crocodylian Biology and Evolution. Surry Beatty and Sons, Chipping Norton. New South Wales, Australia. [ Links ]
Frankham, R., Ballou, J.D., Briscoe, D.A. 2002. Introduction to Conservation Genetics. Cambridge University Press. Cambridge. United Kingdom. [ Links ]
Frankham, R. Genetics and Conservation Biology. 2003. C.R. Biologies. 326:S22-S29. [ Links ]
Frasier, T.R. 2008. STORM: software for testing hypotheses of relatedness and mating patterns. Mol Ecol Resour. 8:1263-1266. [ Links ]
Goudet, J. 2001. FSTAT, a program to estimate and test g/wene diversities and fixation indices (version 2.9.3). Available from http://www2.unil.ch/popgen/softwares/fstat.htm [ Links ]
Haig, S.M. 1998. Molecular contributions to conservation. Ecology. 79(2): 413-425. [ Links ]
Hedrick, P. 2005. Genetics of Populations. Tercera edición. Jones and Bartlett Publishers. Inc.United States of America. [ Links ]
Isberg, S.R., Chen, Y., Barker, G., Moran, C. 2004. Analysis of Microsatellites and Parentage Testing in Saltwater Crocodiles. J Hered. 95(5):445-449 [ Links ]
Kalinowski, S.T., Taper, M.L., Marshall, T.C. 2007. Revising how the computer program CERVUS accommodates genotyping error increases success in paternity assignment. Mol Ecol 16:1099-1006. [ Links ]
Landweber, L.F., Dobson, A.P. 1999. Genetics and the Extinction of species: DNA and the conservation of biodiversity. Princeton University Press. Princeton, United Kingdom. [ Links ]
McVay, J., Rodríguez, D., Rainwater, T.R., Dever, J., Platt, S., McMurry, S., et al. 2008. Evidence of Multiple Paternity in Morelet's Crocodile (Crocodylus moreletii) in Belize, CA, Inferred from Microsatellite Markers. J Exp Zool. 309A:649-660 [ Links ]
Miles, L.G., Lance, S.L., Isberg, S.R., Moran, C., Glenn, T.C. 2009. Cross-species amplification of microsatellites in crocodilians: assessment and applications for the future. Conserv Genet. 10(4):935-954 [ Links ]
Ministerio del Medio Ambiente, Instituto de Investigación de Recursos Biológicos Alexander von Humboldt, Universidad Nacional de Colombia. 2002. Programa Nacional para la Conservación del Caimán Llanero Crocodylus intermedius. Bogotá [ Links ].
Peakall, R., Smouse, P.E. 2006. GENALEX 6: Genetic Analysis in Excel. Population Genetic Software for Teaching and Research. Mol Ecol Notes. 6:288-295 [ Links ]
Queller, D.C., Goodnight, F.C. 1989. Estimating Relatedness Using Genetic Markers. Evolution. 43:258-275. [ Links ]
Ramírez-Perilla, J. 2000. Caimán llanero o cocodrilo del Orinoco (Cro codylus intermedius): Conservación y conocimiento público en la Orinoquía colombiana. Rev. Zoo Divulgación. 2(1). Villavicencio, Colombia. [ Links ]
Raymond, M., Rousset, F. 1995. GENEPOP (version 1.2): population genetics software for exact tests and ecumenicism. J Heredity. 86:248-249. [ Links ]
Ruokonen, M., Andersson, A.C., Tegelström, H. 2007. Using historical captive stocks in conservation. The case of the Lesser white-fronted goose. Conserv Genet. 8:197-207. [ Links ]
Russello, M.A., Amato, G. 2004. Ex situ population management in the absence of pedigree information. Mol Ecol 13:2829-2840. [ Links ]
Selkoe, K.A., Toonen, R.J. 2006. Microsatellites for ecologists: a practical guide to using and evaluating microsatellite markers. Ecol Lett. 9:615-629. [ Links ]
Tzika, A.C., Remy, C., Gibson, R., Milinkovitch, M.C. 2008. Molecular genetic analysis of a captive-breeding program: the vulnerable endemic Jamaican yellow boa. Conserv Genet. 10(1): 69-77. [ Links ]
Weaver, J.P., Rodríguez, D., Venegas-anaya, M., Cedeño-vásquez, J.R., Forstner, M., Densmore, L. 2008. Genetic Characterization of Captive Cuban Crocodiles (Crocodylus rhombifer) and Evidence of Hibridization with the American Crocodile (Crocodylus acutus). J. Exp. Zool. 309A:649-660. [ Links ]
Recibido: 25 de octubre de 2010
Aceptado para publicación: 28 de agosto de 2012.













