Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales
Print version ISSN 0370-3908
Rev. acad. colomb. cienc. exact. fis. nat. vol.36 no.141 Bogotá Oct./Dec. 2012
FITOPATOLOGÍA
1. Magíster en Fitopatología. Programa de Maestría en Fitopatología, Departamento de Fitotecnia, Facultad de Ciencias Agropecuarias, Universidad de Caldas. Carrera 35 No. 62-160. Manizales, Colombia, e-mail: catalinaquinterovar
2. Ph.D. Profesor titular, Departamento de Fitotecnia, Universidad de Caldas. Carrera 35 No. 62-160. Manizales, Colombia, e-mail: jairo.castano_z@ucaldas.edu.co
RESUMEN
Se evaluó el efecto de Fosfito de potasio, Fosetil-Al, Acibenzolar-s-metil, Ácido DL-3-aminobutírico y lixi- viados de raquis de plátano, en la reducción de nematodos fitoparásitos en suelo y raíces de plántulas de plá- tano Dominico-Hartón y FHIA-21. El diseño experimental fue de bloques al azar con siete tratamientos, ocho plántulas por tratamiento, y cuatro repeticiones, incluyendo dos testigos: absoluto y relativo. Se registró la brotación, altura de plántulas, longitud de raíces, materia seca de raíces y nematodos fitoparásitos en 100 g de raíces y suelo. En todos los tratamientos ocurrió el 100% de brotación. La altura de plántulas y longitud de raíces no fue afectada negativamente por la aplicación de los inductores de resistencia, excepto en las tratadas con lixiviados de raquis que presentaron síntomas de fitotoxicidad. La materia seca de raíces aumentó a través del tiempo en los tratamientos con inductores y disminuyó en los testigos. La aplicación de los inductores de resistencia redujo significativamente las poblaciones de nematodos fitoparásitos en raíces de Dominico-Hartón entre 61 y 91% y en FHIA-21 entre 51 y 85%. En suelo la reducción en Dominico-Hartón osciló entre 42 y 78% y en FHIA-21 entre 38 y 72%. En ambos materiales de plátano, se registró Radopholus similis, Helicotylenchus spp. y Meloidogyne spp.
Palabras clave: Dominico-Hartón, FHIA-21, Radopholus similis, Meloidogyne spp., Helicotylenchus spp.
ABSTRACT
It was evaluated the effect of potassium Phosphite, Fosetyl-Al, Acibenzolar-s-methyl, DL-3-aminobutyric acid and lixiviates of rachis of plantain, on the reduction of nematodes in soil and roots of seedlings of Dominico- Hartón and FHIA-21. The experimental design used was a randomized complete block with seven treatments, four replications and eight plants per replication, including two controls: absolute and relative. Sprouting, seedling height, root length, dry matter of roots and number of nematodes in 100 g of roots and soil were regis- tered. In all treatments occurred 100% of sprouting. Seedling height and root length was not affected adversely by the application of inductors of resistance, except in those treated with lixiviates of rachis of plantain, which showed symptoms of phytotoxicity. The dry matter of roots increased over time in treatments with the induc- tors. The application of resistance inductors significantly reduced populations of plant parasitic nematodes in roots of Dominico-Harton between 61 and 91% and FHIA-21 between 51 and 85%. In soil the reduction ranged between 42 and 78% in Dominico-Harton and between 38 y 72% in FHIA-21. In both materials was found Radopholus similis, Helicotylenchus spp. and Meloidogyne spp
Key words: Dominico-Hartón, FHIA-21, Radopholus similis, Meloidogyne spp., Helicotylenchus spp.
Introducción
En Colombia hay alrededor de 368.392 ha en plátano, con una producción de 2.970.435 t año-1 (AGRONET, 2010). Este cultivo genera unos 286.000 empleos directos año-1, lo que equivale a 57.000 familias que viven de él (Martínez et al., 2006).
Entre las plagas que atacan el plátano, se encuentran los nematodos fitoparásitos, distribuidos en diferentes regiones del mundo ocasionando pérdidas en el rendimiento entre 30 y 50% (Araya, 2003). Debido a que poseen un estilete, ingresan a las raíces, liberando toxinas que causan deformidad y destrucción de los tejidos, lo que afecta la absorción de agua y nutrimentos y su posterior translocación hacia las partes aéreas de las plantas; en infestaciones severas, la ruptura radical, ocasiona el volcamiento de las plantas antes del desarrollo completo del racimo.
Se han implementado métodos de manejo cultural, químico y biológico, sin embargo el problema aún continúa, por lo que se requiere de nuevas estrategias, que permitan aumentar el grupo de tácticas usadas para éste fin. La inducción de resistencia puede representar un gran potencial porque consiste en estimular la planta a producir sustancias naturales de defensa contra patógenos como peroxidadas y proteínas PR (relacionadas con la patogenicidad). Este tipo de mecanismo no ocasiona contaminación del medio ambiente (Ryals et al., 1994; Â Kessmann et al., 1994), hay menor probabilidad de un desarrollo rápido de resistencia, posee amplio espectro de acción y ofrece protección prolongada (Kessmann et al., 1994; Kuc, 2001; Riveros, 2001; Andreu et al., 2006). Existen diversos compuestos que estimulan ésta respuesta en la planta, como el Fosfito de potasio, Fosetil-Al, Acibenzolar-s-metil, ASM, Benzothiadiazole, BTH, Ácido aminobutírico, BABA, Ácido 2,6-dicloroisonicotínico, INA, Ácido salicílico, etc. (Kessmann et al., 1994; Schneider et al., 1996; Cohen, 2001; Kuc, 2001) y compuestos orgánicos como lixiviados de raquis de plátano (Álvarez et al., 2001; Escobar-Vélez & Castaño-Zapata, 2005). Los beneficios de su aplicación han sido reportados previamente.
El Fosfito de potasio causó efecto inhibitorio del desarrollo de Phytophthora cinnamomi en raíces de eucaliptus (Eu- calyptus marginata) y redujo la incidencia de éste mismo hongo entre un 72 a 100% en plantas de castaño común (Castanea sativa) después de dos aplicaciones; así mismo ocasionó 99% de control de Phytophthora cactorum, en plantas de fresa (Fragaria spp.) con respecto a las no tratadas (Jackson et al., 2000; Rebollar et al., 2005; Gentile et al., 2009). Fosetil-Al indujo resistencia disminuyendo la severidad de la Pudrición de la corona (P. cactorum) y Pudrición de las raíces (Phytophthora. fragariae) en plantas de fresa (Eikemo et al., 2003); también hubo mayor acumulación e incremento de proteínas -1,3-glucanasas, proteasas, fitoalexinas y compuestos fenólicos en tubérculos de papa (Solanum tuberosum), Â posterior a su aplicación para el manejo de Phytophthora infestans (Andreu et al., 2006). Acibenzolar-s-metil, ASM, redujo significativamente la severidad de la Roña de la pera (Venturia nashicola), con una eficiencia en el control del 42% (Faize et al., 2004) y en plátano Dominico-Hartón (Musa AAB) tuvo una eficiencia del 80% en la reducción de la severidad de las sigatokas negra (Mycosphaerella fijiensis) y amarilla (M. musicola) (Márquez & Castaño-Zapata, 2007). El Ácido DL-3-aminobutírico, BABA, aplicado sobre el follaje de plantas de la vid (Vitis vinífera), proporcionó un control efectivo mayor al 90% de Plasmopara vitícola (Reuveni et al., 2001) y lixiviados de raquis de plátano al 0,5%, disminuyeron la severidad de las sigatokas negra y amarilla en plátano Dominico-Hartón en un 17% con respecto al testigo (Escobar-Vélez & Castaño-Zapata, 2005).
Teniendo en cuenta lo anterior, en el presente trabajo se evaluó el efecto de cinco inductores de resistencia: Fosfito de potasio, Fosetil-Al, Acibenzolar-s-metil, ASM, Ácido DL-3-aminobutírico, BABA, y lixiviados de raquis de plátano, para el manejo de nematodos fitoparásitos en plántulas plátano Dominico- Hartón y el híbrido FHIA-21, bajo condiciones de almácigo.
Materiales y métodos
El experimento se realizó en la granja Montelindo de la Universidad de Caldas, ubicada en el municipio de Palestina (Caldas), con altitud de 1.010 msnm, temperatura media anual de 22,8°C y precipitación anual de 2.200 mm, y en el laboratorio de Fitopatología de la Universidad de Caldas.
Se utilizaron cormos de plátano Dominico-Hartón (361-722 g) y del híbrido FHIA-21 (142-316 g), procedentes de plantaciones en la misma granja y a los cuales se les determinó la población inicial de nematodos fitoparásitos. Los inductores de resistencia fueron formulaciones comerciales de Fosfito de potasio, Fosetil-Al, Acibenzolar-s-metil, ASM, y Ácido DL-3-aminobutírico, BABA. También se utilizaron lixiviados de raquis de plátano procedentes de la granja Montelindo.
Los tratamientos consistieron en la aplicación de los inductores de resistencia sobre cormos de Dominico-Hartón y el híbrido FHIA-21 previamente tratados en inmersión con 10 mL L-1 de Carbofuran, durante 60 min.; también se tuvo un testigo relativo y absoluto para cada material de plátano. Cada material de plátano se consideró un experimento independiente y su establecimiento en campo se realizó con una semana de diferencia iniciando con Dominico-Hartón.
La unidad experimental, consistió en ocho cormos de plátano ya fuese de Dominico- Hartón o FHIA-21, sembrados en suelo previamente cernido y homogenizado para proporcionar mayor soltura, contenido en bolsas plásticas negras perforadas de 5 kg. En cada bolsa se aplicaron 500 mL de una solución de agua más los inductores de resistencia según el tratamiento en una concentración de 1 mL L-1 Â (Fosfito de potasio), 10 g L-1 Â (Fosetil-Al), 0,01 mL L-1 Â (Acibenzolar-s-metil), 100 μg mL-1 (Ácido DL-3-aminobutírico); y lixiviados de raquis de plátano evaporados al 50%. En los testigos relativo y absoluto, se aplicaron 500 mL de agua sobre cormos tratados y sin tratar con Carbofuran, respectivamente. Las aplicaciones de los tratamientos se realizaron en la siembra, 40, 60 y 90 días después de la siembra, DDS, para obtener protección prolongada contra la infestación de los nematodos fitoparásitos a través del tiempo. El diseño experimental fue de bloques completos al azar con siete tratamientos por cada material de plátano evaluado, cuatro unidades experimentales por cada tratamiento y ocho plantas por cada unidad experimental para un total de 32 plantas por cada tratamiento.
Transcurridos 15 días del establecimiento del experimento, se puso una cubierta de polisombra, para proporcionar un ambiente más favorable para el desarrollo de las plántulas. También se separaron las bolsas del suelo con un plástico grueso (Agroclear No. 8), para evitar el contacto de las raíces con éste.
Variables de respuesta:
Brotación (%): Se observó semanalmente durante 40 días, la emergencia de las plántulas por tratamiento.
Altura de plántulas (cm): Se tomaron en cada evaluación muestras destructivas correspondientes a dos plántulas de cada unidad experimental por tratamiento, para un total de ocho por plántulas por tratamiento en cada material de plátano, y la medición se realizó con un flexómetro.
Longitud de raíces (cm): Se realizó midiendo con un flexómetro las raíces de las ocho plántulas muestreadas por tratamiento, en cada momento de evaluación.
Materia seca de raíces (%): Se realizó seleccionando la mitad de las ocho plántulas muestreadas por tratamiento en cada momento de evaluación. Las raíces de dichas plántulas se cortaron y se registró su peso fresco. Luego se depositaron en bolsas de papel y se llevaron al laboratorio de Fitopatología. Éstas se pusieron en una estufa de control de temperatura (marca DIES) a 70 °C durante 48 h y después se registró el peso seco de las raíces.
El porcentaje de materia seca de raíces se determinó con la fórmula:
Donde: MS: Materia seca; PF: Peso fresco y PS: Peso seco.
Número de nematodos fitoparásitos en 100 g de raíces y suelo: Con la mitad restante de las plántulas muestreadas por tratamiento (cuatro), se realizó la evaluación de la población de nematodos en 100g de raíces y suelo en cada momento de evaluación. Las raíces de las plántulas muestreadas se cortaron con porciones del cormo y el suelo se tomó del área radical de dichas plántulas; ambas muestras se depositaron independientemente en bolsas plásticas debidamente marcadas. Estas se llevaron al laboratorio de Fitopatología de la Universidad de Caldas y se realizó el procedimiento de extracción de nematodos por el método de licuado, centrifugación y flotación en azúcar (Flegg & Hooper, 1970). El recuento de los nematodos se realizó en un microscopio estereoscópico (marca LEICA ZOOM 2000), utilizando una cámara provista de cuadrantes de 1 cm2Â y posteriormente se identificaron los géneros presentes, con ayuda del microco- pio compuesto de luz (marca LW Scientific; modelo Revelation III), a través del objetivo de 40X.
Análisis estadístico.
Se uso el programa estadístico SAS® (Statistical Analysis System, SAS Institute) para realizar el análisis de varianza y la prueba de comparación Tukey al 5%, para las variables de respuesta.
Resultados y discusión
Brotación (%): Para el análisis estadístico, se tuvo en cuenta la brotación acumulada a través del tiempo, expresada en porcentaje. El análisis de varianza indicó diferencias signi- ficativas en la primera, segunda y tercera semana después de la siembra, tanto en Dominico-Hartón (P= 0,0089, P=0,0010 y P= 0,0005, respectivamente), como en FHIA-21 (P= 0,0025, P = 0,0025 y P < 0,0001, respectivamente).
En ambos materiales de plátano, el total de cormos sembrados emergió y esto ocurrió entre la primera y la cuarta semana después del establecimiento. El comportamiento de la brotación con la aplicación de los inductores de resistencia reveló que las plantas tratadas con Fosfito de potasio, Fosetil-Al, ASM y BABA, emergieron en su totalidad en la tercera semana, mientras que con la aplicación de lixiviados de raquis de plátano ocurrió solo hasta la cuarta semana después de la siembra (Figura 1).

El tiempo de brotación en general indicó un comportamiento normal para esta variable, dado que estuvo dentro de los rangos normales para la ocurrencia de éste fenómeno, no obstante, es importante resaltar que el tratamiento que más rápido alcanzó el 100% de brotación en la segunda semana
después de la siembra, fue el testigo relativo. En este testigo los cormos fueron expuestos a un tratamiento presiembra con Carbofuran, sugiriendo que éste estimuló una brotación rápida de las plántulas. Este comportamiento también fue reportado por Márquez & Castaño-Zapata (2008), quienes observaron que cormos  de Dominico-Hartón expuestos a 2 mL L-1 de Carbofuran durante 60 min, emergieron 7 días más rápido que los del testigo. Al parecer, la estimulación del crecimiento generada por Carbofuran podría estar relacionada además de su actividad nematicida o insecticida, a que produce una serie de metabolitos que inhiben la oxidación del ácido indolacético (Lee, 1976), considerada la auxina natural más importante que influye en el crecimiento, división celular y formación de raíces en las plantas (Castillo et al., 2005). Es de anotar que aunque los cormos de los tratamientos con inductores también llevaron tratamiento presiembra con Carbofuran, no hubo una superioridad en dicho efecto combinado sobre la brotación.
Altura de plántulas: En Dominico-Hartón las principales diferencias entre tratamientos con inductores de resistencia y los testigos se registraron en la última evaluación (120 DDS, P < 0,0001), mientras que para FHIA-21 estas fueron en la tercera evaluación (90 DDS, P < 0,0001).
Durante las tres primeras evaluaciones, la altura de las plántulas de Dominico-Hartón no fue afectada significativamente por la aplicación de Fosfito de potasio, Fosetil-Al, ASM y BABA. Así mismo, aunque éstos mismos cuatro inductores, presentaron mayor altura que la de ambos testigos en la última evaluación 120 DDS, el efecto solo fue estadísticamente significativo para aquellas tratadas con Fosfito de potasio (41,37 cm). En FHIA-21, la altura tampoco se vio afectada significativamente por la aplicación de Fosfito de potasio, Fosetil-Al, ASM y BABA, con respecto a ambos testigos y éste comportamiento fue consistente a través del tiempo (Tabla 1).
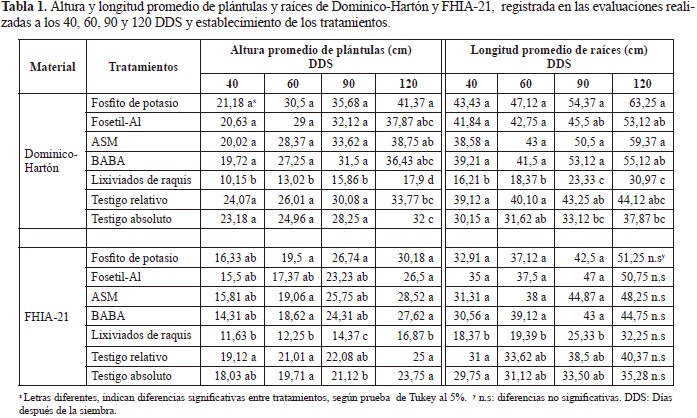
Tanto en Dominico-Hartón como en FHIA-21, las mayores diferencias entre los tratamientos con inductores y los testigos, se apreciaron con la aplicación de lixiviados de raquis de plátano el cual registró el menor valor de altura de plántulas a través del tiempo (Tabla 1). Se observó además, que las plántulas tratadas con este inductor de resistencia, presentaron síntomas de fitotoxicidad manifestada en las hojas con apariencia de rigidez y deformidad y aunque para tratar de contrarrestar este efecto se disminuyó la concentración de lixiviados a la mitad en la tercera evaluación (60 DDS), la recuperación de las plántulas no fue sustancial, siendo éste el inductor que más adversamente afectó el crecimiento.
El comportamiento destacado de Fosfito de potasio en Dominico-Hartón, registrado a los 120 DDS en éste estudio para altura de las plántulas, también fue reportado por Mogollón-Ortíz (2011), quien al evaluar el efecto de diferentes inductores de resistencia, para el manejo de las sigatokas amarilla y negra, indicó superioridad en la altura de plántulas de Dominico-Hartón, al cabo de tres aplicaciones de Fosfito de potasio, con un valor promedio de 36,6 cm registrado a los 112 DDS, con respecto a 29 cm registrado en las plántulas del testigo, sin dicha aplicación. Al respecto, se ha reportado que el efecto que tiene el Fosfito de potasio en el crecimiento de las plantas se debe principalmente a los cambios bioquímicos y estructurales que restringen el desarrollo del patógeno (Lobato et al., 2011; Olivieri et al., 2012), más que a su acción como fertilizante (Thao & Yamakawa, 2009).
Por su parte otros estudios en plátano reportaron que la aplicación de Fosfito de potasio y ASM, no afectó la altura de las plantas cuando se aplicaron cada 6 semanas durante el ciclo del cultivo para el manejo de las sigatokas negra y amarilla dado que no difirieron con las plantas del testigo (Ramírez-Loaiza, 2010), comportamiento que también fue observado en éste estudio para las plántulas de FHIA-21.
En lo referente al proceso de inducción de resistencia, ha sido ampliamente documentado que existe una serie de costos energéticos para la planta, como consecuencia de la redistribución masiva de su energía, hacia la producción de compuestos para la defensa contra el patógeno (Herms & Mattson, 1992; Cipollini et al., 2003; Iriti & Faoro, 2006; Berger et al., 2007; Bolton, 2009). Â En este estudio estos costos no tuvieron un efecto adverso en el crecimiento de las plantas de Dominico-Hartón y FHIA-21, con la aplicación de Fosfito de potasio, Fosetil-Al, ASM ó BABA. Al respecto, Siemens et al. (2003) y Dietrich et al. (2005), afirman que la naturaleza de estos costos aún se encuentra en discusión y dependen del ambiente en que la planta se encuentre y en muchos casos se relaciona con condiciones de estrés.
Longitud de raíces: Las diferencias estadísticas en Dominico-Hartón para esta variable se presentaron en todos los tiempos de evaluación (P < 0,0001, P < 0,0001, P < 0,0001 y P = 0,0004), mientras que en FHIA-21 éstas ocurrieron solo en las tres primeras evaluaciones (P = 0,0006, P = 0,0174 y P = 0,0006).
La longitud de raíces en plántulas de Dominico Hartón, y FHIA-21, no fue afectada significativamente por la aplicación de Fosfito de potasio, Fosetil-Al, ASM y BABA, más si lo fue con la aplicación de lixiviados de raquis de plátano (Tabla 1).
Aunque no hubo un efecto estadísticamente superior en la longitud de raíces con la aplicación de los inductores de re- sistencia con respecto a los testigos, cabe resaltar que al cabo de 120 DDS, las raíces de las plántulas de los dos materiales de plátano evaluados tratadas con Fosfito de potasio, Fosetil-Al, ASM y BABA, fueron mas largas que aquellas que no recibieron aplicación de dichos productos, siendo el mayor valor de 63,25 cm en Dominico-Hartón y de 51,25 cm en FHIA-21, registrado con Fosfito de potasio (Tabla 1).
Las plántulas de Dominico-Hartón y FHIA-21 tratadas con lixiviados de raquis de plátano, presentaron desarrollo radi- cal deficiente, y menor longitud de raíces, comparada con los demás tratamientos, probablemente como resultado de la fitotoxicidad causada por la concentración a la cual se usaron (Figura 2). Esto coincide con lo reportado por Álvarez et al. (2001) quienes observaron que las aplicaciones de lixiviados de raquis de plátano al 50%, aunque redujeron la inciden- cia del Mildeo polvoso de la rosa (Rosa spp.) causado por Sphaerotheca pannosa, causaron fitotoxicidad en plantas.

Materia seca de raíces: Tanto en Dominico-Hartón y FHIA-21, las plántulas tratadas con los inductores de resistencia presentaron mayores valores de materia seca de raíces con respecto a ambos testigos. Sin embargo, estas diferencias solo fueron significativas a los 90 y 120 DDS, tanto en Dominico-Hartón (P < 0,0001 y P = 0,0003), como en FHIA-21 (P = 0,0008 y P < 0,0001).
Las plántulas tratadas con Fosfito de potasio, Fosetil-Al y ASM presentaron un comportamiento similar en Dominico- Hartón y FHIA-21 debido a que difirieron significativamente de ambos testigos tanto en la evaluación realizada a los 90 como en la realizada a los 120 DDS. Los valores de materia seca al final del periodo evaluativo con la aplicación de estos tres inductores fueron en Dominico-Hartón de 44, 39 y 45%, respectivamente, Â mientras que en FHIA-21 estuvieron alrededor de 30% (Tabla 2).
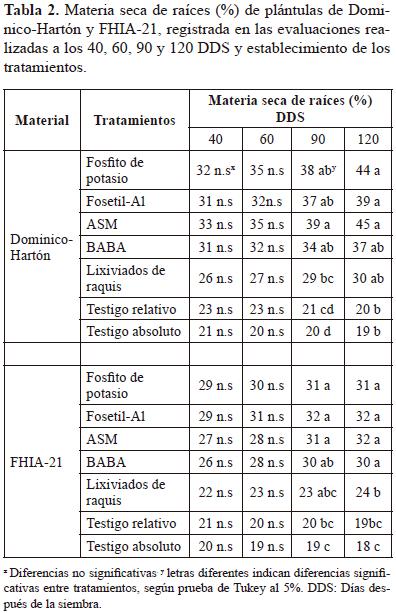
En ambos genotipos la materia seca de raíces aumentó a través del tiempo en los tratamientos con inductores de resistencia, y disminuyó en los testigos, comportamiento que también fue reportado por Becerra-Encinales (2010); esto probablemente se relaciona con mayor número de nematodos fitoparásitos en ambos testigos, cuyos daños, afectaron negativamente la biomasa radical.
Nematodos fitoparásitos en 100 g de raíces y suelo: Las plántulas de Dominico- Hartón y FHIA-21 tratadas con los inductores de resistencia redujeron significativamente el número de nematodos en raíces y suelo en todos los tiempos de evaluación, con respecto a ambos testigos (P < 0,0001).
Las diferencias estadísticas no permitieron distinguir claramente la superioridad en la acción de alguno de los inductores de resistencia, sin embargo en términos de reducción del número de nematodos fitoparásitos, hubo un orden de efectividad que fue consistente tanto para Dominico-Hartón y FHIA-21. En raíces la mayor reducción de nematodos fitoparásitos se presentó con la aplicación de ASM, seguido por Fosfito de potasio, Fosetil-Al, BABA y lixiviados de raquis de plátano. Los valores en Dominico-Hartón para dichos tratamientos al final del periodo evaluativo (120 DDS) fueron de 521, 848, 929, 1.391 y 2.172 individuos 100 g de raíces-1, respectivamente; en FHIA-21 fueron de 970, 1.192, 1.434, 1.714 y 3.109 individuos 100 g de raíces-1, respectivamente (Figura 3). En suelo la mayor reducción de nematodos fitoparásitos se observó con la aplicación de Fosfito de potasio, seguido de ASM, Â Fosetil-Al, BABA y lixiviados de raquis de plátano, con valores al cabo de 120 DDS para Dominico-Hartón de 105, 128, 131, 181, y 284 individuos 100 g de suelo-1, respectivamente y en FHIA-21 de 213, 229, 277, 285 y 476 individuos 100 g de suelo-1, respectivamente (Figura 4).
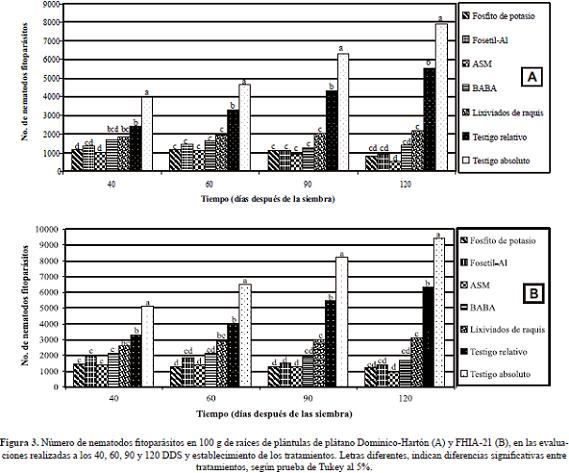
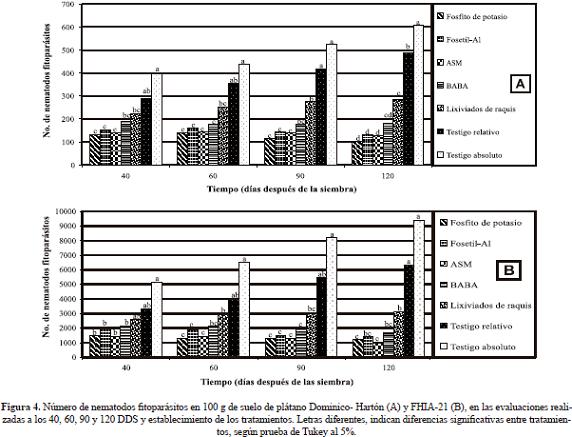
En ambos materiales de plátano, el tratamiento de los cor mos con Carbofuran tuvo una gran influencia en la reducción de las poblaciones de nematodos fitoparásitos. Este compor- tamiento se apreció en el testigo relativo, el cual registró valores inferiores a los registrados en el testigo absoluto a través del tiempo (Figuras 3, 4). El número de  nematodos fitoparásitos en raíces registrado para los testigos relativo y absoluto al final del periodo evaluativo (120 DDS), fue en Dominico-Hartón de 5.522 y 7.940 individuos, respectiva- mente; mientras que en FHIA-21 fue de 6.310 y 9.400 indi- viduos respectivamente. En suelo los valores para Dominico Hartón con estos dos testigos fueron de 487 y 606 individuos, respectivamente y en FHIA-21 de 764 y 945 individuos, res- pectivamente. Teniendo esto en cuenta se realizó un análisis de reducción porcentual de nematodos fitoparásitos tomando como referencia el testigo relativo, dado que los cormos usa- dos en los tratamientos con inductores de resistencia también fueron tratados con Carbofuran (Tabla 3).
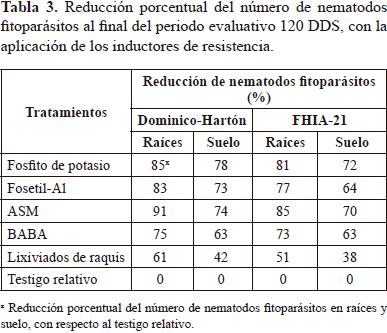
Desde el establecimiento del experimento, hasta el final de la evaluación se realizaron cuatro aplicaciones de los inductores de resistencia y esto dio como resultado al cabo de 120 DDS, una reducción de los nematodos fitoparásitos en raíces en Dominico-Hartón entre 61 y 91%, mientras que en FHIA-21, entre 51 y 85% en comparación con el testigo relativo. En suelo esta reducción en Dominico-Hartón fue entre 42 y 78%, mientras que en FHIA-21 fue entre 38 y 72% (Tabla 3). Estos resultados confirman la efectividad de los inductores de resistencia y coincide con reportes anteriores donde se evidencian los beneficios de su aplicación en la estimulación de los mecanismos de defensa de las plantas y la supresión de las poblaciones de nematodos fitoparasitos. Ramírez- Loaiza (2010), observó que la aplicación de ASM y Fosfito de potasio en plantas de plátano Dominico-Hartón en campo, redujeron las poblaciones de nematodos fitoparásitos en raí- ces en 74 y 44% Â y en suelo en 26 y 17%, respectivamente. Mogollón-Ortíz (2011), reportó una reducción en poblaciones de nematodos fitoparásitos en plántulas de plátano tratadas con Fosfito de potasio, ASM y BABA, que fueron del orden de 22,01, 21,10 y 6,42%, respectivamente. Arias (1999), registró una disminución significativa del número de nematodos en raíces de plantas de banano con la aplicación de Fosetil-Al y un aumento del 15% de las raíces funcionales con respecto a las no tratadas y Llive-Condor (2009), reportó que la aplicación de lixiviados de raquis frescos o maduros, en diferentes concentraciones sobre vitro plantas de banano (Musa paradisiaca) cv. "Gran Enano" en invernadero, redujeron la penetración de Radopholus similis en rangos que oscilaron entre 64 y 91%.
En lo referente a la acción de los inductores de resistencia sobre nematodos fitoparásitos, se ha reportado que éstos compuestos activan genes relacionados con la patogenicidad como inhibidores de proteasas (PR-6), que impiden el desdoblamiento de las proteínas consumidas por los nematodos; también se reporta que afectan su reproducción y desarrollo al alterar los sitios de alimentación ya sea por el suministro inadecuado de nutrientes para los nematodos o por el desplazamiento de sustancias tóxicas para su desarrollo (Chinnasri et al., 2003; Chinansri & Sipes, 2005; Oka et al., 2007).
En esta investigación hubo mayor población de nematodos fitoparásitos en raíces y suelo en FHIA-21 que en Dominico-Hartón, que también fue registrado en trabajos previos en la granja Montelindo (Guzmán & Castaño-Zapata, 2004). Este comportamiento es concordante con mayor población inicial de nematodos fitoparásitos en las raíces de los cormos de FHIA-21 (16.101 individuos 100 g de raíces-1) que de Dominico-Hartón  (12.364 individuos 100 g de raíces-1). En suelo, podría ser el resultado de la reinfestación a partir de poblaciones de nematodos en las raíces.
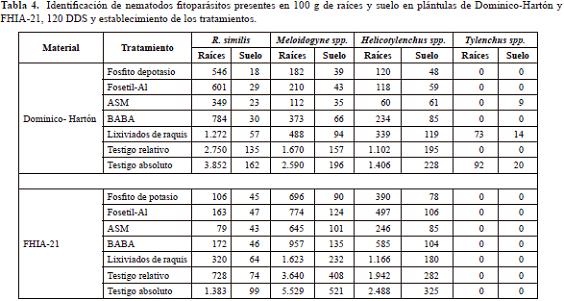
Tanto en Dominico-Hartón y FHIA-21 se registró la presencia en raíces y suelo de nematodos importantes como Radopholus similis, Meloidogyne spp., y Helicotylenchus spp., siendo R similis más predominante en Dominico-Hartón y Meloidogyne spp. en FHIA-21 (Tabla 4).
Conclusiones
Con Fosfito de potasio, Fosetil-Al, Acibenzolar-s-metil (ASM) y Ácido DL-3-aminobutírico (BABA), el 100% de brotación ocurrió tres semanas después de la siembra y con lixiviados de raquis de plátano ocurrió cuatro semanas después de la siembra en plántulas de Dominico-Hartón y FHIA-21.
Aplicaciones continuas de los inductores de resistencia eva- luados, redujeron las poblaciones de nematodos fitoparásitos en raíces y suelo de plántulas de Dominico-Hartón y FHIA-21.
Lixiviados de raquis de plátano evaporados al 50% causaron fitotoxicidad en plántulas de Dominico-Hartón y FHIA-21, ocasionado desarrollo y crecimiento deficiente; sin embargo, redujeron poblaciones de nematodos fitoparásitos en raíces y suelo de dichas plántulas, por lo que se recomienda realizar estudios con otras concentraciones.
La presencia de Radopholus similis, Meloidogyne spp. y Helicotylenchus spp. confirma la importancia de estos nematodos en plátano.
Agradecimientos
A la Vicerrectoría de Investigaciones y Posgrados de la Universidad de Caldas, por la financiación de esta investigación, a M.Sc. Manuel Aristizábal Loaiza, por su asesoría estadística, y a Wilson Puerta y Bernardo Gutiérrez, por su colaboración en labores de campo y laboratorio, respectivamente.
Bibliografía
AGRONET. 2010. Red de información y comunicación estratégica del sector agropecuario. Estadísticas.http://www.agronet.gov.co/agronet-web1/Estad%C3%ADsticas/ReportesEstad%C3%ADsticos.aspx [ Links ]
Álvarez E., C. Grajales, C. J. Villegas & J. Loke. 2001. Control del Mildeo polvoso (Sphaerotheca pannosa var. rosae) en rosa (Rosa sp.), usando un lixiviado de compost del raquis de plátano (Musa AAB). Asocolflores 62:41-47. [ Links ]
Andreu A., M. G. Guevara, E. Wolski, G. Daleo & D. Caldiz. 2006. Enhancement of the natural disease resistance of potatoes by chemicals. Pest Manag. Sci. 62:162-170. [ Links ]
Araya M. 2003. Situación actual del manejo de nemátodos en banano (Musa AAA) y plátano (Musa AAB) en el trópico americano. En: F. E. Rosales., y G. Rivas (Eds.), Manejo Convencional y Alternativo de la Sigatoka Negra, Nemátodos y Otras Plagas Asociadas al Cultivo de Musáceas en los Trópicos. (Guayaquil, Ecuador). Inibap. pp. 79-102. [ Links ]
Arias O. 1999. Desarrollo del método de in-plant con bioroot en el cultivo de banano. Memorias XI Congreso Nacional Agronómico y de Recursos Naturales: vol. 2. Manejo de cultivos. San José (Costa Rica). p. 367. [ Links ]
Becerra-Encinales J. 2010. Efecto de la micorrización sobre el manejo de nematodos fitopatógenos en plántulas de plátano híbrido "FHIA-20 AAAB". Tesis de Magister en Fitopatología. Facultad de Ciencias Agropecuarias, Universidad de Caldas, Manizales. 121 p. [ Links ]
Berger S., A.K. Sinha & T. Roitsch. 2007. Plant physiology meets phytopathology: plant primary metabolism and plant pathogen interactions. J. Exp. Bot. 58(15-6):4019-4026. [ Links ]
Bolton M.D. 2009. Primary metabolism and plant defense fuel for the fire. Mol. Plant Microbe Interact. 22:487-497. [ Links ]
Castillo G., B. Altuna, G. Michelena, J. Sánchez-Bravo & M. Acosta. 2005. Cuantificación del contenido de ácido indolacético (AIA) en un caldo de fermentación microbiana. Anales de Biología 27:137-142. [ Links ]
Chinnasri B. & B.S. Sipes. 2005. Effects of a systemic acquired resistance inducer on nematodes infecting pineapple. Acta Hortic. 666:213-222 [ Links ]
Chinnasri B., B.S. Sipes & D.P. Schmitt. 2003. Effects of acibenzolar- s-methyl application to Rotylenchulus reniformis and Meloidogyne javanica. J. Nematol. 35: 110-114. [ Links ]
Cipollini D., C.B. Purrington & J. Bergelson. 2003. Costs of induced responses in plants. Basic Appl. Ecol. 4:79-85. [ Links ]
Cohen Y. 2001. The BABA story of induced resistance. Phytoparasitica 29:375-378. [ Links ]
Dietrich R., K. Ploss & M. Heil. 2005. Growth responses and fitness costs after induction of pathogen resistance depend on environmental conditions. Plant Cell Environ. 28:211-222. [ Links ]
Eikemo H., A. Stensvand & A.M. Tronsmo. 2003. Induced resistance as a possible means to control diseases of strawberry caused by Phytophthora spp. Plant Dis. 87: 345-350. [ Links ]
Escobar-Vélez J. H & J. Castaño-Zapata. 2005. Manejo de las enfermedades causadas por Mycosphaerella spp. mediante la aplicación de ácidos fúlvicos. InfoMusa 14(2):15-17. [ Links ]
Faize M., L. Faize, N. Koike, M. Ishizaka & H. Ishii. 2004. Acibenzolar- s-methyl-induced resistance to Japanese pear scab is associated with potentiation of multiple defense responses. Phytopathol. 94:604-612. [ Links ]
Flegg J. J. M & D.J. Hooper. 1970. Extraction of free-living stage from soil. In: J. F. Southey (ed). Laboratory Methods for Work with Plant and Soil Nematodes. Technical Bulletin 2. Her majesty's stationary office, London. pp. 5-22. [ Links ]
Gentile S., D. Valentino & G. Tamietti. 2010. Effectiveness of potassium phosphite in the control of chestnut ink disease. Acta Hort. (ISHS) 866:417-424 [ Links ]
Guzmán P. O. A. & J. Castaño-Zapata. 2004. Reconocimiento de nematodos fitopatógenos en plátanos Dominico-Hartón (Musa AAB Simmonds), África, FHIA-20 y FHIA-21 en la granja Montelindo, municipio de Palestina (Caldas), Colombia. Rev. Acad. Colomb. Cienc. 28(107):205-302. [ Links ]
Herms D.A. & W.J. Mattson. 1992. The dilemma of plants: to grow or defend. Quart. Rev. Biol. 67:283-335. [ Links ]
Iriti M. & F. Faoro. 2006. Fitness costs of chemically-induced resistance: double edged sword or (un)stable equilibrium?. Â J. Plant Pathol. 88(1):5-6. [ Links ]
Jackson T.J., T. Burgess, I. Colquhoun & G.E.S. Hardy. 2000. Action of the fungicide phosphate on Eucalyptus marginata inoculated with Phytophthora cinnamomi. Plant Pathol. 49:147-154. [ Links ]
Kessmann H., T. Staub, C. Hofmann, T. Maetzke, J. Herzog, E. Ward, S. Uknes & J. Ryals. 1994. Induction of systemic acquired resistance in plants by chemicals. Annu. Rev. Phytopathol. 32:439-459. [ Links ]
Kuc J. 2001. Concepts and direction of induced systemic resistance in plants and its application. Eur. J. Plant Pathol. 107:7-12. [ Links ]
Lee T. T. 1976. Insecticide-plant interaction: Carbofuran effect on indole-3- acetic acid metabolism and plant growth. Life Sci. 18:205-210. [ Links ]
Llive-Condor F. M. 2009. Uso de extractos acuosos de raquis de banano y Tagetes spp. enriquecidos con bacterias y hongos endofíticos para el control biológico de Radopholus similis (Cobb) Thorne. Tesis, Mag. Sc. en Agricultura Ecológica, Centro Agronómico Tropical de Investigación y Enseñanza CATIE, Turrialba Costa Rica. 79 p. [ Links ]
Lobato M.C., M.F. Machinandiarena, C. Tambascio, G.A.A. Dosio, D.O. Caldiz,  G.R. Daleo, A.B Andreu, & F.P. Olivieri. 2011. Effect of foliar applications of phosphate on post-harvest potato tubers. Eur. J. Plant Pathol. 130(2): 155-163. [ Links ]
Márquez C. L & J. Castaño-Zapata. 2007. Inducción de resistencia a sigatokas  en  plántulas  de  plátano  Dominico-Hartón.  Agronomía 15(2):49-57. [ Links ]
Márquez C. L. & J. Castaño-Zapata. 2008. Efecto de tratamiento químico de la semilla de plátano Dominico-Hartón sobre la población de nematodos fitoparásitos. Boletín Fitotecnia. No. 133. Universidad de Caldas. Manizales. 2 p. [ Links ]
Martínez H., Y. Peña & C. Espinal. 2006. La cadena de plátano en Colombia: una mirada global de su estructura y dinámica 1991-2005. En: Ministerio de Agricultura y Desarrollo Rural. Documento de Trabajo No. 102. Bogota, Colombia. En: http://cadenahortofruticola.org/ad-min/bibli/324caracterizacion_platano.pdf; consulta: agosto de 2010. [ Links ]
Mogollón-Ortiz A. M. 2011. Evaluación in vitro e in situ de inductores químicos de resistencia sobre Mycosphaerella spp. Tesis de Magister en Fitopatología. Facultad de Ciencias Agropecuarias, Universidad de Caldas, Manizales. 115 p. [ Links ]
Olivieri F.P., M.L Feldman, M.F Machinandiarena, M.C. Lobato, D.O. Caldiz, G.R. Daleo & A.B. Andreu, 2012. Phosphite applications induce molecular modifications in potato tuber periderm and cortex that enhance resistance to pathogens. Crop Protection, 32: 1-6 [ Links ]
Oka Y., N. Tkachi & M. Mor. 2007. Phosphite inhibits development of the nematodes Heterodera avenae and Meloidogyne marylandi in cereals. Phytopathol. 97:396-404. [ Links ]
Ramírez-Loaiza  C.  2010.  Efecto  de  inductores  de  resistencia  sobre las sigatokas negra (Mycosphaerella fijiensis Morelet) y amarilla (Mycosphaerella musicola Leach) en plátano cultivariedad Dominico-Hartón. Trabajo de grado de Ingeniera Agrónoma. Programa de Agronomía. Facultad de Ciencias Agropecuarias, Universidad de Caldas. 53 p. [ Links ]
Rebollar-Alviter A., L.V. Madden & M.A. Ellis. 2005. Efficacy of azoxystrobin, pyraclostrobin, potassium phosohite, and mefenoxam for control of strawberry leather rot caused by Phytophthora cactorum. Plant Health Progress. http://www.plantmanagementnetwork.org/pub/php/research/2005/leather/; consulta: agosto de 2010. [ Links ]
Reuveni M., T. Zahavi & Y. Cohen. 2001. Controlling downy mildew (Plasmopara viticola) in field-grown grapevine with b-aminobutyric acid (BABA). Phytoparasitica 9(2):125-133. [ Links ]
Riveros A. S. 2001. Moléculas activadoras de la inducción de resistencia, incorporadas en programas de agricultura sostenible. Rev. Manejo Integrado de Plagas 61:4-11. [ Links ]
Ryals J., S. Uknes & E. Ward. 1994. Systemic acquired resistance. Plant Physiol. 104:1109-1112. [ Links ]
Schneider M., P. Schweizer, P. Meuwly & J.P. Métraux. 1996. Systemic acquired resistance in plants. Intern. Rev. Cytology 168:303-340. [ Links ]
Siemens D.H., H. Lischke, N. Maggiulli, S. Schürch & B.A. Roy. 2003. Costs of resistance and tolerance under competition: the defense-stress benefit hypothesis. Evolutionary Ecology 17:247-263. [ Links ]
Thao H.T.B. & T. Yamakawa. 2009. Phosphite (phosphorous acid): Fungicide, fertilizer or biostimulator? Soil Science and Plant Nutrition 55:228-234. [ Links ]
Recibido: 3 de febrero de 2012
Aceptado para publicación: 5 de diciembre de 2012













