Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales
Print version ISSN 0370-3908
Rev. acad. colomb. cienc. exact. fis. nat. vol.37 no.142 Bogotá Jan./Mar. 2013
FÍSICA
* Departamento de Física, Universidad del Valle, Calle 13 # 100-00, Cali, Colombia.
RESUMEN
Usando medidas de espectroscopia de impedancias en el rango de las radiofrecuencias en dos tipos de conductores protónicos con estructuras desordenadas, cristales iónicos con enlaces de hidrógeno desordenados (MH2PO4, M = NH4, K) y polímeros sólidos basados en poli alcohol de vinilo (PVOH), se ha investigado la dinámica de protones. Se encuentra que obedecen a similares características en los espectros de la conductividad, permitividad y módulo eléctrico complejos. En efecto, muestran una activación térmica de la conductividad tipo Arrhenius; sus conductividades son descritas a altas frecuencias (w/2p) por una ley de potencia wn, donde 0<n≤1 (Jonscher) y el módulo eléctrico en el dominio del tiempo sigue una función de decaimiento exponencial 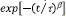 , donde t es un tiempo de relajación térmicamente activado, y 0<b<1 describe esa rapidez de los procesos de relajación como consecuencia del salto protónico.
, donde t es un tiempo de relajación térmicamente activado, y 0<b<1 describe esa rapidez de los procesos de relajación como consecuencia del salto protónico.
Palabras clave: polímeros, cristales iónicos, dinámica protónica, relajación eléctrica, comportamiento universal.
ABSTRACT
Using impedance spectroscopy measurements in the radio-frequency range in two types of proton conducting materials with disordered structure, ionic crystals with disordered hydrogen bonds (MH2PO4, M = NH4, K) and solid polymers based on poly (vinyl alcohol) (PVOH), the proton dynamics have been investigated. They display similar characteristics of their complex conductivity, permittivity and electric modulus spectra. Both materials show an Arrhenius-type thermally activated dc conductivity; their conductivities are described at high frequencies (w/2p) by a power-law dependency wn, where 0<n≤1 (Jonscher's law) and the electric modulus spectra follows in the time domain an exponential decay function 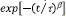 , where t is temperature activated and relaxation time, and 0<b<1 describes the slowing down of the relaxation process as a result of proton hopping.
, where t is temperature activated and relaxation time, and 0<b<1 describes the slowing down of the relaxation process as a result of proton hopping.
Key words: polymers, ionic crystals, proton dynamics, electrical relaxation, universal behavior.
1.Introducción
La conductividad protónica juega un papel muy importante en procesos tan diversos como la fotosíntesis de las plantas y la producción de electricidad en una celda de combustible de hidrógeno. Por consiguiente, el transporte y los fenómenos de transferencia de protones requieren de amplios estudios fundamentales bajo diferentes enfoques investigativos por científicos de materiales, químicos, físicos y biólogos. Desafortunadamente, los datos disponibles, aunque abundantes, son bien heterogéneos, y el entendimiento acumulado hasta el presente de los pasos elementales subyacentes, incluyendo sus mutuas dependencias, estas aún en sus inicios.
Se encuentra más allá del propósito de este artículo relacionar los sistemas materiales para los cuales se tenga referencia del transporte protónico incluyendo sus colisiones a altas energías que tienen lugar en los colimadores atómicos para investigar la estructura de la materia. Nuestro propósito en este trabajo se basa, más bien, en presentar y analizar resultados que hemos obtenido del estudio de la dinámica de protones en materiales iónicos con estructuras desordenadas, principalmente basados en polímeros y ácidos sólidos con hidrógenos estructurales.
Materiales poliméricos que sean conductores iónicos en estado sólido son materiales atractivos para desarrollar separadores electrolíticos, puesto que su estructura y morfología puede variarse en amplios rangos y por ende adaptarse a necesidades específicas Ellos pueden usarse en muchos dispositivos, tales como baterías, ventanas electrónicas, sensores químicos, celdas de combustible y supercondensadores (Yuanet al. 2011, Peighambardoustet al. 2010, Smolinka. 2009; Yang&Wu. 2009). En todas estas aplicaciones se necesitan altas conductividades iónicas para optimizar los electrolitos poliméricos y es por consiguiente, importante encontrar métodos para aumentar la conductividad iónica en la mezcla de diferentes tipos de precursores que intervienen en la síntesis del complejo polimérico. Además, los polímeros y los compósitos poliméricos han ganado una importancia cada vez más creciente en la tecnología que se requiere hoy para reducir la contaminación del medio ambiente y por ser considerados apropiados para desarrollar una electroquímica en estado sólido (Yang et al. 2008; Chenget al. 2007).
Entre los materiales poliméricos que han llamado la atención para desarrollar membranas que reúnan las propiedades de estabilidad térmica, mecánica y electroquímica para ser usados como separadores electrolíticos en estado sólido están los polialcoholes como el polialcohol de vinilo (PVOH) que es un polímero sintético, no tóxico, hidrofílico y biodegradable. Debido a estas excelentes propiedades y a su bajo costo, ha sido usado en diferentes áreas de investigación, desarrollo y producción que se extienden desde los campos de la técnica (textiles, empaques, celdas polares,cementos) (Lee et al.2009) hasta los de los biomateriales (Wanet al.2010) y aplicaciones médicas (Jianget al. 2011).
Nuestro programa de investigación en membranas poliméricas intercambiadoras de protones (PEMs) usando como polímero precursor macromoléculas de PVOH, se basa en la hipótesis de poner coordinar los grupos OH de las cadenas poliméricas con especies iónicas suministradas por sales y ácidos disueltos en la matriz polimérica con alto grado de hidrólisis (Vargaset al. 1999, 2000, 2001; Palacios et al. 2003; Zapata el al. 2007).
Las temperaturas de operación óptima de las membranas poliméricas hidratadas pueden incrementarse si materiales nanoestructurados como óxidos metálicos (esto es, TiO2, ZrO2 y SiO2), fosfatos metálicos (esto es, ZrP. TiP) o heteropoliácidos (HPA) se introducen en la estructura de la membrana(Yang. 2007). La naturaleza higroscópica de estos materiales o su porosidad, pueden ayudar a retener agua en la matriz, permitiendo así operaciones por encima de los 100°C, usualmente alrededor de 120-130°C. Estas combinaciones pueden también suministrar mayor estabilidad mecánica a las membranas de compositos poliméricos (Vargas et al.2011).
Otros materiales orgánicos, tal como el poli-benzimidazole (PBI), pueden usar ácidos como transportador de protones, como el H3PO4 en el caso del PBI, que permitan operar a más altas temperaturas que los hidratados, siendo este límite de aproximadamente 180°C para el PBI + H3PO4(Goñi-Urtiagaet al.2012).
Entre los materiales inorgánicos, que también son objeto de nuestro estudio y que son promisorios para desarrollar membranas intercambiadoras de protones, son los denominados ácidos sólidos (Norby. 1999), los cuales pueden operar a temperaturas intermedias (150-300°C). Estos materiales lo constituyen compuestos con hidrógenos estructurales, como los que pertenecen a la familia MxHy(AO4), (M=Li, K, Rb, Cs, NH4; A=S, Se, P, As), los heteropoliácidos y los pirofosfatos (Goñi-Urtiaga et al. 2012). Nuestro grupo de trabajo investiga los ácidos sólidos, en forma cristalina o formando compositas en las que se dispersan nanopartículas de óxidos metálicos, y de los cuales presentaré en este artículo algunos resultados recientes.
En el caso de los ácidos en soluciones acuosas como el ácido fosfórico (H3PO4), ácido sulfúrico (H2SO4) o ácido perclórico (HClO4), se disocian de acuerdo con su tasa de disociación protónica pKa, generando protones hidratados y por consiguiente conductividad protónica. Sin embargo, compuestos con hidrógenos estructurales como los sulfatos, arsenatos y fosfatos, exhiben en estado anhídrido conducción protónica a temperaturas intermedias (T≥150°C). Estos compuestos consisten usualmente de un metal alcalino (o NH4) y cadenas de oxianiones tetraédricas, enlazados entre sí por puentes de hidrógeno. La fórmula general es MxHy(AO4), (M=Li,K,Rb, Cs, NH4; A=S, Se, P, As). Estos materiales exhiben baja conducción protónica a temperatura ambiente pero por encima de ciertas temperaturas, la conducción protónica se crece por varias órdenes de magnitud.
En la Tabla 1 se ilustra la conductividad eléctrica de un número de materiales conductores de protones y otros iones y sus correspondientes temperaturas de operación, principalmente para su uso en celdas de combustible.
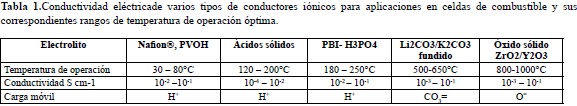
Resumiendo, los materiales que pueden usarse como conductores protónicos para desarrollar membranas intercambiadoras de protones (PEM) se dividen en dos grandes grupos principales: materiales orgánicos o inorgánicos. Sin embargo, se ha inferido de varios estudios (Matosa et al. 2011), que la mezcla de componentes inorgánico/orgánico ofrece una sinergia para combinar las ventajas técnicas de cada material con el objetivo de formar membranas híbridas o compositosnan o estructurados con propiedades mejoradas.
Aunque se ha estudiado el efecto de los grupos funcionales o de las nanopartículas inertes de óxidos cerámicos en las propiedades macroscópicas (bulto) de los compositos poliméricos o cristalinos, es poco lo que se conoce de la dinámica, esto es, de las escalas de tiempo y longitud de los movimientos moleculares que expliquen la respuesta fisicoquímica de estos materiales. Esta información es importante a medida que nuestro objetivo sea el uso de los conceptos de una física a nanoescala para explicar su comportamiento macroscópico.
El objetivo de nuestro estudio es analizar el efecto de las variables moleculares que incluyen el tipo, la concentración, la arquitectura de los los grupos funcionales o de las nanopartículas inertes, así como las características de la matriz polimérica o de la estructura cristalina del material hospedero en los aspectos dinámicos de las compositas resultantes. Para nuestro conocimiento, el uso de las técnicas de espectroscopia de relajación dieléctrica y de conducción iónica ha sido poco usada investigar del efecto de la arquitectura molecular de la fases que intervienen en una composita.
2. Marco teórico
2.1. Permitividad, conductividad y pérdidas dieléctricas:
La respuesta eléctrica de un material se describe básicamente por las ecuaciones de Maxwell, en especial la relacionada con la densidad de corriente total dependiente del tiempo, 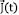 ,
,

donde 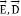 son el campo eléctrico externo y el vector de desplazamiento eléctrico, respectivamente, relacionados por
son el campo eléctrico externo y el vector de desplazamiento eléctrico, respectivamente, relacionados por

donde e0 es la permitividad dieléctrica del vacío (=8.854Ã10-12 Mm-1) y e* la permitividad relativa del material.
Tomando la transformada de Fourier de la Ec.(1), obtenemos:
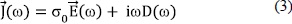
O en término de la susceptibilidad eléctrica, c*, teniendo en cuenta que, la parte real y la parte imaginaria de la permitivitidad relativa, e* = e' - e'', son respectivamente,
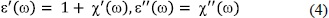
Con lo cual, las Ecs. (2) y (3) se convierten en:
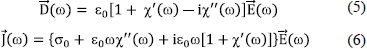
En la Ec. (6), solamente el componente de 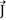 en fase con
en fase con 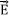 contribuye a la pérdida de potencia debido al efecto Joule, de tal forma que nos referimos a c'' como la pérdida dieléctrica. Además, por la ley de Ohm,
contribuye a la pérdida de potencia debido al efecto Joule, de tal forma que nos referimos a c'' como la pérdida dieléctrica. Además, por la ley de Ohm, 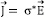 , donde
, donde 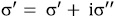 es la conductividad compleja, obtenemos
es la conductividad compleja, obtenemos
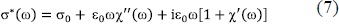
O, en término de la permitividad eléctrica, Ec. (4),
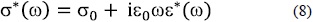
Sin ambargo, un impedancímetro mide la respuesta eléctrica de un material iónico, que para una configuración de caras paralelas delgadas, (d<< A1/2), M l material iónico l M (M= electrodo metálico), la impedancia 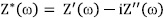 se obtiene de la función respuesta
se obtiene de la función respuesta

donde V = Ed y I= JA. Además, la conductividad compleja se obtiene de la admitancia Y*(w) = 1/Z*(w), que en término del espectro de impedancias llega a ser
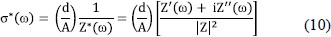
Además, usando la Ec. (8), la permitividad eléctrica relativa, se calcula de
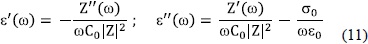
donde CO, capacitancia del condensador vacío.
2.2 Módulo eléctrico
Una imagen en el dominio del tiempo de los efectos de correlación en la relajación de la conductividad con la frecuencia puede obtenerse del formalismo del módulo eléctrico, el cual describe la relajación del campo eléctrico 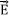 a un vector de desplazamiento constante,
a un vector de desplazamiento constante, 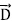 (Rivera et al. 2001). Por otra parte, en el dominio de la frecuencia, el módulo eléctrico complejo, M*(Bw), definido por el inverso de la Ec. (2), o sea por
(Rivera et al. 2001). Por otra parte, en el dominio de la frecuencia, el módulo eléctrico complejo, M*(Bw), definido por el inverso de la Ec. (2), o sea por 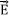 = M*
= M*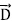 puede obtenerse de los datos de impedancia mediante la expresión:
puede obtenerse de los datos de impedancia mediante la expresión:
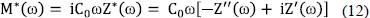
El factor de pérdida, tand se define como:
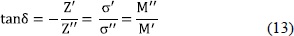
Los efectos de correlación en el salto de los iones, como respuesta a las señales eléctricas, se describen mediante una función de decaimiento del campo eléctrico F(t), la cual se obtiene del espectro del módulo (Ec. 12), ajustándolo a (Rivera et al. 2001):
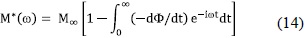
donde M∞ es el inverso de la permitividad eléctrica a altas frecuencias, 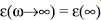 . Funciones de decaimiento exponencial estiradas tipo Kohlrausch-Williams-Watts (KWW), de la forma
. Funciones de decaimiento exponencial estiradas tipo Kohlrausch-Williams-Watts (KWW), de la forma
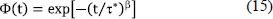
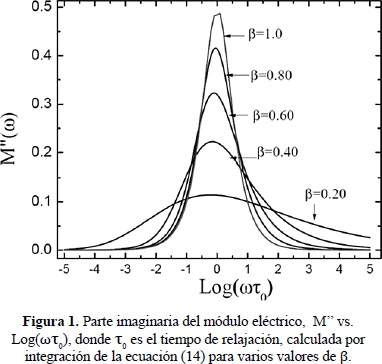
se han obtenido mediante el ajuste de datos del módulo dependiente de la frecuencia a la ecuación (14). t* es un tiempo de relajación activado térmicamente y 1<b<1. El parámetro exponcial de estiramiento b describe la disminución del proceso de relajación como resultado de la correlación en el salto de los iones, (Rivera et al. 2001), tal que uno espera que sea cercano a cero movimientos iónicos fuertemente correlacionados y uno para saltos aleatorios tipo Debye.
Para el caso no correlacionado de Debye, cuando los saltos iónicos no están correlacionados b=1, entonces la Ec. (15) es , 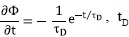 = tiempo de relajación de Debye,
= tiempo de relajación de Debye,
Con lo cual, reemplazando en la Ec.(14), obtenemos
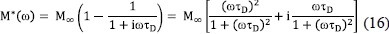
En la Figura 1 se ilustra la variación con la frecuencia de la parte imaginaria del módulo eléctrico para varios valores del exponente b.
Utilizando la relación entre la conductividad y el módulo eléctrico (combinando las ecuaciones (10) y (12), se puede obtener la respuesta en el formalismo de la conductividad del caso no correlacionado b=1:
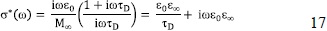
Esta ecuación muestra como en el caso de que la respuesta del campo eléctrico sea una exponencial pura, la parte real de la conductividad es independiente de la frecuencia y toma el valor:

3.Métodos experimentales
3.1. Características estructurales de los materiales
El PVOH consiste de unidades monoméricas con grado de polimerización n:
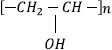
en las que la estereoregularidad del grupo OH a lo largo de la cadena principal genera diferentes combinaciones poliméricas (Ram& Mandal. 2004), esto es, cuando todos los grupos OH se ubican en el mismo lado del plano de las cadenas poliméricas (isotáctico); o alternándose (sindiotáctico); o en forma aleatoria (atáctico). Estudios previos (Ram& Mandal. 2004), presentan fuertes indicios de que bajo condiciones favorables la distribución secuencial de los grupos OH a cada lado de la cadena principal se puede explorar para diseñar un puente regular con moléculas de H2O en una estructura de capas.
La absorción de agua en el PVOH es una de las importantes características que determinan sus propiedades fisicoquímicas y sus aplicaciones. En membranas de PVOH-H3PO2-H2O, hemos inferido que contienen cavidades nanométricas capaces de absorber gran cantidad de electrolito (H3PO2 +H2O). Como en el caso del Nafion®, que es un polímero de ácido perfluorosulfónicodesarrollado por la compañía DuPont y ampliamente usado como PEM, el nuestro basado en PVOH, tiene una buena conducción protónica y buenas propiedades mecánicas.
En el Nafion®, se cree que tiene lugar un mecanismo de conducción protónica llamado "mecanismo vehicular (Kreuer. 1996). El protón se difunde junto con un vehículo (como H3O+) donde la difusión opuesta de un vehículo no protonado (H2O) permite el transporte neto de protones. En este polímero, la trayectoria de conducción para protones se forma entre grupos ácidos laterales (esto es, - HSO3-) unidos a la cadena perfluorinada del polímero (Kreuer. 1996). Durante la absorción de agua, el grupo ácido se ioniza y atrae las moléculas de H2O para formar inicialmente cavidades rodeadas de grupos (-SO3-) de dimensiones nanométricas donde se ubica el agua absorbida. El resto de red polimérica formada por una columna hidrofóbica de politetrafluoroetileno (PTFE) mantiene la estructura o estabilidad mecánica de la membrana. Cuando, debido a la absorción de agua, el polímero llega a una densidad volumétrica crítica, estas regiones nanométricascomienzan a interconectarse entre sí y forman una ruta continua para la conductividad protónica y la difusión de las moléculas de H2O a través de la membrana (fenómeno denominado percolación). Una separación de fases nanoestructuradas por las membranas de ácidos perflurosulfonicos (PFSA) hidratados con un promedio del diámetro de los regiones entre 3 y 6 nm han sido validadas experimentalmente a través de varios métodos como por ejemplo dispersión con neutrones a pequeños y amplios ángulos (SANS), así como por rayos X (SAXS) Kusoglu et al. 2010. Aunque al respecto no existe un consenso entre los investigadores sobre el tamaño y forma de los canales que interconectan las regiones. Es claro, sin embargo, que se requiere, o bien una fase hidrofílica continua o que percola a través de la matriz polimérica, similar a una estructura porosa, para explicar el mecanismo de transporte de carga asistido por la presencia de agua, que explique la conductividad iónica en las membranas PFSA.
En las membranas basadas en PVOH, creemos que también se forman regiones en la matriz polimérica coordinadas con sus grupos OH en las que se segregan fases o regiones líquidas ricas en H3PO2 + H2O, que se interconectan para grandes cantidades de agua y ácido, y explicar así, por un fenómeno de percolación, a partir de una concentración crítica de estos componentes en el polímero, similar a lo que se asume ocurre en el Nafion®. Por lo tanto, el mecanismo de transporte protónico en estas membranas, también es el vehicular (Vargas et al. 1999).
Las temperaturas de operación óptima de las membranas poliméricas hidratadas pueden incrementarse si materiales nanoestructurados como óxidos metálicos (esto es, TiO2, ZrO2 y SiO2), fosfatos metálicos (esto es, ZrP. TiP) o heteropoliácidos (HPA) se introducen en la estructura de la membrana. La naturaleza higroscópica de estos materiales o su porosidad, pueden ayudar a retener agua en la matriz, permitiendo así operaciones por encima de los 100°C, usualmente alrededor de 120-130°C. Estas combinaciones pueden también suministrar mayor estabilidad mecánica a las membranas de compositos poliméricos (Matosa et al.2011¸ Morita et al. 2006; Hasani-Sadrabadi et al. 2009)
Un nivel de desorden estructural diferente a las de los materiales poliméricos puede distinguirse en los materiales cristalinos. En un sólido iónico con ordenamiento cristalino perfecto, es imposible la difusión de carga. Sin embargo, existen cristales iónicos con subredes estructuralmete desordenadas como el a-AgI (T> 147°C) con alta conducción iónica en estado sólido (Funke&Banhatti. 2006). En nuestro grupo de trabajo desarrollamos un programa de investigación en los denominados ácidos sólidos, los cuales pueden operar como excelentes conductores protónicos sólidos a temperaturas intermedias (150-300°C). Estos materiales son perfecto, es imposible la difusión de carga. Sin embargo, existen cristales iónicos con subredes estructuralmete desordenadas como el a-AgI (T> 147°C) con alta conducción iónica en estado sólido (Funke&Banhatti. 2006). En nuestro grupo de trabajo desarrollamos un programa de investigación en los denominados ácidos sólidos, los cuales pueden operar como excelentes conductores protónicos sólidos a temperaturas intermedias (150-300°C). Estos materiales son compuestos con hidrógenos estructurales como los sulfatos, arsenatos y fosfatos, y consisten usualmente de un metal alcalino(o NH4) y cadenas de oxianiones tetraédricas, enlazados entre sí por puentes de hidrógeno. La fórmula general es MxHy(AO4), (M=Li,K,Rb, Cs, NH4; A=S, Se, P, As) [4]. Contrario al caso de los ácidos en soluciones acuosas como el ácido fosfórico (H3PO4), ácido sulfúrico (H2SO4) o ácido perclórico (HClO4), los cuales se disocian de acuerdo con su tasa de disociación pKa, generando protones hidratados, los ácidos sólidos exhiben en estado anhídrido conducción protónica a temperaturas intermedias (T≥150°C).
Los compuestos cristalinos exhiben baja conducción protónica a temperatura ambiente, e inclusive ordenamiento polar a bajas temperaturas, pero por encima de ciertas temperaturas, la conducción protónica crece por varias órdenes de magnitud. Hay una disputa en la literatura con relación al mecanismo por el cual este cambio de conducción protónica. Nuestro grupo de trabajo (Ortiz et al. 1999; Ortiz et al. 2006; Jurado et al. 2012) y Lee (Lee. 1996), explicamos este aumento en la conducción por reacciones de deshidratación que se inicia en sitios localizados en la superficie del material y luego se prolonga hacían su interior al aumentar la temperatura. El agua generada es responsable de la movilidad de protones a través del material electrolítico. El mecanismo que proponemos es el siguiente:
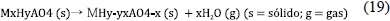
Otros autores, tales como Baranov (Baranov et al. 1982) atribuyen este aumento de la conductividad a un cambio de fase en el volumen del material. De acuerdo con este modelo, a temperaturas por encima de 130°C (dependiendo de su composición química), el material experimenta un cambio estructural a una fase estable a altas temperaturas. En esa fase "superprotónica", los grupos oxianiónicos adquieren altos grados de libertad rotacionales en la red cristalina. Esto conduce a un desorden en los enlaces de hidrógeno entre los grupos aniónicos, a causa de un nuevo arreglo de la red, permitiendo más combinaciones de posibles enlaces de hidrógeno, lo que resulta en la formación de una ininterrumpida trayectoria para la migración de protones de sitios ocupados a otros desocupados (saltos de protones). Este mecanismo es frecuentemente llamado "el mecanismo de Grotthus" (Kreuer. 1996). Este mecanismo se diferencia del vehicular en que la conducción se logra por saltos de protones entre oxianiones en lugar de una conducción por un solvente protónico.
Como en el caso de los membranas poliméricas, también preparamos compositos nanoestructurados mediante la dispersión de nanopartículas cerámicas (TiO2, ZrO2 y SiO2) en la matriz volumétrica, observando, en general que la concentración del dispersor y su naturaleza (morfología, tamaño) juegan un papel crucial en la conductividad del composito(Vargas et al. 2011). También se observan modificaciones en el comportamiento de las fases como función de la temperatura.
Una descripción detallada de la preparación de las muestras se presenta en las referencias (Vargas et al. 2011) para las membranas poliméricas y en las referencias (Jurado et al. 2012) para las cristalinas.
3.2. Técnicas experimentales
Las medidas de espectroscopía de impedancias han sido realizadas usando los medidores LCR (inductancia, capacitancia, resistencia) de alta presición HP4284A y HP4285A, controlados automáticamente, en el rango de frecuencia enter 20 Hz y 20 Mhz y para temperaturas por encima del ambiente hasta 400°C. Las muestras fueron en forma de membranas circulares de 10 mm de diámetro y alrededor de 1-1.5 mm de espesor, en cuyas caras se depositaron electrodos de plata. Las medidas fueron relizadas bajo una atmósfera de nitrógeno para asegurar un ambiente inerte. Más detalles de las medidas de impedancia en sistemas iónicos se discuten en la referencia (Zapata el al. 2012).
La caracterización térmica de las muestras se realizaron con las técnicas usuales de calorimetria de barrido diferencial en la opción mudulada (MDSC) usando un equipo TA Instruments modelo Q100, así como de análisis termogravimétrico (TGA) (usando un equipo TA Instruments modelo 2050. Las medidas se realizaron bajo un flujo de nitrógeno de 50 ml/min. Las caracterizaciones estructurales se relaizaron por difracción de rayos X, usando un difractómetro X'Pert de Panalytical, con filtro de Níquel y radiación Cu-Ka1 = 1.5406 nm.
4. Resultados y discusión
4.1. Membranas poliméricas basadas en PVOH.
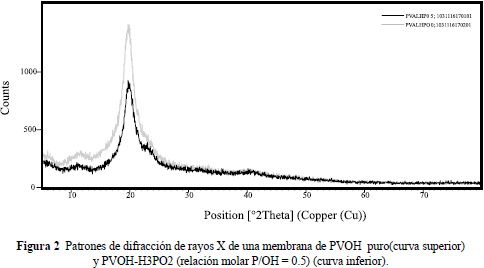
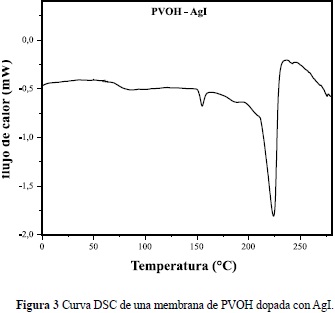
La Figura 2 muestra los patrones de difracción de rayos X, tomado a temperatura ambiente, de una membrana preparadade PVOH puro (espectro superior) y otra con PVOH-H3PO2 en la relación molar P/OH = 0.5 con contenidos de agua menor que el 10% en peso (espectro inferior). Se observa claramente el carácter amorfo de las membranas, siendo evidente solo un pico amplio alrededor de 2q» 20°, indicando cierto grado de cristalinidad en los polímeros. Sin embargo, la altura de este pico disminuye para la membrana con ácido, indicando su mayor grado de amorficidad. Los resultados de análisis térmico de una membrana basada en PVOH y AgI se muestra en la Figura 3, donde se identifica claramente un evento térmico en forma de escalón alrededor de 70°C asociado a la transición vítrea del polímero, seguida de un pequeño pico endotérmico cerca de 150°C atribuible a la transición estructural del AgI de la fase hexagonal a la cúbica y, finalmente, un gran pico endotérmico que se inicia cerca de 200°C debido a la fusión de la parte cristalina del polímero y discutido pata membranas con composición similar en la referencia (Fernández et al. 2005).
La figura 4 muestra un espectro típico de impedancias, 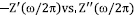 (diagrama de Nyquist) para una muestra de PVOH-H3PO2 con una fracción molar de P/ OH = 0.10, registrado a 30 y a 150°C (recuadro), entre 10 Hz y 10 MHz. Nótese que el espectro tomado a 30°C muestra claramenteun una variación lineal a bajas frecuencia que decrece monotónicamente con con el aumento de la frecuencia, seguido de un arco de circunferencia a altas frecuencias. Este es un comportamiento que frecuentemente se observa en la respuesta eléctrica en materiales iónicos con estructuras desordenadas, incluyendo cristales, vidrios y complejos poliméricos (Funke&Banhatti, 2006). La parte lineal del espectro a bajas frecuencias se debe a los procesos de transferencia de carga entre las superficies intefaciales de los electrodos (metal) con ambas caras de la muestra; mientras que el parte circular del espectro está relacionada con los procesos de conducción en el volumen de la muestra. Es importante enfatizar que el comportamiento de la impedancia observado a bajas frecuencias cambia ligeramente cuando se usan electrodos de metales diferentes (oro, platino,acero, plata, acero inoxidable), pero la respuesta eléctrica volumétrica de la muestra y su intercepto con el eje real es esencialmente constante. La conductividad dc de la muestra se obtiene del intercepto del arco con el eje real, usando la Ec.(10) para Z'' = 0, esto es, sdc = (d/A)Z'-1.
(diagrama de Nyquist) para una muestra de PVOH-H3PO2 con una fracción molar de P/ OH = 0.10, registrado a 30 y a 150°C (recuadro), entre 10 Hz y 10 MHz. Nótese que el espectro tomado a 30°C muestra claramenteun una variación lineal a bajas frecuencia que decrece monotónicamente con con el aumento de la frecuencia, seguido de un arco de circunferencia a altas frecuencias. Este es un comportamiento que frecuentemente se observa en la respuesta eléctrica en materiales iónicos con estructuras desordenadas, incluyendo cristales, vidrios y complejos poliméricos (Funke&Banhatti, 2006). La parte lineal del espectro a bajas frecuencias se debe a los procesos de transferencia de carga entre las superficies intefaciales de los electrodos (metal) con ambas caras de la muestra; mientras que el parte circular del espectro está relacionada con los procesos de conducción en el volumen de la muestra. Es importante enfatizar que el comportamiento de la impedancia observado a bajas frecuencias cambia ligeramente cuando se usan electrodos de metales diferentes (oro, platino,acero, plata, acero inoxidable), pero la respuesta eléctrica volumétrica de la muestra y su intercepto con el eje real es esencialmente constante. La conductividad dc de la muestra se obtiene del intercepto del arco con el eje real, usando la Ec.(10) para Z'' = 0, esto es, sdc = (d/A)Z'-1.
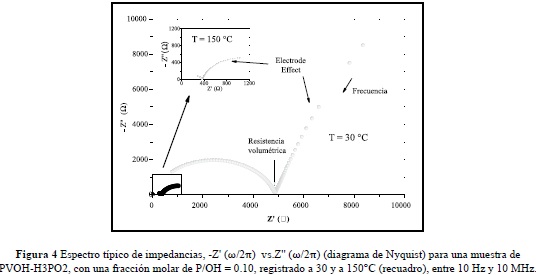
En el espectro tomado a 150°C para la misma muestra, mostrado en el recuadro de la figura 4, se observa que el intercepto con el eje real se reduce varios órdenes de magnitud, además de que predomina el efecto de los electrodos hasta frecuencias más altas, indicando el rápido incremento de la conductividad dc con la temperatura.
En la figura 5, se grafican los datos para varias isotermas entre 30 y 100°C, de la parte real de la conductividad como función de la frecuencia, f = w/2p, en una escala dole logarítmica, para la misma muestra P/OH = 0.10. Todas los gráficos se caracterizan por una región dispersiva a bajas frecuencias que corresponde a los efectos de los electrodos, seguida por una región plana o poca dispersiva a frecuencias inermedias, y por último, una región con un crecimiento potencial de la conductividad con el aumento de la frecuencia.Las líneas punteadas son una guía a los ojos para identifican los diferentes cambios de régimes de la variación de la conductividad con la frecuencia a medida que aumenta la temperatura de la muestra. La respuesta eléctrica en el volumen de la muestra (esto es, a frecuencias intermedias y altas, que corresponden a las regiones planas y las dependientes como una ley de potencia, respectivamente) son frecuentemente descritas para materiales con estructuras desordenadas por la expresión fenomenológica de Jonscher (Jonscher, 1996):
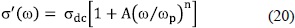
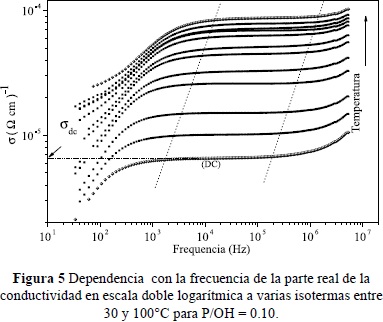
El exponente n varía entre 0.0 y 1.0 y está relacionado con el parámetro exponcial de estiramiento b = 1-n (Ec. 14), cuyo valor indica el grado de correlación de los saltos iónicos; ùP es una frecuencia característica que marca el cruce a la región potencial; sdc es la conductividad dc de la muestra, y A un parámetro de ajuste del orden de 1 que varía poco con la temperatura. En consecuencia, las leyes de potencia en 1la conductividad ac han sido atribuidas a un mecanismo de salto no aleatorio que resulta de las interacciones de muchos cuerpos entre las cargas móviles.
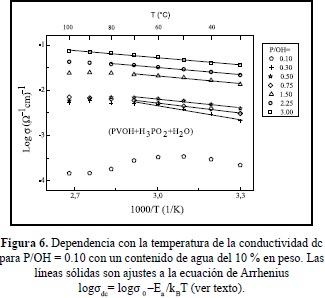
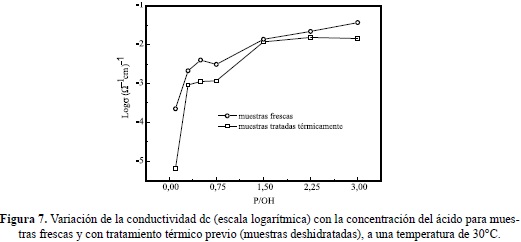
En la figura 6 se presenta la dependencia con la temperatura de la conductividad dc de varias muestras con varias concentraciones de ácido y con contenido de agua de 10% en peso. Basados en análisis de los datos por mínimos cuadrados, líneas rectas ajustan bien (excepto para la muestra con la más baja concentración, P/OH = 0.10) los gráficos de Arrhenius, log sdc vs 1000/T, si se seleccionan segmentos de datos a bajas temperaturas para cada muestra (el punto final el alrededor de 70°C para las más bajas concentraciones, 80°C para la de P/OH = 2.25 y 100°C para la de P/OH= 3.0). Las energías de activación, Ea, calculada del ajuste de los datos a la ecuación de Arrhenius logsdc = logs0-Ea/kBT (kB=constante de Boltzmann, T=temperatura absoluta) se ubican entre 0.20 eV (para P/OH = 0.20) y decrece con el contenido de ácido hasta 0.10 eV ( para P/OH = 3.00). Nótese también al rápido crecimiento de la conductividad dc con la concentración del ácido. El cambio de pendiente a valores más bajos, observado en los diferentes gráficos a altas temperaturas es atribuible a la pérdida de agua en las muestras, como lo comprueban análisis de termogravimetríaen muestras similares (Fernández et al. 2006) La figura 7 muestra la dependencia de la conductividad dc con la concentración del ácido, tanto para muestras sin tratar previamente (frescas) como las tratadas térmicamente para deshidratarlas, notándose el rápido incremento de la conductividad con el contenido del ácido para ambas series de muestras.
En la figura 8 se presenta el espectro de la parte real de la conductividad para una muestra deshidratada con contenido de ácido bajo, P/OH = 0.075, en un amplio rango de temperatura, entre -100°C y 100°C. Se observa que, cuando la temperatura decrece, el exponente n crece hacia 1.0. Este régimen, conocido como de "perdidas constantes", que ha sido previamente observado en otros materiales (Funke & Banhatti, 2006), y aunque su origen no se entiende bien, parece estar relacionado a la vibración de los iones dentro de su pozo de potencial.
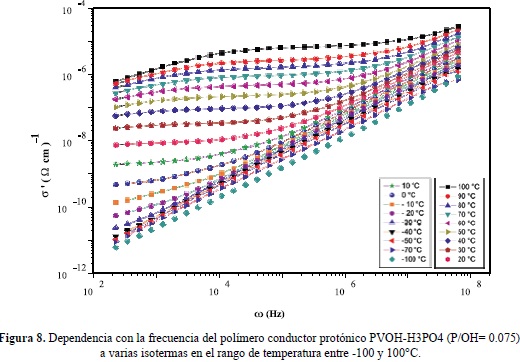
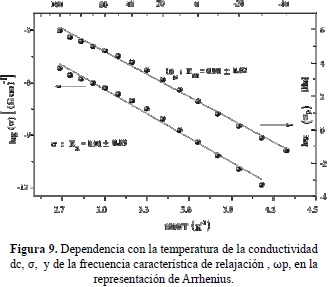
En la figura 9 se comparan el comportamiento de Arrhenius de la conductividad dc y la frecuencia característica de relajación, wp, para la misma muestra deshidratada con contenido de ácido bajo, P/OH = 0.075 (ajustando los datos a la expresión (20) de Jonscher (Jonscher, 1996) en el rango de temperatura, entre -40 y 100°C. Se observan energías de activación similares para ambos procesos, del orden de 0.90 eV, indicando que los el transporte iónico a largo alcance (conductividad dc) y la relajación de la conductividad o las corralaciones entre los iones móviles, obedecen al mismo mecanismo, esto es, al salto de los iones entre sitios disponibles en la matriz polimérica y a sus interacciones con las cadenas poliméricas. Los valores de exponente fraccionario n, que describe el comportamiento de la conductividad a altas frecuencia fueron del mismo orden, con un valor de 0.65 aproximadamente, verificando que las correlaciones iónicas son similares en el rango de temperatura considerado.
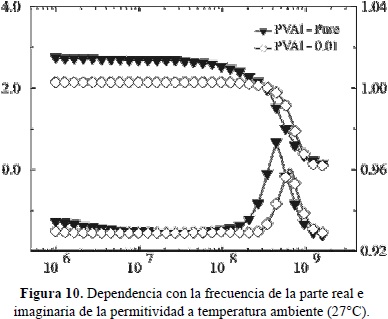
Los fenómenos de relajación dieléctrica, observable en la parte imaginaria de la permitivida (Ec. 11) como un pico, los cuales son originados por correlaciones dipolares inducidas por el campo eléctrico externo, son frecuentemente apantallados en este tipo de materiales iónicos de alta conducción, debido a la fuerte contribución de la conductividad dc, explicable por el último término de la Ec. (11). Hemos, sin embargo, observado relajación dieléctrica en una muestra de PVOH puro y con una concentración baja, de solo 0.01 de AgI, por lo tanto de conductividad dc baja. El espectro dieléctrico a temperatura ambiente, representado por la parte real e imaginaria de la permitividadse presenta en la Figura 10. Se observa un pico de relajación en e'' entre 108 y 109 Hz, que se desplaza ligeramente a más altas frecuencias para el polímero dopado con la sal. Estos procesos de relajación dipolar a altas frecuencias en los polímeros (relajación b) es debido a movimientos localizados de las cadenas poliméricas. Espectros similares en la lapermitividad dieléctrica del sistema polimérico PVOH-CF3COONH4 fueron publicados previamente por nuestro grupo de trabajo (Castilloet al. 2009).
4.2. Compuestos cristalinos basados en sales hidrogenadas
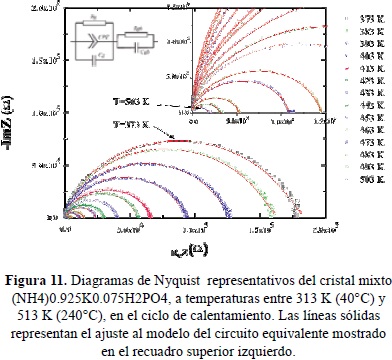
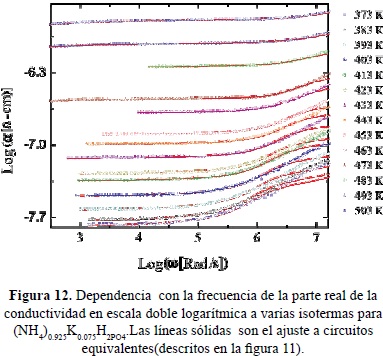
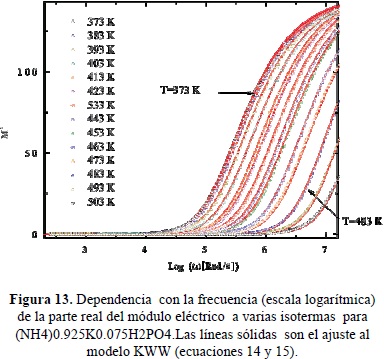
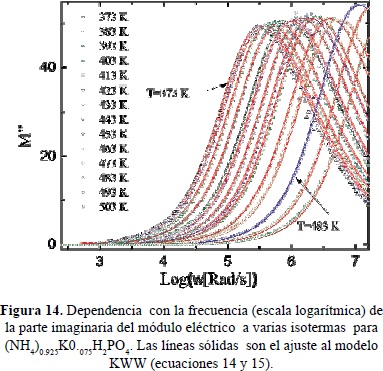
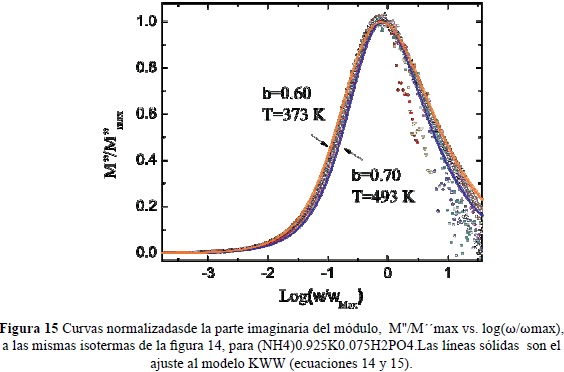
En la Figura 11 se presentan gráficos de Nyquist típicos del espectro de impedancias de (NH4)0.925K0.075H2PO4 tomados a varias temperauras entre 100 y 330°C. Las curvas continuas corresponden a ajustes a un circuito equivalente mostrado en la figura (Castillo. 2012). En la Figura 12 se muestran en una escala doble logarítmica, la parte real de la conductividad como función de la frecuencia, a varias isotermas en el mismo rango de temperatura. Las líneas continuas son ajustes, usando los modelos de circuítos equivalentes que describen los espectros de impedancias mostrados en la Figura 11. En la figuras13 y 14 se muestran las partes real e imaginaria del módulo eléctrico como función de la frecuencia en una escala logarítmica, a varias isotermas Se observan picos de relajación atribuibles a las correlaciones de los saltos iónicos durante el transporte de carga. Las líneas sólidas representan los ajustes a los datos experimentales utilizando la expresión tipo KWW de las ecuaciones (14) y (15). En la Figura 15 se comparan los diferentes picos de relajación observables en M'' al escalar los datos a M''/M''max contra w/wmax, observándose ligeras variaciones del exponente b con la temperatura asociada a la transición de fase del material cerca de 180°C (Jurado et al. 2000).
Las curvas de dispersión de la respuesta dieléctrica de los compuestos hidrogenados cristalinos, también las hemos observado en trabajos previos (Diosa et al. 2004, 2005, 2006, Checa et al.2009) como picos en la parte imaginaria de la permitividad corregida, e''corr, Estas relajaciones dipolares pueden ser debidas al salto del protón H+ y a la reorientación de los grupo PO3-, lo cual causa distorsión y cambio en la polarisibilidad local de la red induciendo cierto tipo de dipolos H2PO4-.
5. Conclusiones
En este trabajo hemos investigado la existencia e importancia de los efectos de correlación protón-protón y protón-red en la relajación de la conductividad eléctrica en dos tipos de materiales con diferentes niveles de desorden estructural, esto es, en conductores poliméricos basados en PVOH y en cristales iónicos basados en sales hidrogenadas del tipo MH2PO4 (M = NH4, K).Las fases sólidas presentes en los materiales como función de la temperatura fueron caracterizadas por análisis térmico y estructural. Los análisis de los resultados relacionados con la respuesta eléctrica de ambas clases de conductores protónicos muestran características similares en sus espectros de impedancias, cuando se analizan en la representación más apropiada según el comportamiento eléctrico predominante: conductividad, permitividad o módulo eléctrico complejos. Al analizar el transporte protónico de largo alcance (conductividad dc), ambos grupos de materiales muestran similares energías de activación siguiendo un modelo de Arrhenius (menores que 1.0 eV)Análogamente, sus conductividades ac se caracterizan a altas frecuencias por una dependencia como una ley de potencia, ùn, con un exponente fraccionario 0≤n≤1.0, el cual se asocia con el grado de correlación de los saltos protónicos. El paso de una amplia región no dispersiva en frecuencia (conductividad dc) a la región con dispersión potencial, determina una frecuencia característica de relajación, wp, Esta frecuencia de corte resulta activada térmicamente como la conductividad dc, con energías de activación del mismo orden, indicando mecanismos similares en los procesos de transporte protónico de largo y corto alcance en ambos materiales, esto es, saltos del protón. En el domino del tiempo, usando la representación del módulo eléctrico, se obtiene una función de decaimiento del campo eléctrico , que para ambos sistemas llega a ser de la forma exp[–(t/t*)b], siendo b=1-n, y t* un tiempo de relajación medio, también activado térmicamente. Se encuentra de igual forma que variaciones de estos parámetros en función de la temperatura se asocian a cambios de fases en los materiales estudiados. En resumen, se ha demostrado un comportamiento "universal" en la respuesta eléctrica asociada al salto de los protones en dos tipos de conductores diferentes, lo que sugiere fuertemente que la activación térmica de su conducción protónica tanto de largo como de corto alcance obedece al mismo tipo de correlaciones protón-protón y protón-red (cadenas poliméricas).
Referencias
Baranov A.I., Shuvalou L.A., Schagina N.M. (1982). Superionic conductivity and phase transitions in CsHSO4 and CsHSeO4. Journal of Experimental and Theoretical Physics Letters 36:459-462. [ Links ]
Castillo J., Chacón M., Castillo R., Vargas R. A., Bueno P. R. , Varela J. A. 2009. Dielectric relaxation and dc conductivityon the PVOHCF3COONH4 polymer system. Ionics 15: 537-544. [ Links ]
Castillo R. 2012. Estudio de relajación dieléctrica en cristales mixtos de (NH4)1-xKxH2PO4. Tesis de doctorado en Ciencias-Física, Universidad del Valle. [ Links ]
Checa O., Diosa J.E., Vargas R.A., Santamaría J. 2009. Dielectric relaxation of CsHSeO4 above room temperature. Solid State Ionics 180: 673-676. [ Links ]
Cheng X., Shi Z., Glass N., Zhang L., Zhang J., Song D., Liu Z.-S., Wang H., Shen J. 2007. A review of PEM hydrogen fuel cell contamination: Impacts, mechanism and mitigation". Journal of Power Sources 165: 739-756. [ Links ]
Diosa J. E., Vargas R.A., Albinsson I., Mellander B. E.2004. Dielectric relaxation in single crystal NH4H2PO4 in the high-temperature regime. Solid State Communications 132: 55-58. [ Links ]
Diosa J. E., Vargas R.A., Albinsson I., Mellander B. E. 2005.Dielectric relaxation of KHSO4 above room temperature. Solid State Ionics 176: 2913-2916. [ Links ]
Diosa J. E., Vargas R.A., Albinsson I., Mellander B. E. 2006. Dielectric relaxation in NH4HSO4 above room temperature. Solid State Ionics 177: 1107-1110. [ Links ]
Fernández M.E., Delgado I., Diosa J.E. , Vargas R.A. 2005. Thermal and transport properties of the polymer electrolyte base donpoly(vinyl alcohol)-LiOH-H2O. phys. stat sol. (c) 2: 3738-3741. [ Links ]
FunkeK..Banhatti R.D. 2006.Ionic motion in materials withdisordered structure. Soli State Ionics 177: 1551-1557. [ Links ]
Goñi-Urtiaga A., Presvytes D., Scott K. (2012). Solids acids as electrolytes materials for proton exchange membrane (PEM) electrolysis: Review. International Journal of Hydrogen Energy 37: 3358-3372. [ Links ]
Hasani-Sadrabadi M. M., Ghaffarian S. R., Mokarram-Dorri N., Dashtimoghadama E., Majedi F. S. 2009.Characterization of Nanohybrid membranes for direct methanol fuel cell applications". Solid State Ionics 180: 1497-1504. [ Links ]
Jiang S., Lin S., Feng W. (2011). Journal of the Mechanical Behavior of Biomedical Materials 4:1228-1233. [ Links ]
Jonscher A. K. (1966). Universal Relaxation Law. Chelsea Dilectrics Press, London. [ Links ]
Jurado J.F., García A., Vargas R.A. 2000. High Temperature phase transition in K1-x(NH4)xH2PO4. Solid Stae Ionics 136-137: 985-989. [ Links ]
Kreuer K.-D. 1996. Proton conductivity: Materials and Applications. Chemistry of Materials 8:610-641. [ Links ]
Kusoglu A., Karlsson A.M., Santare M. H. (2010). Structure property relationship in ionomer membranes. Polymer 51: 1457-1464. [ Links ]
Lee B.Y., Kim J-K., Kim J-Su., Kim Y.Y. (2009). Quantitave evaluation technique of polyvinyl alcohol (PVOH) fiber dispersion in ingineeredcementius composites. Cement and Concrete Composite 31: 408-417. [ Links ]
Lee K-S. (1996). Hidden nature of hightemperature phase transitions on crtistals of KH2PO4 type: is it a physical change? Journal of Physico-Chemical Solids 57: 333-342-. [ Links ]
Matosa B.R., Santiago E.I., Reyb J.F.Q., Ferlautoc A.S., Traversad E., Linardia M., Fonseca F.C. 2011.Nafion-based composite electrolytes for proton exchange membrane fuel cells operating above 120°C with titania nanoparticles and nanotubes as fillers. Jorunal of Power Sources 196: 1061-1068. [ Links ]
Morita M., Noborio H., Yoshimoto N., Ishikawa M. 2006. Ionic conductance of composite electrolytes based on network polymer with ceramic powder". Solid State Ionics 177: 715-720. [ Links ]
Norby T. (1999). Solid-state proton conductors: principles, properties, progress and prospects. Solid StateIonics 125: 1-11. [ Links ]
Palacios I., Castillo R., Vargas R. A. 2003. Thermal and transport properties of the polymer electrolyte based on poly(vinyl alcohol)/KOH/ H2O. Electrochimica Acta 48: 2195-2199. [ Links ]
Peighambardoust S.J., Rowshanzamir S., Amjadi M. 2010. Review of the proton exchange membranes for fuel cell applications. International Journal of Hydrogen 35: 9343-9384. [ Links ]
Ram S., Mandal T. K. 2004. Photoluminescence in small isotactic, atactic and syndiotactic PVA polymer molecules in water. Chemicla Physics 303: 121-128. [ Links ]
Rivera A. Santamaría J. and León C. (2001). Electrictrical conductivity relaxation in thin-film ytria-stabizad zirconia. Applied Physics Letters 78: 610-612 [ Links ]
Smolinka T. 2009. Encyclopedia of Electrochemical Power Sources. Freiburg, Germany: Institute for Solar Energy Systems USE, pp 394-400. [ Links ]
Vargas M. A., Vargas R. A., Mellander B-E. 1999. New Proton Conducting Membranes based on PVAL/H3PO2/H2O". Electrochimica Acta 44: 4227-4232. [ Links ]
Vargas M. A., Vargas R. A., Mellander B-E. 2000. More studies on PVAL+H3PO2+H2O proton conductor gels". Electrochimica Acta 45: 1399-1403. [ Links ]
Vargas R. A., Zapata V.H., Matallana E. and Vargas M.A. 2001. More thermal studies on the PVAL+H3PO2+H2O solid proton conductor gels. Electrochimica Acta 46: 1699-1702 [ Links ]
Vargas R.A., Bedoya F., Castillo J. E., Rodríguez L. A. andChacón M. 2011. Mechanical Relaxation in polymer electrolyte membranes based on PVOH-H3PO2-ZrO2. Journal of Nanostructured Polymers and Nanocomposites 6/3: 87-92. [ Links ]
Wan X., Yucel T., Lu Q., Hu X., Kaplan D-L. (2010). Silk nanosphere and microsphere from silk/PVOH blend films for drug delivery. Biomaterials 31: 1025-1035. [ Links ]
YangC.-C, Wu G.M. 2009. Study of microporous PVA/PVC composite polymer membrane and if application to MnO2 Capacitors". Materials Chemistry and Physics 114: 948-955. [ Links ]
YangC.-C. 2007. Synthesis and characterization of the cross-linked PVA/ TiO2 composite polymer membrane for alkaline DMFC". Journal of Membrane Science 288: 51-60. [ Links ]
YangC.-C., Lin C.-T., Chiu S.-J. 2008. Preparation of the PVA/HAP composite polymer membrane for alkaline DMFC application".Desalinisation 233 (2008) 137-146. [ Links ]
Yang C-C. (2006). Study of alkaline nanocomponent polymer electrolytes based on PVA-ZrO2-KOH. Materials Science and Engineering B 131: 256-262. [ Links ]
Yang C-C. (2007). Synthesis and characterization of the cross-linked PVA/ TiO2 composite polymer membrane for alkaline DMFC. Journal of Membrane Science 288: 51-60. [ Links ]
Yuan X.-Z., Li H., Zhang S., Martin J., Wang H. 2011. A review of polymer electrolyte membrane fuel cell durability test protocols. Journal of Power Sources 196: 9107-9116. [ Links ]
Zapata V.H., Castro W.A., Vargas R.A., Mellander B.-E. 2007. More studies on the PVOH-LiH2PO4 polymer system. Electrochimica Acta 53: 1476-1480. [ Links ]
Recibido: 16 de noviembre de 2012
Aceptado para publicación: 28 de febrero de 2013













