Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales
Print version ISSN 0370-3908
Rev. acad. colomb. cienc. exact. fis. nat. vol.37 no.142 Bogotá Jan./Mar. 2013
QUÍMICA
* Departamento de Química, Universidad del Valle, AA 25360, Cali. E-mail: hector.zuluaga@correounivalle.edu.co
RESUMEN
En este artículo se describen, de manera resumida, algunos trabajos realizados en el laboratorio de polímeros de la Universidad del Valle sobre ácido polil-L-láctico (PLLA), un compuesto biodegradable. Específicamente se describe la síntesis de PLLA de alto y bajo peso molecular y su aplicación en la fabricación de dispositivos o de andamios (scaffolds) para el crecimiento de células óseas, ya sea en forma de bloques blandos, películas, bloques porosos y tornillos. La caracterización de los diferentes materiales se realizó por espectroscopia (resonancia magnética, RMN, e infrarrojo, IR), análisis térmico, y microscopía, por determinación de sus pesos moleculares (viscosimetría, cromatografía) y de sus propiedades mecánicas. Los implantes, las pruebas de biocompatibilidad y de crecimiento celular se realizaron en conejos y se evaluaron de forma macroscópica, y mediante pruebas histológicas.
Palabras clave: PLLA, implantología, ingenieria de tejidos, bicompatibilidad.
ABSTRACT
The succinct description of some works on poly(L-lactic acid) PLLA, a biodegradable compound, in the polymer laboratories of the Universidad del Valle, is the subject of this article. Specifically, the synthesis of low and high molecular weight PLA and its application in the fabrication of devices or scaffolds for bone cells growth, either in the form of soft blocks, films, porous blocks, screws, is described. The characterization of these materials was performed by spectroscopy (NMR and IR), thermal analysis, microscopy, molecular weight determination (viscometry, chromatography) and their mechanical properties. Tissue growth and biocompatibility were studied by implanting the materials in rabbits followed by macroscopic and histological evaluations.
Key words: PLLA, implantology, tissue engineering, biocompatibility.
1. Introducción
Los polímeros son compuestos cuya identidad como macromoléculas, formadas por enlaces covalentes entre unidades más pequeñas llamadas monómeros, fue propuesta por Staüdinger en 1922 (Staüdinger, H. et al., 1922). Desde entonces se han desarrollado un sin número de aplicaciones de estos materiales, desde las fibras, las llantas, los empaques, los polímeros de ingeniería, hasta los implantes, las suturas, los lentes de contacto, las matrices para cultivo de tejidos entre otras. Su costo relativamente bajo, su resistencia a la corrosión, su baja densidad, y sus propiedades mecánicas, les ha permitido sustituír a los metales en muchas aplicaciones, a tal punto que el siglo XX fue denominado como la edad del plástico.
La gran mayoría de los polímeros sintéticos se ha diseñado para aplicaciones en ambientes hostiles que requieren una gran resistencia a diferentes esfuerzos y condiciones extremas y por lo tanto no son fácilmente degradables ya que debido a su origen reciente, la naturaleza no ha alcanzado a crear enzimas capaces de degradarlos (Mueller, R. J. et al, 2006). El problema se torna cada más grave debido al incremento de la producción mundial de plástico que en el año 2001 era del orden de 140 millones de toneladas al año (Shimao, M., et al., 2001) . En el 2011, alcanzó los 280 millones de toneladas al año, lo que representa un aumento del 4% comparado con el año 2010 en el que se produjeron 270 millones de toneladas de plásticos (Wilfried H., 2011). Debido a su larga durabilidad y a su baja densidad ocupan un alto volumen, convirtiéndose en un problema ambiental a la hora de ser desechados. Las alternativas para paliar el impacto ambiental han sido el reciclaje, la incineración y la producción de polímeros biodegradables. Este último tema se discutirá en este artículo con base en algunas investigaciones realizadas en el laboratorio de polímeros de la Universidad del Valle (Solís&Betancur, 2007; Correa&Betancourt, 2011; Correa& Godoy, 2011; Alcalde, J.C.; 2005, Vazquez, J.D. 2009, Gonzalez, 2009).
Se define como polímero biodegradable aquel que se puede convertir completamente en gas carbónico y agua, bajo ciertas condiciones, en un período no mayor de 30 días según la Norma ASTM D 5488-94, es decir puede regresar a sus compuestos de partida en el proceso de fotosíntesis. Existen normas europeas, americanas y japonesas que definen estas condiciones, las cuales varían de un continente a otro.
Los polímeros biodegradables pueden ser de origen natural como los polihidroxi-alcanoatos, los polisacáridos (celulosa, almidón, quitina) o pueden ser sintéticos como el ácido poliláctico, PLLA, el ácido poliglicólico, la policaprolactona, el alcohol polivinílico, entre otros. Las principales aplicaciones de los polímeros biodegradables están orientadas hacia la producción de empaques, suturas, miniimplantes bioabsorbibles, como tornillos y stents, (Soares, J.S., et al., 2008) la liberación controlada de fármacos (Ryttin, E., et al.,, 2008), y la ingeniería de tejidos (Ulery, B. D., et al., 2011; Savioli Lopez, M. et al., 2012).
Desde hace algún tiempo se encontró que las matrices poliméricas podían estimular la regeneración de tejidos con tamaños y formas definidas, este hallazgo llevó, por ejemplo, al desarrollo de injertos vasculares obtenidos a partir de células endoteliales y politetrafluoroetileno expandido, cartílago fabricado de condrocitos y ácidos poliláctico y poliglicólico, aplicaciones para hígado a partir de hepatocitos y ácido poliglicólico, y tubos intestinales de ácido poliglicólico y enterocitos (Mitragotri S. et al.,. 2009).
El ácido poliláctico es producido a partir del ácido láctico, un producto natural, obtenido por fermentación de fuentes renovables. El ácido láctico es un compuesto quiral que dependiendo de su origen puede ser el isómero D, el isómero L o una mezcla DL. La polimerización del ácido láctico se puede controlar para obtener diferentes pesos moleculares y diferentes grados de cristalinidad mediante una selección apropiada de los parámetros de reacción como temperatura, presión, tiempo de reacción y selección del catalizador. A su vez, el grado de cristalinidad y las propiedades físicas y mecánicas del producto dependen del peso molecular y del isómero escogido para realizar la polimerización. Mientras el PLLA y el PDLA son semicristalinos el PDLLA es amorfo.
La policondensación a temperaturas cercanas a 150 °C y presiones de 40-60 Torr produce PLLA de bajo peso molecular, adecuado para producir bloques blandos moldeables manualmente, mientras que la depolimerización del oligómero, seguida de sublimación, da lugar al dímero del ácido láctico, denominado lactide en inglés, que denominaremos lacturo de ahora en adelante, el cual por polimerización con catalizadores, a temperaturas ligeramente mayores y bajo atmósfera inerte, genera PLLA de peso molecular más alto, apropiado para producir películas, tornillos y bloques duros. El catalizador más usado para la síntesis de PLLA de alto peso molecular es el Sn (II)-(2-etilhexanoato) conocido como octoato de estaño, el cual tiene varias ventajas como la solubilidad en solventes orgánicos, en el lacturo fundido, su estabilidad al almacenaje y su reactividad a temperaturas hasta de 180 °C. Además, ha sido aprobado por la Agencia para la Administración de alimentos y drogas de los Estados Unidos, FDA, y por lo tanto se ha ampliado sus aplicaciones biomédicas y en empaques para alimentos (Nijenkuis AJ, et al., 1992).
Las características necesarias para que un material pueda ser utilizado como matriz son su biocompatibilidad, biodegradación/bioabsorción y un grado apropiado de porosidad de tal manera que después de ser implantado se reabsorba en un tiempo determinado y a su vez permita la absorción de proteínas plasmáticas y la unión con células como osteoblastos (Batchelor, A. W. 2004).
El PLLA es biodegradable, biocompatible y tiene una gran cantidad de aplicaciones industriales (Lunt, J., 1998), así como en el campo biomédico (Nampoothiri, K.M., et al., 2010.)
A continuación describiremos la obtención de PLLA de alto y bajo peso molecular, su conversión en materiales para implantología.
2. Materiales y métodos
Se utilizó ácido láctico Carlo Erba al 88%, octoato de estaño y cloruro de estaño Aldrich, cloroformo, diclorometano, acetona, acetato de etilo, 1-Butanol, 1-Octanol, 1-Decanol y metanol grado analítico de Merck, ε-Caprolactona Alfa Aesar destilada previamente.
Los espectros de RMN se tomaron en un espectrómetro Bruker 400 Avance II usando cloroformo deuterado como solvente, los espectros de IR con espectrofotómetro FTIR Perkin Elmer 1600 usando pastillas de KBr, los pesos moleculares se determinaron por viscosimetría con un viscosímetro Canon Fenske tamaño 25 con cloroformo como solvente, a 25 °C, ó por cromatografía de permeación por geles, GPC utilizando un cromatógrafo líquido Prominence LC-20AD equipado con una columna PLgel10µMIXED-B y estándares de poliestireno con THF como solvente a 1.0 mL/min. Los análisis térmicos se realizaron en un calorímetro diferencial de barrido, DSC, TA Instruments Q100, el análisis termogravimétrico (TGA) en el equipo TA Instruments TGA2050. Se realizaron ensayos de microdureza a todas las muestras sintetizadas utilizando un Knoop/VickersTester Wilson Instrument 401MVD con una carga de 10 g con base en las normas ASTM E384-11 y ASTM STP889: Vickers Indentation Curves of Elastoplastics Materials, reportadas como HV y HVexperimental respectivamente. El ensayo a compresión de las matrices porosas se realizó siguiendo la norma ASTM D1621-10 en una máquina de ensayos universales Tinius Olsen H50KS a una velocidad de 1mm/s. La morfología de los sistemas fabricados se estudió en un microscopio electrónico de barrido (SEM) Jeol JSM-6490LV con las muestras recubiertas con oro. El comportamiento de los dispositivos en condiciones reales de uso y la biocompatibilidad del material se evaluó mediante un procedimiento de implantación en tibias de conejos (estudios in-vivo) siguiendo protocolos de ética animal. Para los ensayos de degradación hidrolítica, se siguió la norma internacional ASTM F1635-04a denominada: "Método Estándar para Evaluar la Degradación In Vitro de Resinas de Polímero y Formas Fabricadas Hidrolíticamente Degradables para Implantes Quirúrgicos".
2.1 Síntesis del PLLA de bajo peso molecular
La formación del polímero de bajo peso molecular se realizó mediante policondensación de la solución acuosa de ácido L-láctico sin ningún tipo de catalizador con incrementos graduales de temperatura y presión de vacío. De esta manera se controla la evaporación súbita del ácido láctico y se evita su degradación. El tiempo de reacción fue de 2 a 3 horas una vez alcanzadas la temperatura de 140 a 170 °C y una presión de 80 a 60 Torr. El producto de la reacción se disolvió en acetona y se precipitó en agua destilada con agitación vigorosa. Posteriormente se recuperó por filtración al vacío y se almacenó en un desecador durante 24 horas para eliminar completamente la humedad. Se obtuvieron 7 muestras que se sometieron a caracterización, degradación hidrolítica y se implantaron en los sujetos experimentales.
2.2 Evaluación de la degradación hidrolítica
Para este ensayo se siguió la norma internacional ASTM F1635-04a denominada: "Método Estándar para Evaluar la Degradación In Vitro de Resinas de Polímero y Formas Fabricadas Hidrolíticamente Degradables para Implantes Quirúrgicos". Las muestras de polímero se introdujeron en una solución buffer de fosfatos, con un pH alrededor de 7, y se usó un horno para simular la temperatura corporal (37 °C) en donde se incubaron las muestras. Se hicieron cálculos de pérdida de masa, hinchamiento y del cambio de pH para evaluar la resistencia a la degradación hidrolítica de las muestras. El diseño experimental utilizado permitió evidenciar que el material es biocompatible, y la degradación hidrolitica in vivo se da en un patrón centrípeto, en forma progresiva y simultanea con la neoformacion ósea.
2.3 Implantación y evolución de la absorción del PLLA de bajo peso molecular
El material se sometió a pruebas de reblandecimiento para seleccionar las muestras que pudieran ser moldeadas entre 40 y 42 °C. Con base en este criterio se seleccionó la muestra PLLA 05 como la apta para implantación. Se realizó el proceso quirúrgico de implantación del PLLA en la tibia de 6 grupos de 5 conejos (Orictolagus cuniculus), macho, raza New Zealand, con una edad de 3 meses, y un peso entre 2.800-3.600 g para lo cual se realizó una perforación en la tibia de los sujetos de estudio, y posteriormente se implantó el material polimérico (Figura 1).
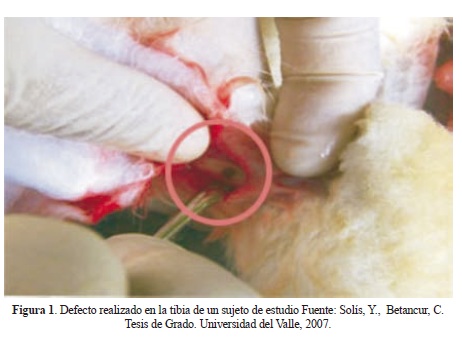
La siguiente etapa incluyó el control y seguimiento físico, fisiológico y radiográfico del material, valorando las respuestas que se pudieron presentar. Se tomaron radiografías antes y después del proceso de implantación para la tibia de cada sujeto de estudio y se siguió por dos meses el proceso de crecimiento de tejido óseo a través de micrometrías, para lo cual se realizó cada 10 días el sacrificio de 5 sujetos de estudio.
2.4 Síntesis del Lacturo
Para la obtención del lacturo se mezclaron 18 g del oligómero, previamente obtenido, con 180 mg de cloruro de estaño dihidratado (1% p/p), en un balón de fondo redondo acoplado a un condensador y con un adaptador para vacío al final, usando otro balón de fondo redondo como recibidor. El balón con la mezcla de reacción, sometida a agitación continua, se calentó a temperaturas entre 200 y 240 °C con presión de 80 a 60 Torr. De igual forma se utilizaron rampas de temperatura y presión para evitar la degradación del oligómero en el reactor y optimizar la formación del lacturo. Éste se recristalizó en acetato de etilo, obteniéndose 7.2 g de un sólido blanco que se almacenó en un desecador durante 24 horas.
2.5 Obtención de PLLA de alto peso molecular
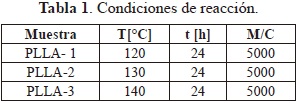
La síntesis de ácido poli(L-láctico), PLLA, se realizó mediante la polimerización por apertura de anillo (ROP) de L-lacturo utilizando como catalizador SnOct2 en ausencia de solvente. Se adicionaron 5 g de L-lacturo a un balón de vidrio de 50 mL, fondo redondo, con una boca, previamente seco y en atmósfera de argón, luego se agregaron 0.05g de SnOct2. El reactor se sumergió en un baño de aceite térmicamente controlado durante 24 horas (120-140 °C). Para purificar y eliminar residuos, el producto se disolvió en cloroformo (20 ml) y se precipitó por la adición de esta solución a 100 mL de metanol bajo agitación vigorosa. Finalmente, el producto polimérico se secó al vacío a 40°C durante 24 horas obteniéndose 4.8 g de un sólido blanco. El polímero fue caracterizado mediante espectroscopia de infrarrojo (FTIR), resonancia magnética nuclear (1H-RMN y 13C-RMN) y calorimetría diferencial de barrido (DSC). En la Tabla 1 se reportan las condiciones de reacción para tres diferentes muestras: temperatura (T), tiempo (t) y relación molar Monómero/Catalizador (M/C).
2.6 Producción de bloques porosos
La elaboración de los bloques porosos de PLLA se realizó con base en la técnica de moldeo por fusión (Lanza, H., 2007). Se mezclaron homogéneamente el PLLA y las partículas de cloruro de sodio, NaCl, con diferentes composiciones p/p de (20:80, 30:70, 40:60 y 50:50) y fueron colocados en un molde de disco. La mezcla PLLA/NaCl se calentó dentro del molde a una temperatura de 170 0C y se comprimió durante un tiempo de 10 min para obtener bloques sólidos los cuales fueron posteriormente cortados en cilindros de 8 mm diámetro y 4 mm de espesor. El NaCl presente en la matriz de PLLA fue disuelto sumergiendo los bloques en agua milli-Q durante 5 días, cambiando el agua milli-Q cada 24 h y finalmente se secaron a 50 °C por 24 h en un horno. Se realizó un ensayo de compresión, con probetas cilíndricas de 12.0 mm de diámetro y una altura promedio de 17.4 mm. Mediante este ensayo se determinó que los bloques que presentaron mejores propiedades mecánicas para aplicaciones médicas fueron los de la composición 30:70 (PLLA/NaCl).
2.7 Obtención de tornillos para fijación ósea
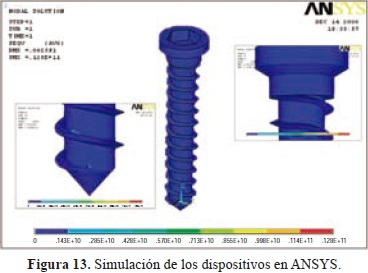
Los dispositivos fueron fabricados mediante el proceso de moldeo por transferencia del PLLA. El polímero se calentó lentamente en un horno hasta alcanzar la completa fusión del mismo, posteriormente se inyectó en moldes metálicos con cavidades en formas de tornillo de 2 mm de diámetro por 10 mm de alto los cuales fueron diseñados con base en modelos de simulación a escala natural por medio del método de análisis de elementos finitos, utilizando el software ANSYS® versión 11.0 licencia académica (Figura 2). Se estudiaron los esfuerzos y las deformaciones generados en el implante bajo condiciones extremas de carga (valores de torque máximo producidos durante una implantación común) detectando concentradores de esfuerzos para evitar posible fracturas en estos.

2.8 Implantación de los dispositivos
Con el fin de evaluar la biocompatibilidad del tornillo y estudiar la interfaz con el tejido, se realizó una prueba piloto en la cual se implantaron tornillos en tibias de 5 conejos (Orictolagus cuniculus), macho, raza New Zealand, con una edad de 3 meses, y un peso entre 2.800-3.600 g además se sujetaron auto-injertos para evaluar su poder de fijación. Para tal efecto se realizaron perforaciones en la zona cortical del hueso con una fresa redonda de 2 mm de la cual se cortó un injerto óseo de 5 x 5mm y éste se fijó a la perforación inicial con el dispositivo el cual fue ajustado con una llave y un ratchet para implantes en forma manual. Después de veinte días de implantación se realizó una evaluación macroscópica y un estudio histopatológico para evaluar posible respuesta inflamatoria. Se analizaron las condiciones de la interfaz huesoimplante y la interfaz injerto-hueso con el objetivo de estudiar el crecimiento de tejido óseo comprobando la correcta osteointegración de los implantes y fijación de los injertos.
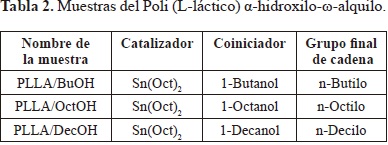
2.9 Síntesis del poli (L-láctico) a-hidroxilo-w-alquilo
La reacción del PLLA con los diferentes alcoholes (1-Buta- nol, 1-Octanol y 1-Decanol) se realizó en un balón de fondo redondo de 25 mL. Para cada muestra se mezcló el L-lacturo sintetizado, el octoato de estaño y el coiniciador respectivo. La temperatura de reacción fue de 170 °C por 24 horas bajo agitación moderada. El polímero obtenido se precipitó con diclorometano/metanol, se recuperó por filtración y se secó al vacío (17 Torr) almacenándolo en un desecador a 40 °C por 24 horas.
2.10 Síntesis de poli (L-láctico-co-ε-caprolactona)
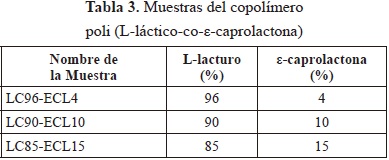
La síntesis de los copolímeros se realizó variando el porcentaje en peso de la ε-caprolactona con respecto al L-lacturo (4, 10 y 15%). Para cada muestra se mezclaron los dos monómeros en las proporciones respectivas junto con el octoato de Estaño al 0.2% p/p. El sistema fue calentado a 120° C por 72 horas. Finalmente el copolímero sintetizado se precipitó con diclorometano/metanol, se recuperó por filtración y se secó al vacío (17 Torr) almacenándolo en un desecador a 40 °C por 24 horas.
3.0 Resultados y discusión
3.1 PLLA de bajo peso molecular
Este material se preparó según se describe en la parte experimental, obteniéndose un sólido blanco que se moldeó manualmente para producir bloques blandos. Se obtuvieron siete oligómeros, mediante pequeñas variaciones de presión y temperatura cuyos pesos moleculares se determinaron por viscosimetría empleando la ecuación de Mark-Houwink-Sakurada (Ecuación 1)

En la cual:
[h] = viscosidad intrínseca
Mv = peso molecular viscosimétrico promedio
k y a = constantes determinadas para un sistema dado conformado por polímero/solvente/temperatura. c
Como el PLLA es soluble en disolventes orgánicos clorados se utilizó CHCl3 a 25 °C. Las constantes para el sistema PLLA/CHCl3 son K (dl/g) = 7.4 x 10-5, a = 0.87. La Tabla 4 presenta los valores de peso molecular viscosimétrico para las diferentes muestras de PLLA.
Los datos obtenidos se pueden ver en la tabla siguiente
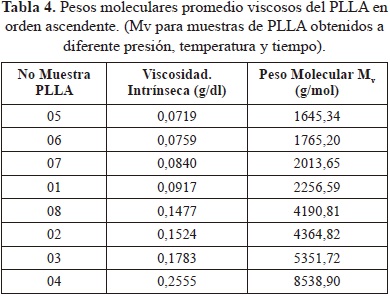
El peso molecular promedio viscoso Mv se incrementó con aumentos de tiempo, temperatura y disminución de presión. El peso molecular de las muestras para la aplicación específica (bloques blandos), especialmente para la fabricación de matrices de relleno óseo, no debe ser muy alto ya que éstas no requieren alta resistencia mecánica, por esa razón, materiales con bajo peso molecular como el PLA sintetizado, pueden ser usados con la ventaja de presentar un comportamiento degradativo apropiado en el cuerpo humano (Proikakis, C.S, et al., 2002). Se espera que los polímeros de bajo peso molecular (Mv) obtenidos, cuyo valor varía desde 1645 hasta 8538 g/mol, presenten un comportamiento degradativo favorable en el cuerpo humano.
3.1.1 Caracterización por calorimetría diferencial de barrido (DSC)
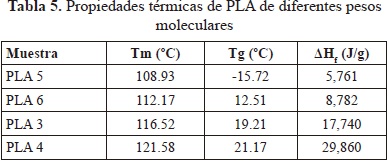
Se realizó la caracterización por calorimetría diferencial de barrido a las muestras de PLLA No. 03, 04, 05 y 06 por ser las que mayor y menor peso molecular presentaron. La temperatura de fusión (Tm) de las muestras varía desde 108.93°C hasta 121.58 °C. También se determinó, en barridos de temperatura adicional, la temperatura de transición vítrea la cual aumentó desde -15.72 °C hasta 21.17 Este fenómeno está relacionado con la influencia de los grupos terminales presentes en la molécula. En un polímero de bajo peso molecular, la presencia de los grupos terminales tiene una mayor influencia relativa, el porcentaje de cristalinidad será menor y la movilidad local mayor, lo que conlleva a obtener temperaturas de transición vítrea menores.
3.1.2 Caracterización por TGA
Se realizó la caracterización por termogravimetría a las muestras PLA 04 y PLA 05, las cuales presentaron el mayor y el menor peso molecular viscosimétrico, respectivamente, para determinar la influencia del peso molecular en la pérdida de masa.
En general se observa que las muestras exhiben un notable decaimiento en la masa cuando son calentados, esto sugiere que los polímeros son relativamente sensibles a la degradación térmica (Lunt, J., 1997). La menor pérdida de peso final la presentó la muestra con mayor peso molecular (PLA 04). Para la aplicación en este estudio, la temperatura de trabajo será de 37 °C donde no presentará pérdida de masa por efecto de la temperatura.
3.1.3 Caracterización por FTIR
La caracterización química se realizó por espectroscopia IR. Se comprobó la formación del polímero al comparar el espectro IR del ácido láctico (Alcalde, J.C., 2005) con el del PLLA. En el espectro FTIR del ácido láctico, la banda de elongación del oxígeno del grupo carbonilo aparece a 1721 cm-1 mientras que en el polímero ocurre a 1758 cm-1, indicando la formación del enlace tipo éster, lo cual se confirma con la aparición de la señales a 1188 y 1093 cm-1Â correspondientes a la elongación del enlace C-O-C. Estos datos concuerdan con los encontrados en la literatura (Achmad, F., et al., 2009). Además, la deformación del enlace -C-O-, 869 y 755 cm-1 pueden ser relacionadas con la fase amorfa y cristalina del PLLA respectivamente (Garlotta, D., 2001).
3.1.4 Evaluación de la degradación hidrolítica
Este ensayo se llevó a cabo con las muestras PLLA 05 y PLLA 06 las cuales presentaron un valor de temperatura de moldeo cercano al valor esperado (42°C). La resistencia al ataque hidrolítico se midió a través del cambio de pH de la solución Buffer, la pérdida de masa del polímero y el %Hinchamiento.
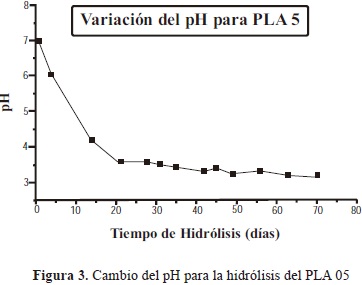
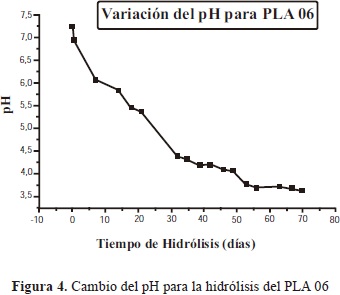
3.1.4.1. Cambio del pH
Al comparar las figuras 3 y 4, se observa que a los 20 días el pH de la solución fue menor para la muestra PLA 05 ya que gracias a su menor peso molecular su degradación será más rápída, dando lugar a una concentración relativamente mayor de grupos carboxilos.
3.1.4.2. Pérdida de masa
La anterior observación se confirma con la pérdida de peso de la muestra PLA 5 y 6 la cual alcanza valores de 60% y 48% respectivamente a los 20 días, y a partir de allí la pérdida de peso se hace más lenta alcanzando valores de 65% y 60%, respectivamente, al cabo de los 70 días de la realización del ensayo.
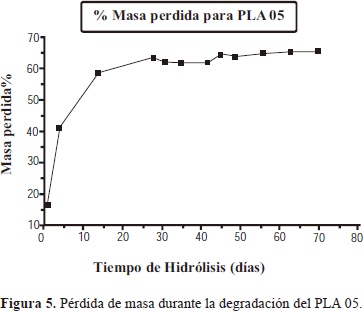
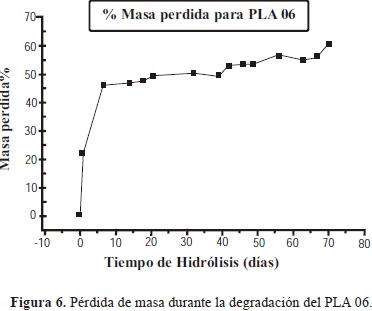
Este comportamiento puede ser explicado por el hecho de que el proceso de hidrólisis ocurre en dos etapas. La primera etapa ocurre en las zonas amorfas, las cuales contienen grupos terminales, plegamientos y cadenas no entrelazadas con rotación libre. La etapa final resulta del ataque a las zonas cristalinas del material, mucho más lenta que la primera debido a que la estructura altamente ordenada de las zonas cristalinas, dificulta la difusión de la solución (Chu, C., 1981).
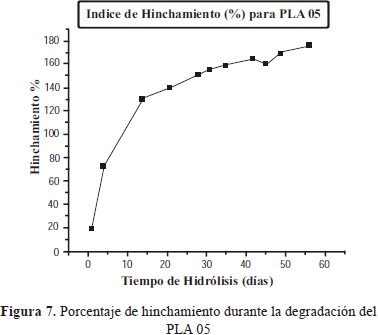
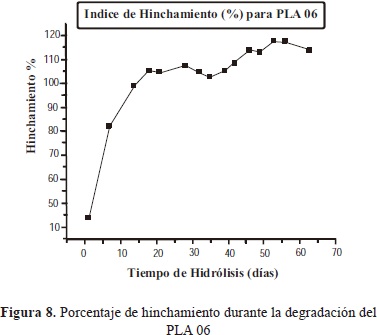
3.1.4.3 Hinchamiento
El comportamiento del índice de hinchamiento es influenciado por el grado de cristalinidad y el peso molecular de la muestra. Es decir, a mayor cristalinidad y mayor peso molecular, menor será el hinchamiento, ya que la difusión de la solución al interior del polímero se da más fácil a través de las zonas amorfas que de las zonas cristalinas. Es por esto que las muestras analizadas presentan un alto índice de hinchamiento, por presentar una mayor proporción de zonas amorfas.
Comparando las muestras analizadas, se encontró que el índice de hinchamiento es mayor para la muestra PLA 05, debido a que ésta presentó menor peso molecular inicial, y se espera que también tenga menor cristalinidad, lo que facilita una mayor difusión de la solución al interior del polímero y comprobando así lo explicado en la teoría.
3.2 PLLA de alto peso molecular
3.2.1 Polimerización
El PLLA de alto peso molecular fue sintetizado por apertura del anillo de L-Lacturo en presencia del SnOct2 como catalizador. La reacción de polimerización se presenta en la figura 9.
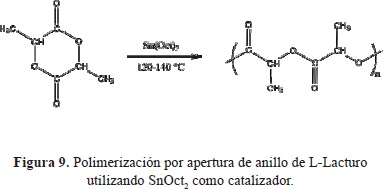
La elección del catalizador se realizó teniendo en cuenta trabajos anteriores (Cabaret, O., et al., 2004;) según los cuales el SnOct2 produce una alta conversión de monómero a polímero, baja racemización del L-Lacturo, dando lugar a polímeros de alto peso molecular en tiempos de reacción cortos. La concentración de catalizador es un parámetro de extrema importancia para el avance de la reacción. Esta se mantuvo en relación molar monómero/catalizador de 5000/1 ideal para obtener pesos moleculares mayores. La temperatura se mantuvo entre 120 y 140 °C, para evitar racemización y a temperaturas mayores a 140 °C se obtiene un producto de color amarillo debido a procesos de degradación térmica (Hyon, S., 1997).
3.2.2 Caracterización
La caracterización se llevó a cabo por espectroscopia IR, RMN y análisis térmico. EL espectro de IR coincide básicamente con el obtenido para el PLLA de bajo peso molecular y por lo tanto nos concentraremos en los espectros de RMN y los termogramas.
3.2.2.1 Espectroscopia de resonancia magnética nuclear (1H-RMN y 13C-RMN)
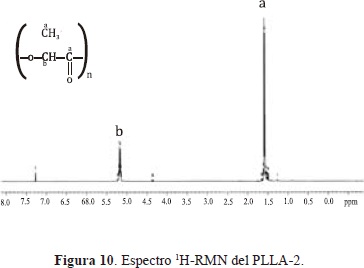
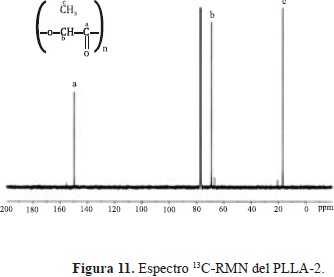
El espectro 1H-RMN (Figura 10) muestra una señal correspondiente a los protones del grupo CH3 a 1.57 ppm (a), una señal a 5.16 ppm (b) referente a los protones del grupo CH y algunas señales de baja intensidad correspondiente a los protones de ambos grupos en los finales de la cadena; a 4.35 ppm (g) para los protones del CH y entre 1.52 y 1.46 ppm para los protones del CH3. El espectro 13C-RMN (Figura 11) muestra tres señales características del esqueleto carbonado del PLLA. Una señal a 169.57 para el grupo CO (a), a 69 ppm para el grupo CH (b), y a 16.61 ppm propia del grupo CH3 (c). La señal a 76.99 ppm pertenece al solvente. Estas señales concuerdan con las reportadas en la literatura (Motta & Duek E. 2006;Â Espartero J.L, et al., 1996).
3.2.2.2 Determinación del peso molecular viscosimétrico Mv
El peso molecular del PLLA se determinó por viscosimetría empleando la ecuación de Mark-Houwink-Sakurada (Ecuación 1)
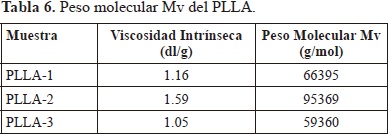
Los defectos debidos a fracturas óseas requieren dispositivos de fijación elaborados a partir de materiales con prestaciones mecánicas adecuadas con el fin de que sean capaces de soportar cargas elevadas durante el período de consolidación del hueso. Las propiedades mecánicas del PLLA se incrementan considerablemente cuando se alcanzan pesos moleculares mayores a 35.000 g/mol (Perego, G., et al., 1996). Se ha encontrado que el peso molecular del PLLA debe ser mayor a 50.000 g/mol para que sea factible su aplicación en dispositivos de fijación ósea (Shyamroy, S2003). Como se puede ver en la tabla 4, todos los polímeros sintetizados cumplen este requisito. En cuanto al efecto de la temperatura de polimerización sobre el peso molecular del PLLA se observa un aumento alrededor de 130 °C y una disminución por encima de esta temperatura. La reducción del peso molecular se puede atribuir a los procesos de depolimerización y degradación térmica que ocurren al aumentar la temperatura de reacción (Wang, X., et al., 2005).
3.2.2.3 Calorimetría diferencial de barrido (DSC)
Las curvas de DSC de todas las muestras de PLLA presentan tres señales correspondientes a temperatura de transición vítrea (Tg), temperatura de fusión (Tm) y temperatura de degradación (Td). (Figura 12).
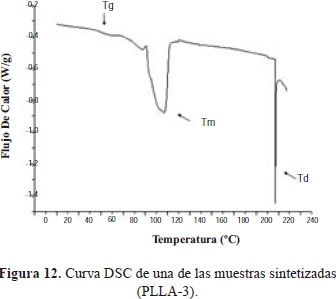
El porcentaje de cristalinidad (c) se calcula a partir de los valores de DHm obtenidos a partir de los análisis de DSC, con la ecuación (2)

En la cual:
DHm = Entalpia de fusión J/g
DHm0 = 93.7 J/g; Corresponde a la entalpia de fusión del PLLA 100 % cristalino
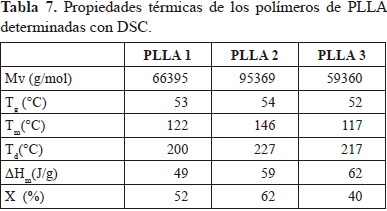
El rango de temperatura de 50 a 56°C corresponde a Tg, y la temperatura de fusión (Tm) alrededor de 120 a 150 °C. Se presenta una pequeña señal antes de la Tm que corresponde a la fusión de cristales más pequeños o imperfectos que se presentan en la estructura (Motta & Duek, 2006; Magon & Pyda, 2009). La degradación térmica del polímero (Td) ocurre entre 210 y 225 °C. En la tabla 7 se observa una relación entre los valores de Tg, Tm y c con el peso molecular; estos son mayores en la muestra con el peso molecular más elevado (PLLA-2).
3.3 Características de los dispositivos de fijación ósea
3.3.1 Simulación
Este estudio se realizó aplicando un torque en la parte superior del implante prototipo empotrando la punta para simular condiciones extremas (atascamiento). En simulación se puede observar que el máximo esfuerzo equivalente de Von Misses en el implante, es superior al esfuerzo de fluencia típico del material, que ocurrió en las aletas cerca a la punta (zona de empotramiento) ocasionando un desgaste que no afecta su integridad ni su capacidad de fijación, lo cual se espera dada la pequeña sección en esta parte del implante, con los resultados obtenidos, se diseñaron tornillos con un cambio de sección gradual en la cabeza que ayudó a reducir acumuladores de esfuerzos en esta parte. Por lo tanto, se puede afirmar que los implantes no fallan con estas condiciones de carga (Figura 13).
3.3.2 Fabricación de los dispositivos
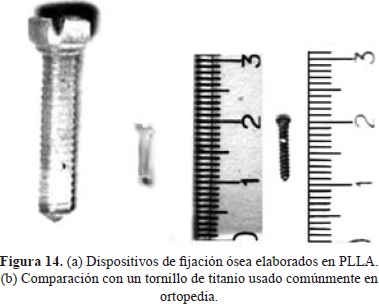
Los dispositivos se fabricaron mediante moldeo por transferencia del PLLA-2. En este proceso el polímero se calienta en una primera cavidad, y en estado líquido, se transfiere, mediante inyección, al molde diseñado según los resultados del estudio de la simulación, donde se comprime y adopta su forma (Groover M., 2007). Para establecer la temperatura óptima de procesamiento se tuvieron en cuenta los resultados del ensayo de DSC; se estableció 170 °C como temperatura de procesamiento para asegurar la completa fusión del material (Tm=146 °C), con una buena fluidez para el adecuado llenado del molde, sin llegar a la degradación del mismo (Td= 227 °C). Con este método se obtuvieron tornillos sin burbujas ni poros, además se observa que en estos se imprime a la perfección la rosca, lo cual es propio del proceso de inyección de polímeros (Figura 14).
3.3.3 Efecto del procesamiento del material en las propiedades de los dispositivos
La sensibilidad a la degradación hidrolítica y térmica de los enlaces del polímero puede llevar a disminuciones importantes del peso molecular durante el conformado del material (Groover M., 2007) por tanto la técnica de procesamiento influye en las propiedades mecánicas del dispositivo obtenido. En la tabla 8 se presentan los valores de peso molecular de dos dispositivos de fijación ósea construidos con PLLA-2.
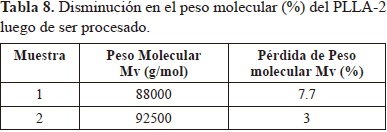
En esta tabla se observa una disminución en el peso molecular del polímero después del proceso de moldeo. Sin embargo ésta no es tan crítica pues los dispositivos presentaron una buena resistencia y se implantaron satisfactoriamente en la tibia del sujeto de estudio. Esto valida el uso de este proceso para la elaboración de dispositivos de fijación ósea en PLLA.
3.4 Prueba de compatibilidad in vivo
3.4.1 Implantación
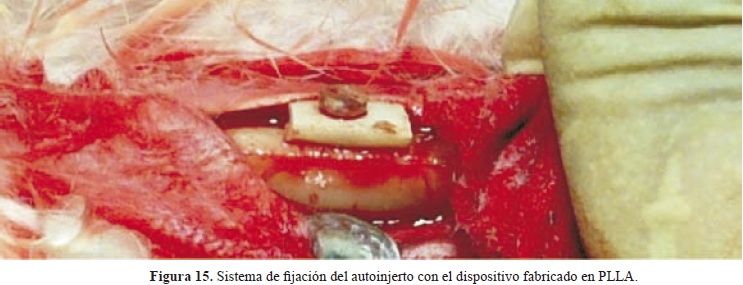
El tornillo se introdujo entre el autoinjerto y el hueso hasta la cabeza sin producirse fracturas en la zona cortical ósea ni en el dispositivo mismo. Se observó que este dispositivo fijaba correctamente el autoinjerto al hueso lo cual comprobó el adecuado diseño (Figura 15). La rosca del tornillo permaneció al interior del hueso y la cabeza se dejó por fuera del mismo, posteriormente el epitelio se suturó. Por dehiscencia de las suturas, la cabeza del tornillo se expuso al medio ambiente a los 10 días de la implantación.
3.4.2 Evaluación macroscópica y estudio histológico
Después de veinte días de implantación se realizó una evaluación macroscópica que mostró un proceso normal de cicatrización con ausencia de tejido de granulación además de una adecuada integración del injerto. El estudio histológico arrojó los resultados que se muestran en la tabla 9.
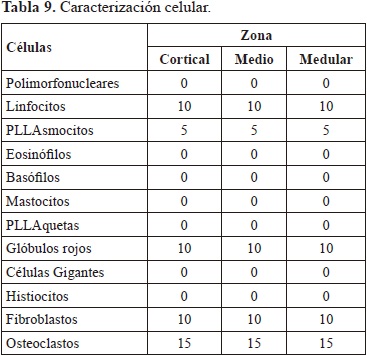
La exposición de la cabeza del tornillo al ambiente permite la entrada de bacterias y elementos irritantes que pueden causar una inflamación crónica. Esto desencadenía una respuesta inmunoespecifica en la cual intervienen linfocitos y los plasmocitos, aunque por el bajo porcentaje en el que se presentan se puede deducir que esta etapa es leve y está terminando. La presencia de fibroblastos y osteoclastos indican que se está iniciando la cicatrización del tejido óseo alrededor del implante. Esto se corrobora con los datos de cicatrización del defecto los cuales se presentan en la Tabla 10.
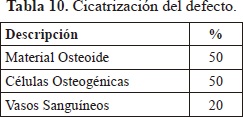
Con esta caracterización se descarta una reacción a cuerpo extraño y se confirmó un proceso de cicatrización en la interfaz del implante con el tejido con presencia de vasos sanguíneos (20%), un 50% de material osteoide y un 50% de células osteogénicas. Las micrografías SEM (Figura 16) muestran que los dispositivos soportaron correctamente el injerto con el hueso favoreciendo la consolidación de ambos.

Esto significa que los dispositivos de fijación ósea son biocompatibles en la medida que no interfieren en la cicatrización del tejido óseo a su alrededor y además tienen un excelente poder de fijación.
4. Copolímeros e iniciadores
Debido a algunos problemas con la ductilidad del PLLA se decidió polimerizar el L-Lacturo utilizando una serie de alcoholes como coiniciadores o copolimerizándolo con e-caprolactona cuyo homopolímero es biodegradable (Rasal, R. M.,. et al., 2010; Darensbourg & Karroonnirun, 2010) esperando obtener una combinación favorable de propiedades (Ulery, B. D., 2011). Uno de los catalizadores usados en la ROP de las lactonas es el octoato de Estaño (Sn(Oct)2) comúnmente usado con coiniciadores como al- coholes alifáticos primarios y secundarios (Kiesewetter, M. K., et al., 2010) que por reacción de transferencia forman un alcóxido de estaño (Oct-Sn-OR) el cual es el verdadero iniciador (Figura 17).
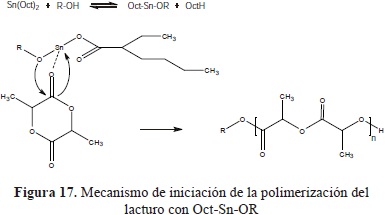
Esta reacción procede mediante el mecanismo de coordinación-inserción, que permite la preparación de poliéste- res con grupos terminales de cadena alquilo (R) e hidroxilo (OH) bien definidos, los cuales presentan un efecto en las propiedades del polímero, como la flexibilidad y tenacidad.
Se fabricaron diversos dispositivos médicos y se evaluaron en pruebas piloto in vivo, en las cuales se comprobó la biocompatibilidad de los copolímeros involucrados en este estudio.
4.1 Caracterización
4.1.1 Espectroscopía IR
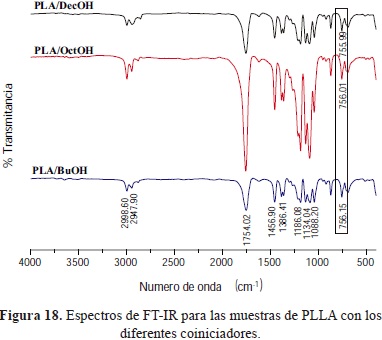
Los espectros de IR de los copolímeros, mostraron las señales características semejantes a las de los polímeros obtenidos anteriormente. Se detectó un leve desplazamiento de la banda correspondiente a la deformación fuera del plano del grupo metileno CH2 la cual aparece alrededor de 760 cm-1 para el PLLA sin modificar desplazándose a 755 cm-1 para el PLLA modificado, lo cual evidenció un aumento de la longitud de los grupos alquilo (Figura 18) y la cantidad de caprolactona en las diferentes muestras.
4.1.2 Espectroscopía RMN
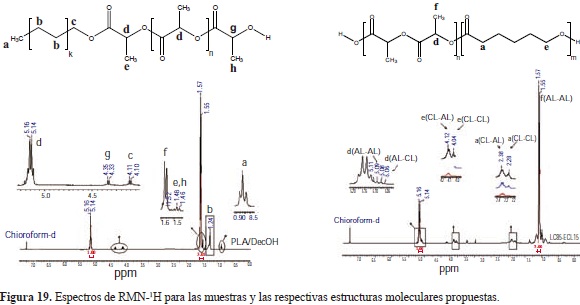
El espectro de RMN-1H confirmó la presencia de los diferentes grupos terminales alifáticos a-hidroxilo-w-alquilo en las cadenas del PLLA mostrando un desplazamiento a 1.24 ppm (b) correspondiente a los protones metilenos (CH2) incrementando su intensidad con el aumento en la longitud (número de metilenos) de dichos grupos. De igual manera se detectó un incremento en las señales características de los protones de las unidades monoméricas de ácido láctico y e-caprolactona, con el incremento de esta última en las cadenas del copolímero para las distintas secuencias de ordenamiento (AL-AL, AL-CL, etc.) evidenciando su exitosa copolimerización. En la Figura 19 se muestran las asignaciones de las diferentes señales.
4.1.3 Análisis térmico
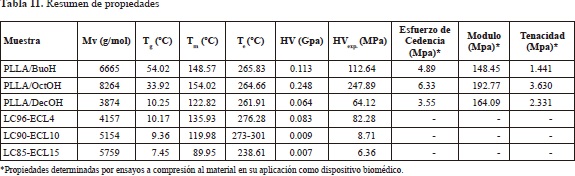
Los análisis térmicos (Tabla 11) mostraron una disminución de la Tg (temperatura de transición vítrea) así como de la Tm (temperatura de fusión) con el aumento de la longitud de los grupos alquilo y con el aumento del contenido del monómero de e-caprolactona (Figura 20) ya que ambos sistemas aportan flexibilidad a las cadenas del polímero produciendo una disminución en el grado de cristalinidad de la estructura y los valores de micro dureza.
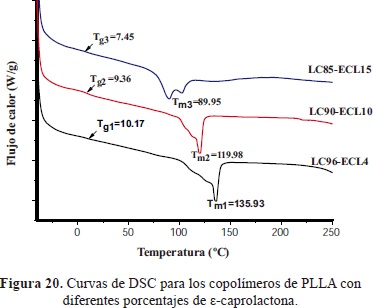
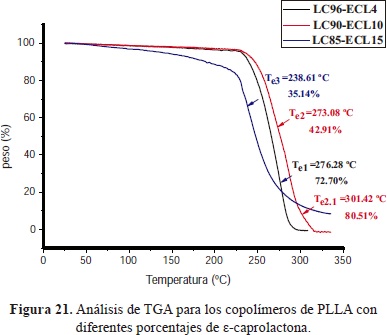
El uso de los coiniciadores produjo polímeros más estables térmicamente con rangos de procesado amplios (hasta 200°C), contrario a lo que ocurrió con el incremento de la caprolactona en los copolímeros que generó disminución en la estabilidad térmica (Figura 21) y en la cristalinidad.
4.1.4 Resumen de propiedades
El uso del coiniciador 1-octanol (muestra PLLA/OctOH) mostró la mayor efectividad en la iniciación de la ROP del L-lacturo en comparación con los otros alcoholes, lo que permitió obtener la muestra con el mayor peso molecular Mv de 8264g/mol, la mayor temperatura de fusión (T =154.02 °C) y los valores de microdureza y tenacidad más altos (HVexp.=247.89 MPa) apropiados para su uso en aplicaciones médicas que requieran deformaciones plásticas a esfuerzos altos (alta tenacidad) como pines, placas, tornillos, andamios (scaffolds), etc. Por su parte, la incorporación del 10% de ca-prolactona en el copolímero (muestra LC90-ECL10) mostró una Tg (9.36 °C) y una microdureza (8.71 MPa) intermedias, comparada con las otras muestras, y como consecuencia, la flexibilidad adecuada para su uso en aplicaciones médicas que requieran ductilidad, como membranas, suturas, hidrogeles, etc.
4.1.5 Implantes
Teniendo en cuenta las características más favorables para la fabricación de los dispositivos biomédicos se escogieron las muestras PLLA/OctOH y LC90-ECL10 para la fabricación de matrices porosas reabsorbibles para la regeneración ósea y membranas flexibles para regeneración tisular guiada, respectivamente.
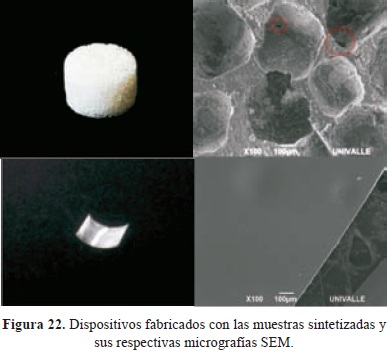
En los bloques el porcentaje de porosidad del 65%, tamaños de poros promedio de 400 µm, y la interconectividad de los poros y una superficie homogénea libre de macroporos para las membranas flexibles (evidenciadas por las micrografías SEM) resultaron ser características ideales para su uso en estas aplicaciones (Figura 22).
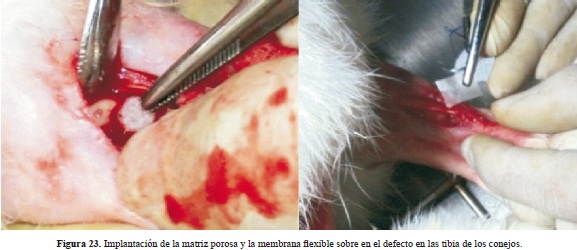
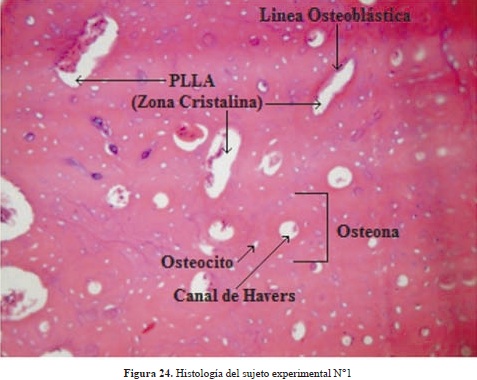
Se comprobó el desempeño de los dispositivos con su satisfactoria implantación en tibias de conejos raza New Zealand como sujetos experimentales, siguiendo todo un protocolo de ética animal encabezado por el odontólogo e implantólogo Carlos Valencia (Figura 23).
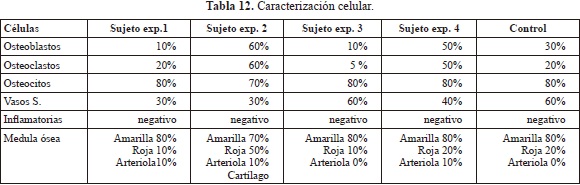
En la Tabla 12 se presentan los resultados de las histologías de los estudios in-vivo realizadas a los 4 sujetos experimentales y al control, a los 21 días de implantación. En todos los casos se observaron las células presentes en un proceso normal de cicatrización ósea, no se encontró en ningún caso inflamación o presencia de macrófagos que evidencian rechazo al material. Por el contrario se detectó en diferentes porcentajes células osteoprogenitoras, tal como se observa en la histología de uno de los sujetos experimentales (Figura 24), se aprecia una línea de osteoblastos rodeando parte del material remanente de la degradación, que corresponde a su región cristalina, formando el "creeping substitution" o remodelamiento óseo, por lo tanto se confirmó que este material es biocompatible en la medida que no afecta el crecimiento normal del hueso además que es osteoinductivo ya que promueve el crecimiento óseo a su alrededor.
Conclusiones
El ácido poli-L-Láctico es un polímero biodegradable adecuado para su utilización como material de implante que promueve la regeneración ósea, como lo confirman las pruebas realizadas en conejos y el análisis macroscópico e histológico de los especimenes estudiados. Sus propiedades mecánicas pueden ser mejoradas con el uso de alcoholes como coiniciadores o por copolimerización con e-aprolactona.
Agradecimientos
El autor agradece a la Universidad del Valle y al Centro de Excelencia en Nuevos Materiales, CENM, por el apoyo financiero. A los estudiantes de pregrado de los programas de Ingeniería de Materiales y de Química, quienes con sus trabajos de grado contribuyeron a la realización de estas investigaciones, a los estudiantes de especialización en implantología del CIEO-Universidad Nueva Granada por el apoyo financiero y por su contribución a las cirugías y a los análisis macroscópicos e histológicos. Gracias especiales al odontólogo implantólogo Carlos Valencia quien asesoró los trabajos de implantología y los análisis macroscópicos e histológicos.
Bibliografía
Achmad, F., Yamane, K., Quan, S., Kokugan, T. 2009. Synthesis of polylactic acid by direct polycondensation under vacuum without catalysts, solvents and initiators, Chemical Engineering Journal, 151, (1-3), 15, 342-350 [ Links ]
Alcalde, J.C. 2005. Trabajo de Grado, Escuela de Ingeniería de Materiales, Director: Fabio Zuluaga, Universidad del Valle, Cali. [ Links ]
Batchelor, Andrew W. 2004. Service Characteristics of Biomedical Materials and Implants, Series on Biomaterials and Bioengineering, Volume 3, Singapore: Imperial College Press, 183. [ Links ]
Betancourt, J., 2012. Informe Joven Investigador, Director: Fabio Zuluaga, Universidad del Valle-Colciencias. [ Links ]
Cabaret O, Martin-Vaca B, Bourissou D. 2004. Controlled ring-opening polymerization of lactide and glycolide, Chem. Rev.; 104 (12): 6147-6176. [ Links ]
Chu, C. 1981. Hydrolytic degradation of poly (glycolic acid): tensile strength and crystallinity study, Journal of Applied Polymer. Science. 26. 1727-1734. [ Links ]
Correa, J.P., Betancourt, J., 2010. Trabajo de Grado, Escuela de Ingeniería de Materiales, Director: Fabio Zuluaga, Universidad del Valle, Cali. [ Links ]
Correa, L.S., Godoy, J., 2011. Trabajo de Grado, Escuela de Ingeniería de Materiales, Director: Fabio Zuluaga, Universidad del Valle, Cali. [ Links ]
Darensbourg, D. J., Karroonnirun, O. 2010. Ring-Opening Polymerization of L-Lactide and e-Caprolactone Utilizing Biocompatible Zinc Catalysts. Random Copolymerization of L-Lactide and e-Caprolactone, Macromolecules, 43: 8880-8886. [ Links ]
Espartero J.L., Rashkov I., Li S., Manolova N., Vert, M. 1996. Macro-molecules, 29: 3535-3539. [ Links ]
Garlotta, D. 2001.A Literature Review of Poly(Lactic Acid), Journal of Polymers and The Environment, 9, (2), 63-84. [ Links ]
Gonzalez, D. 2009. Trabajo de Grado, Programa Académico de Química, Director: Fabio Zuluaga, Universidad del Valle, Cali. [ Links ]
Groover M. 2007. Fundamentos De Manufactura Moderna: Materiales Procesos Y Sistemas, 3a Ed. Mexico:Mcgraw-Hill,Cap 13. [ Links ]
Hyon S, Jamshid K, Ikada Y. 1997. Synthesis of polylactides with different molecular weights, Biomaterials.; 18 (22): 1503-1508. [ Links ]
Kiesewetter, M. K., Shin, E. J., Hedrick, J. L., Waymouth, R. M., 2010. Organocatalysis: Opportunities and Challenges for Polymer Synthesis, Macromolecules, 43: 2093-2107. [ Links ]
Knight, R. I.; Wilcox, H. E.; Korossis, S. A.; Fisher, J.; Ingham, E. 2008. The use of acellular matrices for the tissue engineering of cardiac valves. Journal of Engineering in Medicin, 222(H1), 129-143. [ Links ]
Lanza, H. 2007. Principles of tissue Engineering. Elsevier. [ Links ]
Lunt, J. 1998. Large scale production, properties and commercial applications of polylactic polymers, Polymer Degradation and stability, 59, 145. [ Links ]
Luten, J., Van Nostrum, C.F., De Smedt, S.T., Hennink, W.E. 2008. Biodegradable polymers as non-viral carriers for plasmid DNA delivery, Journal of. Controlled Release 126(2), 97-110. [ Links ]
Magon, A., Pyda M. 2009. Study of crystalline and amorphous phases of biodegradable poly(lactic acid) by advanced thermal analysis, Polymer.; 50 (16): 3967-3973. [ Links ]
Mitragotri Samir , Lahann Joerg. 2009. Physical approaches to biomaterial design. Nature Materials 8, 15-23. [ Links ]
Motta A, Duek E. 2006. Synthesis, characterization and "in vitro" Degra- dation of PLLA, Polímeros: Ciência e Tecnologia.; 16 (1): 26-32; [ Links ]
Mueller, R. J. 2006. Biological degradation of synthetic polyesters-enzymes as potential catalysts for polyester recycling, Proceedings of. Biochemistry., , 43: 2124-2128 [ Links ]
Nampoothiri, K.M., Nair, N.R., Jhon, R.P. 2010. An overview of the recent developments in polylactide research, Bioresearch Technology 101,8493-8501. [ Links ]
Nijenkuis Aj, Grijpme Dw, Pennings AJ. 1992. Lewis acid catalyzed polymerization of L-lactide. Kinetics and mechanism of the bulk polymerization, Macromolecules, 25:6419-6424. [ Links ]
Perego G, Cella G, Bastioli C. J. 1996. Effect of molecular weight and crystallinity on poly(lactic acid) mechanical properties, Journal of Applied Polymer. Science, 59 (1), 37-43. [ Links ]
Proikakis, C.S, Tarantili, P.A, Andreopoulos, A.G. 2002. Synthesis and Characterization of Low Molecular Weight Polylactic Acid, Journal of Elastomers & Plastics, 34, 49-63. [ Links ]
Rasal, R. M., Janorkar, A. V., Hirt, D. E. 2010. Poly (lactic acid) modifi-cations, Progress in Polymers Science, 35: 338-356; [ Links ]
Ryttin, E., Nguyen, J., Wang, X., Kissel, T. 2008. Biodegradable polymeric nanocarriers for pulmonary drug delivery, , Expert Opinion on Drug Delivery, 5(6), 629-639. [ Links ])
Savioli Lopez, M., Jardini, A. L. 2012. Maciel Flho, R., Polylactic acid production for tissue engineering applications, Procedia Engineering, 42, 1402-1413. [ Links ]
Shimao, M. 2001. Biodegradation of Plastics, Current opinion Biotechnology, 12, 242-247 [ Links ]
Shyamroy, S. 2003. Synthesis of Biodegradable Poly (Lactic Acid) Polymers, Ph.D. Thesis, Poona (India): University of Poona. [ Links ]
Soares, J.S., Moore, J.E., Rajagopal, K.R. 2008. Constitutive Framework for biodegradable polymers with applications to biodegradable stents, ASAIO Journal, 54(3), 295-301. [ Links ]
Solis, Y., Betancur, C., 2007. Trabajo de Grado, Escuela de Ingeniería de Materiales, Director: Fabio Zuluaga, Universidad del Valle, Cali. [ Links ]
Stark, W.J., Schneider, O., Loher, S.F., Bruner, T., Simonet, M., Schmidlin, P., Grass, R.N. 2008. Implant materials comprising biodegradable polymers and inorganic particles, Canadian Patent International Application [ Links ]
Staüdinger, H., Fritschi, J. 1922. Helvetica Chimica Acta, 5, 785-806, [ Links ]
Ulery, B. D., Nair, L. S., Laurencin, C. T. 2011. Biomedical Applications of Biodegradable Polymers, Journal Of Polymer Science Part B: Polymer Physics, 49.832-864, [ Links ].
Vazquez, J.D., 2010 Trabajo de Grado, Escuela de Ingeniería de Materiales, Director: Fabio Zuluaga, Universidad del Valle, Cali. [ Links ]
Wang X, Liao K, Quan D, Wu Q. 2005. Macromolecules.; 38: 4611-4617. [ Links ]
Wang, Y., Zern, B., Gumera. 2008. Biomimetic Polymers for Tissue Engineering,, C., Canadian Patent International Application [ Links ]
Wilfried Haensel. 2011. Annual Report, Plastics Europe Association. [ Links ]
Recibido: 13 de diciembre de 2012
Aceptado para publicación: 28 de febrero de 2013













