Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales
versión impresa ISSN 0370-3908
Rev. acad. colomb. cienc. exact. fis. nat. vol.37 no.144 Bogotá jul./set. 2013
CIENCIAS NATURALES
* Profesor Asociado, Instituto de Ciencias Naturales, Universidad Nacional de Colombia, Email: mgandradec@unal.edu.co Twitter: @gonzaloandradec
** M.Sc., candidato a Doctor en Ciencias - Biología, Instituto de Ciencias Naturales, Universidad Nacional de Colombia. Email: erhenaob@unal.edu.co
*** Bióloga, estudiante M.Sc. en ciencias - Biología, Instituto de Ciencias Naturales, Universidad Nacional de Colombia. Email: paola.trivino.cruz@gmail.com
RESUMEN
Se presenta las técnicas que existen actualmente para los estudios de biodiversidad y conservación de mariposas, se explica como se deben recolectar y preservar, qué tipo de trampas se pueden utilizar, metodologías de muestreo, cómo se pueden observar, qué técnica se utiliza para el estudio de los órganos genitales y la venación de las alas; así mismo cómo es el procedimiento para el extendido de sus alas. Se indican los tipos de muebles y cajas en que se deben guardar las mariposas en una colección biológica, las etiquetas que deben llevar una vez son incluidas en una colección, así como el color de las etiquetas que identifican los tipos y se finaliza indicando el método y la forma de hacer fotografías de ejemplares debidamente preservados.
Palabras clave: Colombia, Mariposas, Biodiversidad, Conservación, Recolección Preservación, Montaje.
ABSTRACT
We present the techniques currently existing for biodiversity studies and conservation of butterflies, explain how you should collect and preserve, which kind of traps can be used, sampling methodologies, what you can see, what technique is used to study of genital organs and wing venation, likewise as the procedure for extending their wings, in what types of furniture and boxes should be stored in a collection of butterflies biological, labels redquired once included in a collection, and the color of the labels that identify the types and the method and how to take pictures properly preserved specimens.
Key words: Colombia, Butterflies, Biodiversity, Conservation, Recollection, Preservation, Assembly.
Introducción
Una colección biológica es útil por que sirve para sustentar la biodiversidad del país, nos permite documentar la distribución de las especies y son la base fundamental para la clasificación, sistemática y biogeografía, disciplinas que son esenciales para la conservación. Así mismo las colecciones nos ayudan a identificar especies amenazadas, áreas de endemismos o de alta biodiversidad y establecer prioridades de conservación, en otras palabras son una biblioteca biológica.
Los organismos que están depositados en una colección biológica siempre permitirán consultas posteriores a futuras generaciones y a expertos en los grupos para confirmar, corregir o precisar las identificaciones. Estas funcionan en la medida que se estudien sus ejemplares y sus resultados sean publicados; las colecciones permiten comparaciones de ejemplares recolectados por diferentes personas, en diferentes lugares y en distintos tiempos.
Por lo mismo, la conservación de las colecciones biológicas es de vital importancia para mantener, en el mejor estado posible, los ejemplares que se encuentran depositados en ellas. Se requieren de técnicas y procedimientos de mantenimiento acorde con los organismos que se encuentren depositados y según las necesidades; sin embargo, toda colección biológica, está expuestas a múltiples agentes de deterioro biológico que pueden causar daños, algunas veces irreparables (Llorente 1990, Llorente y Castro 2002).
El propósito de este artículo es indicar las diversas técnicas para la recolección, preservación y montaje de mariposas en estudios de biodiversidad y conservación, que permita que los investigadores interesados en el estudio de las mariposas tengan criterios para decidir cuáles son las mejores técnicas; hay procedimientos que consideramos no son adecuados como lo mencionado por Villareal et al. 2006, en donde recomiendan utilizar la inyección de etanol o acetato de etilo en el tórax del ejemplar para su sacrificio.
1. Técnicas de recolección
Para el trabajo con mariposas en el medio silvestre hay dos técnicas básicas de recolección:
1.1 Red Entomológica
También llamada red lepidopterológica o jama. Ésta consiste en una aro de 40 cm de diámetro (Figura 1A), tiene un cono en tela de tul muy suave, el largo del cono es de 100 cm y la punta de este cono debe terminar de manera redondeada, para evitar daño alar al ingresar en la red (Figura 1B); el mango de la red, está conformado de varias secciones, máximo 6, de 60 cm cada una, que se unen entre si (Figura 1C); el aro con la red se sujeta a la primer sección con un tornillo (Figura 1D), una vez unido este aro a las secciones se tendrá una red de 4 m de largo. Ésta red se utiliza para la captura de ejemplares en cualquier tipo de ecosistema (Figura 1E).

1.2 Trampa van Someren-Rydon
Esta trampa consiste en un cono de tela tul suave, generalmente de color negro o verde, el cual tiene tapado la parte superior (Figura 2A), hacia la mitad del cono debe tener un sistema de apertura y cierre rápido (Velcrom) para poder sacar los ejemplares, la parte inferior del cono no debe estar cerrada, en este debe haber una base con un plato en donde se coloca el cebo, la distancia entre la parte inferior de la trampa y la base no debe superar 2.5 cm. (Figura 2B).

2. Técnica de sacrificio de las mariposas
2.1 Técnica de presión digital en el tórax
Un ejemplar debe ser sacrificado únicamente cuando se tienen objetivos o fines de investigación científica. Utilizando los dedos pulgar e índice se hace presión, según el tamaño del ejemplar, en el tórax de la mariposa, exactamente entre el meso y meta tórax, debe tener cuidado de no presionar o tocar las alas por que podrían quedar marcas de las huellas digitales y el ejemplar se estropearía. (Figura 3).

Esta técnica es la más utilizada por los que trabajan con mariposas, ya que además de permitir preservar el ejemplar en perfecto estado, no daña sus tejidos. Nunca utilice una jeringa para inyectar algún líquido (alcohol, acetato de etilo, acetona, etc, ) con el fin de sacrificarla, ya que esto hace que el ejemplar sufra daños posteriores, especialmente por la humedad que termina degradando el ADN y no permite análisis moleculares posteriores.
Según Márquez (2005) las mariposas pueden ser sacrificadas utilizando una cámara letal que puede contener cianuro de potasio, acetato de etilo, éter o cloroformo, sustancias tóxicas que provocan la asfixia en los insectos. Sin embargo, tampoco es recomendable esta técnica ya que produce deterioro de las alas en el momento de su muerte, daños en los tejidos e impide hacer un análisis molecular.
De manera general podemos recomendar el sacrificio mediante choque térmico, es decir, empleando las bajas temperaturas para evitar daños en los ejemplares y así poder garantizar el empleo de sus moléculas constituyentes en futuros análisis de ADN.
3. Técnicas de Preservación
3.1 Preservación en seco
3.1.1 Triángulo de papel milano o glassine
El triángulo de papel se utiliza como sobre para depositar el ejemplar que se recolecta, este sobre se puede hacer manualmente, utilizando papel milano blanco (casi transparente), para esto se debe recortar un rectángulo de 10 x 14 centímetros (Figura 4A), se debe doblar un extremo sobre uno de sus lados teniendo cuidado de dejar dos de sus lados libres, uno de 1 cm y el otro de 3 cm (Figura 4B); a continuación en el lado libre de 1 cm frote un poco de pegante en barra sobre la superficie y pegue haciendo un segundo dobles (Figura 4C); en el lado libre de 3 cm haga un tercer dobles, sin colocar pegante ya que este será utilizado como tapa del sobre (Figura 4D).
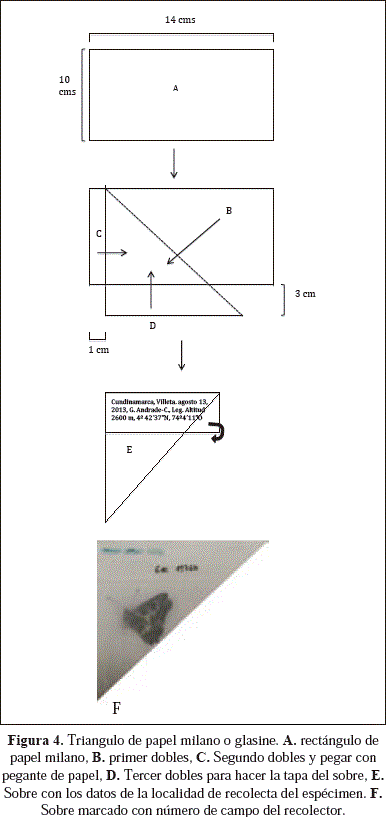
Una vez recolectado el ejemplar colóquelo entre el sobre (Figura 4E), en la tapa se debe colocar los datos de la localidad de recolecta en siguiente orden Departamento, municipio, vereda o inspección de policía, lugar, fecha de recolecta, nombre del recolector, altitud, y coordenadas geográficas tomadas con un GPS directamente en campo y numero de campo del recolector; también puede colocar en la tapa del sobre el nombre del recolector y su numero de campo y en la libreta de campo los respectivos datos de la localidad de recolecta (Figura 4F).
3.1.2 Técnica de relajación o ablandamiento de ejemplares secos
Después de recolectar los ejemplares, se recomienda realizar los montajes en el menor tiempo posible, pero si han pasado más de 3 días, es necesario ablandar los ejemplares, para poder realizar el montaje. Los ejemplares deben ser rehidratados en cámaras húmedas. (Figura 5). A continuación se enumerarán los pasos recomendados para realizar el ablandamiento.

a. Tome los sobres de los ejemplares recolectados y cerciórese que cada sobre posea los datos de procedencia o tengan el respectivo código del recolector.
b. Seleccione un recipiente hermético adecuado según la cantidad y tamaño de los ejemplares que van a ser hidratados.
c. Introduzca en el recipiente un papel o paño absorbente y humedezca con agua de grifo suficientemente pero sin exceso, es decir que no se haga una laguna en el recipiente y agregue cerca de 1 cc de alcohol al 70% para evitar que se produzcan hongos y el material se pueda dañar.
d. Se recomienda colocar en la base del recipiente una malla para evitar el contacto directo del papel o paño con el sobre de papel que contiene la mariposa.
e. Deje durante 24 a 48 horas máximo el ejemplar para que se hidrate, hasta que adquiera la soltura suficiente, como si estuviese recién recolectado.3.1.3 Técnica de montaje
Antes de iniciar el montaje se recomienda realizar un masaje en los músculos alares previamente a la extensión alar, este masaje se realiza ejerciendo una presión digital suavemente en el tórax del ejemplar y con ayuda de pinzas entomológicas presionando el borde costal de las alas anteriores con movimientos suaves tanto de apertura como de extensión alar.
a. Después de tener el ejemplar relajado, proceda a su montaje en una base de madera de balso o de poliestireno expandido o icopor (Figura 6), de la siguiente manera: Abra las alas con ayuda de pinza entomológica de punta plana y sin estrías (Figura 22E), inserte el alfiler entomológico N° 1 o 2 en el centro del mesotórax, (según desee extender el ejemplar, es decir ventral o dorsalmente).


b. Mediante ayuda de una tira de papel milano o plástico delgado sujete las alas del ejemplar a la superficie de la tabla de extensión. (Figura 6).
c. Con ayuda de pinzas de punta plana o alfileres entomológicos suba o baje según sea el caso, las alas anteriores, posicionando el borde inferior en ángulo de 900 respecto al cuerpo del ejemplar, ancle con alfileres la tira de papel bordeando la superficie del ala (no rompa el ala) y termine de posicionar las alas posteriores con un ángulo de abertura de 150 o 200. De igual manera realice este procedimiento con ayuda de alfileres para sujetar el ala, pero no rompa la membrana alar, tenga cuidado de solo utilizar la inserción de los alfileres alrededor de los bordes alares para presionar. (Figura 6).
d. Se recomienda realizar montaje tanto dorsal como ventral especialmente en grupos de coloración obscura o transparente o de difícil determinación como Nymphalidae (Satyrini - Ithomiini); Hesperiidae, Riodinidae y Lycaenidae.
e. En el caso del montaje de mariposas de la subfamilia Dismorphinae, hay que dejar visible la mancha androconial ya que esta es un buen carácter de identificación a nivel de especie (Figura 7A) y para la subfamilia Heliconiinae, debe quedar visible la mancha que esta en el margen costal del ala posterior, (Figura 7B).

f. Los ejemplares deben quedar en lugares frescos y con poca luz durante mínimo cuatro o cinco días y según las condiciones ambientales, es decir si los días son muy lluviosos es preferible dejarlos mas tiempo.
3.1.4 Cajas entomológicas en una colección de mariposas
3.1.4.1 Caja tipo Cornell
La caja en donde se deposita el ejemplar en una colección tiene una medida estándar (48.3 x 42 x 7.7 cm) elaborada en madera con tapa de vidrio para ver el interior. En su interior se coloca una lámina de espuma elaborada con base en un polímero termoplástico conformado por etileno vinil acetato de color blanco con un espesor de 1 cm. (Figura 8).

La caja en su exterior debe llevar varios rótulos o etiquetas que contengan información sobre el orden, familia, subfamilia, tribu, género, especie y subespecie, dependiendo del caso. Se recomienda que la caja sea elaborada en una madera no demasiado delgada o extra gruesa, y debe estar barnizada con laca transparente. (Figura 9).

Estas cajas, con los ejemplares de mariposas se encuentran en muebles compactos con cierre hermético, este tipo de muebles sirven para ahorrar espacio ya que mientras no está en uso la colección se mantienen cerrados sus módulos (Figura 10).

3.1.4.2 Caja tipo Schmidtt
Esta caja tiene una dimensión de 22.9 x 33 x 6.4 cm, sirve para depositar mariposas extendidas pero también pueden ser usadas para mantener duplicados de ejemplares en triángulos de papel milano. (Figura 11).

3.2 Preservación en líquido
Para preservar los órganos genitales después de su extracción, se deben guardar en micro vial de polietileno o de vidrio, de 4 mm de diámetro (2.5 mm x 10 mm) en su interior se deposita glicerina, este micro vial debe tener un número de disección del órgano genital, el cual debe corresponder con una copia de esta etiqueta que debe tener el ejemplar del cual se extrae.
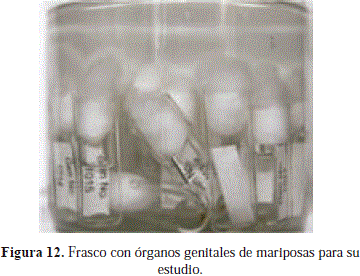
Se pueden archivar de dos formas: adjuntar el micro vial al ejemplar o almacenar varios en un frasco de mayor tamaño, el cual es saturado con alcohol al 70% (Figura 12), este recipiente debe ser rotulado para una mejor ubicación de las muestras. Es necesario que se revisen periódicamente los frascos, con el fin de reponer el alcohol evaporado o cambiarlo, según sea necesario. Se recomienda destinar un lugar fresco, oscuro y seco para la ubicación de las muestras y así, evitar su deterioro (Márquez 2005).
3.3 Preservación en preparaciones
Es común, en algunos casos, que se necesiten realizar preservaciones de ejemplares o de sus partes en laminas portaobjetos, se recomienda emplear materiales de larga durabilidad y naturaleza neutra para garantizar su preservación a futuro. Antiguamente era muy común el montaje de escleritos, partes u órganos genitales en láminas portaobjeto y aún en algunas colecciones se continúa con esta tradición, sin embargo, no recomendamos esta técnica debido a que las estructuras quedan fijadas y no permiten ver la dimensionalidad completa de la estructura.
3.4 Colección de tejidos
3.4.1 Procedimientos toma de muestras de ADN en fresco
Lo ideal es tomar el tejido inmediatamente después del sacrificio de la mariposa. Es necesario que en el campo se tengan los reactivos e implementos necesarios, pinzas, tijeras finas de disección (Figura 22D), tubos para PCR también llamados tubos Eppendorf (Figura 13C) y según sea el caso, el reactivo elegido para su almacenamiento, alcohol analítico, nitrógeno líquido o DMSO/EDTA (Figura 13E). (Márquez 2005, Shokralla et al. 2010, Salazar et al. 2010, Gemeinholzer et al. 2010). Si no se cuenta en campo con todos los implementos necesarios para la adecuada preservación de las muestras, se recomienda que el procedimiento se realice antes de llevar a cabo el proceso de ablandamiento en el laboratorio, antes de su montaje. Lo anterior debido a que la humedad que requiere este proceso, es un factor que degrada el ADN.

Cualquier parte del cuerpo de un ejemplar podría ser usada para análisis molecular, sin embargo, se recomienda tomar como muestra dos patas. Esto se hace porque es importante mantener un voucher, o registro, que conserve el valor taxonómico del ejemplar y que pueda ser usado en estudios de tipo morfológico. Como recomendación, se pueden desprender las dos patas del ejemplar para ser guardadas en seco en un vial esteril.
Para tomar el tejido se usan unas pinzas de punta fina (Figura 13B) y tijeras esterilizadas (Figura 22F), estos implementos en cada ejemplar deben ser esterilizados. Posteriormente, se deposita la muestra en un tubo para PCR estéril (Figura 13C), debidamente etiquetado y que contenga el reactivo elegido para el almacenamiento de la muestra (Figura 13E), (Gemeinholzer et al. 2010).
3.4.2 Procedimiento para preservación en colección de tejidos
Una colección de tejidos se realiza con el fin de preservar las muestras de especímenes y busca garantizar su integridad para que puedan ser usadas en análisis moleculares. Es necesario destinar un espacio acondicionado para su mantenimiento y establecer protocolos para su manejo. Existen varias alternativas en la obtención, manejo y transporte de muestras, para el trabajo con mariposas se resaltan dos, el congelado en seco y en líquido.
Una vez obtenido el tejido, se debe procurar que no esté expuesto a factores como, cambios de pH (Mesa 2006) y temperaturas altas, ya que las enzimas y reacciones químicas que degradan el ADN tienen un óptimo de funcionamiento alrededor de los 37-40 °C. Se recomienda congelar las muestras, en refrigeradores que las mantengan a -20°C; refrigeradores Ultra (-80°C) o, idealmente, usando Nitrógeno líquido que las puede mantener a -180°C (Doorenweerd & Beentjes 2012). Si es necesario transportar las muestras, se recomienda el uso de neveras con hielo seco para mantener la temperatura óptima.
4. Etiquetas
Las etiquetas que llevan las mariposas una vez son ingresadas a una colección, obligatoriamente son dos, la primera es localidad de recolecta o de procedencia y la segunda número de catálogo de la colección donde se deposita el ejemplar, no obstante después de las dos anteriores pueden existir más etiquetas como por ejemplo, una con el número de campo del recolector otra con el número consecutivo de la disección de los órganos genitales, cuando al ejemplar se le quitado su abdomen para su extracción y análisis.
El tipo de papel usado para hacer las etiquetas debe ser totalmente libre de ácido y de hongos y con un pH de 7.5, de color blanco.
4.1 Etiqueta localidad de recolecta o de procedencia.
Esta etiqueta debe contener los datos básicos de recolecta en el siguiente orden Departamento, municipio, inspección de policía, vereda, localidad exacta, fecha (día, mes, año, siempre debe escribir en palabras el respectivo nombre del mes, por ejemplo mayo, julio, en el caso de meses como septiembre, noviembre o diciembre que su escritura es larga se recomienda abreviar como Sep. Nov. Dic.; nunca haga referencia al mes utilizando la numeración romana ya que esto puede llevar a confusiones posteriores), coordenadas geográficas exactas del lugar de recolecta tomadas con un GPS. Nombre del recolector y altitud dada en metros. (Figura 14A).

4.2 Etiqueta identificación
Se recomienda que cuando se identifique el nombre de la especie o subespecie al cual pertenece el ejemplar se escriba el responsable de hacer dicha identificación y el año.
Cuando escriba el nombre de la categoría taxonómica utilizada debe tener en cuenta lo que indica el Código Internacional de Nomenclatura Zoológica en el sentido que todo nombre de una especie está compuesto de dos palabras (género y epíteto específico) y el nombre de una especie esta compuesto de tres palabras (género, epíteto específico y epíteto subespecífico) en cualquiera de estas dos categorías siempre debe escribir el autor y año de dicha categoría, (Figura 14B).
4.3 Etiqueta número de campo del recolector
Esta etiqueta, aunque no es muy utilizada por los entomólogos, hace referencia a un número consecutivo que lleva la persona que hace la recolección de la mariposa, el cual esta relacionado en su libreta de campo. (Figura 14C)
4.4 Etiqueta catálogo de la colección donde se deposita ejemplar
Cada colección debe tener un número consecutivo de catálogo el cual identifica al ejemplar que se deposita, antecedido de un acrónomino de la colección donde está depositado el ejemplar, este número de catálogo debe ser único para este ejemplar, (Figura 14D), también se utiliza como código de barras, (Figura 14E).
4.5 Etiqueta órganos genitales
Se utiliza para identificar el órgano genital que se le disecciona al ejemplar con fines de identificación, es un número consecutivo que lleva tanto el ejemplar como la estructura retirada. (Figura 14F).
4.6 Etiqueta ejemplar Tipo
Se utiliza para identificar un ejemplar designado como tipo nomenclatural, para tal fin internacionalmente se acostumbra diferentes colores para cada tipo, así, holotipo y/o alotipo, color rojo (Figura 15A), paratipo color azul o amarillo (Figura 15B).

5. Metodologías de muestreo
Para el muestreo de mariposas en estudios de biodiversidad existen muchas técnicas, la elección de alguna de ellas debe ser acorde con los objetivos de la investigación que quiera realizar.
5.1 Binoculares
Se ha vuelto costumbre entre los que estudian mariposas, la utilización de binoculares para la identificación de especies y hasta de subespecies y se ha llegado hasta la idea de recomendar esto como una técnica de identificación (Villareal et al. 2004). No es un método recomendable, porque no es posible identificar una mariposa a nivel de especie o subespecie por intermedio de binoculares, ya que es necesario observar pequeñas estructuras, tamaños de manchas o tonos del color en sus alas, tanto en vista dorsal como ventral, y a veces es necesario analizar sus órganos genitales.
Por lo anterior no se recomienda la utilización de esta técnica con fines de identificación, sin embargo, puede ser utilizada para observación de ejemplares importantes de recolectar o la simple observación de las mariposas en su medio natural, ya que para observarlas no es necesaria su recolección.
5.2 Muestreo con Trampas van Someren Rydon
El muestreo con Trampas van Someren Rydon es fundamental en el estudio de las mariposas diurnas, se usa desde la década de 1960 para incrementar la eficiencia de los muestreos (Brown & Freitas 2000) y constituye una técnica complementaria a la captura directa con red entomológica o para cuando se quiere estudiar gremios alimenticos.
Se utilizan diversos tipos de cebos, estos se eligen de acuerdo al estudio que se pretenda realizar, así como las condiciones ambientales que presenta el área de interés. En el neotrópico, los cebos más usados actualmente son banano fermentado, pescado en descomposición y excremento (Raguso & Llorente-Bousquets 1990, Brown & Freitas 2000, Grøtan et al. 2012). En diversos estudios se ha determinado que estas trampas tienen un rango de acción de hasta 50 m (DeVries 1987), por lo que no es recomendable usar trampas con cebos distintos en una distancia menor.
Para estudios de índole ecológico, como los de monitoreo de poblaciones y comunidades de mariposas, se recomienda usar un mínimo de cinco trampas por transecto, con el fin de facilitar el posterior análisis y comparación con otros estudios de este tipo. (Daily & Ehrlich 1995, Uehara-Prado et al. 2007, Uehara-Prado et al. 2009a, Uehara-Prado et al. 2009b, Tufto et al. 2012). Además, se recomienda que el diseño del muestreo incluya al menos, una réplica de cada transecto, procurando que los sitios en que se instalen las trampas, presenten condiciones ambientales, bióticas y abióticas, similares (Tufto et al. 2012) (Figura 2A).
Las trampas, cebadas con el mismo atrayente, pueden ponerse entre 20 y 50 metros entre sí (Uehara-Prado et al. 2007). La distancia entre trampas de 50 m, recomendada en otros trabajos (Villareal et al. 2004) puede limitar el diseño del muestreo, en el sentido de que en el paisaje neotropical, sobretodo en el andino, los relictos de algunas coberturas vegetales presentan áreas bastante disminuidas y su medida lineal no es suficiente para completar los transectos con trampas (Figura 16).

Se recomienda colgar las trampas entre 1 y 3 metros por encima del suelo, dependiendo de la estructura de la vegetación y altura del dosel (Daily & Ehrlich 1995). Para mejorar la acción de los cebos, es recomendable que las trampas duren, por lo menos, 48 horas en su lugar de instalación y la revisión debe hacerse periódicamente (DeVries 1987).
Cuando instale estas trampas busque que el lugar donde se ubica no este en un área en donde se tenga mucho viento ya que este hace que la trampa se mueva mucho y este movimiento termina por asustar a las mariposas que ingresan a la TVSR. (Figura 2B).
5.3 Búsqueda de mariposas en transectos definidos
Hay que tener un recorrido con un tamaño definido, según sea el objetivo del muestreo, a lo largo de coberturas vegetales específicas, estos se recorren con red entomológica, en un horario establecido, procurando siempre que el esfuerzo de muestreo para todos los transectos sea similar. Los transectos deben ser independientes entre sí y cada uno de ellos constituye una unidad muestreal, este es un método sistemático que permite determinar patrones de comportamiento de las mariposas. Uno de sus mayores limitantes es que el registro de especies raras es reducido (Pozo et al. 2005).
5.4 Búsqueda libre de mariposas
Se realizan recorridos con la red entomológica, en horarios definidos, el horario más usado es entre las 9:00 y 18:30 o a veces 19 horas, para completar el registro de especies que presentan hábito crepuscular como son ejemplares de la tribu Morphini (Antirrhea, Caerois) y Brassolini (Caligo, Brassolis, Catoblepia, Dynastor, Eryphanis, Opsiphanes, etc). Según sea el objetivo del muestreo, se debe tener en cuenta recorrer los distintos tipos de vegetación que encuentre en su área de estudio, registrar el tiempo que se permanece en cada una de ellas y la hora en que se recorre. Esta técnica se enfoca en puntos o sitios óptimos para la presencia de mariposas, por lo que se requiere experiencia y conocimiento, tanto del área de muestreo, como de las mariposas presentes. Presenta una limitante, en cuanto al registro de especies comunes, que suelen ser poco registradas con este método (Pozo et al. 2005).
5.5 Método de captura-marcaje-recaptura
Esta técnica ha sido usada para lograr una estimación de la abundancia, dinámica poblacional, actividad de vuelo, longevidad, tasas de dispersión y de supervivencia de las mariposas (Turner 1971, Kingsolver 1999, Matter et al. 2004), así como para estudios de calidad de hábitat y conectividad (Haddad & Tewksbury 2005).
Lo primero que se debe hacer es seleccionar el área determinada para el muestreo (Scott 1975), dependiendo de los objetivos del trabajo, la(s) especie(s) de interés, sus hábitos y hábitat. Dentro del área elegida, se programan jornadas de captura de individuos, procurando que en cada jornada el esfuerzo de muestreo sea similar.
Durante cada jornada de captura se procede a realizar búsqueda de las mariposas de interés y su captura mediante red entomológica. Se debe ser muy cuidadoso con las mariposas capturadas, procurando no hacerles ningún daño, por lo que es recomendable manipularlas con pinzas (Figura 22E). (Sheppard & Bishop 1973).
Se marcan los individuos en la región media del ala posterior izquierda, lado ventral, en donde se encuentra la celda discal, (Figura 17), con un marcador indeleble de punta extrafina. La marca consiste en un número o código único para cada mariposa (Kingsolver 1999, Rivera et al. 2005). En su libreta de campo debe registrar el código, sexo, hora y sitio de captura, nombre de la especie, así como el estado de los individuos y datos de su comportamiento (Turner 1971, Mallet et al. 1987, Baguette 2003).

Después de tomar los datos necesarios, los individuos capturados se liberan. De acuerdo con los objetivos de la investigación, se definen las unidades de tiempo en que se realizan las jornadas de recaptura, así como la duración y frecuencia de estas.
6. Procedimientos para identificación taxonómica de mariposas
6.1 Técnica de preparación de órganos genitales
En los procesos de identificación taxonómica de muchas especies y subespecies de mariposas, es necesario realizar la disección de los órganos genitales con el fin de corroborar o tener certeza en la identificación, esta disección se realiza retirando el abdomen del ejemplar con ayuda de unas tijeras de punta fina (Figura 22F) y sumergiéndolo en una solución de KOH al 10%, se deja actuar esta solución por cerca de 24 horas, o también se puede colocar el abdomen en un vial de vidrio (Figura 22 I) con KOH al 10% y dejarlo al baño de María por 15 minutos con el agua en ebullición.
Una vez realizado cualquiera de los pasos anteriores se puede dar inicio a la respectiva disección bajo un estereoscopio de investigación (Figura 18), coloque el abdomen en una caja de Petri con alcohol al 70% y con la ayuda de un pincel de punta fina (Figura 22A), limpie las escamas que están en el abdomen, hasta que quede completamente limpio, en seguida cambie el alcohol y con dos agujas finas de disección (Figura 22H) inicie a romper el abdomen por un lado hasta que encuentre el órgano genital, hay que tener mucho cuidado, debido a que las estructuras pueden estar aun muy adheridas a las membranas o las estructuras están aun muy duras y esclerosadas y por ende son muy delicadas. Una vez extraídas totalmente, es necesario neutralizar con ácido acético y enjuagar con agua destilada para evitar la transparentación total y pérdida de estas estructuras en el futuro.

6.3 Transparentación alar o Aclareo de alas
La transparentación alar o aclareo de alas es otro proceso importante en la búsqueda de caracteres taxonómicos y requiere de un procedimiento sencillo pero delicado. (Figura 19).

La técnica consiste en los siguientes pasos:
a) Desprenda las alas del tórax de los ejemplares
b) Sumérjalas suavemente en Hipoclorito de sodio por cerca de 30 min
c) Enjuague con agua destilada suavemente.
d) Con ayuda de pincel suave remueva las escamas de la superficie alar.
e) Seque al aire libre por media hora en una superficie lisa f) Transfiera mediante pinzas las alas transparentadas a una lámina portaobjetos.
6.4 Identificación de especies y subespecies
Los procesos de identificación de especies o subespecies pueden ser una tarea de paciencia y mucho trabajo, especialmente en especies raras o poco abundantes, o de grupos taxonómicos poco conocidos donde el trabajo taxonómico es aún incipiente y faltan especialistas junto con literatura asociada.
Los caracteres taxonómicos más empleados para la identificación de especies o subespecies son los patrones de coloración, la forma alar, las bandas y algunas estructuras especiales como palpos, patas y órganos genitales. En algunos casos es necesario realizar comparaciones con descripciones originales que pueden muy dispendiosas y tomar mucho tiempo.
Actualmente cada grupo taxonómico presenta literatura especializada, listas de chequeo y especialistas, por lo cual, es recomendado después de realizar el proceso de identificación, determinar los ejemplares con dudas taxonómicas y ponerse en contacto con personal especializado. Actualmente se cuenta con la lista de chequeo para las mariposas neotropicales de Lamas, 2004 y la lista ilustrada de mariposas de las Américas de Warren et al., 2013, ayudas invaluables en los procesos de identificación y corroboración taxonómica de las especies.
6.5 Clasificación
El orden Lepidoptera está dividido en tres subordenes Zeugloptera, Aglossata y Heterobathmiina, este último tiene dos divisiones Monotrysia y Ditrysia, esta última tiene dos secciones Tineina y Cossina, esta última tiene dos subsecciones Cossina y Bombycina y en esta última están las polillas y mariposas.
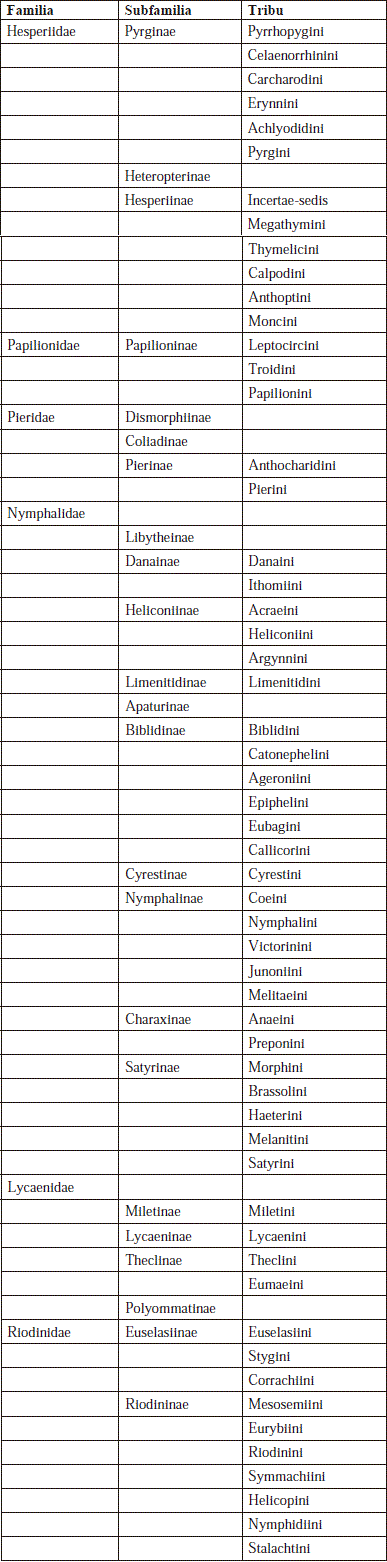
Colombia cuenta con 3274 especies de mariposas de las cuales 350 son endémicas y 10 están amenazadas, Andrade-C. et al. 2012. Están incluidas en seis 6 familias y 23 subfamilias y 56 tribus, (Warren, 2013) así:
7. Fotografía
Para la toma de fotografías de ejemplares de mariposas se utiliza un trípode con una cámara digital tipo réflex de cualquier marca, que contenga 18 Mp, lente de zoom de 17 - 40 mm. (Figura 20), y una caja de Luz blanca.

Coloque la mariposa al interior de la caja y ubique sus etiquetas a la misma altura de la mariposa, coloque una reglilla con escala entre 0 y 5 centímetros y proceda a tomar la fotografía. (Figura 21).

Referencias
Andrade-C. M. G., J. Betancur, E. Forero, J. Lynch, F.G. Stiles, A. Prieto-C. 2012. In. Suárez-Mayorga, A.M. y J.C. Bello, (compiladores). Marco técnico y operativo para la construcción de la Estrategia del INB. Esquema conceptual y operativo para el desarrollo de la Enibio. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt y Ministerio de Ambiente y Desarrollo Sostenible. Bogotá, D.C., Colombia. 72 pp. [ Links ]
Baguette, M. 2003. Long distance dispersal and landscape occupancy in a metapopulation of the cranberry fritillary butterfly. Ecography 26(2): 153-160. [ Links ]
Brown, K.S. & A.V.L. Freitas. 2000. Atlantic Forest butterflies: indicators for landscape conservation. Biotropica 32: 934-956. [ Links ]
Daily, G.C., & P.R. Ehrlich. 1995. Preservation of biodiversity in small rain forest patches: rapid evaluations using butterfly trapping. Biodiversity and Conservation 4:35-55. [ Links ]
DeVries, Ph.J. 1987. The butterflies of Costa Rica and their natural history. Papilionidae, Pieridae, Nymphalidae : 327 pp. Princeton University Press, New Jersey. [ Links ]
Doorenweerd, C. & K. Beentjes. 2012. Extensive guidelines for preserving specimen or tissue for later DNA work. http://science.naturalis.nl/. [ Links ]
Gemeinholzer, B., I. Rey, K. Weising, M. Grundmann, A.N. Muellner, H. Zetzsche, G. Droege, O. Seberg, G. Petersen, D.M. Rawson, L.A. Weigt. 2010. Organizing specimen and tissue preservation in the field for subsequent molecular analyses. IN: ABC-Taxa, Volume 8 - Manual on Field Recording Techniques and Protocols for All Taxa Biodiversity Inventories, Chapter 7, 129-157. [ Links ]
Grøtan, V., R. Lande, S. Engen, B.-E. Saether, Ph.J. DeVries. 2012. Seasonal cycles of species diversity and similarity in a tropical butterfly community. Journal of Animal. Ecology. 81: 714-723. [ Links ]
Haddad, N.M. & J.J. Tewksbury. 2005. Low quality habitat corridors as movement conduits for two butterfly species. Ecological Applications 15: 250-257. [ Links ]
Kingsolver, J.G. 1999. Experimental analyses of wing size, flight, and survival in the western white butterfly. Evolution 53(5): 1479-1490. [ Links ]
Lamas, G. 2004. (Ed.). Atlas of Neotropical Lepidoptera, Checklist: part 4A Hesperioidea - Papilionoidea. Scientific Publisher/Association of Tropical Lepidoptera. Gainesville, U.S.A. [ Links ]
Llorente, J. 1990. La búsqueda del método natural. Fondo de Cultura Económica, México, D.F., 157 p. [ Links ]
Llorente, J. & D. Castro. 2002. Colecciones entomológicas en instituciones taxonómicas de Iberoamérica: ¿Hacia estrategias para el inventario de la biodiversidad?, pp. 307-318. En: C. Costa, S. A. Vanin, J. M. Lobo & A. Melic (Eds.). Proyecto de Red Iberoamericana de biogeografía y entomología sistemática, PRIBES 2002. M3M Monografías Tercer Milenio, vol. 2. Sociedad Entomológica Aragonesa (SEA) & CYTED, Zaragoza. [ Links ]
Mallet, J., J.T. Longino, D. Murawski, A. Murawski & A. Simpson de Gamboa. 1987. Handling effects in Heliconius: where do all the butterflies go? Journal of Animal Ecology 56(2): 377-386. [ Links ]
Márquez, L.J. 2005. Técnicas de colecta y preservación de insectos. Boletín Sociedad Entomológica Aragonesa. 37: 385-408. [ Links ]
Matter, S.F., J. Roland, A. Moilanen, and I. Hanski. 2004. Migration and survival of Parnassius smintheus: detecting effects of habitat for individual butterflies. Ecological Applications 14(5): 1526-1534. [ Links ]
Mesa, D.P. 2006. Protocolos para la preservación y manejo de colecciones biológicas. Boletin Cientifico - Centro de Museos - Museo de Historia Natural. 10: 117-148. [ Links ]
Pozo, C., J. Llorente-Bousquets, A. Luis, I. Vargas y N. Salas. 2005. Reflexiones acerca de los métodos de muestreo para mariposas en las comparaciones biogeográficas, pp. 203-215. En: Llorente, J. & J.J. Morrone. (Eds.). Regionalización biogeográfica en Iberoamérica y tópicos afines: Primeras Jornadas Biogeográficas RIBES Las Prensas Ciencias, Fac. Ciencias, UNAM. México, D.F. [ Links ]
Raguso, R.A. & J.E. Llorente-Bousquets. 1990. The butterflies (Lepidoptera) of the Tuxtlas Mts., Veracruz, Mexico, revisited: Species- richness and habitat disturbance. J. Res. Lep., 29: 105-133. [ Links ]
Salazar, C., S.W. Baxter, C. Pardo-Diaz, Wu. G. Surridge A., M. Linares, E. Bermingham, C.D. Jiggins. 2010. Genetic Evidence for Hybrid Trait Speciation in Heliconius Butterflies. PLoS Genet 6(4): e1000930. doi:10.1371/journal.pgen.1000930 . [ Links ]
Scott, J.A. 1975. Flight patterns among eleven species of diurnal Lepidoptera. Ecology 56 (6): 1367-1377. [ Links ]
Sheppard, P.M., & J.A. Bishop. 1973. The study of populations of Lepidoptera by capture-recapture methods. Journal of Research on the Lepidoptera 12(8) :135-144. [ Links ]
Shokralla, S., G. Singer, M. Hajibabaei. 2010. Direct PCR amplification and sequencing of specimens' DNA from preservative ethanol. BioTechniques 48(3): 233-234. [ Links ]
Rivera, J.M., C.E. Prieto Sierra, & C. Takegami. 2005. Estructura poblacional de Morpho sulkowskyi Kollar, 1850 (Lepidoptera: Nymphalidae) en un sector de la cordillera occidental, departamento del Cauca (Colombia). Entomotrópica 20(1): 15-22. [ Links ]
Tufto, J., R. Lande, T.H. Ringsby, S. Engen, S. Saether, B.E. Walla, T.R. and Ph.J. DeVries. 2012. Estimating Brownian motion dispersal rate, longevity and population density from spatially explicit mark-recapture data on tropical butterflies. Journal of Animal Ecology 81: 756-769. [ Links ]
Turner, J.R.G. 1971. Experiments on the Demography of Tropical Butterflies. 11. Longevity and Home-range Behaviour in Heliconius erato. Biotropica 3(1): 21-31. [ Links ]
Uehara-Prado, M., & A.V.L. Freitas. 2009a. The effect of rainforest fragmentation on species diversity and mimicry ring composition of Ithomiinae butterflies.- Insect Conserv. Diver., 2: 23-28. [ Links ]
Uehara-Prado, M., J. de Oliveira Fernandes, A. de Moura Bello, G. Machado, A.J. Santos, F.Z. Vaz-De-Mello, A.V.L. Freitas. 2009b. Selecting terrestrial arthropods as indicators of small-scale disturbance: A first approach in the Brazilian Atlantic Forest. Biological Conservation, Volume 142, Issue 6., 1220-1228. [ Links ]
Uehara-Prado, M., K.S. Brown, and A.V.L. Freitas. 2007. Species richness, composition and abundance of fruit-feeding butterflies in the Brazilian Atlantic Forest: comparison between a fragmented and a continuous landscape. Global Ecology and Biogeography, 16: 43-54. [ Links ]
Villareal, H., M. Álvarez, S. Córdoba, F. Escobar, G. Fagua, F. Gast, H. Mendoza, M. Ospina, & A.M. Umaña. 2004. Manual de métodos para el desarrollo de inventarios de biodiversidad. Programa de Inventarios de Biodiversidad. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. Bogotá, Colombia. 236 pp. [ Links ]
Warren, A.D., K.J. Davis, E.M. Stangeland, J.P. Pelham & N.V. Grishin. 2013. Illustrated Lists of American Butterflies.[20-VII-2013] [ Links ].
Recibido: 16 de agosto de 2013
Aceptado para su publicación: 6 de septiembre de 2013













