Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales
Print version ISSN 0370-3908
Rev. acad. colomb. cienc. exact. fis. nat. vol.37 no.145 Bogotá Oct./Dec. 2013
CIENCIAS BIOMÉDICAS
Luis Alberto Gómez-Grosso*
* Profesor Titular, Catedrático. Departamento de Ciencias Fisiológicas. Facultad de Medicina, Universidad Nacional de Colombia. Investigador, Grupo de Fisiología Molecular, Dirección de Investigación en Salud Pública, Subdirección de Investigación Científica y Tecnológica. Instituto Nacional de Salud. Email: lgomez@ins.gov.co
RESUMEN
El objetivo de este estudio fue evaluar el preacondicionamiento isquémico, PCI, en cardiomiocitos ventriculares de cobayo adultos individuales y evaluar el perfil de expresión diferencial de microRNAs en estas células. Una supervisión de la morfología, de la actividad metabólica de las células cardíacas individuales aisladas en tiempo real, permite una evaluación de los cambios en la viabilidad de los cardiomiocitos y proporciona evidencia experimental de que el PCI tiene acción citoprotectora directa mediante la promoción de la supervivencia in vitro. La protección cardiaca por PCI asociada con la expresión diferencial de microRNAs específicos en cardiomicitos adultos aislados sugiere que algunos miRNAs están involucrados en lesión y cardioprotección.
Palabras clave: cardioprotección, preacondicionamiento, ensayo de MTT, tiempo real, cardiomiocitos, viabilidad, isquemia, Dinitrofenol, Adenosina.
ABSTRACT
The aim of this study was to evaluate the ischemic preconditioning, PCI, in single quiescent adult guinea-pig ventricular myocytes and assess the differential expression of microRNAs in these cells. Monitoring of the morphology of the metabolic activity of individual cardiac cells isolated in real time, allows evaluation of changes in the viability of the cardiomyocytes and provides experimental evidence that PCI has direct cytoprotective action by promoting survival in vitro. PCI cardiac protection associated with the differential expression of specific microRNAs in isolated adult cardiomyocytes suggests that miRNAs are involved in some injury and cardioprotection.
Key words: cardioprotection, preconditioning, MTT assay, real-time, cardiomyocyte, viability, injury, Dinitrophenol, Adenosine.
Introducción
Las enfermedades cardiovasculares son las principales causas de mortalidad y morbilidad en el mundo occidental. Estas enfermedades representan un gran espectro de entidades, que incluyen la enfermedad hipertensiva, la enfermedad cerebro-vascular, las cardiomiopatías y la enfermedad cardiaca isquémica, entre otras. Por lo tanto, una de las acciones necesarias es la búsqueda de nuevas herramientas terapéuticas lo cual requiere el descubrimiento y caracterización de dianas esenciales para promover la sobrevivencia y la homeóstasis metabólica de células cardiacas, entre otras acciones (World Health Organization, 2011, Gomez, 2011).
La isquemia miocárdica es el desbalance que ocurre entre la suplencia y la demanda de oxígeno en el tejido miocárdico. Su causa más frecuente es la arteriosclerosis de las arterias coronarias; sin embargo, existen otros factores que disminuyan el flujo coronario como los trombos, émbolos, espasmos coronarios, la hipertrofia ventricular secundaria a hipertensión arterial y la anemia grave. Durante la oxigenación normal, el miocardio metaboliza ácidos grasos y glucosa a CO2 y agua. Cuando el tejido cardiaco es expuesto a hipoxia, los ácidos grasos no pueden ser oxidados y la glucosa es metabolizada a lactato, por lo cual se produce disminución del pH, de los fosfatos de alta energía y del fosfato de creatina. La función de la membrana celular se altera, lo cual lleva a liberación de potasio, captación de sodio y cambios en las concentraciones de calcio libre por los cardiomiocitos. La severidad y duración de la hipoxia determinan si los cambios celulares son transitorios o permanentes, en cuyo caso la célula muere (Buerke et al., 1994; Gomez et al., 1997).Durante las dos últimas décadas, se ha producido un renacimiento del estudio de la biología celular y molecular de las células cardiacas en la investigación cardiovascular básica, impulsado en primer lugar por la necesidad de entender las funciones fundamentales de las células cardiacas y sus cambios por la acción de nuevos fármacos para mantener o reponer un número funcional de células cardiacas, un reto de la medicina regenerativa, y en segundo lugar, principalmente por el desarrollo de tecnologías que incluyen las estaciones de trabajo de aislamiento de células cardiacas individuales, estaciones de imágenes de microscopía, de micro-matrices de ácidos nucleicos y nuevos reactivos y herramientas diseñados para monitorear cambios en la actividad y localización de moléculas a nivel celular y subcelular (Taylor, 2001; Klauke, 2003).
Una de las áreas de mayor investigación en el área de la cardiología molecular está orientada a definir los determinantes moleculares involucrados en la hipoxia cardiaca, en la supervivencia y funcionalidad de los cardiomiocitos y en los mecanismos moleculares de un fenómeno de cardioprotección conservado, que protege al corazón de la hipoxia y estrés metabólico y físico, conocido como preacondicionamiento isquémico cardiaco (PCI) (Murray, 1986; Gomez, 1997; Marber, 2000; Amstrong, 2004, Gross, 2013). No obstante, la mayoría de las investigaciones en PCI se han realizado en corazones completos y pocas en células cardiacas aisladas.
El cultivo primario de cardiomiocitos adultos aislados proporciona un modelo experimental útil para las investigaciones de los mecanismos de regulación implicados en la lesión cardíaca y en las respuestas citoprotectoras a diversas condiciones experimentales (Haworth,1980; Jacobson, 1986, Buerke, 1994; Gómez, 1997, Marber, 2000). Sin embargo, el estudio de la viabilidad y la biología molecular de los cardiomiocitos primarios adultos aislados y los efectos directos de condiciones que pueden inducir la protección, así como de agentes con potencial efecto cardioprotector o cardiotóxico sobre la supervivencia celular son limitados, en parte por la dificultad de obtener y mantener en cultivo cardiomiocitos primarios (Gómez, 1997; Ladilov, 1998; Arstall, 1998).
La viabilidad celular es uno de los indicadores finales estándar que se ha utilizado como una medida del efecto de la lesión celular de la isquemia y la toxicidad cardiaca, así como de la acción protectora de agentes exógenos (Vander Heide, 1990; Ohata, 1994; Armstrong, 1997). Varios ensayos de viabilidad de cardiomiocitos se han utilizado para determinar la supervivencia de los cardiomiocitos adultos. En general, se encuentra concordancia entre los diferentes ensayos; sin embargo, sólo unos pocos sistemas de evaluación de la viabilidad cubren varios aspectos de la lesión cardiaca, tales como cambios metabólicos y morfológicos, que se pueden lograr con el examen simultáneo de la integridad de la membrana y del citoplasma, en el transcurso del tiempo (Vidal, 1996; Gómez, 1997; Zarvazyan N, 1998; Andersson, BS, 1999).
Por otra parte, recientemente se ha encontrado que un número de microRNAs (miRNAs) funcionan en el corazón. Los miRNAs son moléculas de RNA endógenos de ∼21-25 nucleótidos que regulan la expresión a nivel postranscripcional por hibridación en regiones 3' de mARN diana. Su expresión es específica de tejidos y regulan la expresión de genes que participan en viabilidad, proliferación y diferenciación celular, entre otros, por medio de un mecanismo de interferencia de miRNAs que representa una de las más recientes adiciones a la complejidad que caracteriza el procesamiento de la información entre el núcleo y el citoplasma en la regulación de la trascripción y de la traducción (Ambros, 2004, van Rooij, 2007).
Investigaciones recientes en miRNAs han proporcionado un mejor conocimiento sobre el circuito genético integrado, que define procesos celulares básicos como la diferenciación, la viabilidad, la proliferación, la apoptosis, que cuando son alterados pueden asociarse con la patogénesis de enfermedades como el cáncer y las enfermedades cardiovasculares (van Rooij, 2007, Hofsli, 2013). La amplia distribución de este novedoso mecanismo, el cual controla la expresión genética y el paradigma aceptado de que las enfermedades crónicas, como las enfermedades cardiovasculares, son entidades multifactoriales, que resultan de una compleja interacción entre genes y ambiente sugieren un ligamiento entre procesos dependientes de miRNAs y enfermedades crónicas. De hecho, ya se ha demostrado la expresión alterada de miRNAs en el proceso tumorigénico (Babashah, 2011, Hofsli, 2013).
En contraste con el cáncer, muy poco se ha explorado sobre los perfiles de expresión de miRNAs en enfermedades cardiovasculares para descubrir si están alterados y puedan constituirse en moléculas que estén involucradas en estas enfermedades. Recientemente se encontró que los microRNAs miR-1 y miR-133 regulan la expresión de los genes KCNJ2 y GJA1que codifican para la subunidad Kir2.1 de un canal de potasio y la conexina 43 respectivamente y participan en la homeostasis eléctrica del miocardio y en el desarrollo de hipertrofia cardiaca (Jang, 2007, van Rooij, 2007). Sin embargo, actualmente no se sabe de manera suficiente cuales miRNAs son expresados en células cardiacas aisladas y menos aun si participan en la viabilidad y protección contra la isquemia.
Nuestra hipótesis de trabajo, es que las células cardiacas responden y se adaptan a condiciones de lesión y se pueden proteger contra la isquemia por preacondicionamiento isquémico y que éste fenómeno puede estar regulado por RNA no codificante, tal como el RNA corto, incluyendo a los miRNAs reguladores de la expresión y estabilidad de genes específicos.
El objetivo de este trabajo fue examinar la viabilidad de cardiomiocitos aislados individuales en tiempo real, en células cardiacas adultas aisladas individuales sometidas a condiciones de lesión por isquemia simulada o exposición a dinitrofenol y a protección por preacondicionamiento isquémico o adenosina y comparar perfiles de expresión de miRNAs asociados con el preacondicionamiento de las células cardiacas aisladas.
Una evaluación simultánea de cambios en la morfología, en la actividad metabólica de los cardiomiocitos, en tiempo real, así como la identificación y cambios en expresión miRNAs asociados en cardiomiocitos preacondicionados, tienen el potencial para ser utilizados como una herramienta de investigación y bioprospección de nuevos medicamentos y de terapias con potenciales propiedades cardiotóxicas o cardioprotectoras.
Materiales y Métodos
Aislamiento de los cardiomiocitos adultos
Células cardíacas ventriculares tolerantes al calcio fueron aisladas mediante disociación enzimática (Gómez, 1997). En breve, cobayos adultos (200-300 g) se anestesiaron con pentobarbital (12 mg/100 g de peso, vía intraperitoneal). Tras la cardiotomía, el corazón fue perfundido retrógradamente / a 37 °C) con: medio 199 (Sigma, St Louis MO, EE.UU.) durante 2 a 3 minutos para eliminar la sangre, seguido de perfusión con Ca2+ 0EGTA-buffer "medio bajo en Ca2+" (Potencial de calcio 7) por 180-240 s, que contenía (en mM): NaCl 100, KCl 10, KH2PO4 1.2, MgSO4 5, glucosa 20, taurina 50, 10 HEPES (pH 7.2 hasta 7.4) y finalmente con medio bajo en Ca2+- que contenía (en P / v) pronasa E (0,8%, Sigma), proteinasa K (1,7%, Promega, Madison WI, EE.UU.) albúmina bovina (0,1%, fracción V, Sigma) y 200 mM de CaCl2. Los ventrículos se separaron de las aurículas y se cortaron pequeños fragmentos (6-10 mm3) en el medio bajo en Ca2+. Por último, las células individuales fueron aisladas por agitación del tejido (a 37 °C) en la misma solución suplementada con colagenasa (0.025mg/ml, Sigma). Después de 20 min, las células se filtraron a través de un filtro de nylon, se centrifugaron (a 35xg) y se lavaron dos veces con la solución baja en Ca2+. Fragmentos de tejidos restantes fueron re-expuestos a la colagenasa y el aislamiento se continuó durante tres ciclos. Para obtener una preparación enriquecida de miocitos ventriculares en reposo, con forma de bastón, las células de forma redonda y los desechos fueron separados mediante centrifugación diferencial y decantación (Jacobson, 1989). Los cardiomiocitos aislados se almacenaron en una solución de Tyrode (en mM) Glucosa 5,5, NaCl 136,5, KCl 5,4, MgCl 0,53, HEPES 5,5 y CaCl2 1,8 y luego se visualizaron usando un microscopio invertido (Nikon) y se tomaron microfotografías (Nikon Digital Sight DG U3). Los experimentos se realizaron con la aprobación del Comité Institucional para el empleo y cuidado de animales del Instituto Nacional de Salud de Colombia.
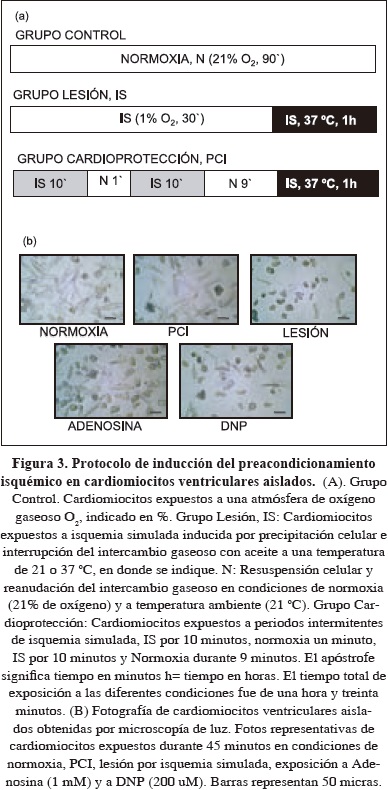
Isquemia simulada y preacondicionamiento isquémico
Se empleó un modelo de isquemia simulada letal (Armstrong, 1994) que se logra por la superposición de los cardiomiocitos (n=2.000) adultos aislados de cobayo (Cavia porcellus) compactados en un precipitado celular y cubiertos con aceite mineral, para reducir el intercambio gaseoso a 37 °C. El preacondicionamiento se logró exponiendo las células cardiacas aisladas del mismo grupo (n=2.000) a periodos breves de lesión por hipoxia (1% de O2) alternada con periodos cortos de suspensión en condiciones de normoxia (21% de O2) en una secuencia y tiempos previamente estandarizados (10 min en hipoxia, 1 min en reoxigenación, 10 min hipoxia, 9 min de reoxigenación), como se indica en la Figura 3.Evaluación de la viabilidad de las células cardiacas
Morfología y exclusión del Tripán azul
El número células se estimó usando un hemocitómetro y el ensayo de la exclusión del Tripán azul fue utilizado para correlacionar la morfología con la viabilidad cuando se indique. La viabilidad celular de cardiomiocitos aislados individuales se evaluó mediante el recuento de las células que excluían el Tripán azul (0,25%) (Gomez, 1997). Las células individuales se clasificaron en uno de los siguientes tres grupos fenotípicos: (1) Células en forma de bastón con clara forma alargada con estriado de sarcómeras definidas, membrana celular lisa y regular, que excluían el Tripán azul; (2) Células de forma redonda sin estrías claras y contractura aparente, que incluían el azul tripán, y (3) Células de forma rectangular, con estrías y superficie regular, que excluyeron el azul tripán. Estas distinciones fueron hechas porque los cardiomiocitos maduros típicos poseen un sarcolema intacto, tienen forma de bastón y son de aspecto rectangular, y se consideran viables, mientras que cuando los cardiomiocitos se dañan, se acortan y luego se hiper-contraen, dando la apariencia de células en forma redondeada y no se consideran viables (Hayashi, 1995, Gomez, 1997, Sarvazyan, 1998).
Reducción del MTT
La viabilidad de células cardiacas individuales también se cuantificó por medición de la formación de un producto de formazán de color morado, resultado de la reducción, de la sal de metil tiazol tetrazolio (MTT, Bromuro de [3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl tetrazolium]) de color amarillo, por reductasas celulares (Mosmann, 1983; Carmichael, 1987). El ensayo se basó en el método descrito en cardiomiocitos ventriculares adultos con pequeñas modificaciones (Gómez, 1997). En breve, un número conocido de células cardiacas aisladas fue distribuido al azar y se dispersó homogéneamente en cubreobjetos de vidrio y se sembró en un sistema de perfusión de bajo volumen (20X20x1mm3) diseñados especialmente para aplicar el MTT y los compuestos para diferentes protocolos experimentales. Los cardiomiocitos aislados se visualizaron utilizando un microscopio (Nikon Digital Sight DG U3) y el MTT se añadió a diferentes concentraciones. La morfología celular y el desarrollo del color morado, asociado con la formación del producto formazán, fue seguido en tiempo real durante 60 minutos. Este período de incubación se utilizó para el posterior análisis morfométrico y de intensidad del color de cada cardiomiocito, mediante microscopía de luz, procesamiento y análisis digital de las imágenes. El ensayo de producción de formazán también se llevó a cabo mediante la medición de la cantidad de producto de reacción disuelto en DMSO (15% V / V) por el cambio de absorbancia a 540 nm de longitud de onda, utilizando un espectrofotómetro Beckman DU64. Todos los experimentos se realizaron a temperatura ambiente (21 ± 2 °C). De esta manera, el diseño experimental utilizó la actividad de MTT reductasa, presente y cuantificable en las células viables, pero ausente en las células no viables (Gómez, 1997).
Procesamiento y análisis digital de imágenes
El procesamiento de imágenes consistió en la comparación de las imágenes de la misma célula en condiciones distintas en el tiempo. La actividad de MTT reductasa y la morfología se midieron en los cardiomiocitos individuales intactos expuestos a diversas condiciones experimentales y los cambios se visualizaron y se siguieron en el tiempo durante 45-60 min. Después de la adquisición de las imágenes digitales de los cardiomiocitos individuales se procesaron para realizar el análisis morfométrico y describir la distribución espacial de la producción de formazán. La actividad MTT reductasa y la morfometría se expresaron con referencia a los valores registrados en las condiciones de partida del control y con el mismo grupo de células.
El diseño experimental se planeó de manera que la misma población de células sirvió como su propio control interno. La lesión química de los cardiomiocitos fue inducida por la exposición de las células cardíacas aisladas puras en solución de Tyrode suplementada con 2,4-dinitrofenol (DNP, 0-500 mM), que fue empleado como control de lesión celular. Las soluciones se prepararon con base en la solución de Tyrode que contenía (en mM) NaCl 136,5, KCl 5,4, MgCl2 0,53, HEPES-NaOH 5,5 (pH 7,4), suplementado con CaCl2 1,8 mM y glucosa 5,5 mM, el pH se ajustó a 7,4. El DNP se disolvió en DMSO, de tal manera que la concentración final de DMSO no excedió 0,1%, una concentración que no afecta a la integridad de los cardiomiocitos (Gómez, 1997). La isquemia simulada se indujo por incubación de los cardiomiocitos en 5% de CO (37 ° C, 60 min). Como otro control del efecto cardioprotector, el mismo grupo de células cardiacas se expuso a una solución de Tyrode que contenía 1 mM de adenosina (Gómez et al 1997). Placas de cultivo de tejidos se obtuvieron de Becton Dickinson (Heidelberg, Alemania). Todos los productos químicos para el cultivo de los cardiomiocitos fueron de grados analíticos y adquiridos de Sigma (St Louis, MO, EE.UU.) a menos que se indique lo contrario. Todas las sustancias se prepararon como soluciones madre concentradas y diluidas a concentraciones finales, antes de realizar los experimentos.
Perfil de expresión diferencial de microRNAs
El análisis de hibridación diferencial de miRNAs se realizó empleando el estuche de microarrreglos (micromatrices) de miRNAs (miRCURY LNATM microRNA Array, EXIQON, Vedbaek-Dinamarca) que contiene 3100 sondas de captura, complementarias a humano, ratón y rata y sus secuencias virales relacionadas. En breve: Primero se realizó la purificación y marcaje de los RNA pequeños. Para esto, el RNA total se obtuvo de las células cardiacas aisladas, en condiciones de lesión y protección por preacondicionamiento isquémico, como se describió arriba. De acuerdo con protocolos proporcionados por el fabricante, 2 · 106 células se lavaron con solución tyrode y el RNA total fue extraído por medio del reactivo Trizol (Life -Technologies). El DNA genómico, potencialmente contaminante de la fracción de ARN, se eliminó usando DNasa I libre de RNasa (Ambion, Austin, TX).
El RNA obtenido se cuantificó con un espectrofotómetro midiendo la densidad óptica a 260 nm de longitud de onda. Se utilizó el RNA con base en su integridad y si la relación A260 / A280 fue de 1,8-2,0 como criterios de alta calidad de preparación de ARN. La integridad del ARN se evaluó mediante visualización en gel de agarosa (1%) de bandas intactas de 28S y 18S ARN ribosomal (ARNr) que migró a aproximadamente 5 y 1,9 kb, respectivamente (datos no mostrados). Debido a las características del RNA de bajo peso molecular (sRNA) y su baja abundancia, los protocolos estándar para aislamiento de ARN total y ARNm no son óptimos para recuperación de moléculas sRNA y pueden conducir a la pérdida importante de miRNAs y otros sRNAs. Por lo tanto, el enriquecimiento de sRNA fue un paso importante para la medición de la expresión relativa de los miRNAs. Para esto se usó el estuche de aislamiento de miRNAs (Cat # 1560, Ambion, Austin, TX) que facilitó el enriquecimiento de especies de RNA de bajo peso molecular (200 nt y más pequeños) .
Las reacciones de marcación de ARN se realizaron con el estuche de marcación de miRNAs (Cat # AM-1562, Ambion, Austin, TX). En breve, la reacción de marcación contenía 500 ng de RNA (de bajo peso molecular < 200 nt) o 500 ng sRNA (< 40nt), 0,5 mM de ATP, 50 mM de Hepes (pH 7,8), DTT 5 mM, 20 mM de MgCl2, 150 mg / ml de PEG , 10 mg / ml de BSA , 10 % DMSO y 1.000 ng de 50 -Biotina con 3 unidades Weiss de T4 ARN ligasa. La reacción de marcaje se incubó a 37 °C durante 2 h. La eficiencia de la marcación fue similar (70%±5% y 69% ±6%) y el RNA marcado se usó para hibridar dos matrices de miRCURY LNAMT microRNAs (micro-matriz 7th generación, humano, ratón y rata de Exiqon, Vedbaek, Dinamarca) que contenía sondas de captura para 3100 diferentes especies de miARN.
La hibridación de las micro-matrices de miRNAs se realizó en una solución que contenía (5x · SSC, 1 % de BSA, 0,2 % de SDS, 15 % formamida y 1 % solución de Denhardt y desnaturalizado por calentamiento durante 3 min a 95 °C, y enfriado en hielo (2 min) antes de la hibridación. Después de colocar las matrices en la estación de hibridación (HS 400 Pro, Tecan, Männedorf, Schweiz), 30 mL de la mezcla de hibridación se inyectó en la cámara de hibridación que permite una separación de las micro-matrices y la dispersión del solución de hibridación entre las matrices de miRNAs. Con control de temperatura y agitación con el fin de facilitar el flujo de la solución entre el chip de miRNAs. El tiempo total para la hibridación fue de 16 horas.
Cuando se terminó la hibridación, las micro-matrices se lavaron una vez en 2X SSC, 0,2 % SDS y tres veces en 0,2X SSC a 42 °C. La detección de las sondas de hibridación marcadas con biotina se realizó con un complejo Streptavidina- Isotiocianato de fluoresceína (dilución 1:500 en solución de bloqueo (3 % BSA/PBS con previo bloqueo de las micromatrices (3 % BSA/PBS por una hora). Después de tres lavados con PBS a 21 °C las matrices se secaron y se protegieron de la luz. Inmediatamente, las matrices fueron leídas en un escaner de fluorescencia (PowerScanner™, Tecan Männedorf, Schweiz) para obtener las señales de fluorescencia. Después de realizar la adquisición de las imágenes de las micro-matrices en archivos digitales con el programa ArrayPro® Analyzer se determinaron los niveles de expresión relativos de 15.840 miRNAs, previa normalización de los datos. En breve, a cada una de las intensidades de las señales se les sustrajo el ruido de fondo y se calculó el valor medio de cuatro replicas de cada miRNA en la misma matriz. Los datos se normalizaron con respecto a controles internos y externos (RNA pequeño U3 y los Spike-in miRNA Kit V2, Exiqon). El nivel de expresión de cada especie miRNA se informó como el log2 de la relación de las intensidades de fluorescencia con respecto a los controles.Análisis estadístico
Los resultados se expresan como medias ± SEM, con n que se refieren al número de experimentos. El análisis de regresión lineal se realizó mediante el OriginPro Software 7.0 (OriginLab Corp. Northampton, MA, EE.UU). La significancia estadística de las diferencias entre los dos promedios se determinó con la prueba de la t de Student para observaciones pareadas o no pareadas según el caso y el análisis de la varianza (prueba de ANOVA de una vía) cuando se compararon más de dos grupos. Un valor de p <0,05 se consideró estadísticamente significativo. Para el análisis de la expresión diferencial de los miRNAs y para otorgar igual valor a los miRNAs que aumentaron o disminuyeron los niveles relativos de expresión, se comparó el logaritmo en base 2 de la proporción entre los promedios de las intensidades de fluorescencia de cada miRNA en cada grupo experimental. Se usó el programa TIGR MeV (www.tigr.org/software/tm4). miRNAs expresados que cambiaron significativamente en respuesta a cada condición experimental (n=4) fueron determinados basados en la T-test. Se consideró como valor crítico de P < 0.05, según la distribución-F y un 95% de intervalo de confianza.
Resultados
Actividad MTT reductasa de cardiomiocitos medida en células individuales por el procesamiento de imágenes de células individuales y por la densidad óptica por espectrofotometría
Para determinar que el preacondicionamiento isquémico se podía obtener y evaluar en cardiomiocitos aislados e individuales, fue necesario evaluar si la reducción de la sal de tetrazolio, MTT se podía detectar y medir en una sola célula cardíaca individual. Para esto, células cardiacas ventriculares aisladas en forma de bastón y en reposo, se expusieron a diferentes concentraciones de MTT en solución Tyrode (concentraciones finales desde 0.025 a 4 mM) y se monitorearon los cambios de color asociados a la producción de formazán durante 45 minutos por microscopia de luz y procesamiento de imágenes digitales en tiempo real. La reducción de la sal de tetrazolio se asoció consistentemente (n = 30) con el desarrollo de cristales microscópicos de un color azul oscuro dentro de 1-2 min. Los cardiomiocitos ventriculares experimentaron con el tiempo, un aumento progresivo de formazán azul derivado de la actividad MTT-reductasa intracelular [Figura. 1 (a)]. Este aumento fue significativo cuando se compararon los valores de formazán obtenidos a los 5, 10, 20, 30, y 45 minutos (226,9 ± 9,52; 188,2 ± 13,5 y 14,4 ± 15,0 unidades de intensidad, medida en escala de grises de 0-255) [Fig. 1 (b).] La intensidad de grises, IG, también fue una función de la concentración del MTT (112,0± 19,4; 120,7 ± 21,2; 122,1 ± 17,4; 123,5 ± 17,6; 120,7 ± 13,9 y 113,0 ± 19,3 unidades de densidad óptica cuando los cardiomiocitos fueron expuestos a 0.025; 0,5; 1,0; 2,0; y 4,0 mM, de MTT respectivamente (datos no ilustrados).
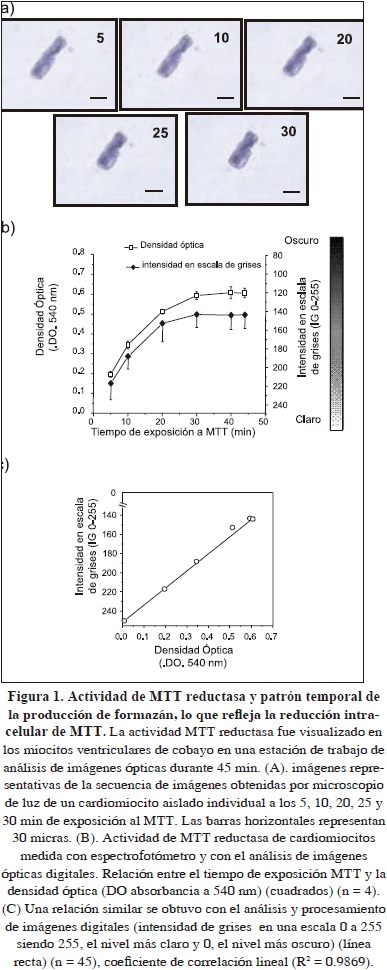
La reducción de MTT se llevó a cabo selectivamente por los cardiomiocitos en forma de bastón y bajo nuestras condiciones experimentales, el nivel formazán intracelular más alto se produjo dentro de 30 min (n = 50) de inicio de la exposición al MTT. Más de 99% de los cardiomiocitos de forma redonda no desarrollaron los cristales de formazán detectables al microscopio de luz y se observó menos pronunciada la coloración azul oscuro asociada a la producción de formazán en menos del 1% de las células de forma redonda (220 ± 19,4, n = 45).
El ensayo MTT clásico evalúa la actividad de reducción del MTT medida por densidad óptica del formazán producido por grupos de células y es un método confiable para evaluar la viabilidad de las células cardíacas (Gómez, 1997). Basándose en las propiedades colorimétricas de la reducción de MTT, se investigó la relación entre las medidas espectrofotométricas de la formación de formazán de células viables con forma de bastón, expresada en densidad óptica (DO a 540 nm) y las mediciones de la intensidad de color de la actividad MTT reductasa de una sola célula. Los valores obtenidos después del procesamiento de imágenes se expresaron en niveles de intensidad de grises, en una escala de 0-255 niveles). Las diluciones de las células se realizaron en medios incoloros utilizando varias preparaciones de cardiomiocitos; cada una derivada de diferentes corazones adultos de cobayos. Las reacciones de formación de formazán se llevaron a cabo en experimentos separados con un número de células conocido (3000) por cuadruplicados; la incubación de los cardiomiocitos se realizó en una solución con MTT (2 mM). El color azul oscuro cuantificable se desarrolló durante 45 min y se cuantificaron usando un espectrofotómetro y el procesamiento de imágenes [Fig. 1 (b)]. Se detectó un aumento de la absorbancia de 0,2 ± 0,0038 a 0,591 ± 0,0358 unidades de densidad óptica cuando 3,000 cardiomiocitos en forma de bastón se evaluaron en el intervalo de 5 a 45 minutos [Fig. 1 (b), los cuadrados], y un cambio en los valores de niveles de grises de 220,3 ± 7,7 a 150,4 ± 14,4 niveles cuando se evaluó la actividad de una única célula en forma de bastón en el mismo período de tiempo [Fig. 1 (b), diamantes llenos]. Las densidades ópticas y los valores de grises para el producto formazán mostraron una relación similar. Para definir los valores de intensidad de grises, medidos por el análisis de imágenes, en relación con el cambio en las unidades de densidad óptica, medidas por espectrofotometría, se utilizó el análisis de regresión lineal para ajustar los datos y este análisis mostró una alta correlación lineal (r2= 0,99; p= 0,001) [Fig. 1 (c)], lo cual es esencial para la estimación confiable de la viabilidad de una única célula por el procesamiento de imágenes en tiempo real.
La relación entre OD por espectrofotometría y los valores de intensidad de grises del formazán obtenido en todas las poblaciones de células en 30 corazones probados, se mantuvo lineal. El valor más bajo detectable para la producción de formazán fue de alrededor de 0.011 unidades de DO (n = 30), producto de 50-70 células después de 90 minutos de exposición al MTT, mientras que el valor mínimo detectable para la producción de formazán fue 220,3 ± 7,7 niveles de intensidad de grises (n = 45) producto de una única célula después de 5 minutos de exposición al MTT.
Efecto del DNP y la Adenosina sobre la viabilidad, la actividad MTT reductasa y la longitud de células cardiacas individuales
Como controles experimentales para evaluar el efecto de lesión o la protección celular, se evaluó el efecto del DNP y la Adenosina sobre la viabilidad de cardiomiocitos aislados empleando el ensayo de Tripán azul y el procesamiento de imágenes en tiempo real para monitorear los cambios en la morfología y en la actividad MTT reductasa de en una célula cardíaca individual durante 50 min. Células ventriculares individuales en reposo expuestas a DNP (50-500 mM) experimentaron cambios en la longitud de la célula afectada. También se observaron cambios en la actividad MTT reductasa intracelular (Fig. 2). Después de la adición de DNP (100, 200, 300, 400 y 500 mM), el acortamiento celular aumentó alrededor de 42,1 ± 7,1%, n = 5; 45,6 ± 5,8%, n = 10; 47,1 ± 10,75%, n = 6 ; 48,6 ± 11,07%, n = 11 y 56,2 ± 8,2%, n = 11, respectivamente. Sin embargo, cuando los cardiomiocitos fueron expuestos a bajas concentraciones de DNP (12,5 y 50 mM) no se observaron cambios significativos (p <0.05, n = 15) en la longitud (2,9 ± 2,2 y 2,0 ± 0,8%, respectivamente) y en la morfología celular, incluso después de 50 min de exposición y toma de imágenes en tiempo real, de una manera similar a los cardiomiocitos no expuestos [Fig. 2 (a)], paneles de 0 y 50 mM). Aunque el acortamiento alcanzó una meseta relativamente constante (60 ± 4,6%) en 20 ± 4,7 min, las concentraciones más altas de DNP promovieron el más rápido grado de acortamiento celular, es decir, en 100 mM de DNP se observó una disminución detectable en la longitud de la célula, que se inició a 6,5 ± 4,7 min, en comparación con 7,3 ± 3,7 min; 10,9 ± 4,6 min y 11,6 ± 3,1 min a concentraciones de 200 [(Fig. 2 (b)], 300 y 500mM DNP, respectivamente (n = 10 en cada caso).
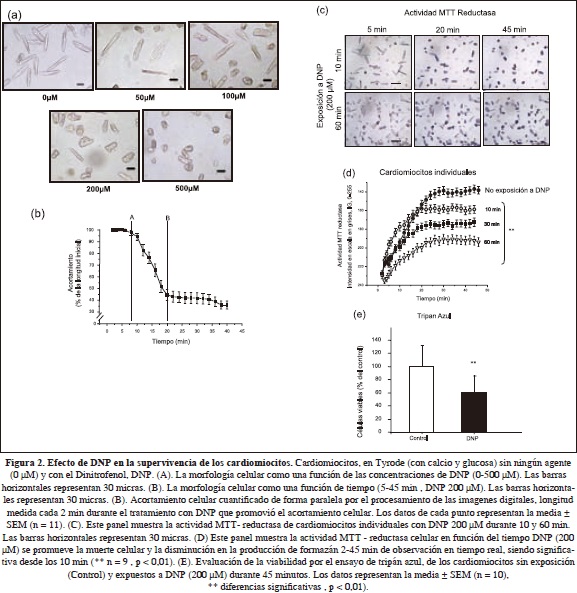
La producción de formazán estimada y evaluada por el procesamiento de imágenes fue significativamente menor en los cardiomiocitos expuestos a DNP 10 min (158,8 ± 17,6 niveles de intensidad de color n = 9) en comparación con los no expuestos (136,9 ± 16,8 n = 45, p <0,01). La intensidad del color disminuyó progresivamente a medida que el tiempo de exposición al DNP se incrementó en cada uno de los 40 cardiomiocitos analizados. Después de 45 minutos de exposición al MTT, las intensidades del color expresadas en niveles de grises fueron 158,8 ± 17,6; 172,7 ± 20,3; 192,2 ± 23 y 189,3 ± 23 para cardiomiocitos expuestos a DNP 200 mM durante 10, 30, 60 y 120 min, respectivamente [Fig. 2 (c) y 2 (d)]. El perfil de la viabilidad celular, derivada de la morfología y la actividad de la reductasa de MTT, usando el sistema de procesamiento de imágenes en tiempo real, fue similar a la obtenida usando el ensayo de exclusión del tripán azul [Fig. 3 (e)].
Como control experimental para evaluar el efecto de protección celular, se evaluó el efecto de la Adenosina (1 mM) sobre la viabilidad de cardiomiocitos aislados y los resultados fueron similares a los ya informados (Gómez, 1997; Jovanovic, 1998; Vinten-Johansen, 1999), especificamente que la adenosina proporciona una protección de los cardiomiocitos contra la hipoxia [Fig. 3 (b)].
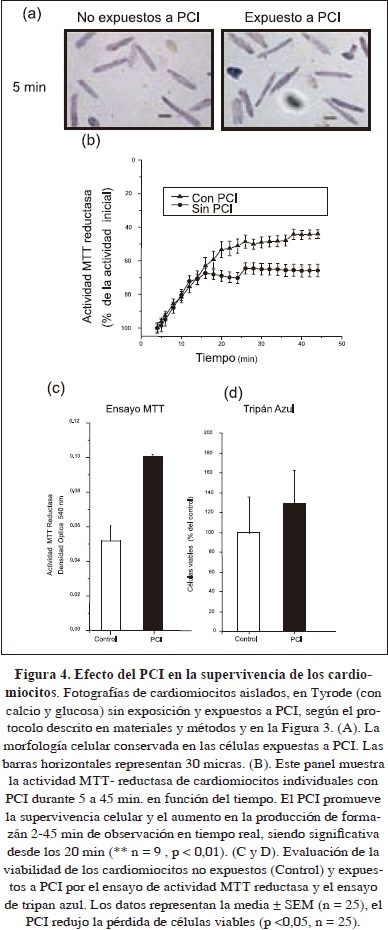
Efecto de la isquemia simulada y del preacondicionamiento sobre la viabilidad de cardiomiocitos aislados
El preacondiconamiento isquémico proporciona una protección de los cardiomiocitos obtenidos de diferentes especies (Gomez, 1997; Jovanovic, 1998; Vinten-Johansen, 1999). Para investigar el efecto de la lesión por isquemia simulada (IS) y preacondicionamiento isquémico (PCI) sobre la viabilidad de las células cardiacas, miocitos ventriculares individuales fueron expuestos a IS y PCI [Fig. 3] y a continuación, la lesión se indujo por incubación de los cardiomiocitos en 5% de CO2, 37 °C; 60 min. La condición de PCI afectó significativamente (p <0,01) la actividad MTT reductasa unicelular medida como la intensidad del color en escala de grises, es decir, (150,5 ± 10,8, n = 40) en ausencia vs (113,0 ± 10,7 n = 25) después del PCI [Figura 4 (a)]. Los cardiomiocitos expuestos a PCI resultaron con un aumento significativo de la actividad MTT reductasa [Fig. 4 (a) y 4 (b)], es decir, 0,0617 ± 0,009 unidades de DO (n = 10) en células expuestas a PCI y 0,0902 ± 0,002 unidades de DO (n = 10) en células expuestas a IS [Fig. 4 (c)]. Consistente con lo anterior, la producción de formazán de una sola célula en condiciones de IS fue significativamente menor en comparación con los niveles de formazán desarrollado en cardiomiocitos expuestos a PCI, es decir, (36,4 ± 3,0% vs 52,2 ± 4,2% de niveles de intensidad respectivamente, p <0,05, n = 25) [Fig. 4 (b)]. El perfil de la viabilidad celular detectado con la actividad MTT reductasa de poblaciones de células y de células individuales, como consecuencia de las condiciones de IS y PCI, fue similar a la obtenida a partir del ensayo de tripan azul [Figs. 4 (b), 4 (c) y 4 (d)]. Con base en la evaluación de la actividad MTT reductasa, la morfología celular y el ensayo de exclusión del tripan azul, el PCI redujo la pérdida de células viables (p <0,05, n = 25; Fig. 4) inducida por el tratamiento con 5% de CO2 , 37 ° C; 60 min, una condición de isquemia térmica simulada.
Perfil de expresión diferencial de microRNAs de cardiomiocitos expuestos a PCI
Para caracterizar los perfiles de expresión de miRNAs en cardiomiocitos aislados en condiciones de normoxia y PCI, visualizamos el patrón de expresión de miRNAs mediante el uso de micromatrices en una estación de trabajo Nimblegen, como se describió en materiales y métodos (Fig. 5). Los cambios en la intensidad de fluorescencia después de haber sido normalizadas [Fig. 6 (a)], se registraron como cambios en los perfiles de expresión de miRNAs. Por ejemplo, los niveles de intensidad de fluorescencia fueron medidos para cada uno de los 3100 miRNAs dispuestos en la matriz [Figs. 6 (a) y 6 (b)]. El aumento o disminución de las intensidades de fluorescencia calculados como el log2 del cociente de la relación de la intensidad de fluorescencia de los miRNAs en cardiomiocitos expuestos a condiciones de normoxia (21% O2) y a PCI, se interpretó como cambios en los miRNAs expresados y patrones heterogéneos de las intensidades de fluorescencia detectadas en las matrices y se asociaron con diferencias de los perfiles de expresión de miRNAs, no obstante, para algunos miRNAs se observaron intensidaes de fluorescencia similares localizados en diferentes cuadrantes de las micro-matrices [Fig. 6 (b)]. En conjunto, cardiomiocitos aislados de cobayo expuestos a PCI se asociaron con un perfil de expresíon diferencial de miRNAs en comparación con los cardiomiocitos en condiciones de normoxia [Fig. 6 (b)].
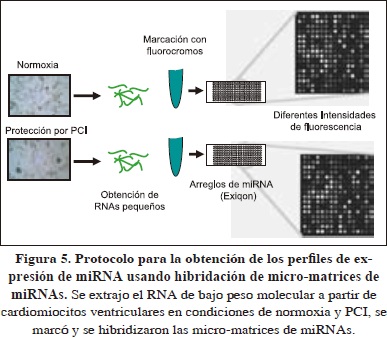
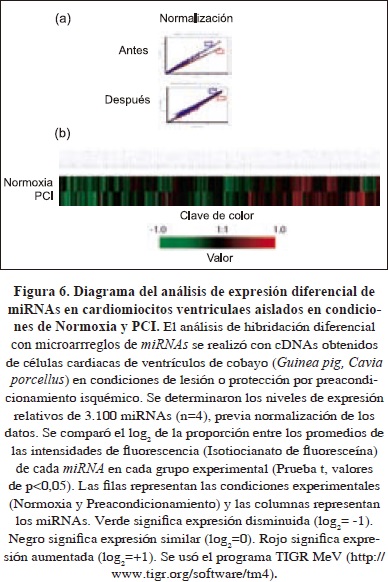
De las 3100 sondas de miRNAs impresas en las micro-matrices, 238 fueron detectados en los cardiomiocitos en normoxia y en PCI y se asignaron a miRNAs específicos. En total, 62 y 95 miRNAs específicos cambiaron su expresión significativamente en respuesta a cada condición de normoxia y PCI, respectivamente (Cuadro 1). La comparación fue determinada basada en la T-test, según la distribución-F, con un valor critico de P < 0.05 y un 95% de intervalo de confianza, después de haber sido normalizados. Algunos los miRNAs expresados diferencialmente en los cardiomiocitos expuestos a PCI, en comparación con los no preacondicionados se relacionan en el cuadro 2.


Con el fin de identificar las posibles vías funcionales mediadas por estos miRNAs expresados diferencialemente y con base en las secuencias de los miRNAs se identificaron algunos potenciales mRNAs objetivos validados de la base de datos miRWalk (Dweep H, 2011). Los18 miRNAs evaluados (Cuadro 2), resultaron tener mRNAs dianas validados, cuya identidad reveló que las vías predominantes mediadas potencialmente por los miRNAs identificados estaban involucrados en proliferación celular, diferenciación y muerte celular, reparación de daños en el DNA, canales iónicos, así como mRNAs dianas implicados en cambios epigenéticos, siendo este último proceso identificado como particularmente implicado (Fig. 6b, Cuadro 2).
Discusión
En este trabajo se presenta evidencia experimental de que la exposición de miocitos cardiacos aislados de corazones de cobayos, a las condiciones de preacondicionamiento descritas en materiales y métodos y en la figura 3 induce efectos cardioprotectivos actuando de manera directa en la supervivencia de los cardiomiocitos ventriculares. Se muestra que el preacondicionamiento isquémico en cardiomiocitos individuales se puede evaluar mediante el monitoreo de la morfología y de la actividad MTT reductasa en tiempo real, como indicadores simultáneos del estado de viabilidad. También, se presenta evidencia de la expresión diferencial de miRNAs, en cardiomiocitos asilados en condiciones de preacondicionamiento.
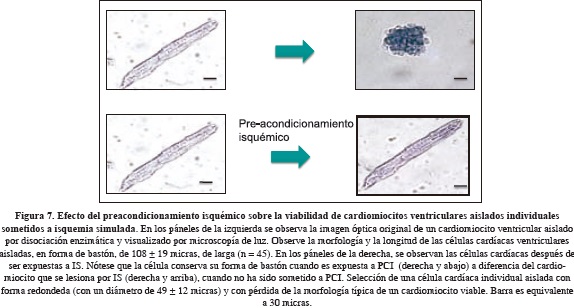
Los resultados mostraron que la reducción de la sal de tetrazolium MTT al pigmento formazán es una función del número de células viables presentes. Típicamente, la célula cardiaca viable tiene forma de bastón (10-30 mm de ancho and 80-150 mm de largo), es estriada, íntegra y con actividad metabólica, reflejado por la integridad y regularidad de la membrana celular observada en el microscopio de luz y la reducción del MTT en formazán que se puede cuantificar en las células viables, respectivamente. El cardiomiocito, cuando es lesionado, se acorta, luego se hipercontrae y presenta una forma redondeada (10-30 mm X 40-60 mm) con una contractura miofibrilar y reducción de la actividad MTT reductasa (Gomez, 1997).
La determinación del nivel de viabilidad de células cardiacas individuales mediante la evaluación de la actividad MTT reductasa es común (Carmichael, 1987; Yu, 2013), sin embargo, hacía falta una caracterización más detallada de la reducción del MTT. Especialmente, algunos aspectos importantes son si los cardiomiocitos individuales en forma de bastón, acortados o de forma redonda soportan la reducción de MTT y si la inhibición o estimulación del metabolismo de estas células puede ser discriminado por la actividad MTT reductasa observada mediante el registro en tiempo real, de las secuencias de imágenes de la misma célula viable en forma de bastón y expuestas a condiciones de preacondicionamiento y a la adenosina, dos condiciones informadas que inducen cardioprotección contra la isquemia (de Jong, 1990; Toombs CF, et al 1992; Gross, 1992; Gómez, 1997; Sato, 2000; Vinten-Johansen, 2013), así como a la exposición al 2,4-dinitrofenol (DNP), un conocido inhibidor de la fosforilación oxidativa, que se ha utilizado para simular los efectos de la hipoxia (Alekseev, 1997; Hudman, 2002).
El examen de la morfología celular y de la actividad de la MTT reductasa de manera simultánea y en tiempo real pueden ser indicadores sensibles, precisos y menos variables para determinar el nivel de viabilidad de estas células, en particular cuando el número de células es muy bajo (Gómez, 1997; Sarvazyan, 1998) y proporciona evidencia adicional de que el PCI tiene acción citoprotectiva directa sobre los cardiomiocitos promoviendo su supervivencia in vitro (Fig. 7). Por lo tanto, una evaluación simultánea de la morfología y actividad metabólica en el tiempo en cardiomiocitos individuales revela el efecto del PCI en células cardiacas aisladas e individuales y tiene el potencial de ser usada como una herramienta de bioprospección de nuevas drogas o diversas condiciones que tengan propiedades de lesión o cito-protección.
La confirmación del efecto lesivo del DNP así como del efecto protectivo directo de la Adenosina y del PCI sobre células cardiacas aisladas e individuales, en ausencia de otros tipos celulares, tales como células vasculares o nerviosas, mediante el monitoreo de la supervivencia en tiempo real, sugieren que ésta aproximación experimental puede servir como una herramienta de tamizaje para determinar los efectos sobre la viabilidad de células cardiacas aisladas expuestas a agentes o a condiciones con propiedades cardioprotectivas o cardiotóxicas en estudios farmacológicos y biotecnológicos de cardioprotección. Estos podrían incluir, soluciones cardioplégicas, inducción de hipotermia para reducir el metabolismo miocárdico, condiciones para disminuir la demanda de oxígeno. En todos estos estudios está involucrado la evaluación de la inducción o la promoción de la sobrevivencia celular y la reducción o limitación del daño de las células cardiacas.
Debido a la dependencia de la citoprotección de la naturaleza de la condición experimental a la que los cardiomiocitos se han expuesto y a las limitadas medidas biológicamente relevantes de daño de la célula cardiaca, para evaluar la acción citoprotectora o la eficacia de intervenciones cardioprotectores, éstas se han basado en la evaluación y seguimiento de los cambios fisiológicos (Gomez, 1997; Jiovanovic, 1998). Por lo tanto, la evaluación en tiempo real de la actividad MTT reductasa y la morfología puede ayudar a la identificación de sustancias con propiedades de cardioprotección y, de manera específica y precisa evaluar el éxito en la supervivencia celular a nivel de célula cardíaca aislada e individual.
Un enfoque sencillo pero muy valioso, en la evaluación de estas sustancias, implicaría la determinación de efectos específicos sobre la viabilidad de cardiomiocitos individuales antes de su implementación en soluciones de adyuvantes y en ensayos clínicos. Por ejemplo, un efecto de supervivencia más alta después de las exposiciones directas de la célula cardíaca individual indicaría una posible recuperación miocárdica atribuibles a la intervención.
En este trabajo además evaluamos la expresión diferencial de miRNAs, genes reguladores de la expresión genética (Ambros, 2004), en cardiomiocitos aislados. Este trabajo utilizó una herramienta reciente de biotecnología molecular para estudiar el perfil de miRNAs (Castoldi, 2007) en cardiomiocitos aislados expuestos a condiciones de lesión por isquemia y protección por exposición a PCI. Los miRNAs diferencialmente expresados y validados resultan ser moléculas útiles para anticipar cambios en la expresión de genes importantes en la fisiología de las células cardiacas (Hofsli, 2013). La identificación de miRNAs como potenciales marcadores moleculares que regulen la expresión de genes con propiedades cardiotóxicas o cardioprotectoras y que estén implicados en la fisiopatología de enfermedades cardiovasculares, como en la isquemia y la falla cardiacas, será clave para estudios dirigidos identificar miRNAs con potencial diagnóstico y terapéutico (Baker, 2013).
La investigación de la expresión de algunos de estos microRNAs en células cardiacas aisladas, con la posibilidad de generar interferencia de la expresión de algunos genes, se espera tenga impacto, no solo en investigaciones básicas, sino también en futuras aplicaciones clínicas (Manne, 2010; Ali, 2011, Baker, 2013). Los resultados obtenidos sugieren que los miRNAs identificados pueden ser potenciales marcadores moleculares de prevención, detección temprana y tratamiento de enfermedades cardíacas (van Rooij, 2012). Este avance en la identificación y caracterización funcional de miRNAs en cardiomiocitos, no solo puede contribuir a establecer una herramienta molecular para avanzar en lo que se ha llamado la genómica de tercera generación para resolver el entrecruzamiento entre Genoma-Transcriptoma-Proteoma-Función (Xie, 2005; Parsons, 2012) y enfermedades crónicas como las cardiovasculares, sino también aporta al conocimiento de genes involucrados en la fisiopatología de enfermedades cardiovasculares, como la isquemia y la falla cardiaca y es clave para estudios dirigidos identificar miRNAs con potencial diagnóstico y terapéutico (Small, 2011; Baker, 2013). Los miRNAs expresados diferencialmente en cardiomiocitos identificados en este trabajo pueden ser usados para el estudio funcional de genes reguladores, que contribuyan al estudio de la biología molecular de células cardiacas y de genes que puedan asociarse con la iniciación o la progresión de las enfermedades cardiovasculares (Yang, 2012).
En conclusión, el preacondicionamiento isquémico en cardiomiocitos aislados evaluado por la supervisión de la morfología y la actividad MTT reductasa, de manera simultánea y en tiempo real, en asocio con la expresión e identificación de miRNAs específicos, que cambian su expresión con el PCI, plantea la importancia de investigar la función de algunos miRNAs bajo condiciones fisiopatológicas de estrés y enfermedad. Adicionalmente, este modelo experimental se puede constituir en un procedimiento de bioprospección guiado por un filtro celular, metabólico y molecular para el estudio de la fisiología y patología de la célula cardiaca, así como para el tamizaje de fármacos, productos naturales o procedimientos con potenciales efectos cardiotóxicos o cardioprotectores, encaminados a reducir el riesgo de daño celular y disfunción ventricular.
Limitaciones del trabajo
El monitoreo en tiempo real del preacondicionamiento isquémico cardiaco en células individuales puede haber sesgado favorablemente la interpretación de los cambios asociados con cardiotoprotección, en parte porque los datos de la función de los cardiomiocitos no estaban disponibles y las células cardiacas podrían exhibir una susceptibilidad heterogénea a la lesión y a la respuesta a condiciones de estrés celular; sin embargo, esto puede ser un valor agregado porque ésta aproximación de evaluar la viabilidad de células cardíacas individuales como parámetro de protección permite la evaluación simultánea de una actividad metabólica y de la morfología de la célula cardíaca individual en tiempo real. Por otra parte, se requieren investigaciones adicionales para validar por PCR en tiempo real la expresión diferencial de miRNAs, así como la identificación y la validación experimental de sus principales dianas moleculares (Xie, 2005; Gomez, 2011) en los cardiomiocitos .
Agradecimientos
Este estudio fue posible gracias al apoyo financiero del Instituto Nacional de Salud y de Colciencias, así como a la vinculación de estudiantes de pregrado y posgrado de la Universidad Nacional de Colombia que apoyaron la ejecución de algunos de los experimentos.
Bibliografía
Alekseev, A. E., Gomez, L. A., Aleksandrova, L. A., Brady, P.A., Terzic, A. Opening of cardiac sarcolemmal KATP channels by dinitrophenol separate from metabolic inhibition. J Membr Biol 157:203-214. [ Links ]
Ali, S., Almhanna, K., Chen, W., Philip, P. A., Sarkar, F. H. 2011. Differentially expressed miRNAs in the plasma may provide a molecular signature for aggressive pancreatic cancer Am J Transl Res 3:28-47. [ Links ]
Ambros V. 2004. The functions of animal microRNAs. Nature 43:350-355. [ Links ]
Andersson, B. S., Eksborg, S., Vidal, R. F., Sundberg, M., Carlberg, M. 1999. Anthraquinone-induced cell injury: acute toxicity of carminomycin, epirubicin, idarubicin and mitoxantrone in isolated cardiomyocytes. Toxicology 135:11-20. [ Links ]
Armstrong SC. 2004. Protein kinase activation and myocardial ischemia/reperfusion injury. Cardiovasc Res 61:427-36. [ Links ]
Arstall, M. A., Zhao, Y.Z., Hornberger, L., Kennedy, S. P., Buchholz, R. A., Osathanondh, R., Kelly, R. A. 1998. Human ventricular myocytes in vitro exhibit both early and delayed preconditioning responses to simulated ischemia. J Mol Cell Cardiol 30:1019-25. [ Links ]
Babashah. S., Soleimani, M. 2011. The oncogenic and tumour suppressive roles of microRNAs in cancer and apoptosis. Eur J Cancer 47:1127-1137. [ Links ]
Baker, A. H., van Rooij, E. 2013. miRNA overexpression induces cardiomyocyte proliferation in vivo. Mol Ther 21:497-498. [ Links ]
Buerke M, Weyrich AS, Lefer AM. 1994. Isolated cardiac myocytes are sensitized by hypoxia-reoxygenation to neutrophil-released mediators. Am J Physiol 266:H128-36. [ Links ]
Carmichael, J., DeGraff, W. G., Gazdar, A. F., Minna, J. D., Mitchell, J. B. 1987. Evaluation of a tetrazolium-based semiautomated colorimetric assay: assessment of chemosensitivity testing. Cancer Res 47:936-942. [ Links ]
Castoldi, M., Benes, V., Hentze, M. W., Muckenthaler, M. U. 2007. miChip: a microarray platform for expression profiling of microRNAs based on locked nucleic acid (LNA) oligonucleotide capture probes. Methods 43:146-152. [ Links ]
Cohen, M. V., Walsh, R. S., Goto, M., and Downey, J. M. 1995. Hypoxia preconditions rabbit myocardium via adenosine and catecholamine release. J Mol Cell Cardiol 27:1527-1534. [ Links ]
de Jong, JW., Keijzer, E., Huizer, T., Schoutsen, B. 1990. Ischemic nucleotide breakdown increases during cardiac development due to drop in adenosine anabolism/catabolism ratio. J Mol Cell Cardiol 22:1065-1070. [ Links ]
Dweep, H., Sticht, C., Pandey P., Gretz, N. 2011. miRWalk-database: prediction of possible miRNA binding sites by "walking" the genes of three genomes. J Biomed Inform 5:839-847. [ Links ]
Gómez, L. A. 2011. Avances científicos y tecnológicos. Genoma humano y salud pública. Segunda edición. Editores: Malagón-Londoño G, Moncayo-Medina A. Salud Pública. Perspectivas. Bogotá: Editorial Médica Panamericana; p. 615-630. [ Links ]
Gomez, L. A. 2011. Las enfermedades cardiovasculares: un problema de salud pública y un reto global. Biomédica 31:469-473. [ Links ]
Gomez, L. A., Alekseev, A., E., Aleksandrova L. A., Brady, P., A., Terzic, A. 1997. Use of the MTT assay in adult ventricular cardiomyocytes to assess viability: Effects of adenosine and potassium on cellular survival. J Mol Cell Cardiol 29:1255-1266. [ Links ]
Grimson, A., Farh, K. K., Johnston, W. K., Garrett-Engele, Ph., Lee P. Lim, L.P., Bartel, D. P. 2007. MicroRNA targeting specificity in mammals: Determinants beyond seed pairing. Molecular Cell, 27:91-105. [ Links ]
Gross, G. J., and Auchampach, J. A. 1992. Blockade of ATP-sensitive potassium channels prevents myocardial preconditioning in dogs. Cir Res 70: 223-233. [ Links ]
Gross, G. J., Hsu, A., Gross, E.R., Falck, J.R., Nithipatikom, K. 2013. Factors mediating remote preconditioning of trauma in the rat heart: central role of the cytochrome p450 epoxygenase pathway in mediating infarct size reduction. J Cardiovasc Pharmacol Ther 18:38-45. [ Links ]
Haworth, R. A., Hunter, D. R., Berkoff, H. A. 1980. The isolation of Ca2+-resistant myocytes from the adult rat. J Mol Cell Cardiol 12:715-23. [ Links ]
Hayashi, M., Nasa, Y., Tanonaka, K., Sasaki, H., Miyake, R., Hayashi, J., Takeo, S. 1995. The effects of long-term treatment with eicosapentaenoic acid and docosahexaenoic acid on hypoxia/rexoygenation injury of isolated cardiac cells in adult rats. J Mol Cell Cardiol 27:2031-2041. [ Links ]
Hofsli, E., Sjursen, W., Prestvik, W. S., Johansen, J., Rye, M., Tranø, G., Wasmuth, H. H., Hatlevoll, I., Thommesen, L. 2013. Identification of serum microRNA profiles in colon cancer. Br J Cancer 108:1712-1719. [ Links ]
Hudman, D., Rainbow, R. D., Lawrence, C.L., Standen, N. B. 2002. The origin of calcium overload in rat cardiac myocytes following metabolic inhibition with 2,4-dinitrophenol. J Mol Cell Cardiol 34:859-871. [ Links ]
Jacobson, S. L., Piper, H. M. 1986. Cell cultures of adult cardiomyocytes as models of the myocardium. J Mol Cell Cardiol 18:661-78. [ Links ]
Jovanovic, A., Lopez, J. R., Alekseev, A. E., Shen, W. K., Terzic, A. 1998. Adenosine prevents K+-induced Ca2+ loading: insight into cardioprotection during cardioplegia. Ann Thorac Surg 65:586-591. [ Links ]
Kang P.M., Haunstetter A., Aoki H., Usheva A., Izumo S. 2000. Morphological and Molecular Characterization of Adult Cardiomyocyte Apoptosis During Hypoxia and Reoxigenation. Circulation Research 87:118-125 [ Links ]
Klauke, N., Smith, G. L., Cooper, J. 2003. Stimulation of single isolated adult ventricular myocytes within a low volume using a planar microelectrode array. Biophys J 85:1766-74. [ Links ]
Ladilov, Y. V., Balser, C., Piper, H. M. 1998. Protection of rat cardiomyocytes against simulated ischemia and reoxygenation by treatment with protein kinase C activator. Circ Res 82:451-7. [ Links ]
Lewis, B. P., Burge Ch. B., Bartel D.P. 2005. Conserved seed airing, often flanked by Adenosines, indicates that thousands of human genes are microRNA targets. Cell, 120:15-20. [ Links ]
Lewis, B. P., Shih, I., Jones-Rhoades, M. W., Bartel, D. P., Burge, Ch. B. 2003. Prediction of Mammalian MicroRNA Targets. Cell, 115:787-798. [ Links ]
Manne, U., Shanmugam, CH., Bovell, L., Katkoori, V. R. Bumpers, H.L. 2010. miRNAs as biomarkers for management of patients with colorectal cancer Biomark Med 4:761-770. [ Links ]
Marber, M. 2000. Ischemic preconditioning in isolated cells. Circ. Res. 86:926-931. [ Links ]
Margolin, A. A., Greshock, J., Naylor, T. L., Mosse, Y., Maris, J. M., Bignell, G., Saeed, A. I., Quackenbush, J., Weber, B. L. 2005. CGHAnalyzer: a stand-alone software package for cancer genome analysis using array-based DNA copy number data. Bioinformatics 21:3308-3311. [ Links ]
Minners, J., van den Bos, E. J., Yellon, D. M., Schwalb, H., Opie, L. H., Sack, M. N. 2000. Dinitrophenol, Cyclosporin A, and Trimetazidine Modulate Preconditioning in the Isolated Rat Heart: support for a mitochondrial role in cardioprotection. Cardiovascular Research 47:68 -73. [ Links ]
Mosmann, T. 1983. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J Immunol Methods 65:55-63. [ Links ]
Murray, C. E., Jennings, R. B., and Reimer, K. A. 1986. Precoditioning with ischemia: a delay of lethal cell injury in ischemic myocardium. Circulation 74:1124-1136. [ Links ]
Ohata, H., Trollinger, D. R., Lemasters, J. J. 1994. Changes in shape and viability of cultured adult rabbit cardiac myocytes during ischemia/reperfusion injury. Res Commun Mol Pathol Pharmacol 86:259-71. [ Links ]
Parsons, X. H., Parsons, J. F., Moore, D. A. 2012. Genome-scale mapping of microRNA signatures in human embryonic stem cell neurogenesis. Mol Med Ther. 1:105-124. [ Links ]
Sarvazyan N. 1998. A New approach to Assess Viability of Adult Cardiomyocytes: Computer-assisted image analysis. J Mol Cell Cardiol 30:297-301. [ Links ]
Sarvazyan N. 1998. An alternative preconditioning mechanism? J Mol Cell Cardiol 30:2785-2786. [ Links ]
Sato, T., Sasaki, N., O'Rourke, B., Marban, E. 2000. Adenosine primes the opening of mitochondrial ATP-sensitive potassium channels: a key step in ischemic preconditioning? Circulation 102:800-805. [ Links ]
Small, E. M. & Olson, E. N. 2011. Pervasive roles of microRNAs in cardiovascular biology. Nature 469:336-342. [ Links ]
Taylor, D., L., Woo, E.S., Giuliano, K., A. 2001. Real-time molecular and cellular analysis: the new frontier of drug discovery. Curr Opin Biotechnol 12:75-81. [ Links ]
Toombs, C. F., McGee, S., Johnston, W. E., Vinten-Johansen, J. 1992. Myocardial protective effects of adenosine. Infarct size reduction with pretreatment and continued receptor stimulation during ischemia. Circulation 86:986-994. [ Links ]
van Rooij, E., Sutherland, L. B., Qi, X., Richardson, J. A., Olson, N.A. 2007. Control of stress-dependent cardiac growth and gene expression by a miicroRNA. Science 316:575-579. [ Links ]
Vander Heide, R. S., Rim, D., Hohl, C. M., Ganote, C. E. 1990. An in vitro model of myocardial ischemia utilizing isolated adult rat myocytes. J Mol Cell Cardiol 22:165-81. [ Links ]
Vinten-Johansen, J., Dobson, G. P. 2013. Adenosine-procaine cardioplegia and adenosine-lidocaine cardioplegia: Two sides of the same coin? J Thorac Cardiovasc Surg 145:1684-1685. [ Links ]
Vinten-Johansen, J., Thourani V. H., Ronson R. S., Jordan, J. E., Zhao, Z. Q., Nakamura M, Velez D, Guyton R. A. 1999. Broad-spectrum cardioprotection with adenosine. Ann Thorac Surg 6:1942-1948. [ Links ]
World Health Organization. 2011. Global status report on non communicable diseases. Fecha de consulta: 25 de noviembre de 2011. Disponible en: http://www.who.int/nmh/publications/ncd_report2010/es/. [ Links ]
Xie, X, Lu, J., Kulbokas, E. J. Todd R. Golub, T. R., Mootha, V., Kerstin Lindblad-Toh, K., Lander, E. S., Kellis, K. 2005. Systematic discovery of regulatory motifs in human promoters and 3' UTRs by comparison of several mammals. Nature 434:338-345. [ Links ]
Yang, B., Lin, H., Xiao, J., Lu, Y., Luo, X., Li, B., Zhang, Y., Xu, C., Bai, Y., Wang, H., Chen, G., Wang, Z. 2007. The muscle-specific microRNA miR-1 regulates cardiac arrhythmogenic potential by targeting GJA1 and KCNJ2. Nature Medicine 13: 486-491. [ Links ]
Yang, S., Banerjee, S., de Freitas, A., Cui, H., Xie, N., Abraham, E., Liu, G. 2012. miR-21 regulates chronic hypoxia-induced pulmonary vascular remodeling. Am J Physiol Lung Cell Mol Physiol 302: L521-L529. [ Links ]
Yu, B., Song, B. 2013. Notch 1 Signalling inhibits cardiomyocyte apoptosis in ischaemic postconditioning. Heart Lung Circ 13:1080-1089. [ Links ]
Recibido:16 de octubre de 2013
Aceptado para publicación:8 de noviembre de 2013













