Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales
versión impresa ISSN 0370-3908
Rev. acad. colomb. cienc. exact. fis. nat. vol.38 no.146 Bogotá ene./mar. 2014
Ciencias naturales
1 Yoluka ONG, Fundación de Investigación en Biodiversidad y Conservación
2 Grupo de investigación en Biogeografía Histórica y Cladística Profunda, Laboratorio de Anfibios, Instituto de Ciencias Naturales, Universidad Nacional de Colombia
*Correspondencia: Teddy Angarita-Sierra, teddy.angarita@yoluka.org.co; tgangaritas@unal.edu.co
Recibido: 3 de septiembre de 2013. Aceptado: 7 de mayo de 2014
Resumen
El propósito de este estudio fue hacer la primera aproximación al conocimiento del ensamble de anfibios y reptiles presente en las sabanas inundables de río Pauto y evaluar los efectos de las transformaciones causadas en él por la introducción de cultivos de arroz y pastos exóticos. Para ello se valoró la riqueza de las especies, así como su abundancia, composición y preferencia de hábitat. Se encontró que la dinámica ecológica de los anfibios y reptiles presentes en las sabanas inundables de río Pauto está determinada por tres factores: (1) la estacionalidad, (2) el pulso de inundación y (3) las coberturas vegetales y su transformación. Así mismo, se concluyó que para la herpetofauna de las sabanas inundables, las coberturas más importantes son los bosques de galería, las vegas y las matas de monte. Finalmente, se evidenció que la actividad humana más nociva y la que más tensión ejerce en los ecosistemas de las sabanas inundables del río Pauto es la de los cultivos transitorios como el arroz.
Palabras clave: pulso de inundación, estacionalidad, dinámica ecológica, transformación de coberturas naturales.
Abstract
The main goal of this study was to provide a first approach to the knowledge of the amphibian and reptile ensembles in the flooded savannas of the Pauto River, and to assess the effect derived from the introduction of rice and pasture crops. To do so we first evaluated the richness, abundance, composition and habitat preferences of the species found in the ensemble. We established three factors that determine the ecological dynamics of the ensemble: (1) seasonality, (2) flood pulse and (3) transformations of natural coverts to crops. We concluded that the forest, especially the riparian forest, is the most important natural covert for amphibian and reptile ensembles during the annual climate cycle. Finally, the most harmful and stressful human activity for the flooded savannas of the Pauto River is the practice of transitional crops such as rice.
Key words: Flood pulse, seasonality, ecology dynamics, transformations of the natural coverts.
Introducción
El modelo de desarrollo económico y sociocultural actual de Colombia se basa en la transformación de los ecosistemas naturales para el uso de sus recursos dentro de cadenas productivas. Esto ha generado grandes impactos ambientales que modifican las dinámicas de los ecosistemas, poniendo en riesgo la sostenibilidad de los bienes y servicios ambientales que estos proveen a la sociedad. Así mismo, dichos impactos se han producido sobre ecosistemas escasamente conocidos, lo que hace incalculable la pérdida, deterioro o destrucción derivada de las actividades de este modelo de desarrollo (Mora-Fernández & Peñuela-Recio, 2013).
Sin embargo, en el país aún existen ecosistemas como los bosques húmedos del Chocó biogeográfico y la Amazonia, los manglares de las costas Caribe y Pacífica, y las sabanas de los llanos orientales, entre otros, que, a pesar de su acelerada transformación en los últimos 30 años, conservan una extensión e integridad considerables (Rangel-Ch, 1997, 2004, 2012; Cortés & Rangel-Ch, 2011; Palacios, et al., 2012). Las sabanas inundables del río Pauto en el departamento del Casanare hacen parte de los ecosistemas que han logrado mantener las condiciones espaciales y ecológicas que permiten evaluar sus atributos, dinámicas y función, así como los bienes y servicios ambientales que proveen a la sociedad y sostienen su naturaleza ecológica (Mora-Fernández & Peñuela-Recio, 2013).
La naturaleza estacional de las sabanas inundables les impone limitaciones para el establecimiento de ensambles de anfibios y reptiles, lo que presiona la selección de aquellos organismos lo suficientemente tolerantes a las exigencias climáticas y con una plasticidad adaptativa amplia para afrontar cambios en el paisaje durante los periodos de sequía y lluvias (Wells, 2007). En su evolución, las sabanas han adquirido regímenes hidrológicos (diciembre-marzo: época de sequía; abril-noviembre: época húmeda) que orientan y controlan la renovación de los hábitats, la variabilidad estacional de la producción primaria, el ciclo de nutrientes, el éxito reproductivo y el reclutamiento de la fauna y la flora, así como el mantenimiento de la variabilidad espacio-temporal de los cuerpos de agua que hacen parte de este ecosistema (Montoya, et al., 2011).
En la última década el gobierno nacional, así como empresas privadas, organizaciones no gubernamentales, universidades y centros de investigación, han vuelto su atención hacia los diferentes ecosistemas de Casanare motivados por el acelerado crecimiento económico de la región y las radicales transformaciones de los paisajes naturales de las llanuras. Esto ha generado un creciente número de investigaciones con aportes y avances significativos en el conocimiento de los anfibios y reptiles del departamento.
Los registros existentes se remiten únicamente a las regiones aledañas al piedemonte llanero y a las inmediaciones de las riberas del río Orinoco, dejando de lado los 16.000.000 de hectáreas de paisaje de sabanas, bosques de galería y matas de monte, equivalentes al 90 % de los ecosistemas presentes (Angarita-Sierra, et al, 2013). Actualmente, la información sobre la herpetofauna del Casanare se encuentra consignada en un informe técnico sobre el complejo de humedales asociados a los ríos Caranal, Lipa y Cinaruco en el departamento de Arauca (Caro, et al., 2006), en los reportes de reptiles hallados en los municipios de Trinidad y San Luis de Palenque (Cortes & Sánchez-Palomino, 2010), en la actualización realizada por Acosta-Galvis y Alfaro- Bejarano, 2011, sobre el estado de conocimiento de los anfibios y reptiles del Casanare en los últimos cinco años, y en los listados de la fauna y la flora de las reservas de la sociedad civil del nodo Orinoquia (Peñuela, et al., 2011). Recientemente, Angarita-Sierra, et al., 2013, y Mora- Fernández, et al., 2013, redujeron los vacíos de información sobre la herpetofauna del departamento del Casanare, logrando avanzar en el conocimiento de los anfibios y reptiles presentes en 16 de los 19 municipios del departamento. No obstante, los autores de estos estudios reconocen que aún deben desplegarse mayores esfuerzos en la investigación de su distribución, ecología y estado de conservación, así como de los efectos sobre los ensambles de anfibios y reptiles producidos por el cambio en el uso del suelo y la pérdida de coberturas naturales.
Tomando en cuenta lo anotado, este estudio realizó la diagnosis del estado de conservación del ensamble de anfibios y reptiles presentes en los ecosistemas de sabanas inundables asociados a la cuenca media y baja del río Pauto con los siguientes objetivos principales: (1) proporcionar una primera aproximación al conocimiento de este ensamble de anfibios y reptiles, evaluando su riqueza, composición y preferencia de hábitat, y (2) evaluar los efectos producidos en las comunidades de anuros por la transformación de los ecosistemas naturales debida a la introducción de cultivos de arroz y pastos exóticos.
Materiales y métodos
Se realizaron dos salidas de campo durante el 2012, la primera en la época de sequía, del 3 al 20 de marzo, y la segunda en la época húmeda, del 5 al 22 de julio, invirtiendo entre 12 y 15 días efectivos de muestreo en cada época. El esfuerzo de muestreo fue de 8 horas/hombre/día, contando con dos a tres personas en el equipo de trabajo en campo. Se establecieron tres campamentos a lo largo de la cuenca del río Pauto: la estación 1, en predios del Colegio Emaús, 5° 8'40,4'' N, 70° 58' 22,6'' O, y en las fincas Altamira, 5° 11' 9,77" N, 70° 58' 53,9" O; La Bretaña, 5° 8' 41,2" N, 70° 57' 27,9" O, y Matamoriche, 5° 9' 7,6" N, 70° 58'5,4" O; la estación 2, en la finca Candalayes, 5° 18'47,2" N, 71° 22' 5,4" O, y la estación 3: en las fincas La Palmita, 5° 19' 11,4" N, 71° 20'51" O, El Mirador, 5° 26' 9,1" N, 71° 35' 46,8" O y San Miguel, 5° 24' 49,8" N, 71° 36' 38,4" O. En estas localidades se identificaron las siguientes unidades paisajísticas y sus transformaciones: sabanas (sabanas de valles aluviales de desborde, sabanas inundables típicas, sabanas con influencia eólica), que exhiben marcadas diferencias entre los periodos de sequía y humedad, son hiperestacionales, con largos periodos de estrés hídrico en sus suelos y un régimen anual de lluvias unimodal (Sarmiento, 1984); bosques (bosques de galería, bosques de vega, matas de monte), que ocupan áreas transicionales semiterrestres influenciadas regularmente por aguas continentales que se extienden desde las márgenes de los cursos de agua hacia los límites de las comunidades terrestres alejadas de la influencia del agua; arroceras (sabanas o bosques transformados en cultivos de arroz) de Oryza sativa establecidas sobre los bajos de la sabana, y potreros (sabanas o bosques transformadas en potreros de pastos de Urochloa humidicola y Urochloa decumbens sembrados sobre las banquetas de la sabana (Figura 1).
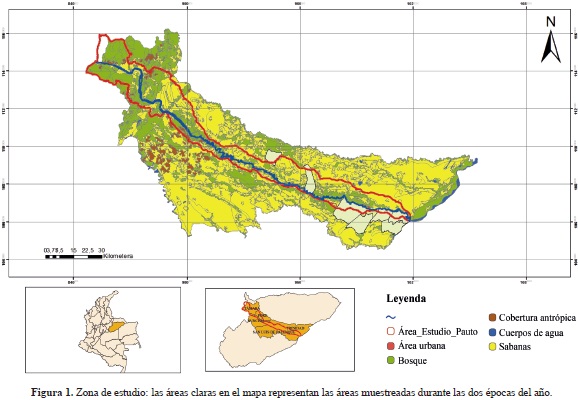
El levantamiento y caracterización del ensamble de anfibios y reptiles se llevó a cabo mediante tres técnicas: búsqueda libre sin restricciones, trampas de caída, nasas y búsqueda selectiva en hábitats y microhábitats (Angulo, et al., 2006). El muestreo se llevó a cabo durante el día y la noche de forma sistemática, procurando abarcar la mayor cantidad de hábitats y microhábitats posibles en cada jornada. En el día se realizaba la búsqueda de larvas (renacuajos), lagartijas y serpientes diurnas, utilizando redes de arrastre de fondo (no se hizo captura manual o captura directa) para su posterior identificación en el laboratorio. En la noche se buscaban anfibios adultos y jóvenes y lagartijas y serpientes nocturnas recorriendo los mismos hábitats y microhábitats en los se realizaba la búsqueda diurna. La recolección se hizo de forma manual y los individuos encontrados se depositaron en bolsas de tela para su identificación preliminar en campo y posterior determinación definitiva en el laboratorio. Se registraban el hábitat y el microhábitat en los cuales se había recolectado cada individuo. El sistema de clasificación utilizado fue el establecido por Frost, et al., 2006, Lynch, 2006a, y Lynch, 2011, para anuros, por Wüster, 2001, Lehr, 2002, Campbell & Lamar, 2004, para serpientes, por Harvey, et al., 2012, Caicedo-Portilla & Dulcey-Cala, 2011, y Ayala, 1986 para lagartos y por Rueda-Almoacid, et al., 2007, para tortugas y cocodrilos. Todos los especímenes recolectados se depositaron en la colección biológica de anfibios y reptiles del Instituto de Ciencias Naturales (ICN) de la Universidad Nacional de Colombia, sede Bogotá (Anexo 1).
Análisis de datos
La diagnosis del estado de conservación de la herpetofauna presente en los ecosistemas de sabanas inundables se realizó mediante la evaluación de la perturbación o degradación del hábitat de las comunidades de anfibios y reptiles presentes en cada unidad de paisaje con base en el estudio de la riqueza, la abundancia, la composición relativa, la presencia o ausencia de taxones, la preferencia de hábitat (entendido como el mayor porcentaje de presencias por cobertura), las especies sensibles o tolerantes y los endemismos. Se valoró igualmente la diversidad, la composición y los grados de amenaza según lo establecido por Pedroza-Banda & Angarita-Sierra, 2011, y Cáceres & Urbina, 2009. La diversidad total se estimó mediante dos estimadores de riqueza no paramétricos (Magurran, 1988, Colwell & Coddington, 1994) del tipo jacknife de primero y segundo orden utilizando el programa EstimateS (Colwell, 2006), debido a que suponen heterogeneidad en las muestras y son idóneos para estimar la riqueza de anuros y reptiles en el área de estudio, la cual está compuesta por una gran diversidad de hábitats. Se analizó la diversidad alfa entre las dos épocas del año mediante el índice Shannon-Wiener (H'), que expresa la uniformidad de los valores de importancia de todas las especies de la muestra. La diversidad beta se estimó mediante la comparación gráfica directa de cada una de las coberturas vegetales usando el estimador de similitud Bray-Curtis y la aplicación PAST (Hammer, et al., 2004). Finalmente, para evaluar el uso y la preferencia de hábitat se utilizó la prueba no paramétrica de ji al cuadrado, comparando los valores esperados de cada una de las coberturas evaluadas, así como la preferencia entre las coberturas naturales y transformadas.
Resultados
Diversidad taxonómica
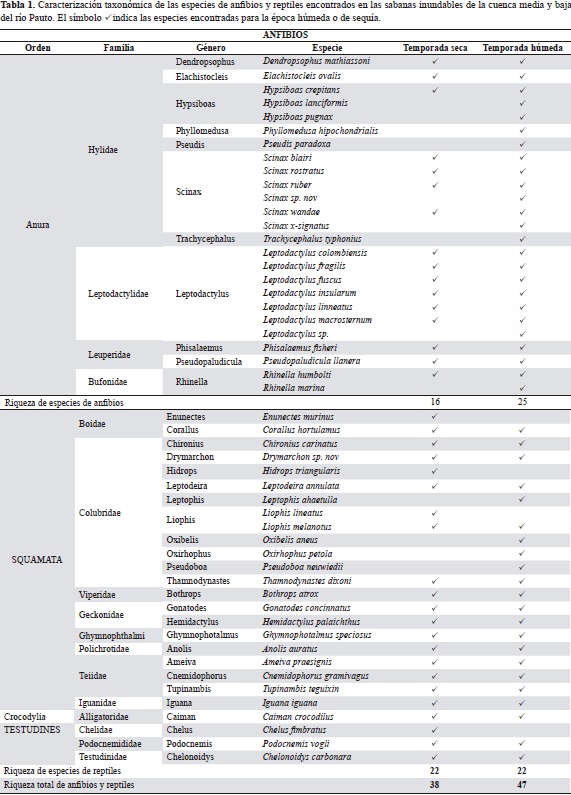
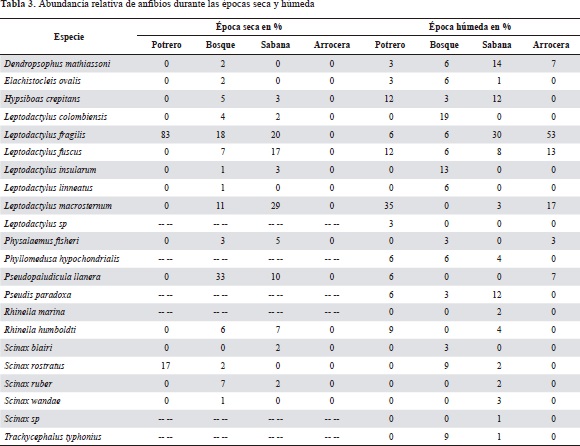
En el estudio se recolectaron 452 individuos y se obtuvo un total de 48 especies pertenecientes a 36 géneros, 16 familias y cuatro órdenes, de los cuales dos son nuevos registros para el departamento del Casanare, los reptiles Hemidactylus palaichthus y Thamnodynastes dixoni. Además, se detectaron dos posibles nuevas especies para la ciencia, una rana del género Scinax y una serpiente del género Drymarchon. De todas las especies detectadas, el 46 % (23 especies) correspondió a anfibios pertenecientes a 11 géneros y cuatro familias, y el 54 % (25 especies) a reptiles pertenecientes a 24 géneros, 11 familias y tres órdenes. Los géneros más diversos entre los anfibios fueron Leptodactylus, con siete especies, Scinax, con cinco especies, y Rhinella, con dos especies; entre los reptiles el género más diversos fue el de las serpientes Liophis, con dos especies (Tabla 1).
Diversidad total de anfibios
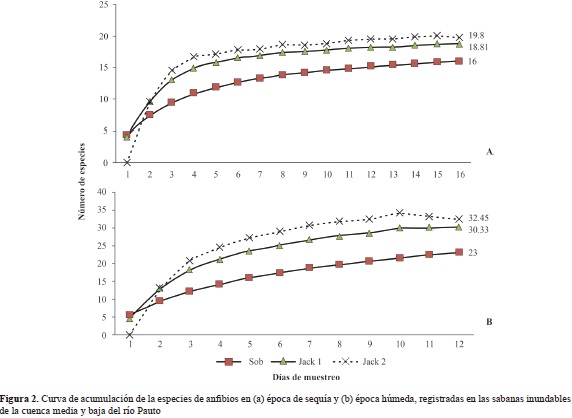
Los estimadores empleados indicaron que para la época de sequía el número de especies esperadas de anfibios estaba en el rango de 18,81 a 19,8, por lo cual las especies observadas tuvieron un 85,1 % de representatividad según el estimador jacknife de primer orden y de 80,8 % según el estimador jacknife de segundo orden. En contraste, los estimadores indicaron que el muestreo realizado durante la época húmeda requería un mayor esfuerzo de muestreo o una búsqueda más prolongada parar lograr una representatividad aceptable de la comunidad de anfibios. Las especies esperadas de anfibios estaban en el rango de 30,33 a 32,45, y las especies observadas tuvieron un 75,8 % de representatividad según el estimador jacknife de primer orden y de 71,1 % según el estimador jacknife de segundo orden. A pesar de esto, el muestreo durante la época húmeda logró detectar cinco especies más que el muestreo durante la época de sequía (Figura 2).
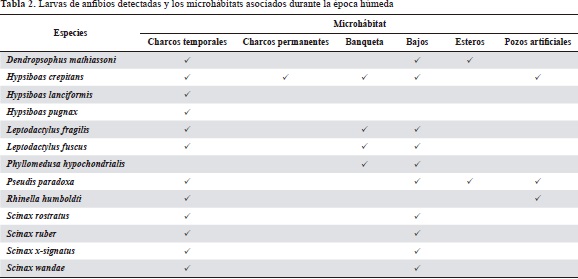
Se obtuvieron doce lotes de renacuajos con más de 2.500 larvas en total. De las 22 especies de anuros detectadas en forma adulta, solo el 54,5 % de las especies (12 especies) quedó representado en los muestreos de renacuajos. Sin embargo, se detectaron tres especies de Hylidos no registradas (Hypsiboas pugnax, Hypsiboas lanciformis y Scinax x-signatus) en los muestreos de adultos (Tabla 2). Las larvas se encontraron en los siguientes microhábitats: charcos temporales, charcos permanentes, banqueta, bajos, esteros y pozos artificiales. Los charcos temporales mostraron ser los microhábitats preferidos por los anuros para el desarrollo de sus estadios larvarios (X20.95 (5) renacuajos: 19,35), seguidos por los bajos y por las banquetas (Tabla 3). Las especies dominantes en el muestreo fueron Hypsiboas crepitans (21,4 %), seguida por Pseudis paradoxa, Scinax x-signatus (11,9 %), Leptodactylus fragilis, Leptodactylus fuscus y Phyllomedusa hipochondrialis (9,5 %), siendo H. crepitans la única especie presente en casi todos los microhábitats.
Diversidad total de reptiles
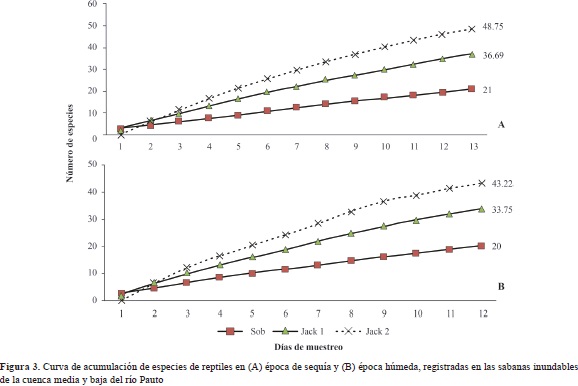
Las comunidades de escamados, tortugas y cocodrilos que se esperaba encontrar en la zona de estudio, tanto en la época seca como en la húmeda, tuvieron poca representación en el muestreo. Los estimadores indicaron que para la época húmeda, el número de especies esperadas de reptiles debían estar en el rango de 33,75 a 42,22, por lo cual las especies observadas tuvieron un 59,3 % de representatividad según el estimador jacknife de primer orden y de 46,31 % según el estimador jacknife de segundo orden. En la época de sequía la representatividad fue incluso más baja, ya que los estimadores mostraron que las especies esperadas debían estar en el rango de 36,69 a 48,75, equivalente a 57,2 % según el estimador jacknife de primer orden y a 43,1 % según el estimador jacknife de segundo orden (Figura 3).
Variación espacio-temporal del ensamble de anfibios y reptiles
El efecto derivado de las épocas de lluvia y sequía ocasiona grandes cambios en la riqueza, la abundancia y la composición del ensamble de anfibios y reptiles de las sabanas inundables. Como era de esperase, se observó un aumento significativo en la riqueza de anfibios entre la época húmeda (Nseca = 16; Nhúmeda = 25), y un cambio en la composición del ensamble, pues se sumaron nueve especies no detectadas durante la sequía: Hypsiboas lanciformis, Hypsiboas pugnax, Leptodactylus sp., Phyllomedusa hypochondrialis, Pseudis paradoxa, Scinax x-signatus, Scinax sp., Trachycephalus typhonius y Rhinella marina. Por el contrario, la riqueza de reptiles permaneció constante en las dos épocas el años (Nseca y húmeda= 22), pero su composición cambió significativamente en los taxones de serpientes presentes en cada una de las épocas del año (Tabla 1).
En las cuatro coberturas vegetales evaluadas se encontró que durante la época de sequía la biomasa de anfibios y reptiles se concentró mayoritariamente en los bosques (64,4 %, 150 individuos), seguidos por las sabanas (32,6 %, 76 individuos) y los potreros (3 %, 7 individuos). En esta época las arroceras se encuentran aradas, sin cobertura vegetal de ningún tipo, lo que significa que estas zonas no pueden proporcionar hábitats para los anfibios y reptiles de la región. En contraste, durante la época húmeda la biomasa del ensamble de anfibios y reptiles se distribuye más equitativamente (H'sequía =0,7542; H'húmeda =1,253) entre los cuatro tipos de cobertura evaluados. Sin embargo, se observó una clara dominancia de la capacidad de carga de las sabanas (48,6 %, 108 individuos) para sostener un mayor número de individuos en comparación con los bosques (20,3 %, 45 individuos), las arroceras (15,8 %, 35 individuos) y los potreros (15,3 %, 34 individuos).
El grado de semejanza en términos de la composición y abundancia de especies entre las cuatro coberturas evaluadas también mostró una gran variación espacio-temporal entre cada época del año y para cada una de las coberturas. Durante la época de sequía, las coberturas más similares fueron los bosques y sabanas, lo cual era de esperarse, ya que estas dos coberturas albergan el 96,8 % de la herpetofauna de las sabanas inundables en este periodo del año. En consecuencia, las coberturas más disímiles fueron los potreros y las arroceras, en las cuales no se encontró ningún individuo, o solo se detectaron individuos de especies tolerantes a condiciones extremas de desecación y baja humedad relativa (D. mathiassoni, L. fuscus, S. rostratus) (Figura 4A).
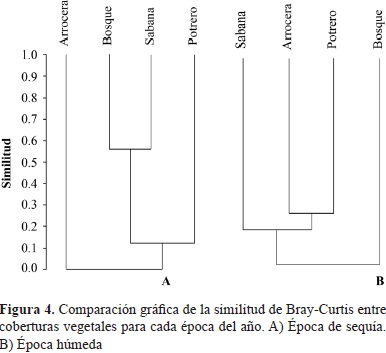
Durante la época húmeda las coberturas más similares fueron los potreros y las arroceras, y las más disímiles fueron las sabanas y los bosques. En esta época del año las sabanas albergaron el 48,6 % de la biomasa de anfibios y reptiles de las sabanas inundables con una representatividad del 86 % de la especies de anfibios y reptiles presentes en estos ecosistemas. Los bosques, a su vez, albergaron el 20,3 % de la biomasa del ensamble de anfibios y reptiles de estos ecosistemas con una representatividad del 77,3 % de las especies presentes. Esto lleva a que la complementariedad entre las coberturas sea alta, y, además, a que las sabanas y los bosques conformen unidades con ensambles faunísticos propios, con especies únicas y distribuciones de abundancias particulares de cada especie (Tabla 3).
Uso del hábitat
En cada época del año la presencia de los anfibios y reptiles en los microhábitats y el uso que de ellos hicieron fue distinto. Durante la época de sequía, el 68,7 % (11 taxones) de las especies de anfibios prefirió usar microhábitats dentro de los bosques, y unas pocas especies como L. macrosternum, L. fuscus y S. blairi, prefirieron usar los limitados recursos de las sabanas y potreros en esta época del año (X20,95 (3) época de sequía=22). En contraste, durante la época húmeda la disponibilidad de recursos permitió que cada una de las especies ocupara múltiples hábitats y microhábitats, dándoles diferentes usos (X20,95 (3) época húmeda =4,26) (Tabla 4). Esto se reflejó en que el 41 % (9 taxones) de las especies usara las coberturas naturales de bosques y sabanas, y un 50 % (11 taxones) lograra usar las coberturas transformadas de pastizales y arroceras, que durante la época de sequía no estaban disponibles.
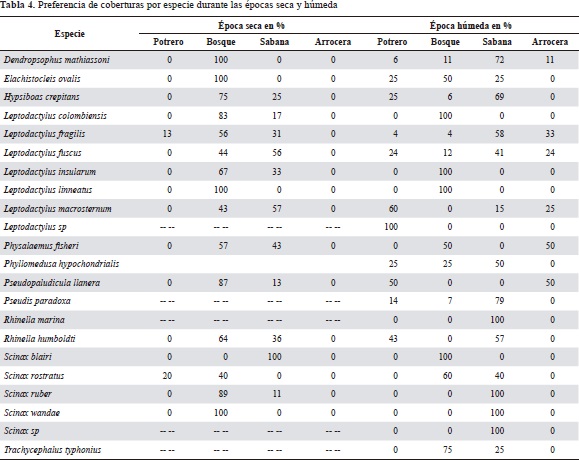
Los cambios de preferencia más notables durante las dos épocas del año los presentaron P. llanera, R. humboltdti, L. macrosternum y S. ruber, ya que durante la época de sequía mostraron una alta preferencia por los bosques, mientras que en la época húmeda estuvieron totalmente ausentes en esta cobertura (Tabla 5). No se incluye a S. blairi en este resultado, ya que el reemplazo obtenido fue un artefacto debido al bajo número de individuos de esta especie recolectados. A pesar dela variación en las preferencias de coberturas durante las dos épocas del año, es evidente que el ensamble de anfibios prefirió mayoritariamente las coberturas naturales a las transformadas (preferencia de coberturas naturales Vs. coberturas transformadas: X20,95 (1) época de sequía =20,57; X20,95 (1) época húmeda=13,13).
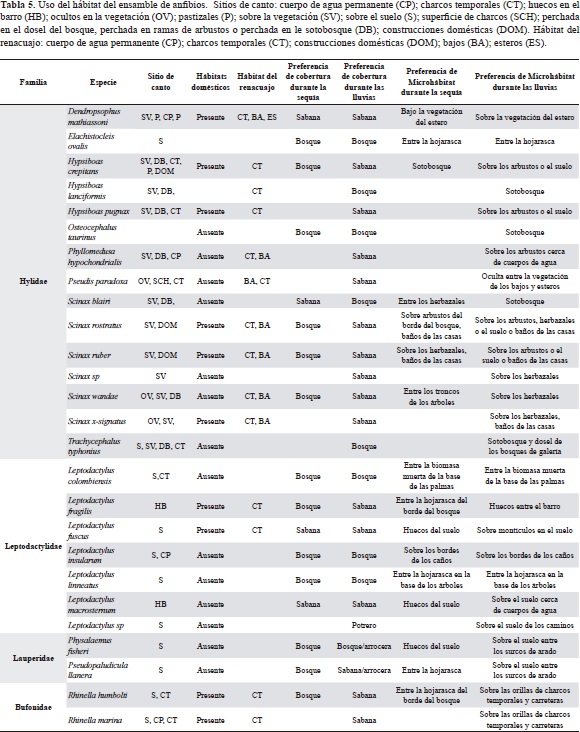
Las ranas y sapos de las sabanas inundables mostraron una clara organización vertical y horizontal dentro de las coberturas naturales de estos ecosistemas. Esta disposición en el espacio, al igual que la riqueza, la abundancia y la composición de este ensamble de anfibios, se vio afectada por el ciclo de inundación y sequía. Durante la época de sequía casi todas las especies detectadas se concentraron en el estrato herbáceo, muy cerca de los caños o madre viejas, entre la hojarasca y los elementos caídos dentro de los bosques (Figura 5). Pocas especies utilizaron el estrato arbustivo (S. wandae, S. rostratus, S. ruber, H. crepitans, D. mathiassoni), en el cual se les suele encontrar alimentándose u ocultas entre los huecos de ramas secas. Las pocas especies presentes en las sabanas durante la sequía no hicieron uso de las partes altas de las macollas (Andropogon selloanus, Andropogon bicornis o Paspalum plicatulum), se congregaron cerca de las orillas de los esteros o en los bancos de sabana (L. fuscus, L. macrosternum, R. humboldti), o se ocultaron entre las marcas del ganado o las oquedades del suelo (L. fragilis) (Figura 6).
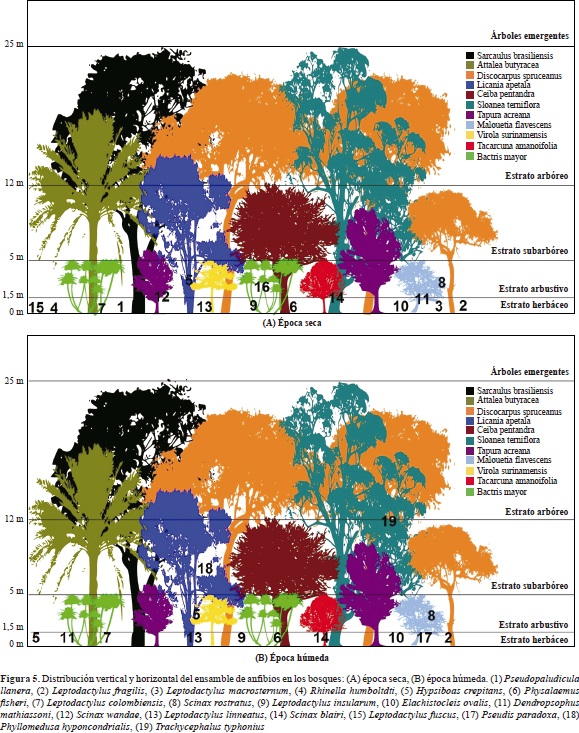
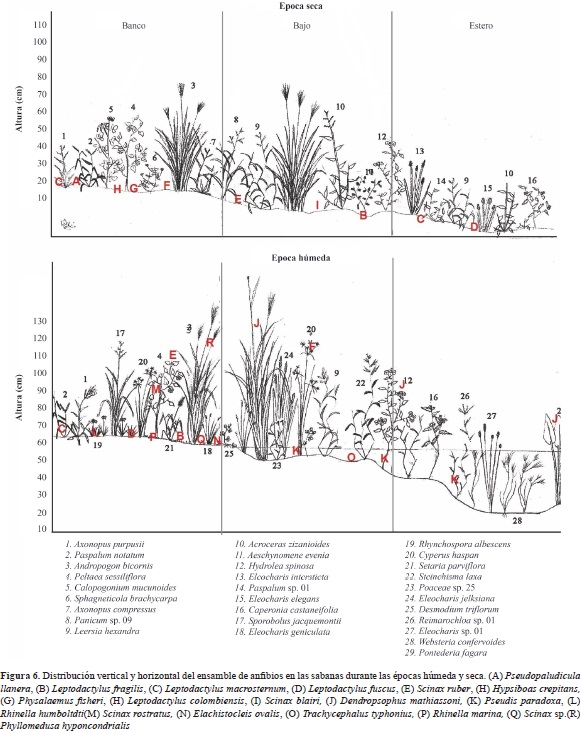
Con la llegada de las lluvias los estratos verticales de las sabanas y los bosques empezaron a ser colonizados por las especies que durante la sequía se concentraban en el suelo (D. mathiassoni, H. crepitans, S. rostratus, S. blairi) y aparecieron otras con una gran afinidad por los estratos arbustivos de las sabanas y el estrato subarborio de los bosques (P. hypocondrialis, S. ruber, T. typhonius). Las especies que se encontraban concentradas en la hojarasca durante el verano, se desplazaron hacia la sabana o las partes no inundadas de los bosques de galería (P, llanera, E. ovalis, S. ruber). De igual forma, la estratificación horizontal de la vegetación y la topografía de las sabanas hizo que en la época húmeda el ensamble de anuros se distribuyera de forma más homogénea entre los microhábitats (Figura 6).
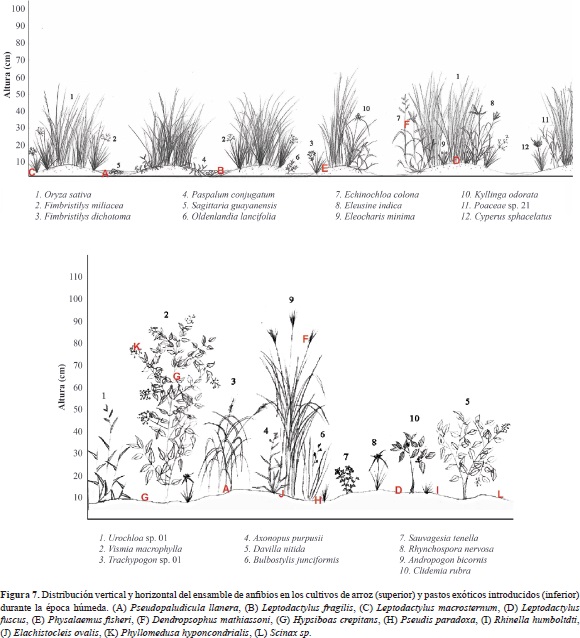
Esta colonización también se presentó en los cultivos de arroz y en los pastizales, sin embargo, la poca estratificación vertical de estas coberturas no proveyó hábitats aéreos que favorecieran la presencia de ranas con hábitos de percha. Solamente se observó un par de machos de D. mathiassoni posados y cantando en las espigas de Urochloa humidicola y Urochloa decumbens (Figura 7).
En el caso de los reptiles no se pudo establecer la preferencia y el uso del hábitat, debido a que, en su gran mayoría, las especies observadas fueron registros únicos o con número muy bajo de individuos, por lo que sus hábitats y hábitos no quedaron suficientemente representados. Las especies más abundantes entre las lagartijas y la salamanquejas fueron Gonatodes concinnatus (48 %, 24 individuos) y Hemidactylus palaichthus (30 %, 15 individuos), y entre las serpientes, Chironius carinatus (29 %, 8 individuos), Corallus hortulanus (11 %, 3 individuos), Liophis melanotus (11 %, 3 individuos) y Thamnodynastes dixoni (11 %, 3 individuos). Sin embargo, algunas especies, como las siguientes, presentaron asociaciones muy claras con unidades o elementos del paisaje de las sabanas inundables.
G. concinnatus (O'Shaughnessy, 1881) fue el lagarto más común durante las dos épocas del año. Su preferencia de hábitat se inclinó por los bosques y ruinas de las construcciones abandonadas, en las cuales se registraron numerosas posturas eclosionadas (N=9) y sin eclosionar (N=4) entre las grietas, las oquedades de las paredes y las placas del suelo durante la época lluviosa del año. A su vez, se recolectaron ejemplares en los troncos de las palmas y en árboles de los bosques de galería, activos durante las primeras horas de la mañana y las últimas de la tarde.
H. palaichthus (Kluge, 1969) presentó una fuerte afinidad con los hábitats que ofrecen las construcciones domésticas o las ruinas de estas construcciones abandonadas por los campesinos. Todos los ejemplares de esta especie se recolectaron en estos hábitats. Al parecer su preferencia de hábitat no cambia entre las épocas seca y húmeda.
Chironius carinatus (Linnaeus, 1758) fue la serpiente más común durante las dos épocas del año, presentando una mayor abundancia en la época húmeda. Mostró una mayor afinidad por las sabanas arboladas, aunque también se la observó fácilmente en los bosques de galería y las matas de monte durante las primeras horas de la mañana y las últimas de la tarde. De los ocho ejemplares recolectados, dos poseían contenidos estomacales identificados como H. crepitans y L. macrosternum. Durante las noches se les observó durmiendo a dos o tres metros del suelo sobre ramas de arbustos o árboles. Se recolectaron dos ejemplares (una hembra y un macho) muertos en las carreteras municipales durante la época húmeda, la hembra (LRC: 1.170 mm, LC: 470 mm, incompleta) tenía huevos en gestación, y el macho, de gran tamaño (LRC: 1.065 mm; LC: 505 mm) se encontraba sexualmente activo, lo que siguiere que durante esta época se presenta el periodo reproductivo de esta especie.
Chelonoidys carbonara (Spix, 1824) se observó en casi todas las unidades de paisaje durante la época de sequía, sin embargo, mostró preferencia por los boques de galería y las matas de monte como refugio y por las sabanas como fuente de alimento. Se le pudo observar realizando grandes travesías por las sabanas en búsqueda de refugio durante las últimas horas de la tarde. En la época húmeda se le vio preferentemente en las zonas no inundadas de las sabanas como las banquetas o los taludes de las carreteras.
Discusión
La dinámica ecológica de los ensambles de anfibios y de reptiles de la sabanas inundables estuvo determinada principalmente por tres factores: (1) la marcada estacionalidad entre las épocas seca y húmeda; (2) el pulso de inundación de los principales caños y ríos, y (3) las coberturas vegetales y su transformación debida a las actividades humanas. La relación de estos factores, así como la plasticidad adaptativa de las especies que componen el ensamble de anfibios y reptiles, nos permite comprender cómo la transformación o alteración de estas dinámicas ecológicas por la acción del hombre tiene un impacto negativo en estos organismos y en la integridad de este ecosistema. A continuación se analiza cada uno de estos factores detalladamente.
Estacionalidad
Se puede considerar que los estimadores de tipo jacknife de primer y segundo orden sobrestimaron la riqueza del ensamble de anfibios y reptiles durante las dos épocas del año, debido al aumento constante de especies únicas en cada día de muestreo (Figura 2 y 3). No obstante, considerando la dificultad para detectar anfibios durante la época seca del año (Wells, 2007), las curvas de acumulación sugieren que la comunidad de anuros durante esta época del año estuvo bien representada. Por otro lado, aunque en la época húmeda del año la riqueza encontrada estuvo cerca de un 30 % por debajo de lo esperado por los estimadores jacknife de primer y segundo orden, se la consideró representativa y, además, concuerda con la riqueza reportada para estos ecosistemas de sabana por Dixon & Staton, 1976, Tárano, 2010, y Acosta- Galvis & Alfaro-Bejarano, 2011. La diferencia entre el número de especies de anfibios detectadas durante las dos épocas del año se debió a dos factores: (1) a la variación en la cantidad de días efectivos de muestreo (16 en la época seca y 12 en la época húmeda) y (2), a la mayor cantidad de hábitats y microhábitats disponibles en la época húmeda. Este es un patrón común para las especies que habitan zonas tropicales, en las cuales las marcadas temporadas de lluvias y los pulsos de inundación y sequía establecen y modulan los ciclos de vida de los anfibios (MacDiarmind & Altig, 1999; Montoya, et al., 2011).
En concordancia con los patrones de los ciclos de vida de los anfibios tropicales (Duellman & Trueb, 1994; Duellman, 2005), durante la época de sequía no se detectó actividad reproductiva en ninguna de las especies registradas o renacuajos en ninguno de los cuerpos de agua visitados. Durante la época húmeda, como se esperaba, se observó una gran actividad reproductiva, la cual generó una abundante cantidad de renacuajos disponibles para la observación durante el estudio. Esto permitió detectar especies nunca antes encontradas en las sabanas inundables, como H. lanciformis, o especies no detectadas en sus estadios adultos. Este resultado ilustra la importancia de estudiar los estadios larvales de los anfibios como herramienta útil para maximizar la detección de especies en inventarios de fauna y en evaluaciones ecológicas rápidas, así como para evaluar el impacto de las modificaciones ecológicas ocasionadas por las intervenciones humanas en los hábitats (Lynch, 2006a). En la zona de estudio, los drenajes naturales de las sabanas han sido modificados de forma directa por las vías de acceso y las zanjas de desagüe de los cultivos de arroz. Esto ha producido la segmentación de las sabanas inundables, creando charcos o pozos temporales aislados de los sistemas hídricos naturales. Esta nueva oferta de microhábitats ha resultado en que los anuros muestren preferencia por depositar sus huevos en charcos temporales derivados de las intervenciones humanas más que en los microhábitats naturales disponibles (X20,95 (5) renacuajos=19,35). Posiblemente, este efecto se debe a que los charcos temporales derivados de las intervenciones humanas poseen menos predadores de los renacuajos, pues están aislados de los sistemas hídricos naturales, en contraste con los microhábitats acuáticos naturales en los cuales los renacuajos cohabitan con peces, larvas de odonatos y coleópteros (MacDiarmid & Alting, 1999). No obstante, se recomienda llevar a cabo estudios más detallados sobre la preferencia y el uso de hábitats y su relación con las transformaciones antrópicas de la estructura y la función de los sistemas hídricos naturales.
Por el contrario, de las 35 especies de reptiles esperadas de acuerdo a lo reportado por Cortéz-Duque & Sánchez-Palomino, 2011, para la zona de estudio, tan solo se detectaron 23 especies en este estudio. Esta baja representatividad de las comunidades de reptiles en los muestreos obedece a tres factores principales: (1) la dificultad para realizar un muestreo eficiente y preciso en cada uno de los hábitats y microhábitats utilizados por los grupos que componen esta comunidad, lo que disminuyó la probabilidad de detección del mayor número posible de especies en el tiempo disponible para el trabajo en campo; (2) la división del esfuerzo de muestreo debido a la especificidad de las técnicas de muestreo para cada uno de los grupos de reptiles (escamados, tortugas y cocodrilos), lo que resultó en una pérdida de efectividad en la detección de las especies, y (3), el cambio estacional en el uso de los hábitats y microhábitats por parte de las especies tropicales (Zug, et al., 2001; Wiederhecker, et al., 2003), lo que ocasiona que especies fácilmente detectables durante la sequía no lo sean durante el invierno y viceversa.
La detección de Hydrops triangularis y Eunectes murinus únicamente durante la época de sequía es un claro ejemplo de cómo los factores (2) y (3) afectan la detección de los reptiles, ocasionando una baja representatividad en el muestreo. El único ejemplar de H. triangularis se recolectó a 30 cm bajo la hojarasca de un bosque de vega a orillas del río Pauto. Su detección se logró gracias al intenso esfuerzo de muestreo rastrillando el suelo del bosque y al estado de reposo o estivación que presentaba el individuo en espera del pulso de inundación del río. Por otro lado, los ejemplares de E. murinus se detectaron al interior de los bosques de vega, entre las cavidades de las raíces de los árboles, mudando su piel o en estivación.
Además, de las 35 especies esperadas (Cortéz-Duque & Sánchez-Palomino, 2011) y las 55 probables para la región (Acosta-Galvis & Alfaro-Bejarano, 2011; Peñuela, et al., 2011), en este estudio tan solo se compartieron 11 y 15 especies, respectivamente, denotando una baja correspondencia con estos reportes. Sin embargo, las listas presentadas por estos autores no permiten estimar con claridad el estado de conocimiento de la herpetofauna del Casanare y el estado de conservación de sus ecosistemas debido a que: 1) algunos de estos estudios basan sus análisis principalmente en registros del piedemonte con una baja representatividad de los paisajes de sabanas, de bosques de galería y de matas de monte, los cuales son los ecosistemas dominantes en la región; 2) los listados carecen de voucher o depósito de ejemplares en las colecciones nacionales registradas que respalden los registros para el Casanare y permitan corroborar su identidad taxonómica y su distribución, y 3) las listas de anfibios y reptiles reportadas representan un recuento histórico de la herpetofauna de la región que dista de representar su situación actual. No obstante, se debe destacar que, a pesar de las falencias, estas aproximaciones a la herpetofuana del Casanare han sido la base para su conocimiento y han ayudado a orientar las futuras investigaciones.
La composición del ensamble de anuros evidencia la evolución de las sabanas y la elección de organismos altamente tolerantes a las condiciones de sequía y a la transformación del paisaje. De las cinco familias de anuros presentes en este estudio, tres (Leptodactylidae, Bufonidae y Microhylidae) contienen las mayores abundancias y están compuestas por especies con rasgos de vida oportunistas, minadoras, poco dependientes del agua y muy versátiles en su preferencia de hábitat (Duellman & Trueb, 1994). Sin embargo, la preferencia del hábitat cambia según la época del año. Durante la época de sequía, los bosques resultaron ser los elementos clave para el establecimiento y mantenimiento del ensamble de anfibios de las sabanas inundables. Para este ensamble, los bosques funcionan como el refugio del 96,8 % de la biomasa de estos organismos y del 93,7 % de las especies. Cortéz-Duque & Sánchez-Palomino, 2011, corroboran que los bosques, en especial los bosques de galería, son las coberturas naturales más importantes para los ecosistemas de sabanas inundables del río Pauto. Esto implica que cualquier transformación o destrucción de estas coberturas durante esta época del año pone en riesgo de extinción a las poblaciones de anfibios presentes en estos ecosistemas. En contraste, durante la época húmeda son las sabanas las que sostienen la mayor proporción de biomasa y de especies de anfibios, proporcionando las condiciones necesarias para el éxito reproductivo y el reclutamiento de larvas. Por ende, las transformaciones mecánicas derivadas de las actividades humanas sobre los suelos de los bancos, las banquetas, los bajos, los esteros o los caños repercuten en las condiciones fisicoquímicas del agua, el hábitat físico y los drenajes naturales (Montoya, et Al., 2011), interrumpiendo y deteriorando las dinámicas de reclutamiento de larvas o individuos jóvenes que garantizan la continuidad de las poblaciones.
Al parecer, la familia Leptodactylidae es el taxón con el mayor grado de adaptación a los marcados cambios periódicos de precipitación. Esta familia presentó la mayor abundancia y riqueza entre todos los anfibios encontrados debido a que los rasgos de historia de vida de las especies que componen este taxón han evolucionado de los hábitats acuáticos a los terrestres, reduciendo paulatinamente la dependencia del medio acuático (Heyer, 1969). Estas cualidades les permiten ser las especies dominantes en los bosques y sabanas, así como en los arrozales y potreros durante todo el año. La gran plasticidad adaptativa de estas especies (Heyer, 1969) les permite colonizar una mayor cantidad de hábitats y microhábitats, reduciendo así la competencia con otras especies por los recursos (Wells, 2007), y ocupar hábitats y microhábitats con condiciones extremas de desecación por insolación durante la sequía, así como colonizar hábitats degradados por actividades agrícolas y ganaderas.
Pulso de inundación
El evento hidrológico más importante para las sabanas inundables del río Pauto es el pulso de inundación, ya que esta es la fuerza motriz que modula los cambios anuales en las variables bióticas y abióticas que tienen lugar en los canales principales y en todos los cuerpos de agua asociados a la planicie de inundación (Montoya, et al., 2011). En consecuencia, este evento influye de forma directa en todos los aspectos del ciclo de vida de los anfibios debido a su inevitable dependencia del medio acuático (Wells, 2007) y, de forma indirecta, en los reptiles por la necesidad de encontrar hábitats disponibles para su establecimiento. El comportamiento de la herpetofauna encontrada evidenció de forma conspicua esta causalidad, expresándola en la distribución mayoritaria de la biomasa y la riqueza del ensamble durante la época de sequía en los bosques, y en la distribución más equitativa de la biomasa y la riqueza entre las cuatro coberturas evaluadas durante la época húmeda (H'seca =0,7542; H'húmeda =1,253). Otras señales evidentes del efecto del pulso de inundación en la dinámica del ensamble de anfibios y reptiles, fueron los cambios de preferencia de hábitat durante las dos épocas del año de P. llanera, R. humboltdti, L. macrosternum, y S. ruber, así como la aparición durante la época húmeda de especies como P. paradoxa, P. hyponcondrialis y T. typhonius en microhábitats específicos, los cuales no se encontraban disponibles durante la sequía (bajos y esteros, Figura 6), o no poseían las condiciones necesarias de humedad para ser utilizados (estratos arbustivo o subárboreos de los bosques, Figura 5).
Por otro lado, las inundaciones periódicas que generan el pulso de inundación proporcionan el medio conector entre las poblaciones de anfibios y reptiles que se refugian en los bosques durante la sequía y los nuevos hábitats disponibles de las sabanas con la llegada de las lluvias. La conectividad hidrológica lateral entre el canal principal del río Pauto y los caños sabaneros, la planicie de inundación y la gran cantidad de cuerpos de agua existentes, genera un intercambio de materia orgánica entre la planicie de inundación y los bancos, bajos, esteros y caños durante el pulso de inundación (Montoya, et al., 2011). Este evento permite la colonización de nuevos hábitats en las sabanas por parte de E. ovalis, H. crepitans, L. fragilis, L. macrosternum, P. llanera, S. wandae y, S. x-signatus, entre otros, garantizando así el éxito reproductivo debido a la persistencia de cuerpos de agua y el intercambio genético entre las poblaciones de estas especies (Wells, 2007).
En las sabanas inundables del río Pauto el proceso de colonización hecho por L. fragilis, L. macrosternum y P. llanera de las coberturas de arroz y pastos exóticos introducidos ha dependido principalmente de la conectividad con las sabanas y los bosques aledaños proporcionada por el pulso de inundación; si no ocurriera así, los ensambles de anfibios estarían ausentes de estas coberturas. Si bien se logró detectar el proceso de colonización de los anfibios sobre los cultivos y los pastos, se desconoce su tasa de colonización, las especies pioneras y la dinámica del ensamble de anfibios tolerantes a este tipo de coberturas transformadas. Por tal razón, se recomienda desarrollar estudios que consideren estos aspectos, lo cuales permitirían entender cómo la fauna local se adapta a las transformaciones del paisaje.
En un estudio realizado en las sabanas inundables del estado de Guárico en Venezuela, Tárano, 2010, también registra el mismo patrón de distribución horizontal del ensamble de anuros encontrado en las sabanas inundables del río Pauto en Colombia. Este patrón de distribución se relaciona directamente con el gradiente de inundación y sus hábitats derivados en la época húmeda. Si bien el ensamble de anuros en Guárico, Venezuela, es distinto al del río Pauto en Colombia, comparten varias especies con el mismo uso de microhábitats (E. ovalis, H. pugnax, L. fragilis L. fuscus, L. macrosternum, R. humbolti, P. paradoxa y S. x-signatus) (Figura 8). Al parecer, el uso de los microhábitats por parte de los anfibios de los ecosistemas de sabanas inundables durante la época húmeda es bastante específico. La mayoría de las especies presenta una marcada preferencia por un tipo de microhábitat específico, ya sea porque la fisonomía de la vegetación les permite poner sus huevos, ubicar sitios a la manera de percha para emitir su canto de aviso, o porque les proporciona refugio y alimento (Wells, 2007). Los esteros y los bajos resultaron ser los únicos microhábitats utilizados por P. paradoxa, considerándosela, así, una especie de hábitos exclusivamente acuáticos. Igualmente las banquetas y los bancos de las sabanas mostraron ser los microhábitats exclusivos de L. macrosternum. Dixon & Staton, 1976, reportan la gran habilidad de los individuos de L. macrosternum para retornar al microhábitat terrestre del cual han sido retirados después de ser liberados a una distancia prudente del punto de captura y para mantenerse allí durante toda la temporada húmeda. Con la llegada de la sequía y la pérdida de humedad en las sabanas, estas ranas se desplazan hacia el borde de los caños y los cuerpos de agua. Sin embargo, durante la época de sequía en este estudio se pudo observar a numerosos individuos adultos de esta especie usando las oquedades del suelo de los bajos como refugios, los que demuestra la gran tolerancia de esta especie a la desecación.
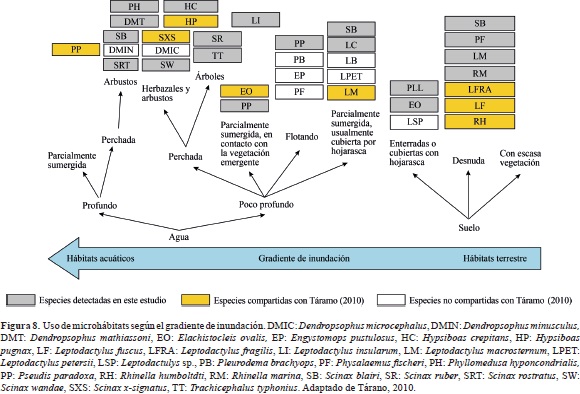
Coberturas vegetales y su transformación
El deterioro de los ecosistemas de las sabanas inundables encontrado concuerda con lo reportado por Cardona-Corzo, et al., 2011, y con lo previsto por Romero-Ruiz, et al., 2009 acerca de los cultivos de pastos exóticos introducidos, los cultivos transitorios y los permanentes. La reducción de la riqueza, la diversidad y la complejidad estructural del ensamble de anfibios y reptiles del río Pauto fue evidente en estas coberturas. Durante la época húmeda, más del 40 % (13 taxones) de las especies de anfibios perdieron su hábitat por el establecimiento de cultivos de pastos exóticos introducidos (Urochloa humidicola y Urochloa decumbens) y el 72,3 % (18 taxones), por el establecimiento de cultivos de arroz (Figura 7). Aún más drástica fue la pérdida de 100 % de la biodiversidad de anfibios y reptiles durante la sequía, la cual se debió al arado de los suelos para la preparación de los cultivos de arroz, que los convierte en verdaderos desiertos, sin cobertura vegetal, y desnudos ante la erosión del viento, la insolación y las altas temperaturas. De igual forma, en esta época del año, los cultivos de pastos introducidos ofrecen un hábitat muy pobre, por lo que solo el 12,5 % (2 taxones) de las especies logró utilizar esta cobertura, manteniendo muy bajas abundancias. En aquellos pastizales que durante este periodo se encontraban en siembra, la pérdida de la biodiversidad fue de 100 %.
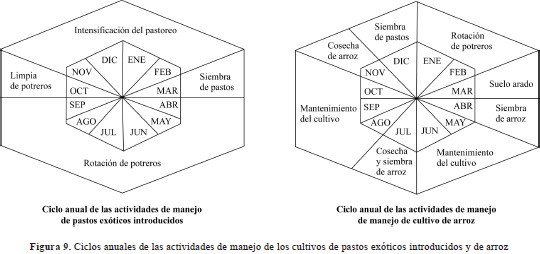
La causa principal del deterioro del ensamble de anfibios y reptiles se debe a la periodicidad, gravedad y persistencia de la transformación de los bosques y sabanas durante los ciclos anuales de siembra de pastos y arroz. La mayor pérdida de hábitat debida a estos cultivos se presenta entre los meses de marzo y abril, en los cuales se realizan las actividades de arado y preparación del suelo para la siembra. Durante este proceso se tala, poda y extrae toda la cobertura natural, dejando el desnudo el suelo y destruyendo los microhábitats de los anfibios (E. ovalis, L. macrosternum, P. hyponcondrialis, P. paradoxa, T. typhonius, entre otros) y reptiles (B. atrox, L. linneatus, L. melanotus, O. petolarious, P. neuwiedii, G. speciosus, T. teguixin, entre otros) que se refugian bajo el suelo en espera de la época húmeda que da inicio en mayo (Figura 9). En los cultivos de pastos exóticos introducidos se presenta una segunda âlimpieza" de potreros durante el mes de octubre, la cual consiste en tumbar el matorral que ha crecido desde la primera limpia al final de la época seca (Cardona-Corzo, et al., 2011). En este proceso se destruye parte del hábitat de las especies de anfibios (H. crepitans, H. pugnax, S. blairi, S. ruber, S. rostratus, S. wandae, S. x-signatus) y de reptiles (C. hortulanus, Leptophis ahaetulla, Oxybelis aeneus, T. dixoni) de hábitos arborícolas.
Al parecer, el cultivo de pastos exóticos introducidos no tiene mucha aceptación entre los ganaderos debido a sus altos costos y el esfuerzo que requieren (Cardona-Corzo, et al., 2011). En consecuencia, en un futuro cercano, los cultivos de pastos exóticos introducidos no representarán una amenaza para el ensamble de anfibios y reptiles, por lo que se reducirá la presión negativa que causan en los ecosistemas de sabanas inundables del rio Pauto.
Por el contrario, el cultivo de arroz es una práctica agrícola que se encuentra en crecimiento en la región. Según FEDEARROZ (2011), el crecimiento en la Orinoquia es de 29 % gracias a las cepas modificadas resistentes a los suelos ácidos. Durante el trabajo de campo del presente estudio, se presenció el cambio de coberturas de sabana por cultivos de arroz en dos de las tres estaciones de muestro (finca Candalayes y finca El Mirador). El número de hectáreas transformadas fue de 50 a 100, respectivamente, y en conversaciones con los propietarios de estos terrenos, expresaron su intención de aumentar los cultivos al doble en la siguiente temporada. Comparativamente, los cultivos transitorios como el del arroz representan una mayor amenaza para el ensamble de anfibios y reptiles que los cultivos de pastos. La frecuencia de las perturbaciones y las modificaciones de las coberturas naturales, en especial en los bajos, es mucho más alta (Figura 9). Igualmente, la gravedad y agresividad de la transformación mecánica de los suelos de las sabanas producida por el arado y la construcción de diques o canales para drenar los bajos provocan una devastación total de las coberturas naturales y de la matriz del suelo. Esto promueve la colonización de especies invasoras que toleran mejor los cambios topográficos e hídricos y se ven favorecidas por las nuevas condiciones ambientales (L. fragilis, L. fuscus, P. fisheri, P. llanera, R. humboldti y R.marina) (Bunn & Arthington, 2002).
La colonización de L. fragilis, con abundancias cuarenta veces mayores que las demás especies colonizadoras de los cultivos de arroz, se debe en gran medida a su extraordinaria plasticidad adaptativa frente a ambientes fuertemente perturbados (Heyer, 1969; Heyer, et al., 2012), y a la gran oferta de sitios de canto y refugio provistos por las huellas dejadas por el labrado de las llantas de los tractores. Los hábitos de canto de L. fragilis son bastante específicos, los machos cantan únicamente desde oquedades o huecos en el suelo, por lo cual las huellas dejadas por el labrado de las llantas se convierten en el microhábitat ideal para desplegar su canto de cortejo, para la formación de los nidos y para el desarrollo de los renacuajos sin que corran el riego de desecación. En consecuencia, el efecto derivado de la transformación de los hábitats bajos y de banquetas por los cultivos de arroz provoca el desplazamiento generalizado de las especies de hábitos acuáticos en condiciones naturales como P. paradoxa, siendo sustituidas por especies como L. fragilis, L. fuscus, L. macrosternum, y P. llanera, de hábitos terrestres, lo que limita el éxito reproductivo, el reclutamiento y el mantenimiento de la variación espacio-temporal de las poblaciones de hábitos acuáticos en el ecosistema (Montoya, et al., 2011).
En conclusión, se logró realizar una aproximación al conocimiento del ensamble de anfibios y reptiles de las sabanas inundables de río Pauto, evaluando su riqueza, abundancia, composición y preferencia de hábitat. Sin embargo, se hizo evidente que se necesita un mayor esfuerzo de muestreo para detectar más especies de probable presencia en estos ecosistemas. En futuros estudios se recomienda hacer salidas de campo en las épocas de transición entre la época húmeda y la seca para así dilucidar del todo la dinámica de este ensamble durante el ciclo anual completo. La actividad agrícola que actualmente representa la mayor amenaza para los anfibios y reptiles son los cultivos transitorios como el de arroz, debido a la devastadora pérdida de hábitat que ocasionan, la periodicidad con la que transforman las coberturas naturales y su acelerada expansión en la región. Esta, sumada a la modificación mecánica de los regímenes hídricos, es la actividad humana más nociva y la que mayor tensión causa en los ecosistemas de las sabanas inundables de la cuenca media y baja del río Pauto.
Agradecimientos
Este estudio no hubiera sido posible sin la colaboración de los llaneros que habitan las sabanas inundables del río Pauto, en especial a Ramón Gómez, Juan Carlos Gómez (Chigüi), Ana Mora, Pedro Chaquea, Nilson Gualdrón, Renzo Amaya, Manuel Torres, Marixa Barragán, Esaú Gualdrón, Críspulo Bernabé (Venado), Evaristo Ansola, José Hugo Ramírez (Piraña), Polo Sandoval, Marina Cruz y Jhon Fredy Fuentes. Igualmente, agradezco a Felipe Andrés Aponte y Alejandro Montes por su apoyo en el trabajo de campo. También expreso mi gratitud a los curadores, investigadores, docentes y auxiliares de colecciones que facilitaron mi trabajo en la búsqueda de registros de anfibios y reptiles del Casanare, en especial a Lucas Barrientos y Andrew J. Crawford, de la Universidad de los Andes, John D. Lynch y Martha Calderón, del Instituto de Ciencias Naturales de la Universidad Nacional de Colombia, Julio Mario Hoyos, de la Pontificia Universidad Javeriana, Claudia Medina, del Instituto Alexander von Humboldt, Hno. José Edilson Espitia Barrera y José Joaquín Celetia Bernal, de la Universidad de la Salle. Agradezco a los amigos y colegas que me facilitaron fotos de algunas especies, así como parte de sus resultados parciales sobre la vegetación y estructura de las coberturas vegetales de las sabanas inundables, en especial a Luisa F. Montaño-Londoño, Diego M. Cabrera, Laura Giraldo, Vicente Preciado, Daniel Cubillos y Liz K. Ladino. Finalmente, doy gracias a Javier Méndez, quien con su revisión crítica del documento hizo que este fuera más sólido y completo.
Este estudio se desarrolló en el marco del convenio de colaboración DHS No. 5211409 celebrado entre Ecopetrol y la alianza Yoluka ONG - Fundacion Horizonte Verde para la ejecución del proyecto "Evaluación de la salud ecosistémica de las sabanas inundables de la cuenca media y baja el río Pauto, Casanare", proyecto ganador de la Convocatoria a la Biodiversidad 2011 de Ecopetrol con el apoyo del Ministerio de Medio Ambiente y Desarrollo Sostenible.
Conflicto de interés
El autor declara que no tiene conflicto de interés.
Bibliografía
Acosta-Galvis, A.R., Bejarano, J. 2011. Anfibios del Casanare. En: Usma, J.S., & F., Trujillo. (Editores). Biodiversidad del Casanare: ecosistemas estratégicos del Departamento. Gobernación de Casanare - WWF Colombia. Bogotá D.C.138-152pp. [ Links ]
Alfaro-Bejarano, J., Acosta-Galvis, A.R. 2011. Reptiles del Casanare. En: Usma, J.S. & Trujillo, F. (Editores). Biodiversidad del Casanare: ecosistemas estratégicos del Departamento. Gobernación de Casanare - WWF Colombia. Bogotá D.C., 53-168pp. [ Links ]
Angarita-Sierra T., Ospina-Sarria, J., Anganoy-Criollo, M., Pedroza-Banda, R., Lynch, J.D. 2013. Guía de campo de los anfibios y reptiles del departamento de Casanare (Colombia). Serie Biodiversidad para la Sociedad No. 2. Universidad Nacional de Colombia, Sede Orinoquia; YOLUKA ONG, Fundación de Investigación en Biodiversidad y Conservación. Bogotá-Arauca.173pp [ Links ]
Ayala, S. C. 1986. Saurios de Colombia: lista actualizada y distribución de ejemplares colombianos en los museos. Caldasia 15 (71-75): 555-597. [ Links ]
Angulo, A., Rueda-Almonacid, J.V., Rodríguez-Mahecha, J.V., La Marca, E. (Eds). 2006. Técnicas de inventario y monitoreo para los anfibios de la región tropical andina. Conservación Internacional. Serie Manuales de Campo N° 2. Panamericana Formas e Impresos S.A., Bogotá D.C. 230pp [ Links ]
Bunn, S. E., Arthington, A.H. 2002. Basic principles and ecology consequences of alterated flow regimens for acuatic biodiversity. Environmental Management. 30: 492-507 [ Links ]
Cáceres-Andrade S.P., Urbina-Cardona, J.N. (2009). Ensamble de anuros de sistemas productivos y bosque en el piedemonte llanero, departamento del Meta, Colombia. Caldasia 31 (1): 175-194. [ Links ]
Campbell, J. A. and W.W. Lamar. 2004. The venomous reptiles of the western hemisphere, 2 vols. Comstock (Cornell University Press), Ithaca, NY, 962 pp. [ Links ]
Cardona-Cardozo, A., Pinzón-Pérez, L., Castellanos-Castro, C., Mora-Fernández, C., Vargas-Ríos, O. 2011. Amenazas para la conservación de las comunidades vegetales de la cuenca del baja Río Pauto. En Sicard, T.L. (Editor) Mamíferos, reptiles y ecosistemas del bloque Cubiro (Casanare): educación ambiental para la conservación. Instituto de Estudios Ambientales, Universidad Nacional de Colombia, Alange Energy Corp. Bogotá, 191-226pp. [ Links ]
Caro C., Trujillo. F., Suárez, C. 2006. Evaluación y oferta regional de humedales de la Orinoquía: contribución a un sistema de clasificación de ambientes acuáticos. Ministerio de Ambiente, Vivienda y Desarrollo Territorial - MAVDT.150pp. [ Links ]
Caicedo-Portilla, R., & C.J Dulcey-Cala. 2011. Distribución del gecko introducido Hemidactylus frenatus (Dumeril y Bribon 1836) (Squamata: Gekkonidae). En Colombia, Biota Colombiana, 12, 2: 45-56pp. [ Links ]
Cortés-C., Rangel-Ch, J.O. 2011. Los bosques de mangle en un gradiente de salinidad en la bahía de Cispatá - Boca Tinajones, departamento de Córdoba - Colombia. Caldasia 33(1): 155-176. [ Links ]
Cortés J., Sánchez-Palomino, P. 2011. Diversidad de reptiles del bloque Cubiro. En Sicard, T.L.(Editor), Mamíferos, reptiles y ecosistemas del bloque Cubiro (Casanare): educación ambiental para la conservación(Editor). Instituto de Estudios Ambientales, Universidad Nacional de Colombia, Alange Energy Corp. Bogotá, 247-273pp. [ Links ]
Dixon, J.R, Staton, JM. 1976. Some aspects of the biology of Leptodactylus macrosternum Miranda-Ribeiro (Anura: Leptodactylidae) of the Venezuelan Llanos. Herpetologica. 36; 2: 227-232. [ Links ]
Duellman, W.E. 2005. Cusco Amazónico/ the Lives of Amphibians and Reptiles in an Amazonian Rainforest. Comstock Publishing Associates, Ithica, New York. Xv + 433 pp. [ Links ]
Duellman, W.E., Trueb, L. 1994. Biology of Amphibians. Baltimore: The Johns Hopkins University Press. 670 pp. [ Links ]
Fedearroz. 2011. Boletín informativo de la federación nacional de arroceros. Fondo Nacional del arroz. Bogotá D.C. (251): 1-8 pp. [ Links ]
Frost D. R, Grant, T., Faivovich, J. Bain, R. H., Haas, A., Haddad, C., De Sa' R., Channing, A., Wilkinson, M. Donnellan, S. C., Raxworthy, C. J., Campbell, J. A., Blotto, B. L., Moler, P., Drewes, R. C., Nussbaum, R. A., Lynch, J. D. Green, D. M., Wheeler D. 2006. The Amphibian Tree of Life. Bulletin of the American Museum of Natural History. (297): 370 pp. [ Links ]
Hammer, Ã. Harper, D.A. T., Ryan, P.D. 2004. Past: Paleontological statistics software package for education and data analysis. Palaeontologia Electronica 4, art.4. [ Links ]
Harvey M. B., Ugueto, G.N., Gutberlet, R. L. Jr. 2012. Review of Teiid Morphology with a Revised Taxonomy and Phylogeny of the Teiidae (Lepidosauria: Squamata) Zootaxa (3459): 1-156. [ Links ]
Hayer, R. W. 1969. The adaptative ecology of the species groups the genus Leptodactylus (Amphibians, Leptodactylidae). Evolution (23): 421-428. [ Links ]
Heyer, W. R., Heyer, M. M. 2012. Systematics, distribution, and bibliography of the frog Leptodactylus validus Garman, 1888 (Amphibia: Leptodactylidae). Proceedings of the Biological Society of Washington, 125 (3): 276-294. [ Links ]
Lerh, E. 2002. Amphibien und Reptilien in Peru - Natur und Tier Verlag, Münster. 206 pp. [ Links ]
Lynch, J.D., Suárez-Mayorga, A. 2011. Clave ilustrada de los renacuajos en las tierras bajas al oriente de los Andes, con énfasis en Hylidae. Caldasia 33 (1): 235-270. [ Links ]
Lynch, J.D. 2006a. The tadpoles of frogs and toads found in the lowlands of Northern Colombia. Rev. Acad. Colomb. Cienc. 30 (116): 443-457. [ Links ]
McDiarmid, R.W., Altig, R. 1999. Tadpoles. The biology of anuran larvae. University of Chicago Press. 444 pp. [ Links ]
Montoya, J. V., Castillo, M. M., Sánchez, L. 2011. La importancia de las inundaciones periódicas para el funcionamiento y conservación de los ecosistemas inundables de grandes ríos tropicales: estudios en la cuenca del Orinoco. Interciencia. 36 (12): 899-907 [ Links ]
Mora-Fernández C., Peñuela-Recio L. (Eds) 2013. Salud ecosistémica de las sabanas inundables asociadas a la cuenca del río Pauto, Casanare, Colombia. Yoluka ONG, Fundación de Investigación en Biodiversidad y Conservación, Fundación Horizonte Verde y Ecopetrol S.A. 150 pp. [ Links ]
Mora-Fernández, C., Castellanos, C., Cardona, A., Pinzón, Vargas-Ríos, O. 2011. Introducción. 15-56 pp. En Sicarad T. L. (Editor) Mamíferos, reptiles y ecosistemas del bloque Cubiro (Casanare): educación ambiental para la conservación. Instituto de Estudios Ambientales, Universidad Nacional de Colombia, Alange Energy Corp. Bogotá. 432 pp. [ Links ]
Neiff, J. J. 1981. Panorama ecológico de los cuerpos de agua del nordeste argentino. Symposia, VI Jornadas Argentinas de Zoología: 115 - 151. [ Links ]
Rangel-Ch., J.O. 1997. (Ed.) Colombia Diversidad Biótica II. Tipos de vegetación en Colombia. Instituto de Ciencias Naturales - Universidad Nacional de Colombia. 436 pp. [ Links ]
Rangel-Ch., J.O. 2004. (Ed.) Colombia Diversidad Biótica IV. El Chocó biogeográfico/Costa Pacífica. Instituto de Ciencias Naturales - Conservación Internacional. 997 pp. [ Links ]
Rangel-Ch., J.O. 2012. (Ed.). Colombia Diversidad Biótica XII. La región Caribe de Colombia. Universidad Nacional de Colombia-Instituto de Ciencias Naturales. 1018 pp. [ Links ]
Palacios-P., Rodríguez-Z., Rangel-Ch, J.O. 2012. Cambios en el clima y en la vegetación en ambientes estuarinos de la bahía de Cispatá (Córdoba - Caribe colombiano). En: J.O. Rangel-Ch. (ed.). Colombia Diversidad Biótica XII. La región Caribe de Colombia: 145-164. Universidad Nacional de Colombia - Instituto de Ciencias Naturales. 1018 pp. [ Links ]
Pedroza-Bandan R., Angarita-Sierra, T. 2011. Herpetofauna de los humedales La Bolsa y Charco de Oro, Andalucía, Valle del Cauca. REV. ACAD. COLOMB. CIENC.: XXXV (35): 243-260. [ Links ]
Peñuela L., Castro, F., Ocampo-Peñuela, N. 2011. Las reservas naturales del nodo Orinoquía en su rol de conservación de la biodiversidad. Fundación Horizonte Verde y RESNATUR. Colombia. 104 pp. [ Links ]
Rueda-Almonacid, J. V., Mittermeier, C.L., Rodríguez- Mahecha, A., Mast, J. V., Vogt, R. B., Rhodin, R. C., de la Ossa-Velásquez, G. J., Rueda, J. N., Mittermeier, C.G. 2007. Las tortugas y los cocodrilianos de los países andinos del trópico. Serie de guías tropicales de campo No. 6. Conservación Internacional. Editorial Panamaricana, Formas e Impresos. Bogotá, Colombia, 538 pp. [ Links ]
Sarmiento, G. 1984. Ecology of Neotropical Savannas. Harvard University Press. Boston. USA. Xii + 235 p. [ Links ]
Tárano, Z. 2010. Advertisement calls calling habits of frogs from a flooded savanna of Venezuela. South American Journal of Herpetolgy. 5 (3): 221-240 [ Links ]
Wells, K. D. 2007. The Ecology and Behavior of Amphibians. The University of Chicago Press. Chicago-London. 729-783 pp. [ Links ]
Wiederhecker, H., Pinto, C., Adriana, C., Paiva, S., Marcela, S., Colli, E., Guarino, R. 2003. The demography of the lizard Tropidurus torquatus (Squamata, Tropiduridae) in a highly seasonal neotropical savanna. Phyllomedusa. 2 (1): 09-19. [ Links ]
Wüster, W., Yrasuquin J. L., Mijares-Urrutia, ?. 2001. A new species of Indigo Snake from North-Western Venezuela. (Serpentes: Colubridae: Drymarchon) Herpetological Journal. (11): 157-165. [ Links ]
Zug, G. R., Vitt, L. J., Caldwell, J. P. 2001. Herpetology: An Introductory Biology of Amphibians and Reptiles. Academic Press, New York xiv + 630 pp. [ Links ]













