Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales
Print version ISSN 0370-3908
Rev. acad. colomb. cienc. exact. fis. nat. vol.38 no.146 Bogotá Jan./Mar. 2014
Ciencias químicas
Grupo de Química de Recursos Energéticos y Medio Ambiente, Instituto de Química, Facultad de Ciencias Exactas y Naturales, Universidad de Antioquia, Medellín, Colombia
*Correspondencia: Andrés Moreno, amoreno.udea@gmail.com
Recibido: 17 de febrero de 2014. Aceptado: 28 de abril de 2014
Resumen
En este trabajo se evaluó el efecto del método de preparación (auto-combustión Vs. impregnación) del rutenio como promotor (0,3 % Ru) de catalizadores a base de cobalto (10 % Co) soportado sobre óxidos mixtos de MgO-Al2O3 en la síntesis de Fischer-Tropsch (SFT). Los catalizadores soportados sobre MgO y Al2O3 se utilizaron como materiales de referencia. En todos los casos, la actividad catalítica se evaluó en la SFTen un reactor de lecho fijo a 260 °C y presión atmosférica. De acuerdo a los resultados independientes del método de preparación empleado, los catalizadores soportados sobre óxidos mixtos favorecieron más los hidrocarburos más pesados (fracción C5+) que los materiales de referencia. En cuanto a los sistemas promovidos con Ru, se observó un incremento en la conversión de CO para los catalizadores preparados por autocombustión y una propensión hacia la formación de fracciones en el rango de la gasolina (C5 - C11) y del diésel (C12 - C21). En general, los resultados obtenidos indican que los sistemas catalíticos del tipo Ru-CoO/ Al2O3-MgO son promisorios para la síntesis F-T.
Palabras clave: síntesis F-T, óxidos mixtos, hidrotalcita.
Abstract
In this work we evaluated the effect of the preparation method (auto-combustion vs impregnation), and of ruthenium as promoter (0.3 wt% Ru) for cobalt-based catalysts (10 wt% Co) supported on MgO-Al2 O3 mixed oxides on the Fischer-Tropsch synthesis (FTS). Cobalt supported on MgO and Al2 O3 were used as reference catalysts for the mixed oxides. The activity of the catalysts for the FTS was evaluated in a fixed-bed reactor at 260°C and atmospheric pressure. According to the results and independently from the preparation method,cobalt supported on MgO-Al2 O3 mixed oxides were more selective to heavy hydrocarbons (C5+) than catalysts supported on single (MgO or Al2 O3) oxides. Furthermore, all Ru-promoted catalysts were more active (i.e., had higher conversion) than non-promoted catalysts, and the selectivity to hydrocarbon fractions in the range of gasoline (C11 - C12) and diesel (C21 - C23) increased. In general, the results suggest that Ru-promoted Co/MgO-Al2 O3 catalyst is a promising catalytic system for the FTS.
Key words: Fischer-Tropsch synthesis, mixed oxides, hydrotalcites.
Introducción
La disminución de las reservas de petróleo alrededor del mundo en los últimos años, la variabilidad en su precio y su impacto ambiental ha suscitado la búsqueda de métodos alternativos para la obtención de combustibles líquidos más limpios y a precios competitivos. La síntesis de hidrocarburos a partir de gas de síntesis (H2 - CO), conocida como la síntesis Fischer - Tropsch (F-T), es una etapa clave para la obtención de combustibles líquidos producidos de fuentes diferentes del petróleo, tales como el carbón, la biomasa y el gas natural (Khodakov, Chu, et al., 2007).
En la síntesis Fischer-Tropsch se usan comúnmente catalizadores a base de hierro (Fe), cobalto (Co) y rutenio (Ru). El rutenio es el metal más activo y presenta una gran selectividad hacia hidrocarburos de cadena larga (C5+) a bajas temperaturas, sin embargo, debido a su alto costo, comparado con el de los otros metales, en ocasiones se utiliza como promotor. Los metales empleados como catalizadores a nivel industrial son el hierro y el cobalto, siendo los catalizadores a base de cobalto los más utilizados debido a su mayor actividad y selectividad de hidrocarburos de cadena más larga y su mayor resistencia a la desactivación con el tiempo(Van Der Laan & Beenackers, 1999).
Generalmente, los catalizadores de cobalto se emplean soportados sobre óxidos, específicamente sobre SiO2, Al2O3 y TiO2. La selección del soporte es de gran relevancia porque desempeña diversas funciones, entre ellas, la de dispersar y estabilizar la fase activa para evitar la desactivación con el tiempo, lo cual está directamente relacionado con la pérdida de actividad y selectividad (Zhang, Kang, et al., 2010).
El MgO ha sido poco empleado como soporte para catalizadores de cobalto, ya que en estudios previos se ha demostrado que estos sistemas son poco activos en la hidrogenación del cobalto (Reuel & Bartholomew, 1984; Bartholomew & Reuel, 1985; Putanov, Boskovic, et al., 1992). La baja actividad de los catalizadores a base de cobalto se ha asociado al hecho de que el cobalto es poco reducible en estos sistemas debido a una fuerte interacción metal-soporte.
A pesar de la baja actividad observada en catalizadores de cobalto soportados sobre MgO, se ha reportado que la presencia de MgO en catalizadores de cobalto soportados sobre alúmina aumenta la estabilidad debido a la disminución de deposición de carbono en la superficie del catalizador, así como al grado de reducción del cobalto, favoreciendo la actividad catalítica hacia la hidrogenación de CO. Además, minimiza la formación de compuestos cobalto-soporte como aluminatos y silicatos de cobalto (Zhang, Xiong, et al., 2005; Tsai, Mo, et al. 2011). En este mismo sentido, algunos estudios recientes en catalizadores a base de cobalto depositado sobre soportes de óxidos mixtos MgO-Al2O3, obtenidos a partir de precursores tipo hidrotalcita (HT), indican que este tipo de soporte permite obtener catalizadores con alta actividad y selectividad hacia hidrocarburos C5+. Las mejoras en el comportamiento de los catalizadores soportados sobre óxidos mixtos MgO-Al2O3 con respecto a los soportados en alúmina, se ha atribuido a la mayor área superficial del soporte y la modificación de la capacidad de reducción del cobalto, lo cual permite obtener catalizadores con mayor dispersión de las partículas de cobalto metálico (Khassin, Yurieva, et al., 2001; Krylova, Kulikov, et al., 2008; Tsai, Mo, et al., 2011).
Con el propósito de mejorar la comprensión sobre la función del MgO en los catalizadores del tipo CoxOy/MgO-Al2O3, en este trabajo se compararon dos catalizadores con igual composición química y carga de cobalto (10% Co), obtenidos por el método de autocombustión y por impregnación de Co2+ sobre un precursor de tipo hidrotalcita. Para facilitar la interpretación de los resultados, también se prepararon catalizadores soportados sobre los óxidos independientes CoxOy/MgO y CoxOy/Al2O3. Todos los catalizadores se caracterizaron mediante diversas técnicas de análisis y su reactividad se evaluó en la reacción de Fischer-Tropsch.
Por otro lado, teniendo en cuenta los reportes previos en torno al impacto negativo del MgO sobre la capacidad de reducción en catalizadores a base de cobalto, y el hecho de que el rutenio facilita la reducción de los precursores de Co (óxidos de cobalto) a partículas de cobalto metálicas mediante el efecto spillover (Ma, Jacobs, et al., 2012), en este trabajo también se evaluó el efecto promotor del rutenio y su impacto sobre la capacidad de reducción de los catalizadores del tipo CoxOy/MgO-Al2O3 y su comportamiento catalítico en la reacción de Fischer-Tropsch.
Materiales y métodos
Preparación de los catalizadores
Los diferentes sistemas catalíticos a base de cobalto (10 % m/m Co) se sintetizaron por medio delos métodos de autocombustión e impregnación húmeda con un contenido nominal de 10% en masa de cobalto con respecto al soporte MgO-Al2O3.
Un catalizador del tipo Co O /MgO-Al O se preparó por impregnación húmeda de una solución acuosa de nitrato de cobalto (II) sobre una hidrotalcita comercial (PURAL® MG 70) según la metodología descrita por Tsai, et al. (Tsai, Mo, et al., 2011). La mezcla se dejó en agitación hasta la evaporación del solvente a temperatura ambiente, seguida por secado a 90 °C durante 24 horas. El precursor obtenido se calcinó en aire estático a 500°C durante 10 horas (5 °C/min).
Un catalizador del tipo CoxOy/MgO-Al2O3,con la misma composición del catalizador obtenido por impregnación de la hidrotalcita comercial, se sintetizó mediante el método de autocombustión (Gallego, Mondragón, et al., 2006). A una solución acuosa que contenía las sales de nitrato de los diferentes metales en la proporción deseada, se le añadió glicina (Merck, 99,7%) como agente de ignición en una relación NO3 -/NH2 = 1. Como precursores de los diferentes metales se emplearon nitrato de cobalto (II) (Co(NO3)2·6H2O, Panreac, 98%), nitrato de aluminio (III) (Al(NO3)3·9H2O, Merck, 99%)y nitrato de magnesio(II) (Mg(NO3)3·6H2O,Panreac,98%). Durante la evaporación de la solución se obtuvo un líquido viscoso, el cual sufrió un proceso de autocombustión por calentamiento moderado. Durante la reacción se generaron gradientes de temperatura de llama que fluctuaron entre 1.100 °C y 1.450 °C, lo que, conjuntamente con la atmósfera de aire, permitió que se oxidaran los compuestos orgánicos, liberándose N2 y CO2 y dando lugar a la formación del óxido mixto y de un residuo carbonoso. Por último, este residuo carbonoso se eliminó por calcinación en aire estático a 500 °C durante 10 horas (5 °C/min). Este mismo procedimiento se empleó para preparar los catalizadores de referencia soportados sobre óxido de magnesio (CoxOy/MgO) y sobre óxido de aluminio (CoxOy/Al2 O3).Preparación de catalizadores promovidos con rutenio
Los catalizadores calcinados se promovieron con rutenio, empleando como precursor cloruro de rutenio (III) (Profeti, Ticianelli, et al. 2009; Cook, Poudyal, et al., 2012). El Ru3+ se añadió mediante el método de impregnación húmeda. Para tal fin, se preparó una solución de cloruro de rutenio (III) en una mezcla de agua y acetona (1:1) y se usaron 2 ml de la solución por gramo de catalizador previamente calcinado. Todos los sólidos se impregnaron con un contenido nominal de 0,3% en peso de rutenio. Después de la evaporación del solvente y de secarlo a 90 °C durante 24 horas, los sólidos se calcinaron en una mufla en aire estático a 300 °C durante 10 horas (5 °C/min).
Caracterización de los catalizadores
La morfología de los catalizadores sintetizados antes de la reacción se evaluó en un microscopio electrónico de barrido JEOL JSM 6490. Se empleó un voltaje de aceleración de 20 kV y las micrografías se tomaron en el modo de electrones secundarios. Se realizó también un análisis composicional por espectrometría de energía dispersiva (Energy Dispersive Spectrometry, EDS) mediante un mapeo elemental a partir del análisis en cinco zonas diferentes para cada muestra. El área superficial de las muestras calcinadas se determinó siguiendo el modelo BET. Las medidas se tomaron en un equipo Micromeritics ASAP 2020 a -196 °C empleando nitrógeno molecular como adsorbato. Antes del análisis de fisisorción, las muestras se sometieron a un proceso de desgasificación durante 24 horas a 350 °C.
Las propiedades estructurales de los catalizadores se determinaron por análisis de difracción de rayos X en undifractómetro (PANalyticalX'Pert PRO MRD) equipado con ánodo de cobre (Cu Ka1 = 1.5406 Å) y operado a 45kV y 40mA. La recolección de datos se hizo en un ángulo 2q entre 5 y 90°, con un paso de 0,024° y un tiempo de paso de 185 segundos.
La información sobre el estado de coordinación del cobalto en los catalizadores calcinados se obtuvo mediante espectroscopia ultravioleta visible (UV-VIS) empleando un espectrofotómetro marca Thermo Scientific (modelo Evolution™ 600 UV/VIS) con un accesorio de reflectancia difusa DRA-EV-600 y lámparas de tungsteno (325-900 nm) y deuterio (220-325 nm). El rango de medición de las muestras se situó entre 200 y 600 nm con un ancho de banda de 4 nm y velocidad de barrido de 240 nm/min.
La identificación del tipo de especies de óxidos de cobalto presente en los catalizadores calcinados se realizó por espectroscopia Raman empleando un espectrómetro Raman con foco marca Horiba Jobin-Y von (modelo Lab RAM HR) de alta resolución, y luz láser a 784,5 nm como fuente de excitación. Los espectros de las muestras se obtuvieron en el rango de 100 a 1.000 cm-1 y un tiempo de exposición de 60 segundos. Para este análisis los sólidos se maceraron y se analizaron en forma de pastillas de 1 cm de diámetro.
La capacidad de reducción de todos los catalizadores, con promotor de rutenio y sin él, se evaluó mediante la reducción a la temperatura programada (Temperature- programmed Reaction, TPR) en un equipo Autochem II 2920 (Micromeritics) equipado con un detector de conductividad térmica. Los análisis se realizaron sobre 100 mg de sólido (106-250 mm) utilizando una atmósfera reductora (10%H - 90%Ar)con un flujo de 100 ml/min desde 50 hasta 1.000 °C a una velocidad de calentamiento de 10°C/min.Actividad catalítica
La evaluación de la actividad catalítica para los sólidos promovidos y sin promover se realizó en un reactor tubular de lecho fijo y flujo descendente (diámetro interno de 13 mm),como se observa en la figura 1.
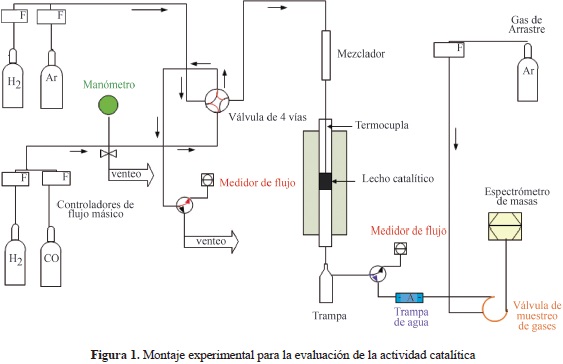
Se emplearon 0,5 g de catalizador (300 - 500 mm) diluido con 1,0 g de carburo de silicio (SiC) para evitar los puntos calientes. Los catalizadores se redujeron inicialmente en hidrógeno puro a 600 °C durante 15 horas con un flujo de hidrógeno de 30 ml/min y a presión atmosférica. La reacción de Fischer-Tropsch se llevó a cabo bajo las siguientes condiciones: H2/CO = 2, empleando un flujo total de gas de síntesis de 30 ml/min, una temperatura de reacción de 260°C (±3°C), bajo presión atmosférica y por un período de 24 horas. Aunque es bien conocido que las altas presiones favorecen la síntesis Fischer-Tropsch, para facilitar el procedimiento experimental, la reacción se llevó a cabo bajo presión atmosférica con el único propósito de evaluar el efecto del método de preparación de los catalizadores sobre su reactividad frente a la reacción de Fischer-Tropsch. Los resultados reportados en la literatura indican que las tendencias de la actividad en catalizadores a base de cobalto no se ven afectadas por la presión total de la reacción, aunque pueden presentarse diferencias en términos de las concentraciones de reactivos en las fases gaseosa y líquida (Girardon, Lermontov, et al., 2005; Khodakov, Chu, et al., 2007). Los gases de reacción H , CO y los hidrocarburos en fase gaseosa (C1-C6) se analizaron en línea mediante un espectrómetro de masas tipo cuadrupolo (QMS 200 Pfeiffer, OmniStar GSD 301 C) con detectores Faraday y SEM (Secondary Electron Multiplier).
Los productos condensados se analizaron en un cromatógrafo de gases equipado con un detector de masas (Shimadzu GCMS- QP2010 ultra). Se identificaron empleando una columna SHRXI - 5MS (Shidmadzu) con un diámetro interno de 0,25 mm, longitud de 30 m y espesor de la fase estacionaria de 0,25 mm. La identificación y calibración de los productos gaseosos se logró empleando mezclas estándar de gases: alcanos (C1-C6 ), alquenos (C2 -C6 ), CO2, (Scott Specialty Gases).
Resultados y discusión
Caracterización de los catalizadores
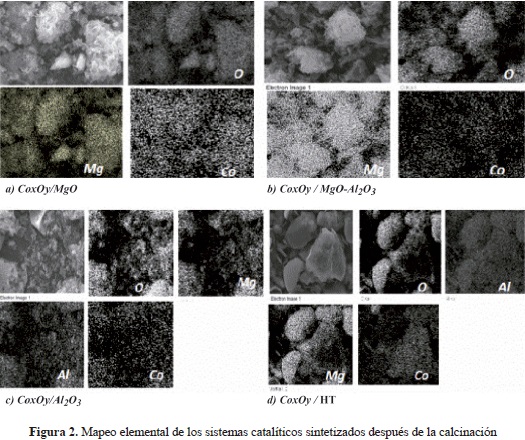
Los sólidos calcinados sin promover se caracterizaron mediante análisis composicional por EDS con microscopía electrónica de barrido (Scanning Electron Microscopy, SEM). Aunque esta no es una técnica de superficie debido a que la profundidad del análisis puede alcanzar hasta 2 mm, permite obtener valores promedios de composición en regiones próximas a la superficie. Esta técnica ha sido empleada por varios autores para el estudio composicional de catalizadores de cobalto (Jongsomjit, Wongsalee, et al., 2005; Shen, Li, et al., 2009; Tsai, Mo, et al., 2011). En la tabla 1 se observan las diferentes relaciones molares de Co/Mg, Co/Al y Al/Mg. Las relaciones obtenidas experimentalmente concordaron con los valores calculados por este quiometría en lo referente a la cantidad de cobalto nominal adicionada (10 % Co). El resultado anterior indica que el método de autocombustión fue el adecuado para la preparación del óxido mixto MgO- Al2O3. El mapeo elemental en la superficie de los sólidos sintetizados después de la calcinación mostró que el cobalto se encontraba ampliamente distribuido en todos los sólidos, lo cual era de esperarse debido al método de síntesis empleado, como se observa en la figura 2.
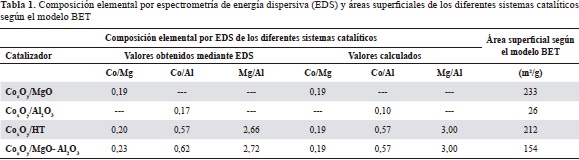
a) CoxOy/MgO, b) CoxOy/MgO- Al2O3, c) CoxOy /Al2 O3 y d) CoxOy/HT
Los resultados de la microscopía electrónica de barrido (SEM) de los diferentes sólidos mostraron que los materiales no tenían una morfología definida, excepto en el caso del catalizador CoxOy/HT, el cual presentó la típica morfología esférica de esta hidrotalcita comercial. Una morfología de tipo esponja se observó en los sólidos preparados por el método de autocombustión; este tipo de morfología es común en sólidos preparados con esta metodología, pues con ella la evolución de los gases formados durante la combustión en el proceso de autoignición genera una porosidad aparente en los sólidos (Figura 3).

a) CoxOy/MgO, b) CoxOy/MgO- Al2O3, c) CoxOy /Al2 O3 y d) CoxOy/HT
En general, la caracterización por medio de la difracción de rayos X (x-ray diffraction, XRD) mostró picos anchos y de menor intensidad para todos los sistemas catalíticos comparada con la obtenida en el difractograma de un MgO, la cual logró un alto grado de cristalinidad y se obtuvo con el mismo método de síntesis pero con calcinación a 800 °C. Esto podría sugerir que los materiales sintetizados son en gran medida amorfos (Figura 4). También se observaron algunos picos pequeños a 36° y 59 °C para los sistemas CoxOy/MgO y CoxOy/MgO-Al2 O3, que pueden eventualmente asignarse a Co3O4 (Zhang, Wei, et al.,1999; Tavasoli, Malek Abbaslou, et al., 2008; Tsai, Mo, et al. 2011).
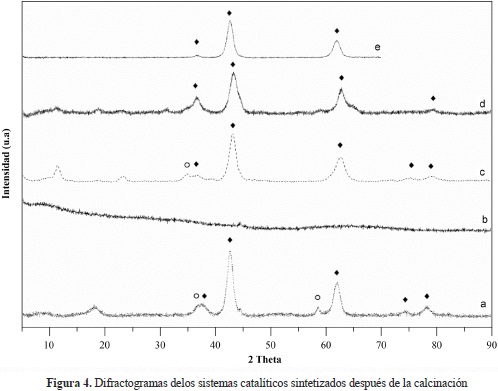
a) CoxOy/MgO, b) CoxOy/Al2O3, c) CoxOy/MgO- Al2O3, d) CoxOy/HT, e) MgO, (u) MgO, (o) CoxOy
El área superficial BET para las muestras calcinadas se presenta en la tabla 1. Se puede ver que en el sólido CoxOy/MgO-Al2O3 sintetizado por autocombustión este método de preparación causa un detrimento en el área superficial comparado con el material sintetizado por impregnación sobre la hidrotalcita comercial. Esta disminución en el área superficial podría estar asociada con la incorporación de los cationes de cobalto a la estructura del óxido de aluminio provocando la formación progresiva de espinela estable (Bellotto, Rebours, et al., 1996; Kanezaki, 2004). Probablemente, un efecto similar ocurrió en el caso del sólido CoxOy/Al2O3, pues el método de autocombustión favorece la migración de iones de cobalto en sitios tetraédricos del Al2O3, formando aluminatos de cobalto, los cuales pudieron identificarse por UV-vis (van de Water, Bezemer, et al., 2006; Backman, Rautiainen, et al., 2009), y generando poca área superficial. En el sólido CoxOy/MgO se observó un área superficial mayor comparada con los valores reportados en la literatura para materiales con la misma composición nominal de cobalto, pero obtenidos por otros métodos de preparación: 90 m2/g por impregnación (Tsai, Mo, et al., 2011) y 179 m2/g por coprecipitación (Shen, Li, et al., 2009), lo que muestra que, en este caso, el método de autocombustión para los óxidos mixtos MgO - CoOx favoreció una dispersión adecuada de la fase activa en el soporte.
Los patrones de difracción muestran que los sistemas catalíticos CoxOy/MgO, CoxOy/MgO-Al2O3, y CoxOy/HT presentaron características típicas del MgO (estructura de la periclasa) o de soluciones sólidas (Co, Mg)O con picos a 37°, 42° y 61°C (Shen, Li, et al., 2009). No fue posible observar señales significativas correspondientes a las fases de los óxidos de cobalto. Los resultados de algunos estudios sugieren que las fases que contienen cobalto están dispersas en el soporte y que las partículas tienen un tamaño muy pequeño (Tsai, Mo, et al., 2011), lo que concuerda con la distribución homogénea que se observó en los resultados del mapeo elemental mediante SEM. En cuanto al catalizador CoxOy/Al2O3, no fue posible observar señales asociadas a la alúmina ni a las fases de los óxidos de cobalto o de los óxidos binarios de aluminio y cobalto.
En la figura 5 se presentan los espectros Raman para los cuatro sistemas catalíticos superpuestos al espectro Raman de la espinela Co3O4 no soportada. Mediante espectroscopia Raman se evidenció la formación de una fase correspondiente a la espinela de cobalto (Co3O4) en el sólido CoxOy/HT, cuyo espectro exhibió cinco señales intensas a 194, 477, 513, 615 y 684 cm-1, correspondientes a los modos activos en Raman (A1g, Eg, 3F2g) (Jongsomjit, Panpranot, et al., 2001) de este óxido de cobalto. Esto podría sugerir una interacción moderada entre el óxido de cobalto y el soporte, ya que no se observó la formación de fases mixtas soportadas encobalto de mezclas de óxido, como en el caso de la espinela aluminio-cobalto CoAl O (Khodakov, Chu, et al., 2007), ni de óxidos mixtos del tipo CoxMg1-x O (Richards, Mulukutla, et al., 2001). Además, se observaron fases mixtas soportadas en cobalto para los catalizadores CoxOy/MgO y CoxOy/MgO-Al2O3. Estos resultados sugieren que en estos últimos sistemas hay presencia de sitios de naturaleza diferente. Con base en estos resultados, se propone el planteamiento de que en algunos sitios de la superficie habría una interacción fuerte entre el óxido de cobalto y el soporte, específicamente en sitios superficiales donde se hayan formado óxidos mixtos de cobalto y magnesio, mientras que en otros sitios superficiales se presentaría una interacción menor, permitiendo que el cobalto esté presente como Co3O4 y no forme algún tipo de óxido mixto. La formación de este tipo de especies probablemente se vio favorecida por el método de síntesis empleado para obtener el precursor catalítico, ya que durante el proceso de autocombustión se alcanzaron altas temperaturas en la llama (1.100 - 1.450 °C).
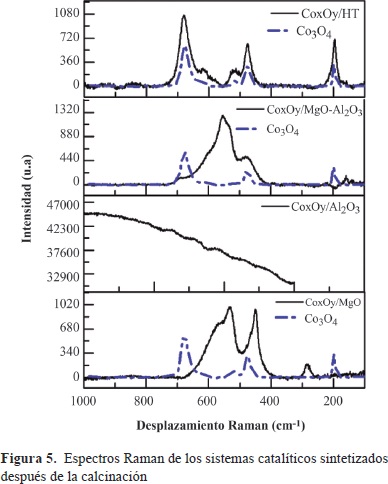
En el caso del catalizador CoxOy/Al2O3 no se observó ninguna señal correspondiente a la espinela de cobalto (Co3O4) ni al aluminato de cobalto (CoAl2O4). En la literatura se han reportado las siguientes señales para sistemas Co/Al2O3 preparados por impregnación incipiente y que presentan las fases ya mencionadas: 198, 480, 519, 619 y 690 cm-1 y dos bandas débiles a 412 y 753cm-1 (Jongsomjit & Goodwin Jr., 2002).
Para complementar la información obtenida por espectroscopia Raman sobre las fases de cobalto presentes en los sistemas catalíticos después de la calcinación, los catalizadores calcinados se caracterizaron por espectroscopia UV-vis. En la tabla 2 se observan las asignaciones espectrales para los diferentes sistemas catalíticos.
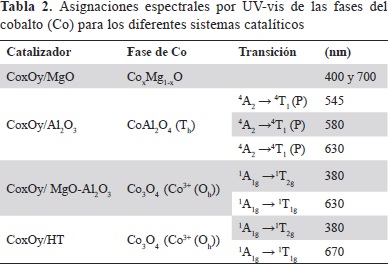
En el caso de los precursores catalíticos preparados sobre óxidos mixtos de tipo MgO-Al2O3 (CoxOy /MgO-Al2O3 y CoxOy/HT), se observaron señales características de la espinela de cobalto Co3O4 a 380 y 700 nm, lo que concuerda reportado previamente en óxidos mixtos de tipo CoxMg1-xO y corresponden a cobalto con coordinación octaédrica Co (III) (Das & Deo, 2011; Das & Deo, 2012).
Un resultado importante fue la identificación de la formación de aluminato de cobalto en el sistema catalítico CoxOy/Al2O3, el cual no se evidenció por espectroscopia Raman. Para el sólido CoxOy/Al2O3 se observaron en el espectro Raman bandas a 545, 580 y 630 nm, las cuales están asociadas a una fase del cobalto tipo espinela CoAl2O4, en la que el cobalto posee una coordinación tetraédrica (van de Water, Bezemer, et al., 2006; Das & Deo, 2011).
Los perfiles de reducción a temperatura programada (H2-TPR) para los sólidos calcinados promovidos y sin promover se muestran en la figura 6. En los perfiles de los sólidos sin promover se observaron señales asociadas a fases difícilmente reducibles, con temperaturas de reducción superiores a los 600 °C; el catalizador CoxOy/MgO-Al2O3 mostró eventos de reducción a 744 y 868 °C. Estos resultados sugieren que se produjo una interacción marcada entre el CoxOy y el soporte en los catalizadores, debida, probablemente, al método de síntesis empleado y a la temperatura a la cual se realizó el tratamiento térmico de calcinación (Querini, Ulla, et al., 1998; Jongsomjit, Panpranot, et al., 2001; Khassin, Yurieva, et al., 2001; Wang & Ruckenstein, 2001). De forma coherente con esta explicación, el perfil de TPR para el catalizador obtenido por impregnación de la hidrotalcita presentó eventos de reducción a temperaturas más bajas: 352 y 898 °C, lo que sugiere que, en este caso, la interacción entre las especies oxidadas del cobalto y el soporte MgO-Al2O3 fueron moderadas y de menor intensidad que en el caso del catalizador obtenido por autocombustión (Tsai, Mo, et al., 2011).
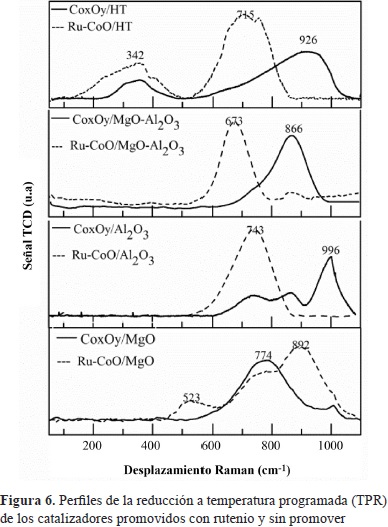
En los perfiles de TPR para las muestras promovidas con rutenio se observó, en general, un desplazamiento de los eventos de reducción hacia una temperatura más baja, lo cual indica que la presencia del rutenio, el cual cambia las propiedades estructurales de los materiales, modificó la estabilidad de las interacciones. Estos resultados son similares a los reportados por Khodakov, et al., (Khodakov, Chu, et al., 2007) para los catalizadores de Co/Al2O3; estos autores observaron que el rutenio inhibe la formación de óxidos de difícil reducción y de aluminatos de cobalto, disminuyendo las interacciones entre el cobalto y el soporte, lo que podría estar asociado a un efecto spillover del rutenio, y favoreciendo, de esta manera, la reducción de las partículas del óxido de cobalto cercanas (Khassin, Yurieva, et al. 2001; Diehl & Khodakov, 2009; Cook, Poudyal, et al., 2012).
Actividad catalítica en la síntesis Fischer-Tropsch
En la tabla 3 se presentan los resultados obtenidos de la evaluación de la actividad de los diferentes catalizadores después de 24 horas de reacción. Los valores reportados para las conversiones presentan una desviación estándar inferior a 5% y los reportados para las selectividades, inferior a 7%.
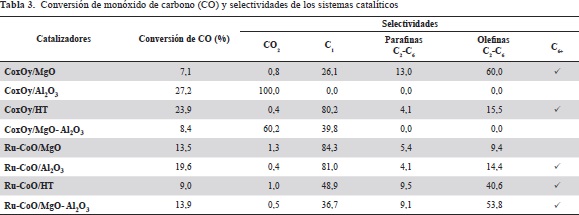
No se presentan los valores numéricos para los hidrocarburos C6+, ya que no se cuantificaron porque una parte de ellos se condensó en una trampa de agua ubicada a la entrada del sistema de análisis, lo que causó su pérdida masiva.
Los sistemas catalíticos sobre óxidos mixtos (MgO-Al2O3 y HT) mostraron diferencias significativas en la actividad y la selectividad dependiendo del método de preparación. Para el sólido obtenido por autocombustión se presentó baja conversión y alta selectividad hacia metano, lo que sugiere la existencia de sitios difícilmente reducibles y pocos sitios activos, como se evidenció en la TPR. El sistema catalítico obtenido por impregnación mostró una alta conversión y selectividad hacia hidrocarburos en el rango de las gasolinas (C5-C11) sin necesidad de emplear un promotor de la reducción, lo que probablemente se debió a que la interacción entre el cobalto y el soporte no fue tan fuerte como en el caso de los catalizadores sintetizados por autocombustión. La mayor actividad sobre el catalizador obtenido por impregnación concuerda con los resultados relativos a la capacidad de reducción obtenidos por TPR, dando cuenta de interacciones moderadas entre CoxOy y el soporte, al igual que los resultados obtenidos por espectroscopia Raman y UV-vis. Además, la mayor área superficial del catalizador obtenido por impregnación probablemente facilitó una mejor dispersión de la fase activa.
En cuanto a los materiales de referencia, se pudo observar que el catalizador a base de cobalto soportado sobre alúmina (CoxOy/Al2O3) presentó la mayor conversión; sin embargo, este catalizador presentó alta selectividadhacia la formación de CO2. Este resultado sugiere que hay pocos sitios activos (Co metálico) para la hidrogenación del monóxido de carbono, posiblemente debido a la baja capacidad de reducción de las especies de cobalto presentes en el catalizador (es decir, formación de aluminato de cobalto), las cuales no se reducen durante el proceso de reducción de los catalizadores previo a la introducción de la mezcla de reacción. Esta hipótesis es coherente con los resultados de XRD, UV-vis y TPR. Algunos autores han reportado que en los sistemas de cobalto soportados sobre alúmina se observa una tendencia al incremento de CO2 (y otros hidrocarburos) a medida que aumenta el porcentaje de conversión, (Ma, Jacobs, et al., 2011; Bukur, Pan, et al., 2012). El análisis elemental del catalizador CoxOy/Al2O3 después de la reacción no mostró un contenido significativo de carbono, lo cual permite descartar la formación de residuos carbonosos y CO2 a través de la reacción de Boudouard (CO → C + CO2). Se requiere un estudio más detallado de este sistema catalítico que permita explicar la elevada formación de CO2 observada. El sistema catalítico CoxOy/MgO presentó una baja conversión, lo que coincide con lo reportado en la literatura para este tipo de sistemas. Como posibles razones para esta baja actividad se han propuesto la supresión de adsorción de H2, la formación de fases mixtas inactivas del tipo CoxOy/MgO después del tratamiento a altas temperaturas (> 500 ° C) y la fuerte alcalinidad de MgO, la cual incrementa la densidad electrónica del cobalto soportado, creando una interacción fuerte entre el cobalto (Co) y el monóxido de carbono (CO), lo cual dificulta la posterior disociación del CO adsorbido sobre un sitio activo (Khodakov, Chu, et al., 2007; Chen, Tian, et al., 2012). En el presente trabajo, los resultados de TPR sugieren la existencia de interacciones fuertes entre el cobalto y el soporte, lo que supone la formación limitada de sitios activos a la temperatura de reducción adoptada.
Con respecto a los catalizadores promovidos con rutenio, los sistemas catalíticos sobre óxidos mixtos mostraron un incremento en la producción de hidrocarburos C1-C6, y en el caso del sistema Ru-CoO/MgO-Al2O3, también se observó la formación de hidrocarburos pesados hasta alcanzar el C27, los cuales no se formaron en ausencia del promotor. Por otro lado, se observó un incremento en la conversión de CO para el material obtenido por autocombustión, lo que podría estar relacionado con un cambio en las propiedades estructurales de los materiales, como el incremento en la dispersión de la fase metálica y el mejoramiento en la capacidad de reducción de los sólidos, debido a un efecto spillover del rutenio (Morales & Weckhuysen, 2006).
Para los materiales de referencia se observó un incremento en la conversión de CO para el material Ru-CoO/MgO relacionado con cambios estructurales del material como se mencionó anteriormente; sin embargo, en la selectividad se observó una preferencia hacia la producción de metano, probablemente debida a la formación de aleaciones bime- tálicas de rutenio y cobalto, las cuales no permiten una densidad alta de sitios de cobalto ni una buena dispersión (Morales & Weckhuysen, 2006). Además, el sistema catalítico Ru-CoO/Al2O3 presentó una disminución en la conversión y un incremento en la producción de hidrocarburos C1-C6 debidos al aumento de sitios activos, lo que se evidenció en la disminución de la temperatura de los eventos de reducción, fenómeno que también podría responder a la formación de aleaciones bimetálicas entre el rutenio y el cobalto que modifican las propiedades electrónicas de los materiales (Morales & Weckhuysen, 2006).
Conclusiones
El método de autocombustión permitió obtener sistemas catalíticos del tipo Coxoy/MgO-Al2O3 altamente dispersos (resultados con XRD y SEM-EDS) y estables, proba- blemente por la existencia de interacciones fuertes entre el cobalto y el soporte. Por otro lado, el método de impregnación permitió la obtención de sistemas catalíticos de tipo Coxoy/MgO-Al2O3 altamente dispersos y con mejores propiedades de reducción debido a la interacción más débil entre el cobalto y el soporte.
La actividad catalítica mostró que el material obtenido por impregnación presentó una mayor conversión que el obtenido por autocombustión, sin embargo, presentó una alta selectividad hacia CH4.
El efecto del rutenio como promotor fue favorable en el caso de los materiales sintetizados por autocombustión, con un aumento de la conversión y la selectividad hacia los hidrocarburos C6+. En el caso del método de impregnación, la conversión disminuyó, pero mejoró la selectividad hacia hidrocarburos de cadena más larga.El método de autocombustión es promisorio para la obtención de materiales del tipo Ru-CoO/MgO-Al2O3 enla síntesis F-T con preferencia hacia la formación de fracciones de interés en el rango de la gasolina (C5-C11) y del diésel (C12- C21).
Agradecimientos
Los autores agradecen a Colciencias por la financiación del proyecto 1115-521-28804, y al Programa de Sostenibilidad (2013-2014) de la Universidad de Antioquia. M. López agradece a Colciencias por la financiación recibida.
Conflicto de interés
Los autores declaran que no tienen ningún conflicto de interés.
Bibliografía [ Links ]
Bartholomew, C. H., Reuel, R. C. (1985). Cobalt-support interactions: Their effects on adsorption and carbon monoxide hydrogenation activity and selectivity properties. Industrial & Engineering Chemistry Product Research and Development. 24(1): 56-61. [ Links ]
Bellotto, M., Rebours, B., et al. (1996). Hydrotalcite decomposition mechanism: A clue to the structure and reactivity of spinel-like mixed oxides. Journal of Physical Chemistry. 100(20): 8535-8542. [ Links ]
Bukur, D., Pan, Z., et al. (2012). Effect of CO Conversion on the Product Distribution of a Co/Al2O3 Fischer-Tropsch Synthesis Catalyst Using a Fixed Bed Reactor. Catalysis Letters. 142(11): 1382-1387. [ Links ]
Cook, K. M., Poudyal, S., et al. (2012). Reducibility of alumina-supported cobalt Fischer-Tropsch catalysts: Effects of noble metal type, distribution, retention, chemical state, bonding, and influence on cobalt crystallite size. Applied Catalysis A: General. 449(0): 69-80. [ Links ]
Chen, L., Tian,X., et al. (2012). The effect of surface acidic and basic properties of highly loaded Co catalysts on the Fischer-Tropsch synthesis. Catalysis Communications. 28(0): 155-158. [ Links ]
Das, T., Deo, G. (2011). Synthesis, characterization and in situ DRIFTS during the CO2 hydrogenation reaction over supported cobalt catalysts. Journal of Molecular Catalysis A: Chemical. 350(1-2): 75-82. [ Links ]
Das, T., Deo, G. (2012). Effects of metal loading and support for supported cobalt catalyst. Catalysis Today. 198(1): 116-124. [ Links ]
Diehl, F., Khodakov, A. Y. (2009). Promotion par les métaux nobles de catalyseurs Fischer-Tropsch à base de cobalt : une revue. Oil & Gas Science and Technology - Rev. IFP. 64(1): 11-24. [ Links ]
Gallego, G. S., Mondragón, F., et al. (2006). CO2 reforming of CH4 over La-Ni based perovskite precursors. Applied Catalysis A: General. 311: 164-171. [ Links ]
Girardon, J.S., Lermontov, A.S., et al. (2005). Effect of cobalt precursor and pretreatment conditions on the structure and catalytic performance of cobalt silica-supported Fischer-Tropsch catalysts. Journal of Catalysis. 230(2): 339-352. [ Links ] [ Links ]
Jongsomjit, B., Panpranot, J., et al. (2001). Co-Support Compound Formation in Alumina-Supported Cobalt Catalysts. Journal of Catalysis. 204(1): 98-109. [ Links ]
Jongsomjit, B., Wongsalee, T., et al. (2005). Characteristics and catalytic properties of Co/TiO2 for various rutile: Anatase ratios. Catalysis Communications. 6(11): 705-710. [ Links ]
Kanezaki, E. (2004). Preparation of layered double hydroxides. Interface Science and Technology. W. Fernando and S. Kestur Gundappa, Elsevier. Volume 1: 345-373. [ Links ]
Khassin, A. A., Yurieva, T.M.,et al. (2001). Cobalt-aluminum co-precipitated catalysts and their performance in the Fischer-Tropsch synthesis. Journal of Molecular Catalysis A: Chemical.168(1-2): 193-207. [ Links ]
Khodakov, A. Y., Chu, W., et al. (2007). Advances in the Development of Novel Cobalt Fischer-Tropsch Catalysts for Synthesis of Long-Chain Hydrocarbons and Clean Fuels. Chemical Reviews. 107(5): 1692-1744. [ Links ]
Krylova, M. V., Kulikov, A.B., et al. (2008). Cobalt-containing catalysts made from layered double hydroxides for synthesis of hydrocarbons from carbon monoxide and hydrogen. Chemistry and Technology of Fuels and Oils 44(5): 339-343. [ Links ]
Ma, W., Jacobs, G., et al. (2011). Fischer-Tropsch Synthesis: Influence of CO Conversion on Selectivities, H2/CO Usage Ratios, and Catalyst Stability for a Ru Promoted Co/Al2O3 Catalyst Using a Slurry Phase Reactor. Topics in Catalysis 54(13-15): 757-767. [ Links ]
Ma, W., Jacobs, G., et al. (2012). Fischer-Tropsch synthesis: Effect of Pd, Pt, Re, and Ru noble metal promoters on the activity and selectivity of a 25%Co/Al2O3 catalyst. Applied Catalysis A: General 437-438(0): 1-9. [ Links ]
Zhang, Y., Xiong, H., et al. (2005). Effect of magnesia on alumina-supported cobalt Fischer-Tropsch synthesis catalysts. Journal of Molecular Catalysis A: Chemical 237(1-2): 172-181. [ Links ]
Morales, F., Weckhuysen, B.M. (2006). Promotion Effects in Co-based Fischer-Tropsch Catalysis. Catalysis 19: 1-40. [ Links ]
Profeti, L. P. R., Ticianelli, E.A., et al. (2009). Ethanol steam reforming for production of hydrogen on magnesium aluminate-supported cobalt catalysts promoted by noble metals. Applied Catalysis A: General 360(1): 17-25. [ Links ]
Putanov, P., Boskovic, G., et al. (1992). Promoter effect of Cu, Co and K on Fe/MgO in CO hydrogenation. Journal of Molecular Catalysis 71(1): 81-92. [ Links ]
Querini, C. A., Ulla, M.A., et al. (1998). Catalytic combustion of diesel soot particles. Activity and characterization of Co/MgO and Co,K/MgO catalysts. Applied Catalysis B: Environmental 15(1-2): 5-19. [ Links ]
Reuel, R. C., Bartholomew, C.H. (1984). Effects of support and dispersion on the CO hydrogenation activity/selectivity properties of cobalt. Journal of Catalysis 85(1): 78-88. [ Links ]
Richards, R., Mulukutla, R.S., et al. (2001). Nanocrystalline ultra high surface area magnesium oxide as a selective base catalyst. Scripta Materialia 44(8-9): 1663-1666. [ Links ]
Shen, Q., Li, L., et al. (2009). A study on N2O catalytic decomposition over Co/MgO catalysts. Journal of Hazardous Materials 163(2-3): 1332-1337. [ Links ] [ Links ]
Tsai, Y.T., Mo, X., et al. (2011). Hydrotalcite supported Co catalysts for CO hydrogenation. Applied Catalysis A: General 396(1-2): 91-100. [ Links ]
van de Water, L. G. A., Bezemer, G.L., et al. (2006). Spatially resolved UV-vis microspectroscopy on the preparation of alumina-supported Co Fischer-Tropsch catalysts: Linking activity to Co distribution and speciation. Journal of Catalysis 242(2): 287-298. [ Links ]
Van Der Laan, G. P., Beenackers, A. A. C. M. (1999). Kinetics and Selectivity of the Fischer-Tropsch Synthesis: A Literature Review. Catalysis Reviews: Science and Engineering 41(3): 255 - 318. [ Links ]
Wang, H. Y., Ruckenstein, E. (2001). Partial Oxidation of Methane to Synthesis Gas over Alkaline Earth Metal Oxide Supported Cobalt Catalysts. Journal of Catalysis 199(2): 309-317. [ Links ]
Zhang, Q., Kang, J., et al. (2010). Development of Novel Catalysts for Fischer-Tropsch Synthesis: Tuning the Product Selectivity. ChemCatChem 2(9): 1030-1058. [ Links ]
Zhang, Y., Wei, D., et al. (1999). Effect of water vapor on the reduction of Ru-promoted Co/Al2O3. Journal of Catalysis 188(2): 281-290. [ Links ]













