Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales
Print version ISSN 0370-3908
Rev. acad. colomb. cienc. exact. fis. nat. vol.39 no.152 Bogotá July/Sept. 2015
https://doi.org/10.18257/raccefyn.242
doi: http://dx.doi.org/10.18257/raccefyn.242
1 Programa de Ingeniería Pesquera, Universidad del Magdalena, Grupo de Investigación ''Ciencia y Tecnología Pesquera Tropical'' (CITEPT), Santa Marta, Colombia. *Correspondencia: Jorge Paramo, jparamo@unimagdalena.edu.co
2 Programa de Biología, Universidad del Magdalena, Grupo de Investigación ''Ciencia y Tecnología Pesquera Tropical'' (CITEPT), Santa Marta, Colombia
Recibido: 09 de junio de 2015. Aceptado: 24 de agosto de 2015
Resumen
Con el fin de presentar información biológica de los camarones de profundidad de importancia comercial para una eventual pesquería en el mar Caribe colombiano, en el presente estudio se propuso suministrar información sobre la estructura de tallas, la talla media de madurez y la razón de sexos de los camarones de profundidad Aristaeomorpha foliacea, Pleoticus robustus y Penaeopsis serrata. Las muestras se recolectaron con pesca de arrastre en profundidades entre los 200 y los 550 m (estratos de profundidad de 100 m) en el Caribe colombiano. Se registró la longitud total, el peso total, el sexo y el número de individuos por especie en cada estación. La talla media de madurez sexual se modeló ajustando la función logística de la proporción de especímenes maduros con un intervalo de 5 mm de la longitud total. Se encontraron diferencias estadísticamente significativas en las tallas y pesos entre los sexos para las tres especies de camarones de aguas profundas, lo que reveló el dimorfismo sexual. La proporción sexual en todos los camarones de profundidad mostró diferencias significativas (p=0,000) entre el número de hembras y machos por clase de talla al compararla con una constante de referencia de 50 % de razón sexual. La relación entre la razón sexual con la talla y la distribución de la frecuencia demostró claramente una predominancia de hembras en los grupos de menor talla en A. foliacea y P. robustus. Sin embargo, en P. serrata la proporción de sexos fue igual en los grupos con las menores tallas.
Palabras clave: estructura de tallas, razón sexual, talla media de madurez, Caribe colombiano, camarones de aguas profundas.
Abstract
We present biological information of commercially important deep-sea shrimps for a potentially new fishery in the Colombian Caribbean Sea. To do so, our study aimed at providing information on the size structure, the size at sexual maturity and the sex ratio of the deep-sea shrimps Aristaeo morphafoliacea, Pleoticus robustus, Penaeopsis serrata. The samples were collected by trawling in depths ranging between 200 and 550 m (100 m strata intervals) in the Colombian Caribbean Sea. We recorded the total weight, total length, sex and number of individuals per species from each station. The size at sexual maturity was determined by adjusting the logistic function of the proportion of mature specimens to 5 mm intervals of the total length. We found statistically significant differences in size and weight between sexes for the three species, thus revealing sexual dimorphism. The sex ratio in all deep-sea shrimp showed statistically significant differences (p=0,000) between the number of females and males by size class when compared to a 50% constant reference sex ratio. The relationship between the sex ratio and the size frequency distribution clearly showed a predominance of females in the smaller size groups in P. robustusand A. foliacea. However, in P. serratathe sex ratio was equal in the smaller sizes.
Key words: Size structure, sex ratio, size at 50% maturity, Colombian Caribbean, deep-sea shrimps.
Introducción
Los cambios en la estructura de las tallas debidos a la actividad pesquera se pueden atribuir a la vulnerabilidad diferencial de las especies, los cambios en la composición de las tallas, las historias de vida, los cambios genéticos, las relaciones predador-presa, y los efectos de la competencia (Jennings & Dulvy, 2005). Por esta razón, se han utilizado indicadores para hacer el seguimiento de los cambios ecológicos y evaluar el desempeño del manejo pesquero desde un enfoque ecosistémico y con base en la estructura de la talla de las poblaciones marinas (Jennings & Dulvy, 2005, Shin, et al., 2005, Yemane, et al., 2008).
Se han propuesto el tamaño medio, el tamaño en la madurez y la longitud media en la madurez (Lmax) como indicadores del nivel de población por efecto de las pesquerías (Rochet &Trenkel, 2003; Rice, 2003). De hecho, se ha demostrado que un cambio en la estructura del tamaño de un ensamblaje tiene gran influencia en la estructura y el funcionamiento del ecosistema (Borgmann, 1987; Boudreau & Dickie, 1992; Calder, 2001), de tal manera que la selectividad de los tamaños hace que las pesquerías influyan en la organización estructural y funcional de los ecosistemas marinos (Haedrich & Barnes, 1997, Shin, et al., 2005; Yemane, et al., 2008). Sin embargo, las proporciones relativas de los tamaños de las clases en las comunidades marinas cambian no solo con el nivel de explotación (Daan, et al., 2005), sino que también están asociados con la razón sexual en crustáceos marinos (Wenner, 1972). Como posibles causas de los cambios en la razón sexual en relación con el tamaño se han planteado la mortalidad diferencial, la restricción en la nutrición, la mayor actividad de un sexo, la migración de uno de los sexos en determinado momento y el uso de hábitats diferentes por parte de los dos sexos (Wenner, 1972; Charnov, et al., 1978; King & Moffit, 1984; Company & Sarda, 1997; Koeller, et al., 2000; Charnov & Hannah, 2002; Chiba, et al., 2006; Lizárraga-Cubedo, et al., 2008; Baeza & Piantoni, 2010; Pongtippatee, et al., 2012; Grabowsky, et al., 2014).
En estudios previos se ha determinado el potencial de nuevas pesquerías de crustáceos de profundidad con alto valor comercial, tales como la gamba española (Aristaeomorpha foliacea), el camarón rojo real (Pleoticus robustus) (Paramo & Saint-Paul, 2012a), el camarón rosado manchado (Penaeopsis serrata) (Paramo & Saint-Paul, 2012b) y la langosta de aguas profundas del Caribe (Metanephrops binghami) (Paramo & Saint-Paul, 2012c). La gamba española (A. foliacea) se encuentra en las aguas profundas del mar Mediterráneo y es un camarón comercialmente importante (D'Onghia, et al., 1998; Figueiredo, et al., 2001; Papaconstantinou & Kapiris, 2003; Politou, et al., 2004; Mytilineou, et al., 2006; Mouffok, et al., 2008). Esta especie tiene una amplia distribución geográfica que se extiende desde el mar Mediterráneo y el Atlántico oriental, el Atlántico occidental y el océano Índico y el Pacífico occidental, y desde Japón hasta Australia, Nueva Zelanda y las islas Fidji, y se le captura activamente debido a su alto valor comercial (Tavares, 2002). Gracia, et al., (2010) exploraron las aguas profundas de la península de Yucatán en México y demostraron que A. foliaceay P. robustusrepresentan un potencial recurso pesquero. A. foliaceacons-tituye una pesquería valiosa de camarón de profundidad en la costa sur y sureste de Brasil (Pezzuto, et al., 2006; Dallagnolo, et al., 2009). Esta especie también se captura en gran abundancia frente a la costa del noreste de Florida, en el delta del río Misisipi (Tavares, 2002). El camarón rosado manchado (P. serrata) es de importancia comercial en el Atlántico oriental y en el occidental (Holthuis, 1980): se le encuentra en el Atlántico oriental frente al noroeste de África (Marruecos, Río de Oro), y en el Atlántico occidental desde Carolina del Norte (EE.UU.) hasta Surinam, las islas Bahamas, y el golfo de México en el mar Caribe (Holthuis, 1980; Pérez-Farfante, 1980); en el mar Mediterráneo se le encuentra fuera de la costa de la isla Alborón y en el canal de Cerdeña (Mura, et al., 2002). Con base en esta información, el objetivo del presente estudio fue suministrar datos sobre la estructura de las tallas, la talla media de madurez y la razón de sexos de los camarones de profundidad de potencial importancia comercial en el mar Caribe colombiano.
Materiales y métodos
Área de estudio
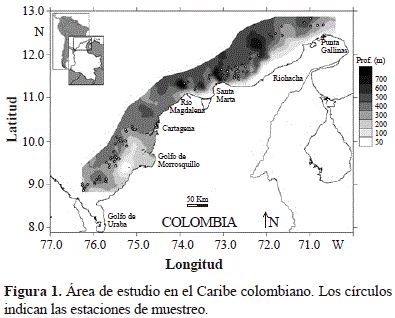
Las muestras se recolectaron en el mar Caribe colombiano con pesca de arrastre en profundidades entre los 200 y los 550 m, en estratos de profundidad de 100 m con un mínimo de dos lances por cada estrato de profundidad (aunque el último estrato fue de 50 m). Se hicieron muestreos en agosto y diciembre de 2009 en la zona sur y en marzo y mayo de 2010 en la zona norte a bordo del barco camaronero comercial "Tee Claude" con una red de arrastre de tamaño de malla al final del copo de 44,5 mm de nudo a nudo, sobre una grilla de 87 estaciones (Figura 1). No fue posible recolectar muestras entre Cartagena y el río Magdalena debido a la irregularidad del fondo. La ubicación de los arrastres se estableció usando una ecosonda comercial FURUNO FCV 1150 con un transductor de 28 Khz de frecuencia. La duración de cada arrastre fue de 30 minutos y la distancia arrastrada por la red y la velocidad del barco (2,5 nudos en promedio) se estimó con un GPS Garmin MAP 76CSx. La abertura de la red fue de 11,58 m.
Estructura de las tallas
Se registraron el peso total, el sexo y el número de individuos por especie en cada estación. Todos los especímenes se pesaron (peso total, PT) con una precisión de 0,1 g; la longitud total (LT) se midió desde la punta del rostro hasta la punta del telson con una precisión de 0,01 mm usando calibradores digitales. Se evaluaron las diferencias en la distribución de frecuencias de las tallas y los pesos entre hembras y machos mediante la prueba no paramétrica de Kruskall-Wallis (Gotelli & Ellison, 2004). La separación de las distribuciones de la frecuencia de la longitud total para hembras y machos permitió calcular la razón sexual para cada clase de talla. Se hizo la prueba de ji al cuadrado para establecer la significancia estadística de las diferencias entre el número de hembras y machos por clase de talla, con una constante de referencia de 50 % de razón sexual.
Talla media de madurez
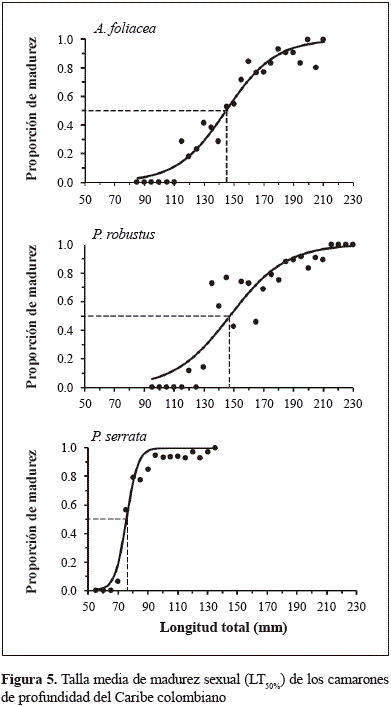
Los estadios de madurez macroscópica para las hembras de camarones de profundidad (A. foliacea, P. robustusy P. serrata) se determinaron visualmente siguiendo la escala de madurez de cinco estadios: I, inmaduras; II, desarrollo temprano; III, desarrollo tardío; IV, en desove; V, posterior al desove (Levi & Vacchi, 1988; Figueiredo, et al., 2001). Para estimar la talla media de madurez (LT50%) se consideraron los estadios I y II como inmaduros y los estadios III, IV y V como maduros. La LT50% se modeló ajustando la función logística de la proporción de especímenes maduros con un intervalo de 5 mm de LT. La curva se ajustó mediante mínimos cuadrados usando una regresión no lineal para estimar los parámetros y la LT50%.
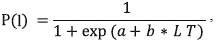
donde P(l) es la proporción de hembras maduras, a y b son los parámetros estimados y LT es la longitud total. La talla en el 50 % de madurez es LT50% = (-a/b) (King, 2007).
Resultados
Se encontraron diferencias estadísticamente significativas en las tallas de los sexos para las especies de camarones de aguas profundas estudiadas (Figura 2; Tabla 1), lo que reveló el dimorfismo sexual (p=0,00). Los machos fueron más pequeños que las hembras en todas las especies. La estructura de las tallas para las hembras de A. foliaceavarió entre 72,53 y 225,00 mm de LT (talla media 163,95±27,59 mm de LT) y para los machos entre 87,67 y 203,00 mm de LT (talla media 130,60±15,63 mm de LT). La distribución de frecuencia de LT para las hembras de P. robustusvarió entre 99,05 y 232,00 mm de LT (talla media 179,98±26,14 mm de LT) y en machos entre 111,00 y 207,00 mm de LT (talla media 144,83 ±12,55 mm de LT). La estructura de tallas para P. serrataen las hembras estuvo entre 56,07 y 139,95 mm de LT, con una talla media de 108,10±16,77 mm de LT, mientras que las tallas de los machos oscilaron entre 59,71 y 123,13 mm de LT, con una talla media de 96,15±13,49 mm de LT.
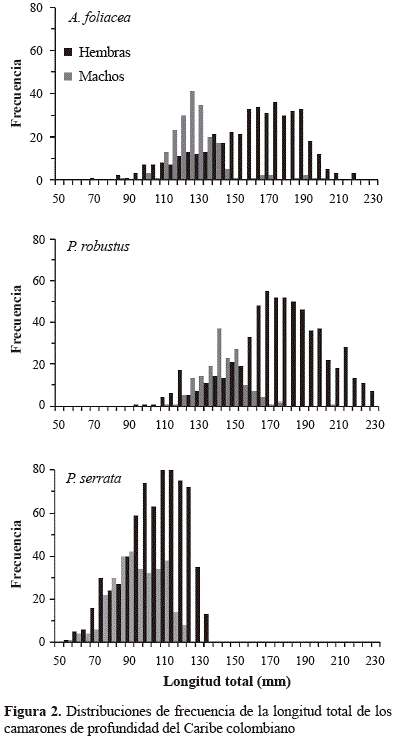
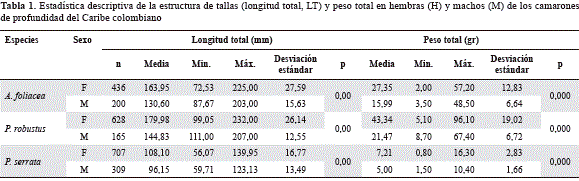
Se encontraron diferencias estadísticamente significativas en los pesos entre los sexos de las especies estudiadas (Figura 3; Tabla 1), lo que reveló el dimorfismo sexual (p=0,00). En todas las especies de camarones de profundidad los machos tuvieron menos peso que las hembras. La estructura del peso en las hembras de A. foliaceavarió entre 2,00 y 57,20 gr (peso medio 27,35±12,83 gr) y para los machos entre 3,50 y 48,50 gr (peso medio 15,99±6,64 gr). La distribución de frecuencia del peso en las hembras de P. robustusvarió entre 5,10 y 96,10 gr (peso medio 43,34±19,02 gr) y en machos, entre 8,70 y 67,40 gr (peso medio 21,47±6,72 gr). La estructura del peso en las hembras de P. serrataestuvo entre 0,80 y 16,30 gr, con un peso medio de 7,21±2,83 gr, mientras que los pesos de los machos oscilaron entre 1,50 y 10,40 gr, con un peso medio de 5,00±1,66 gr.
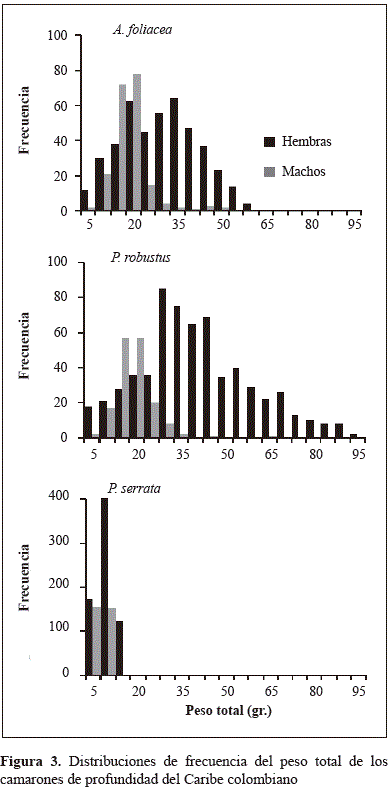
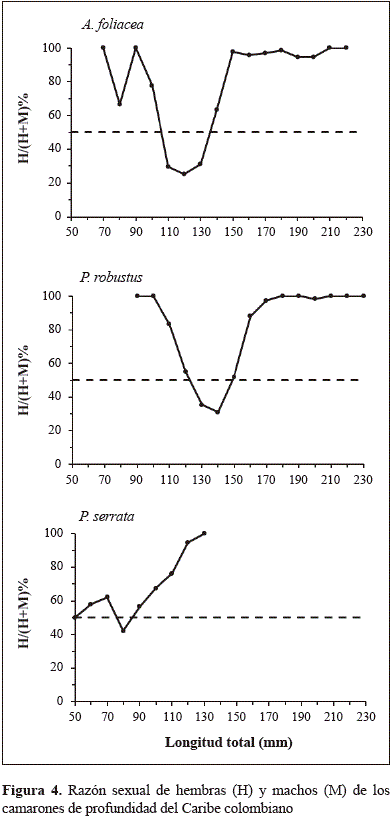
La proporción sexual en todos los camarones de profundidad mostró diferencias significativas (p=0,000) entre el número de hembras y machos por clase de talla al compararla con una constante de referencia de 50 % de razón sexual. La razón sexual de acuerdo a la clase de talla evidenció que la proporción de hembras fue alta en las tallas menores. Se encontró una gran proporción de hembras de gamba española (A. foliacea) de hasta 100 mm de LT, aunque dicha medida fue variable, pues disminuyó hasta 29,41 % a los 110 mm de la LT, y a partir de 130 mm y hasta los 140 mm de LT volvió a incrementarse a 63,33 % para luego mantenerse en 97,72 % en las tallas mayores de 150 mm de LT (Figura 4). El 100 % de las hembras de camarón rojo real (P. robustus) tuvo tallas menores hasta la clase de 100 mm de LT, pero la proporción disminuyó en las hembras a partir de la clase de talla de 110 mm de LT a 83 % y después siguió disminuyendo hasta llegar a 35,29 % en las hembras en la clase de tallas de 130 mm de LT y 31,03 % en la clase de tallas de 140 mm de LT. Posteriormente, la razón sexual aumentó en favor de las hembras hasta alcanzar 97,27 % en la clase de tallas de 170 mm de LT. En las tallas menores de camarón rosado manchado (P. serrata) se encontró la proporción sexual de 50 % en la clase de talla de 50 mm de LT, la cual aumentó hasta 62,16 % en la clase de 70 mm de LT para luego disminuir hasta 42,15 % en la clase de 80 mm de LT; en la clase de talla de 90 mm de LT la razón sexual llegó a 56,57 % de hembras y siguió aumentando hasta llegar a 100 % en la clase de tallas de 130 mm de LT.
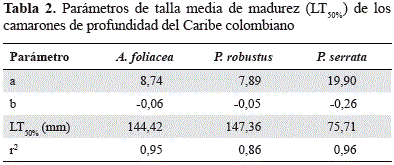
La talla media de madurez sexual (LT50%) para las hembras de A. foliacea fue de 144,42 mm LT (32,3 % inmaduras y 67,7 % maduras); para P. robustusfue de 147,36 mm LT (26,8 % inmaduras y 73,2 % maduras), y para P. serratafue de 75,71 mm LT (12,4 % inmaduras y 87,6 % maduras) (Figura 5; Tabla 2).
Discusión
La talla media de captura de A. foliacea(hembras: 163,95 mm LT; machos: 130,60 mm LT) fue similar a la talla media reportada para una región de pesca sin explotación en el mar Jónico en Grecia (Papaconstantinou & Kapiris, 2003). En P. robustusla talla media fue similar a la reportada en una región de pesca sin explotación frente a la península de Yucatán en México (Gracia, et al., 2010). En el mar Jónico en Grecia se encontraron diferencias significativas entre los sexos de A. foliacea: la talla media de las hembras fue de 156,85 mm LT y la de los machos de 120,43 mm LT (Papaconstantinou & Kapiris, 2003), lo cual coincide con nuestros resultados (Tabla 1; Figura 2). La talla media de madurez de las hembras de A. foliaceaen el presente estudio fue similar a la talla media de madurez en el oeste del Mediterráneo (150,81 mm LT, Belcari, et al., 2003) y en el noroeste del mar Jónico en el Mediterráneo (160,72 mm LT) (Carlucci, et al., 2006). En cuanto a los aspectos reproductivos de A. foliacea, se ha sugerido que el desarrollo de los ovarios es inducido por la copulación. Los machos tienen una actividad reproductiva más extensa que las hembras. Las hembras inmaduras reciben los espermatóforos de los machos maduros y los conservan hasta su maduración sexual (Kapiris & Thessalou-Legaki, 2009). Las hembras de A. foliaceacomienzan su actividad reproductiva en el segundo año de vida (Politou, et al., 2004), por lo tanto, la gran proporción de individuos de crustáceos de profundidad con tallas grandes encontrada en este estudio, y el hecho de que la talla media de captura fue mayor que la LT50%, refleja la existencia de poblaciones sin explotar en el Caribe colombiano.
La relación de la razón sexual con la talla y la distribución de frecuencia mostró claramente un predominio de hembras en los grupos de talla menor en A. foliacea y P. robustus. Sin embargo, en los grupos de talla menor de P. serratala proporción de sexos fue igual. La razón sexual de A. foliacearegistrada en el occidente del mar Mediterráneo se inclinó significativamente en favor de las hembras, aunque favoreció a los machos en las clases de talla intermedia y a las hembras en las clases de talla mayor (Belcari, et al., 2003). Otro estudio en el mar Mediterráneo encontró que, en general, la razón sexual en A. foliaceaestuvo a favor de las hembras; en los individuos de menos de 118,09 mm de LT estuvo a favor de las hembras y en las clases de más de 118,09 mm de LT estuvo a favor de los machos (Politou, et al., 2004). Sin embargo, la razón sexual de A. foliacea en el mar Jónico en Grecia mostró un predominio de los machos. El patrón general es que en los machos se presentan dos modas anuales mientras que en las hembras se dan tres o cuatro. Además, las hembras presentan una alta tasa de crecimiento y la mortalidad natural es mayor en los machos que en las hembras (Papaconstantinou & Kapiris, 2003). La explicación de la relación de la razón sexual con la talla puede responder a las diferencias sexuales en el crecimiento, a la mortalidad o a la migración (Siegel, et al., 2008). De hecho, las diferencias en la mortalidad natural entre los sexos es un factor que contribuye potencialmente a la desigualdad de la razón sexual (Wenner, 1972). En este sentido, si las tasas de crecimiento y mortalidad de machos y hembras fueran las mismas, la razón sexual debería permanecer constante; por el contrario, para que haya aumentos y reducciones en ciertas clases de talla debe haber diferencias en las distribuciones de frecuencia de talla entre hembras y machos con altas tasas de crecimiento en un sexo comparado con el otro. Por lo tanto, el patrón de la razón sexual es un resultado de los efectos mezclados de las diferencias en la tasa de crecimiento entre machos y hembras, de las tasas de mortalidad y de la composición de las edades (Siegel, et al., 2008).
En el estrecho de Sicilia (mar Mediterráneo), el desembarco de A. foliacea se estima en 1.000 toneladas por año, con un valor de alrededor de 15 millones de dólares (Ragonese, et al., 1997, 2002). A. foliacearepresenta un tercio de la biomasa total que se desembarca en el puerto Santo Stefano (Italia), lo que se traduce en altos ingresos económicos (Belcari, et al., 2003). En estudios anteriores en el Caribe colombiano se ha señalado el potencial de una nueva pesquería de crustáceos de profundidad con gran valor comercial no solo a nivel local sino en mercados internacionales. Sin embargo, se necesita más investigación biológica para entender los parámetros del ciclo de vida de los crustáceos de aguas profundas en el Caribe colombiano, tales como el crecimiento, la reproducción, el reclutamiento, la mortalidad, las áreas y épocas de desove, las áreas de crianza y la biodiversidad asociada, antes de la iniciar una iniciativa de ese tipo (Paramo, 2011; Paramo, et al., 2011; Paramo & Saint-Paul, 2012a, b, c). Esta información ayudará a desarrollar estrategias apropiadas para iniciar, manejar y sostener una nueva pesquería comercial con criterio ecosistémico (Bianchi, 2008). Por último, se recomienda hacer un estudio mensual para conocer los aspectos reproductivos de los crustáceos de aguas profundas: la época reproductiva y el máximo potencial reproductivo con la presencia de espermatóforos en el telicum, lo cual indicaría que ha habido apareamiento, así como estudios histológicos para comprobar los estadios de madurez gonadal y la actividad de mudas durante el año y estudios de selectividad y uso de dispositivos excluidores de fauna acompañante.
Agradecimientos
Agradecemos a la tripulación del barco "Tee Claude" y al Capitán José Guillén. Este proyecto fue financiado por Colciencias (código 117-452-21288), la Universidad del Magdalena, el Instituto Colombiano de Desarrollo Rural (INCODER) a través de la Subgerencia de Pesca y Acuicultura, y la Autoridad Nacional de Acuicultura y Pesca (AUNAP) (convenio No. 790).
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Bibliografía
Baeza, J.A., Piantoni, C. 2010. Sexual system, sex ratio, and group living in the shrimp Thor amboinensis(De Man): Relevance to resource-monopolization and sex-allocation theories. Biol. Bull. 219:151-165. [ Links ]
Belcari, P., Viva, C., Mori, M., De Ranieri, S. 2003. Fishery and biology of Aristaeomorphafoliacea (Risso, 1827) (Crustacea: Decapoda) in the Northern Tyrrenien Sea (western Mediterranean). J. Northw. Atlant. Fish. Sci. 31:195-204. [ Links ]
Bianchi, G. 2008. The concept of the ecosystem approach to fisheries. In: Bianchi, G., Skjoldal, H.R. (editors). The ecosystem approach to fisheries. CAB and FAO, Rome, p. 20-38. [ Links ]
Borgmann, U. 1987. Models on the slope of, and biomass flow up, the biomass size spectrum. Can J Fish Aquat Sci. 44 (2):136-140. [ Links ]
Boudreau, P. R., Dickie, L. M. 1992. Biomass spectra of aquatic ecosystems in relation to fisheries yield. Can J Fish Aquat Sci., 49 (8): 1528-1538 [ Links ]
Carlucci, R., D'Onghia, G., Sion, L., Maiorano, P., Tursi, A. 2006. Selectivity parameters and size at first maturity in deep-water shrimps, Aristaeo morphafoliacea(Risso, 1827) and Aristeus antennatus (Risso, 1816), from the North-Western Ionian Sea (Mediterranean Sea). Dev. Hydrobiol. 184: 145-154. [ Links ]
Calder, W. 2001. Ecological consequences of body size. Encyclopedia of life sciences, John Wiley & Sons Ltd., Chichester. DOI: 10.1038/npg.els.0003208 [ Links ]
Company J.B., Sarda, F. 1997. Reproductive patterns and populations characteristics of five deep water pandalid shrimps in the western Mediterranean along a depth gradient (150-1100 m). Mar. Ecol. P.S. 148: 49-58. [ Links ]
Charnov, E.L., Gotshall, D.W., Robinson, J.G. 1978. Sex ratio: Adaptive adjustments to population fluctuations in pandalid shrimp. Science, 200: 204-206. [ Links ]
Charnov, E. L. & Hannah, R.W. 2002. Shrimp adjust their sex ratio to fluctuating age distributions. Evolutionary Ecology Research. 4: 239-246. [ Links ]
Chiba, S., Yoshino, K., Kanaiwa, M. Kawajiri, T., Goshima, S. 2006. Maladaptive sex ratio adjustment by e sex changing shrimp in selective fishing environments. Journal of Animal Ecology. 82: 632-641. [ Links ]
Daan, N., Gislason, H., Pope, J.G., Rice, J.C. 2005. Changes in the North Sea fish community: Evidence of indirect effects of fishing. ICES J. Mar. Sci./J. Cons. int. Explor. Mer. 62: 177-188. [ Links ]
Dallagnolo, R., Pérez, J.A.A., Pezzuto, P.R., Wahrlich, R. 2009. The deep-sea shrimp fishery off Brazil (Decapoda: Aristeidae) development and present status. Lat. Am. J. Aquat. Res. 37 (3): 327-346. [ Links ]
D'onghia, G., Tursi, A., Maiorano, P., Panza, M. 1998. Distribution, biology, and population dynamics of Aristaeo morphafoliacea (Risso, 1827) (Decapoda, Natantia, Aristeidae) in the north-western Ionian Sea (Mediterranean Sea). Crustaceana. 71: 518-544. [ Links ]
Figueiredo, M.J., Figueiredo, I., Machado, P.B. 2001. Deep-water penaeid shrimps (Crustacea: Decapoda) from off the Portuguese continental slope: An alternative future resource? Fish. Res. 51: 321-326. [ Links ]
Gracia A., Vázquez-Bader A.R., Lozano-Álvarez E., Briones-Fourzán, P. 2010. Deep-water shrimp (Crustacea: Penaeoidea) off the Yucatan peninsula (southern Gulf of Mexico): A potential fishing resource. J. Shellfish Res. 29: 37-43. [ Links ]
Gotelli, N.J., Ellison, A.M. 2004. A primer of ecological statistics. Sinauer Associates. Sunderland, MA. [ Links ]
Grabowsky, R., Morilhas-Simoes, S., Castilho, A. 2014. Population structure, sex ratio and growth of the seabob shrimp Xiphopenaeus kroyeri(Decapoda, Penaeidae) from coastal waters of southern Brazil. ZooKeys. 457: 253-269. [ Links ]
Haedrich, R.L. & Barnes, S.M. 1997. Ecological consequences of body size. Fish Res. 31: 229-239. [ Links ]
Holthuis, L.B. 1980. Shrimps and prawns of the world. An annotated catalogue of species of interest to fisheries. (FAO Species Catalogue, 1). FAO Fisheries Synopsis. 125 (1): 1-271. [ Links ]
Jennings, S. & Dulvy, N.K. 2005. Reference points and reference directions for size-based indicators of community structure. ICES J. Mar. Sci. 62: 397-404. [ Links ]
Kapiris, K. & Thessalou-Legaki, M. 2009. Comparative reproduction aspects of the deep-water shrimps Aristaeo morphafoliaceaand Aristeus antennatus(Decapoda, Aristeidae) in the Greek Ionian Sea (Eastern Mediterranean). International Journal of Zoology. Article ID 979512, 9 pages. http://dx.doi.org/10.1155/2009/979512
King, M. 2007. Fisheries Biology, Assessment and Management. Wiley-Blackwell. Oxford, UK. 400 p. [ Links ]
King, M. 1984. The species and depth distribution of deep water Caridean shrimps (Decapoda, Caridea) near some southwest Pacific Islands. Crustaceana. 47 (2): 174-191. [ Links ]
Koeller, P., Mohn, R., Etter, M. 2000. Density dependant sex change in Northern shrimp Pandalus borealis on the Scotian Shelf. J. Northw. Atl. Fish. Sci. 27: 107-118. [ Links ]
Lizárraga-Cubedo, H.A., Pierce, GJ., Santos, M.B. 2008. Reproduction of crustaceans in relation to fisheries: 169-222 (en) MENTE, E. (editor) Reproductive biology of crustaceans. Science Publishers, Enfield. 565 p. [ Links ]
Levi, D. & Vacchi, M. 1988. Macroscopic scale for simple and rapid determination of sexual maturity in Aristaeo morphafoliacea (Risso, 1826) (Decapoda: Penaeidae). J Crustacean Biol. 8: 532-538. [ Links ]
Mytilineou, S., Kavadas, C., Politou, Y., Kapiris, K.,Tursi, A., Maiorano, P. 2006. Catch composition on red shrimps' (Aristaeomorpha foliacea and Aristeus antennatus) grounds in the Eastern Ionian Sea. Dev. Hydrobiol. 184: 155-160. [ Links ]
Mouffok, S., Massuti, E., Boutiba, Z., Guijarro, B., Ordines, F., Fliti, K. 2008. Ecology and fishery of the deep-water shrimp, Aristeus antennatus (Risso, 1816) off Algeria (South-western Mediterranean). Crustaceana. 81 (10): 1177-1199. [ Links ]
Mura, M., Murenu, M., Cau, A. 2002. The occurrence of Penaeopsis serrata Bate 1881 (Decapoda, Penaeidae) in the Middle-West Mediterranean Sea. Crustaceana. 75 (10): 1263-1269. [ Links ]
Papaconstantinou, C. & Kapiris, K. 2003. The biology of the giant red shrimp (Aristaeomorpha foliacea) at an unexploited fishing ground in the Greek Ionian Sea. Fish. Res., 62: 37-51. [ Links ]
Paramo, J. 2011. Deep-sea fishery in the Colombian Caribbean Sea: Management and conservation strategies for an ecosystem approach to fisheries. PhD Thesis. Universität Bremen, Alemania. 141 p. [ Links ]
Paramo, J., Saint-Paul, U., Moreno, F., Pacheco, M., Almanza, M., Rodríguez, E., Ardila, G., Borda, C., Barreto, C., González, H. 2011. Crustáceos de profundidad en el Caribe colombiano como nuevo recurso pesquero. Informe final. ISBN: 9789584485236. 26 p. [ Links ]
Paramo, J. & Saint-Paul, U. 2012a. Deep-sea shrimps Aristaeomorpha foliacea and Pleoticus robustus (Crustacea: Penaeoidea) in the Colombian Caribbean Sea as a new potential fishing resource. J. Mar. Biol. Ass. U.K. 92 (4): 811-818. [ Links ]
Paramo, J. & Saint-Paul, U. 2012b. Spatial structure of the pink speckled deep-sea shrimp Penaeopsis serrata (Bate, 1881) (Decapoda, Penaeidae) during November-December 2009 in the Colombian Caribbean Sea. Crustaceana. 85 (1): 103-116. [ Links ]
Paramo, J. & Saint-Paul, U. 2012c. Spatial structure of deep sea lobster (Metanephrops binghami) in the Colombian Caribbean Sea. Helg. Mar. Res. 66: 25-31. [ Links ]
Pérez-Farfante, I. 1980. Review of the penaeid shrimp genus Penaeopsis (Crustacea: Decapoda). Fish. Bull., U.S. 77 (4): 721-763. [ Links ]
Pezzuto, R., Pérez, J.A.A., Wahrlich, R. 2006. Deep-sea shrimps (Decapoda: Aristeidae): New targets of the deep-water trawling fishery in Brazil. Braz. J. Oceanog. 54: 123-134. [ Links ]
Politou, Ch-Y., Kapiris, K., Maiorano, P., Capezzuto, F., Dokos, J. 2004. Deep-sea Mediterranean biology: The case of Aristaeomorpha foliacea (Risso, 1827) (Crustacea: Decapoda: Aristidae). Sci. Mar. 68 (3): 129-139. [ Links ]
Pongtippatee, P., Laburee, K., Thaweethamsewee, P., Hiranphan, R., Asuvapongpatana, S., Weerachatyanukul, W., Srisawat, T., Withayachumnarnkul, B. 2012. Triploid Penaeus monodon: Sex ratio and growth rate. Aquaculture. 356-357: 7-13. [ Links ]
Ragonese, S., Bertolino, F., Branchini, M.L. 1997. Biometric relationships of the red shrimp, Aristaeomorpha foliacea Risso 1827, in the Strait of Sicily (Mediterranean Sea). Sci. Mar. 61 (3): 367-377. [ Links ]
Ragonese, S., Branchini, M.L., Di Stefano, L. 2002. Trawl cod-end selectivity for deepwater red shrimp (Aristoaeomorphafoliacea, Risso 1827) in the strait of Sicily (Mediterranean Sea). Fish. Res. 57: 131-144. [ Links ]
Rochet M.J. & Trenkel, V. 2003. Which community indicators can measure the impact of fishing? A review and proposals. Can. J. Fish. Aquat. Sci. 60: 86-99. [ Links ]
Rice, J. 2003. Environmental health indicators. Ocean. Coast. Manag. 46 (3): 235-259. [ Links ]
Shin, Y.J., Rochet, M.J., Jennings, S., Field, J.G. Gislason, H. 2005. Using size-based indicators to evaluate the ecosystem effects of fishing. ICES J. Mar. Sci. 62: 384-396. [ Links ]
Siegel, V., Damm, U., Neudecker, T. 2008. Sex-ratio, seasonality and long-term variation in maturation and spawning of the brown shrimp Crangon crangon (L.) in the German Bight (North Sea). Helgol. Mar. Res. 62 (4): 339-349. [ Links ]
Tavares, M. 2002. Shrimps: 251-291 (en) CARPENTER, K. E. (editor) The living marine resources of the western central Atlantic, species identification guide for fisheries purposes. FAO, Rome. 600 p. [ Links ]
Yemane, D., Field, J.G., Leslie, R.W. 2008. Indicators of change in the size structure of fish communities: A case study from the south coast of South Africa. Fish. Res. 93: 163-172. [ Links ]
Wenner, A.M. 1972. Sex ratio as a function of size in marine Crustacea. Amer. Naturalist. 106: 321-351. [ Links ]













