Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales
Print version ISSN 0370-3908
Rev. acad. colomb. cienc. exact. fis. nat. vol.39 no.153 Bogotá Oct./Dec. 2015
https://doi.org/10.18257/raccefyn.271
Doi: http://dx.doi.org/10.18257/raccefyn.271
Grupo de Investigación en Productos Naturales, Facultad de Ciencias, Universidad del Tolima, Ibagué, Colombia. *Correspondencia:Walter Murillo Arango, wmurillo@ut.edu.co
Recibido: 4 de agosto de 2015. Aceptado: 3 de noviembre de 2015
Resumen
El estudio evaluó el potencial amilolítico de microorganismos aislados de sustratos relacionados con el cultivo de arroz a partir de almidón extraído por el método alcalino en arroz de tercera de las variedades Índica y Fedearroz 60. El almidón se fermentó de forma directa con microorganismos aislados de los sustratos, se evaluó el efecto del tipo de microorganismo y del tiempo de fermentación (24, 48 y 72 h) en reactores de 50 ml suplementados con 20 g/l de almidón, y se midió la liberación de azúcares totales y azúcares reductores, así como la actividad amilolítica directa. Entre los microorganismos recuperados de los sustratos se destacaron los hongos Aspergillus spp., Rhizopus oryzae, Penicillum spp. y Candida krusei, por su mayor crecimiento en el medio suplementado con almidón y por su actividad amilolítica diferencial. Se observó una dependencia entre los factores evaluados y el potencial amilolítico. El organismo más eficiente fue Aspergillus spp., que liberó 2,85 g/l de azúcares a las 72 horas de fermentación con el almidón de la variedad Fedearroz 60, y el menos eficiente fue C. krusei, con 0,300 g/l de azúcares reductores en el mismo tiempo de fermentación y sin diferencia significativa debida al tipo de variedad, lo que Índica un apreciable potencial amilolítico en microrganismos nativos asociados al cultivo del arroz y un efecto importante de la estructura y la composición química de los almidones de las variedades estudiadas.
Palabras clave: almidón de arroz, subproductos agroindustriales, capacidad amilolítica, microorganismos nativos.
Abstract
We evaluated the amylolytic potential of microorganisms isolated from substrates related to rice crops cultured on starch extracted by the alkaline method from third category Índica and Fedearroz 60 rice varieties. The starch was subjected to direct fermentation with microorganisms isolated from the substrates; we evaluated the effect of the type of microorganism and the fermentation time (24, 48 and 72 h) in 50 ml reactors supplemented with 20 g/l of starch, and we measured total sugars, reducing sugars and direct amylolytic activity. Among the microorganisms recovered from the substrates, Aspergillus spp., Rhizopus oryzae, Penicillium spp. and Candida krusei were especially efficient given their growth rate in the starch-supplemented medium, and their differential amylolytic activity. The most efficient organism was Aspergillus spp., releasing 2.85 g/l of reducing sugar at 72 h in starch from the Fedearroz 60 rice variety, and the least efficient was C. krusei, with 0.300 g/l of reducing sugars during the same fermentation time, apparently regardless of the variety. This Índicates a significant amylolytic potential of native microorganisms associated with rice crops and their significant effect on the structure and chemical composition of the starch varieties under study.
Key words: Rice starch, agroindustrial byproducts, amylolytic potencial, native microorganism.
Introducción
El arroz se considera uno de los cereales más importantes debido a su aporte nutricional básico, y es parte esencial de la dieta en 17 países de Asia y el Pacífico, nueve países de América, y ocho países de África. Aporta cerca de 20 % de la energía alimentaria a nivel mundial y proporciona, vitaminas como la tiamina, la niacina y la riboflavina; además, tiene un gran contenido de ácido aspártico y glutámico (FAO, 2004). En Colombia la producción de arroz registrada para el primer semestre de 2015 fue de 780.997 toneladas, de las cuales el departamento del Tolima produjo 317.978, lo que representa el 41 % del total nacional (Dane-Fedearroz, 2013); no obstante, aproximadamente 20 % de la producción corresponde a granos manchados, partidos y de tercera calidad que son escasamente comercializados (Espinal, et al., 2005).
Los granos de arroz están constituidos en un 90 % por almidón, el cual se considera un recurso económico para la producción de glucosa, fructosa y jarabes de maltosa muy utilizados en la industria de alimentos (Roy & Gupta, 2004), así como de productos a partir de su fermentación, como son el etanol y las dextrinas (Binod, et al., 2010; Kim, et al., 2010; Ko, et al., 2009). El almidón de arroz posee características únicas como su textura suave, su alta resistencia al ácido y los amplios rangos de variación en sus contenidos de amilosa y amilopectina (el de la amilosa, por ejemplo, puede variar entre 8 y 37 %), por lo cual se ha incrementado su demanda en aplicaciones farmacéuticas y alimenticias (Wani, et al., 2012).
Convencionalmente, la conversión del almidón a glucosa y otros productos derivados requiere de la previa gelatinización de los gránulos para el óptimo desarrollo del proceso de hidrolisis enzimática, lo cual exige una gran energía de entrada, con el consecuente incremento de los costos del proceso (Tester, et al., 2006).
La búsqueda de microorganismos con potencial para sacarificar directamente los gránulos de almidón crudo a temperaturas moderadas y mediante la producción de alfa amilasas, sigue siendo atractiva desde el punto de vista económico, pues reduce los costos del proceso (Goyal, et al., 2005). En este sentido, se conoce la capacidad de los hongos de los géneros Aspergillus y Rhizopus, así como de una amplia variedad de microorganismos, para producir diferentes tipos de amilasas. Estas enzimas tienen la capacidad de hidrolizar diferentes fuentes de sacáridos (Sivaramakrishnan, et al., 2006; Sodhi, et al., 2005). Por lo tanto, el estudio de la capacidad amilolítica de microorganismos asociados al cultivo del arroz se convierte en una oportunidad no solo para encontrar nuevas fuentes de amilasas, sino también para establecer su potencial en la trasformación de almidones en otros productos de valor agregado. Por tal razón, en este estudio se evaluó la capacidad amilolítica de microorganismos aislados de sustratos asociados con el cultivo de este grano y cultivados en almidón extraído de arroz de tercera de las variedades Índica (In) y Fedearroz 60 (F60) procedentes del departamento del Tolima.
Metodología
Aislamiento e identificación de microorganismos
Se aislaron microorganismos de los siguientes sustratos asociados al cultivo de arroz: suelo, cascarilla, arroz integral y arroz de las variedades In y F60. Las muestras se recogieron directamente en agar Sabouraud suplementado con cefalexina y ampicilina al 0,1 %. La preselección se hizo con base en el crecimiento y la morfología: los aislamientos que crecieron más rápidamente en el medio de cultivo selectivo y que presentaron una morfología típica de levaduras y hongos, se purificaron posteriormente mediante repiques sucesivos (Vanegas, et al., 2003).
Las levaduras se identificaron inicialmente bajo el microscopio óptico con tinción de Gram, y posteriormente con el kit bioquímico API 20C AUX; los hongos se identificaron mediante el uso de claves taxonómicas (Gilman, 1963) y con base en la información morfológica recolectada.
Almidón de arroz
Se usó almidón de arroz previamente extraído y caracterizado a partir de granos de tercera calidad de las variedades In y F60, según se describió en el estudio adelantado por Zamora, et al., 2013, es decir, una extracción bajo condiciones alcalinas.
Determinación de la actividad amilolítica
Se utilizó un medio de cultivo mínimo en el que el almidón era la única fuente de carbono. La composición del medio, medida como porcentaje de masa por volumen (% p/v), fue la siguiente: almidón, 10 g/l; (NH4)2SO4, 5g/l; KH2PO4: 5g/l, y 2g/l de agar (Vanegas, et al., 2004). El cultivo se incubó a 37 °C, y posteriormente se midió su eficiencia a las 48 y 72 horas, evaluando el consumo de almidón mediante el método del halo de crecimiento.
La cuantificación de la actividad amilolítica se llevó a cabo en reactores de flujo continuo de 50 ml con un medio mínimo líquido (20 g/l de almidón, 5 g/l de (NH4)2SO4 y KH2PO4, 20 g/l de agar, 4 g/l de extracto de levadura y 3 g/l de peptona), al que se le agregó una suspensión de 5 ml del microorganismo; se incubaron 3,9 x109 levaduras/ ml, 4,3 x109 esporas de Rhizopus spp/ml, 2,8 x109 esporas de Penicillium spp/ml y 2,3 x109 esporas de Aspergillus/ml. La actividad se midió como UA/min l a las 24, 48 y 72 horas, previa inactivación de la actividad enzimática en un baño a 100 °C durante 15 minutos. El filtrado se usó para la determinación de los azúcares reductores (Sarmiento, et al., 2003). Todos los ensayos se hicieron por duplicado.
Cuantificación de los azúcares reductores
Los azúcares reductores se cuantificaron utilizando el método del ácido 3,5 dinitrosalicílico (Miller, 1959). Se elaboró una curva de calibración con glucosa entre 0,12 y 2,0 g/l, y las determinaciones se hicieron en un espectrofotómetro Thermo scientific UV-V Helios Gamma, modelo UVG154501.
Análisis estadístico
Se hizo un análisis factorial compuesto del tipo de microorganismo, el tiempo de fermentación y la variedad de arroz usando como variables la respuesta al contenido de azúcares reductores y la actividad amilolítica en cada uno de los ensayos. Se consideraron dos réplicas para cada uno de los tratamientos.
Las comparaciones múltiples se hicieron mediante el test de las mínimas diferencias significativas (least significant differences, LSD), con un nivel de significación de 95 %, usando el programa estadístico Statgraphic Centurion XV.
Resultados y discusión
Aislamiento e identificación de microorganismos
Se aislaron e identificaron los organismos Candida krusei, Aspergillus spp., Penicillum spp. y Rhizopus oryzae. Este último hongo fue el microorganismo más común entre los sustratos evaluados, posiblemente debido a su capacidad para colonizar diversos sustratos y tomar un amplio rango de azúcares (Karimi, et al., 2006). La cascarilla fue el sustrato que presentó el mayor número de microorganismos, probablemente por su alto contenido de carbono (39 %), lo que facilitaría el desarrollo microbiano (Camargo, 2005).
Metabolismo y trasformación microbiana del almidón
Los microorganismos que evidenciaron un desarrollo apreciable en el medio de cultivo suplementado con almidón a las 48 horas de la siembra fueron R. oryzae, Aspergillus spp., Penicillum spp. y C. krusei fueron los organismos que mostraron un desarrollo más apreciable.
La actividad amilolítica observada coincidió con la reportada para especies de los géneros Aspergillus y Rhizopus, cuya producción de glucoamilasas implicadas en el proceso de degradación del almidón se ha documentado previamente (Prasad, et al., 2007). En el caso particular de Aspergillus spp., su capacidad para degradar almidón se ha demostrado mediante la inducción de sustratos como el aceite de torta de cacahuete, el salvado de trigo y el salvado de maíz mezclados en una proporción de masa de 1:2:2 (Alva, et al., 2007), al igual que en especies como A. niger, empleada en la degradación de residuos agroindustriales, ya que produce enzimas del tipo de la celulasa, la pectinasa y la hemicelulasa, y otras del tipo de la amilasa, las cuales han demostrado su efectividad en la degradación de almidones crudos bajo diferentes condiciones experimentales (Tester, et al., 2006). En las Figuras 1 y 2 se puede observar la actividad enzimática de los diferentes microrganismos en los almidones de las variedades de arroz estudiadas.
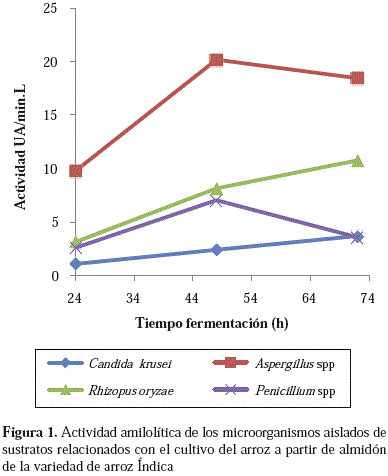
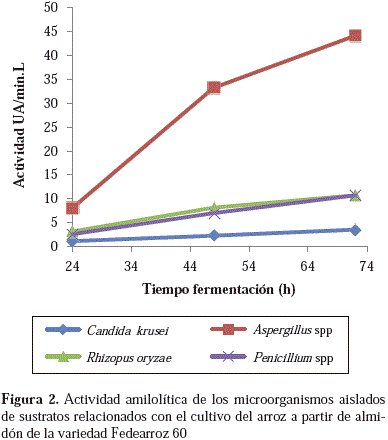
El microorganismo con la mayor actividad enzimática a las 72 horas de fermentación con el almidón de la variedad F60 fue Aspergillus spp., con una actividad promedio de 44 UA/min/l, es decir, casi 10 veces mayor a la de la levadura C. krusei (3,53 UA/min/l), y casi cuatro veces mayor a la observada con los hongos Rhizopus spp. y Penicillum spp., cuyos niveles de actividad enzimática fueron muy semejantes para el mismo tiempo de fermentación (10,73 UA/min/l). Una menor actividad enzimática se observó con el almidón de la variedad In para Aspergillus spp., con un valor de 18,45 UA/min/l, mientras que los demás mantuvieron niveles de actividad enzimática similares a los obtenidos con la variedad F60. La amilólisis llevada a cabo por Aspergillus spp. fue comparable a la de especies como A. niger en almidón de yuca reportada por Villalba, et al., (2008), lo que demuestra el potencial de la aplicación de los almidones de arroz en la producción de azúcares simples.
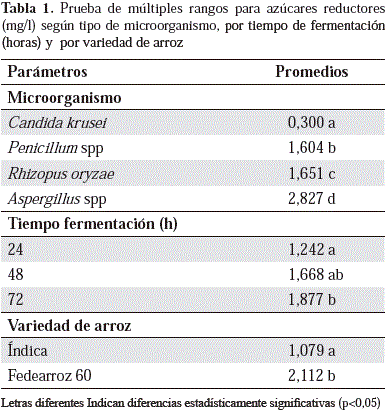
La acción enzimática se relaciona con los resultados de los carbohidratos reductores, cuyo aumento se observó a medida que transcurrió el tiempo de fermentación en casi todos los casos y cuya liberación dependió estadísticamente del tipo de microorganismo, el tiempo de fermentación y la variedad de arroz, tal como se observa en la Tabla 1, en la cual se presenta el efecto de los factores antes mencionados sobre la liberación de azúcares reductores.
El microorganismo que generó mayor cantidad de azúcares reductores fue Aspergillus spp. (4,31 g/l) a las 48 horas de fermentación con el almidón de la variedad F60, mientras que con la variedad In se generaron 2,61 g/l. Para los demás microorganismos no se observaron diferencias estadísticamente significativas entre las 48 y las 72 horas de fermentación. Los hongos R. oryzae y Penicillum spp. liberaron alrededor de 1,0 g/l, y C. krusei fue el menos eficiente, con un promedio de 0,3 g/l, independientemente de la variedad de arroz en todos los casos. Estos resultados se pueden apreciar en las Figuras 3 y 4.
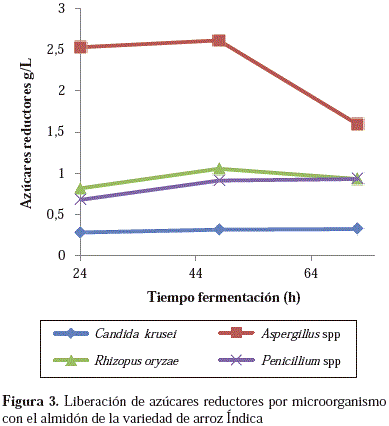
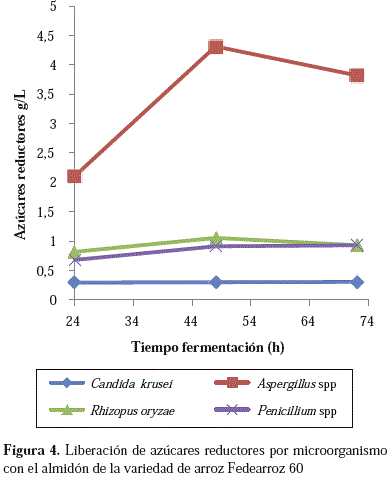
La dependencia entre el tiempo de fermentación y la cantidad de azúcares reductores fue directa en casi todos los microorganismos con excepción de Aspergillus spp., en la cual se observó una disminución marcada de la cantidad de azúcares reductores a las 72 horas de fermentación, lo que posiblemente se debió a la inhibición enzimática por producto o a que el hongo comenzó a incrementar el consumo de azúcares simples para el desarrollo de sus procesos metabólicos.
Los resultados presentados coinciden con los reportes acerca de la capacidad de los hongos de los géneros Penicillum, Rhizopus y Aspergillus como buenos productores de enzimas amilolíticas (de Castro, et al., 2011).
La expresión de amilasas se ha conseguido con diferentes especies de los géneros de hongos usados en este estudio y subproductos agroindustriales como la cáscara de yuca, el ñame, el plátano, el banano, el bagazo de caña, el salvado de trigo y el salvado de arroz, entre otros, los cuales han demostrado ser buenos inductores de amilasas en los hongos A. awamori, A. wentii, P. verrucosum, R. microsporus y R. oryzae.
Como se presenta en la Tabla 1, hubo una relación estadísticamente significativa entre el almidón de la variedad de arroz y la liberación de azúcares reductores, aspecto que puede sugerir una dependencia importante de la estructura y la composición química de los almidones usados, lo que en la literatura científica se ha asociado específicamente con los contenidos de amilosa y amilopectina. En este sentido, los almidones con mayores contenidos de amilosa o con cadenas cortas de amilopectina son más resistentes a la hidrólisis enzimática, ya que una menor cantidad de ramificaciones, o de sitios disponibles de configuración , hace más lenta la degradación (Tahir, et al., 2010). Igualmente, los estudios sobre la digestibilidad de las alfa-amilasas de almidones de diversas leguminosas mostraron que la tasa de hidrólisis se vio afectada por la organización de las cadenas de almidón dentro del granulo, así como por el grado de interacción entre las cadenas de amilosa (Zhou, et al., 2004), en tanto que en almidones de trigo y maíz el tamaño del granulo afectó su amilólisis (Naguleswaran, et al., 2012); las investigaciones futuras sobre estos aspectos deberán determinar la relación entre la estructura química de los almidones de arroz analizados y los resultados presentados en este estudio.
Conclusiones
Con excepción de C. krusei, los demás microorganismos aislados de los diversos sustratos relacionados con el arroz tuvieron una actividad amilolítica apreciable en los almidones de las variedades de arroz en estudio, lo cual Índica que son una fuente importante de organismos que podrían usarse en el futuro en procesos que conlleven a la hidrólisis y posterior conversión de almidones en otros productos. Aunque en este estudio no se determinó el efecto de la estructura y la composición química de los almidones en su hidrólisis enzimática, su medición en términos de la liberación de azúcares simples, así como su actividad enzimática, se vio afectada por el tipo de almidón, lo cual debe revisarse de manera más detallada en futuros estudios, dada su relevancia en el aprovechamiento biotecnológico del almidón de arroz de las variedades aquí estudiados.
Agradecimientos
Los autores del trabajo extienden sus agradecimientos a la Universidad del Tolima por la financiación del presente estudio.
Conflicto de Intereses
Los autores manifestamos no presentar ningún conflicto de intereses frente a la información presentada en el presento documento.
Bibliografía
Alva, S., Anupama, J., Savla, J., Chiu, Y., Vyshali, P., Shruti, M., Ruchi, K. (2007). Production and characterization of fungal amylase enzyme isolated from Aspergillus sp. JGI 12 in solid state culture. Afr.J. Biotechnol. 6 (5): 576-581. [ Links ]
Binod, P., Sindhu, R., Singhania, R. R., Vikram, S., Devi, L., Nagalakshmi, S., Pandey, A. (2010). Bioethanol production from rice straw: An overview. Bioresource Technol. 101 (13): 4767-4774. doi: 10.1016/j.biortech.2009.10.079 [ Links ]
Camargo, J. V. (2005). Diseño, construcción y puesta a punto de un prototipo de quemador para la combustión continua y eficiente de la cascarilla de arroz. El Hombre y la Máquina. 25: 128-135. [ Links ]
Dane-Fedearroz. (2015). Encuesta nacional de arroz mecanizado, I semestre de 2013. Dane-Fedearroz. Recuperado el 14 de noviembre, 2015, de http://www.dane.gov.co/files/investigaciones/boletines/arroz/bol_arroz_Isem15.pdf. [ Links ]
de Castro, A., de Andréa, T., Carvalho, D., Teixeira, M., dos Reis Castilho, L., Freire, D. (2011). Valorization of residual agroindustrial cakes by fungal production of multienzyme complexes and their use in cold hydrolysis of raw starch. Waste. Biomass. Valorization. 2 (3): 291-302. doi: 10.1007/s12649-011-9075-5 [ Links ]
Espinal, C., Martínez, H., Ortíz, L. (2005). La cadena del arroz en Colombia, una mirada global de su estructura y dinámica, 1991-2005. Ministerio de Agricultura y Desarrollo Rural Observatorio Agrocadenas Colombia, 38. [ Links ]
FAO. (2004). El arroz y la nutrición humana. Recuperado el 20 de marzo, 2014, de http://www.fao.org/rice2004/es/f-sheet/hoja3.pdf. [ Links ]
Gilman, I. (1963). Manual de los hongos del suelo (Primera edición). México DF: Compañía Editorial Continental. [ Links ]
Goyal, N., Gupta, J. K., Soni, S. K. (2005). A novel raw starch digesting thermostable a-amylase from Bacillus sp. I-3 and its use in the direct hydrolysis of raw potato starch. Enzyme. Microb. Tech. 37 (7): 723-734. doi: 10.1016/j.enzmictec.2005.04.017 [ Links ]
Karimi, K., Emtiazi, G., Taherzadeh, M. J. (2006). Ethanol production from dilute-acid pretreated rice straw by simultaneous saccharification and fermentation with Mucor indicus, Rhizopus oryzae, and Saccharomyces cerevisiae. Enzyme. Microb. Tech. 40 (1): 138-144. doi: 10.1016/j.enzmictec.2005.10.046 [ Links ]
Kim, H.-N., Sandhu, K. S., Lee, J. H., Lim, H. S., Lim, S.-T. (2010). Characterisation of 2-octen-1-ylsuccinylated waxy rice amylodextrins prepared by dry-heating. Food. Chem. 119 (3), 1189-1194. doi: 10.1016/j.foodchem.2009.08.036 [ Links ]
Ko, J. K., Bak, J. S., Jung, M. W., Lee, H. J., Choi, I.-G., Kim, T. H., Kim, K. H. (2009). Ethanol production from rice straw using optimized aqueous-ammonia soaking pretreatment and simultaneous saccharification and fermentation processes. Bioresource. Tech. 100 (19): 4374-4380. doi: 10.1016/j.biortech.2009.04.026 [ Links ]
Miller, G. L. (1959). Use of Dinitrosalicylic Acid Reagent for Determination of Reducing Sugar. Anal. Chem. 31 (3): 426-428. doi: 10.1021/ac60147a030 [ Links ]
Naguleswaran, S., Li, J., Vasanthan, T., Bressler, D., Hoover, R. (2012). Amylolysis of large and small granules of native triticale, wheat and corn starches using a mixture of a-amylase and glucoamylase. Carbohyd. Polym: 88 (3): 864-874. [ Links ]
Prasad, S., Singh, A., Joshi, H. C. (2007). Ethanol as an alternative fuel from agricultural, industrial and urban residues. Resour. Conserv. Recy. 50 (1): 1-39. doi: 10.1016/j.resconrec.2006.05.007 [ Links ]
Roy, I., & Gupta, M. N. (2004). Hydrolysis of starch by a mixture of glucoamylase and pullulanase entrapped individually in calcium alginate beads. Enzyme. Microb. Tech. 34 (1): 26-32. doi: 10.1016/j.enzmictec.2003.07.001 [ Links ]
Sarmiento, V., Vargas, D., Pedroza, A., Matiz, A., Piñales, R. P. (2003). Producción de a-Amilasa con celulas libres e inmovilizadas de Thermus sp. Revista MVZ Córdoba. 8 (2): 310-317. [ Links ]
Sivaramakrishnan, S., Gangadharan, D., Nampoothiri, K. M., Soccol, C. R., Pandey, A. (2006). a-Amylases from microbial sources-an overview on recent developments. Food. Technol. Biotechnol. 44 (2): 173-184. [ Links ]
Sodhi, H. K., Sharma, K., Gupta, J. K., Soni, S. K. (2005). Production of a thermostable a-amylase from Bacillus sp. PS-7 by solid state fermentation and its synergistic use in the hydrolysis of malt starch for alcohol production. Process. Biochem. 40 (2): 525-534. doi: 10.1016/j.procbio.2003.10.008 [ Links ]
Tahir, R., Ellis, P. R., Butterworth, P. J. (2010). The relation of physical properties of native starch granules to the kinetics of amylolysis catalysed by porcine pancreatic a-amylase. Carbohyd. Polym. 81 (1): 57-62. doi: 10.1016/j.carbpol.2010.01.055 [ Links ]
Tester, R. F., Qi, X., Karkalas, J. (2006). Hydrolysis of native starches with amylases. Animal. Feed. Sci. Tech. 130 (1-2): 39-54. doi: 10.1016/j.anifeedsci.2006.01.016 [ Links ]
Vanegas, I., Yepes, M., Duque, M. (2003). Búsqueda de cepas colombianas de levaduras productoras de xilitol. Facultad de Ciencias Agropecuarias. 28 (2): 27-32. [ Links ]
Vanegas, I. A., Yepes, M. d. S., Ruiz, O. S. (2004). Producción de xilitol a partir de levaduras nativas colombianas. Rev. Colomb. Biotecnol. 6 (2): 31-36. [ Links ]
Villalba, P., Bula, A., Juan, H. S., Ávila, A. (2008). Yucca (Manihot esculenta Crantz) starch polysaccharide dextrination through biological procedures. Interciencia. 33 (4): 314-316. [ Links ]
Wani, A. A., Singh, P., Shah, M. A., Schweiggert-Weisz, U., Gul, K., Wani, I. A. (2012). Rice starch diversity: Effects on structural, morphological, thermal, and physicochemical properties - A review. Compr. Rev. Food. Sci. F. 11 (5): 417-436. doi: 10.1111/j.1541-4337.2012.00193.x [ Links ]
Zamora, R. J. V., Perea, E. M., Murillo, W. (2013). Caracterización de almidón extraído de arroz de tercera de las variedades Índica y Fedearroz 60.Tumbaga. 2 (8): 1. [ Links ]
Zhou, Y., Hoover, R., Liu, Q. (2004). Relationship between a-amylase degradation and the structure and physico-chemical properties of legume starches. Carbohyd. Polym. 57 (3): 299-317. [ Links ]













