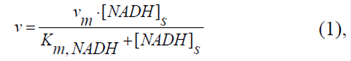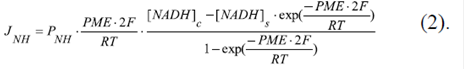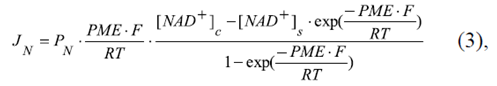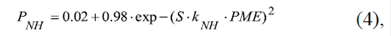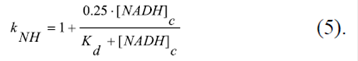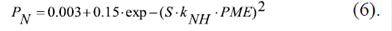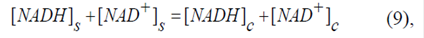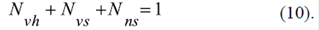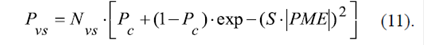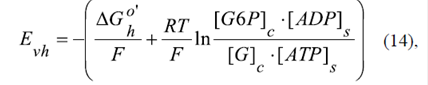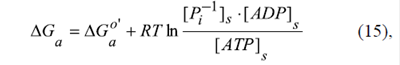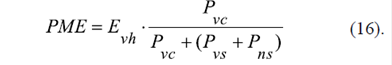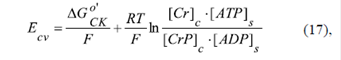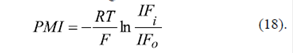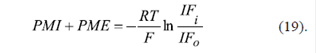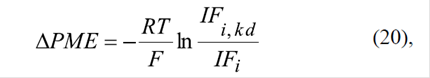Introducción
Las mitocondrias, organelas intracelulares formadas por dos membranas, desempeñan un papel fundamental en el metabolismo energético celular. El ATP se sintetiza en la matriz mitocondrial mediante el proceso de la fosforilación oxidativa en la membrana mitocondrial interna. En las mitocondrias de los cardiomiocitos, en las neuronas, en las células musculares y en otras, también se sintetiza el fosfato de creatina (CrP) a partir del ATP y de la creatina (Cr) (O’Gorman, et al., 1997). Para suministrar la energía al citosol, el ATP y el CrP producidos en las mitocondrias atraviesan la membrana mitocondrial externa en su forma aniónica. En varias demostraciones experimentales se ha visto cómo la membrana externa restringe significativamente el flujo entre las mitocondrias y el citosol de estos y otros metabolitos cargados (Vander Heiden, et al., 2000; Lemasters & Holmuhamedov, 2006; Rostovtseva & Bezrukov, 2012; Simson, et al., 2016).
La mayor parte de las proteínas de la membrana externa corresponde a las porinas de tipo VDAC (Mannella, 1982), a través de las cuales atraviesan los metabolitos cargados (Colombini, 1979, 2016). Se ha demostrado que el VDAC, con una compuerta sensible al voltaje, cambia su permeabilidad a los aniones en una forma dependiente del potencial eléctrico de la membrana (Colombini, et al., 1996; Rostovtseva & Colombini, 1997; Colombini & Mannella, 2012). Por ejemplo, el VDAC se cierra casi completamente para el ATP, con un potencial de membrana de unos 40 mV (positivo o negativo), aunque sigue siendo permeable a los cationes (Benz, et al., 1990; Colombini, et al., 1996; Hodge & Colombini, 1997).
Sin embargo, varios autores han descartado la posibilidad del control eléctrico del metabolismo energético mitocondrial y celular a nivel de la membrana externa (Benz, et al., 1990; Lemasters & Holmuhamedov, 2006). Tampoco se han propuestos otros mecanismos para explicar la generación del potencial de la membrana externa, excepto el equilibrio de Donnan (Liu & Colombini, 1992).
En la actualidad el concepto más aceptado para la regulación de la permeabilidad de la membrana externa es el “taponamiento” molecular de los VDAC, especialmente con la tubulina y otras proteínas mitocondriales o citosólicas (Liu & Colombini, 1992; Kmita, et al., 2003; Rostovtseva & Bezrukov, 2012; Rostovtseva, et al., 2015). En el más reciente ejemplo, hasta 98 % de los VDAC en la membrana externa de los cardiomiocitos podría verse taponado por la tubulina y el retículo sarcoplasmático muy cercano a las mitocondrias (Simson, et al., 2016). Sin embargo, los datos experimentales obtenidos en el estudio de Simson, et al. (2016) no descartan que el “taponamiento” solo de una parte de los VDAC favorezca la generación del potencial de la membrana externa y la modulación eléctrica de su permeabilidad frente a varios metabolitos cargados de una manera dependiente del metabolismo energético (Lemeshko, 2014, 2016, 2017a), lo cual también facilita la unión dependiente del potencial de la tubulina con el VDAC (Rostovtseva & Bezrukov, 2012; Rostovtseva, et al. , 2017).
Por otro lado, se ha reportado un potencial eléctrico de hasta -43 mV relacionado con la membrana externa en células vivas (Porcelli, et al., 2005). Según el análisis teórico (Lemeshko, 2006), se puede suponer que el potencial superficial de la membrana interna de las mitocondrias energizadas pudo haber interferido significativamente en los resultados reportados.
Como alternativa a la regulación de la permeabilidad de la membrana externa mediante el “taponamiento” molecular de los VDAC, se han propuesto varios mecanismos de generación del potencial de la membrana externa (Lemeshko, 2002, 2006, 2014-2017b).
En este estudio se proponen varios mecanismos de generación del potencial de la membrana externa con base en las evaluaciones termodinámicas en los modelos computacionales desarrollados. Se halló que para algunas condiciones fisiológicas, el potencial de la membrana externa puede alcanzar niveles suficientemente elevados para generar el cierre eléctrico de los VDAC en la membrana externa. Se describen dos tipos de mecanismos de generación del potencial: mediante la difusión simple de los metabolitos negativamente cargados a través de la membrana externa, y la transferencia activa del grupo fosforilo a través de esta o de las dos membranas mitocondriales. Asimismo, se evidencia el posible papel fisiológico y patofisiológico del potencial de la membrana externa, lo cual explicaría, por ejemplo, el mecanismo de los efectos de Crabtree y Warburg, y la protección de las células frente a la muerte debida a niveles tóxicos de calcio.
Generación del potencial de la membrana mitocondrial externa mediante la diferencia de su permeabilidad frente a varios metabolitos cargados
Generación del potencial de la membrana externa mitocondrial mediante la circulación de varios compuestos fosforilados. Las primeras evaluaciones termodinámicas de la generación del potencial de la membrana externa mediante la circulación de metabolitos cargados, con distintos grados de permeabilidad, se hicieron para el modelo con flujos estacionarios del CrP, del fosfato inorgánico y de la creatina (Cr), sin contar con la posible contribución del potencial del equilibrio de Donnan, o contando con ella (Lemeshko & Lemeshko, 2000). Se ha demostrado que la magnitud del potencial de la membrana externa calculado, con valores de hasta -5 mV (sin la contribución adicional del potencial de Donnan) y de -10 mV (con la contribución adicional del potencial de Donnan), depende de la intensidad del flujo metabólico.
En el caso más general (Lemeshko, 2017a), que incluye también la circulación de otros compuestos fosforilados, como el ATP, el adenosín difosfato (ADP) y el adenosín monofosfato (AMP), se puede desarrollar un modelo computacional más complejo que tenga en cuenta las características cinéticas de todas las enzimas y transportadores involucrados en el proceso estacionario, las características voltampéricas de los VDAC en la membrana externa y las concentraciones de varios metabolitos, aplicando la ecuación de Goldman para cada flujo metabólico a través de la membrana externa. En general, el valor y el signo del potencial final de la membrana externa debe ser el resultado de la superposición de los potenciales eléctricos generados mediante distintos mecanismos en los cuales el VDAC y la membrana externa representan los elementos cruciales en el control del metabolismo energético celular.
Los metabolitos activos de reacciones de reducción oxidación (redox) de carga negativa, también pueden atravesar la membrana externa y entregar electrones directamente a la cadena respiratoria desde el espacio entre las membranas mitocondriales. En varios casos particulares, como las mitocondrias de plantas (Earnshaw, 1975) y levaduras (Ohnishi, et al., 1966; Rigoulet, et al., 2004), los nucleótidos reducidos de piridina, el NADH o el NADPH producidos en el citosol, la oxidación se da por la vía externa mitocondrial atravesando la membrana.
Modelo de generación del potencial de la membrana mitocondrial externa mediante la circulación de los nucleótidos de piridina, NADH y NAD+ a través de la membrana. En la levadura S. cerevisiae, el NADH que se produce en exceso en el citosol se oxida en la superficie de la membrana interna por acción de la deshidrogenasa externa (DHe), y entrega electrones a la cadena respiratoria (Luttik, et al., 1998; Bakker, et al., 2001; Vazeille, et al., 2004). El NAD+ que se acumula en el espacio entre las membranas mitocondriales vuelve al citosol atravesando la membrana externa para recuperar el NADH. De esta manera, la circulación de los nucleótidos de piridina (Figura 1A) con distintas cargas netas, NADH(2-) y NAD+(1-), puede llevar a la generación del potencial de la membrana externa (Lemeshko, 2017b). Suponiendo, con base en algunos datos indirectos (Rostovtseva, et al., 2002; Lemeshko, 2017b), que la permeabilidad del VDAC para el NADH(2-) es más alta que para el NAD+(1-), el potencial de la membrana externa calculado es negativo (Lemeshko, 2017b). Se sabe, asimismo, que la actividad de la DHe se incrementa significativamente con los iones de calcio (Earnshaw, 1975) (Figura 1A).
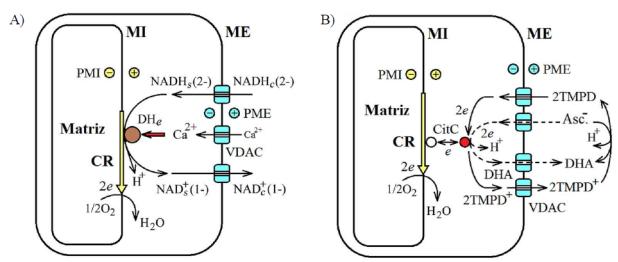
Figura 1 A. Oxidación del NADH en mitocondrias de levaduras y de plantas. B. Oxidación del ascorbato en mitocondrias intactas. MI: membrana interna; ME: membrana externa; CR: cadena respiratoria; DHe: NADH deshidrogenasa externa de la membrana interna; CitC: citocromo C; Asc-.: ascorbato; DHA: dehidroascorbato; TMPD: N,N,N’N’-tetrametil p-fenilendiamina
Sin embargo, la generación del potencial de la membrana externa en las mitocondrias de levaduras nunca se ha demostrado experimentalmente. Además, las restricciones de la permeabilidad observadas en la membrana externa para los metabolitos cargados en estas células, se han explicado por el “taponamiento” de los VDAC con las proteínas citosólicas (Kmita, et al. , 2003). Las evaluaciones termodinámicas del potencial de la membrana externa que podría generarse con la circulación del NADH(2-) y el NAD+(1-) a través de la membrana externa, demuestran que, según el modelo propuesto, la magnitud de dicho potencial, (Figura 1A) puede alcanzar niveles suficientes para el cierre eléctrico del VDAC (Lemeshko, 2017b).
Para mostrar el principio de generación del potencial de la membrana externa mediante la oxidación directa del NADH externo en las mitocondrias, se describió el proceso estacionario (Figura 1A) con un modelo computacional. La actividad de la DHe, que cataliza la reacción irreversible de la oxidación del NADH, se expresó con la ecuación:
donde vm es la actividad máxima de la DHe de la membrana interna; [NADH]s es la concentración del NADH en el espacio entre las membranas mitocondriales; Km,NADH es la constante de Michaelis-Menten, correspondiente a 50 μM NADH (Rigoulet, et al ., 2004). Las velocidades vm y v, como también los flujos metabólicos de NADH y NAD+ a través de la membrana externa, se presentan en unidades arbitrarias relativas.
El flujo de NADH (2-) a través de la membrana externa (JNH) se describió con la ecuación de Goldman:
Aquí, P NH es la permeabilidad de la membrana externa al NADH(2-) a través de los VDAC; F es la constante de Faraday; R es la constante universal de los gases; T=298 K es la temperatura del medio, y [NADH]c y [NADH]s son las concentraciones de NADH en el citosol y en el espacio entre las membranas mitocondriales, respectivamente.
De la misma manera se puede expresar el flujo de NAD+(1-) a través de la membrana externa:
donde PN es la permeabilidad de la membrana externa al NAD+(1-) a través de los VDAC, y [NAD+]c y [NAD+]s son las concentraciones de NAD+ en el citosol y en el espacio entre las membranas mitocondriales, respectivamente.
La permeabilidad PNH de la membrana externa al NADH(2-) a través de los VDAC (Figura 1A) en función de su potencial, se describió con la siguiente ecuación (Lemeshko, 2017b):
donde S es un parámetro de la sensibilidad del VDAC al voltaje tomado a S=40
V-1. El factor k NH describe la modulación de la sensibilidad eléctrica del VDAC por su interacción directa con el NADH (Zizi, et al ., 1994). Este factor se puede expresar con la ecuación:
Aquí, [NADH]c es la concentración del NADH en el citosol, y K d es igual a 16 μM NADH (Zizi, et al., 1994).
La permeabilidad P N de la membrana externa al NAD+ en función del potencial se presenta de la misma manera que la del NADH, para cuyo cálculo se tomó un valor absoluto de la permeabilidad de la membrana externa 6,5 veces menor que para el NADH (Lemeshko, 2017b):
En el estado estacionario, los flujos de NADH y NAD+ deben ser iguales a la actividad de la DHe de la membrana interna (Figura 1A), es decir:
Se debe cumplir también la ecuación de balance de masas:
donde [NADH]s y [NAD+]s corresponden a las concentraciones en el espacio entre las membranas mitocondriales, y [NADH]c y [NAD+]c a las concentraciones en el citosol. La ecuación (9) del sistema de ecuaciones (1) (2) (3) (4) (5) (6) (7) (8) (9) permite definir la concentración del NADH adicionado en ausencia del NAD+ adicionado o, también, presentar el [NADH]c como si fuera NADH producido por alguna deshidrogenasa extramitocondrial a partir de cierta cantidad del NAD+ adicionado a la concentración inicial de [NAD+]c =1,5 mM.
Se supone que el estado estacionario se establece iniciando la actividad de la DHe de la membrana interna desde el estado de equilibrio del sistema con las concentraciones de [NADH]c y [NAD+]c definidas según la ecuación (9).
El sistema de ecuaciones (1), (2), (3), (4), (5), (6), (7), (8) y (9) se resolvió usando el programa Mathcad Professional.
En la Figura 2A se muestran los resultados de las evaluaciones del potencial de la membrana externa generado por la circulación de NADH(2 )/NAD+(1-) a través de esta (Figura 1A) para el caso del NADH adicionado a la suspensión de mitocondrias de levadura S. cerevisiae sin adición de NAD+. Dicho potencial está expresado en función de la concentración de [NADH]c en el medio exterior y de la actividad máxima de la deshidrogenasa DHe de la membrana interna. El potencial de la membrana externa calculado alcanza hasta -30 mV, y según las ecuaciones (4), (5) y (6), su signo negativo se debe a una supuesta mayor permeabilidad del VDAC al NADH(2-) en comparación con el NAD+(1-) (Lemeshko, 2017b).
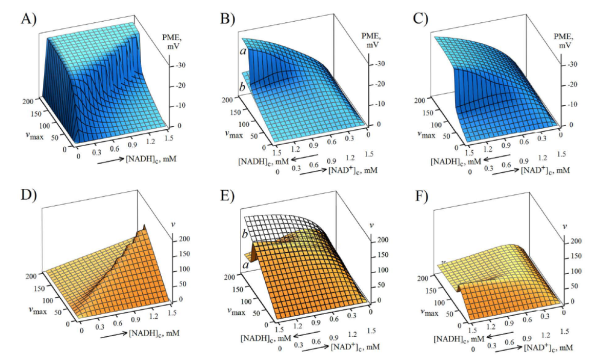
Figura 2 Evaluación del potencial de la membrana externa (A-C) y del flujo metabólico de NADH(2-)/NAD+(1-) a través de la membrana externa (D-F) para varias condiciones del modelo (Figura 1A). A,D: en función de la concentración del NADH adicionado, y en ausencia de NAD+; B,C,E,F: en función del NADH producido en la concentración [NADH] a partir de una fracción de 1,5 mM de NAD+ adicionado; A,B(a),C,D,E(a),F: S=40 V-1; B(b),E(b) - S=0 V-1; C,F: knockdown o inhibición de 50 % de los VDAC de la membrana externa, en comparación con B(a),E(a).
Los cálculos demuestran una restricción significativa del flujo metabólico (v) (Figura 2D) en el rango de valores relativamente altos de la velocidad máxima de la DHe. Debe señalarse que el efecto de la restricción en estas condiciones se debe al cierre eléctrico de los VDAC de la membrana externa, porque no se observa restricción a la sensibilidad eléctrica nula del VDAC, S=0 V-1 (Lemeshko, 2017b).
En experimentos con los esferoplastos permeabilizados de S. cerevisiae, se ha visto que la velocidad de oxidación del NADH producido por las deshidrogenasas citosólicas, o por la externa, es mucho más alta que la del NADH adicionado (Avéret, et al., 2002). Es muy importante resaltar que para la producción del NADH por las deshidrogenasas en estos experimentos el medio de incubación contenía 1-2 mM de NAD+, lo que según las ecuaciones (3), (6) y (9), debería afectar la generación del potencial de la membrana externa y el flujo metabólico a través de esta.
Los cálculos realizados con distintas concentraciones [NADH]c del NADH producido en el medio extramitocondrial a partir de 1,5 mM de NAD+ en reemplazo de parte del NAD+ adicionado, también evidenciaron un mayor flujo metabólico (Figura 2E,a), aunque todavía restringido para el rango de valores relativamente altos de ambos, así como de la actividad máxima de la DHe y de la relación [NADH]c/[NAD+]c (Figura 2E,a). Para este rango, el potencial de la membrana externa generado es de mayor magnitud (Figura 2B, a).
La restricción metabólica mencionada se debe al cierre eléctrico del VDAC, ya que ésta no se observó esencialmente en el caso de la sensibilidad nula del VDAC al voltaje cuando S=0 V-1 (Figura 2E, b), y los valores calculados del potencial de la membrana externa fueron relativamente bajos (Figura 2B, b).
Se sabe, asimismo, que la permeabilidad de la membrana externa de las mitocondrias de levaduras puede verse restringida por las interacciones de los VDAC de la membrana con las proteínas citosólicas (Kmita, et al., 2003), o por la deficiencia de los VDAC en esta (Avéret, et al., 2002; Kmita, et al., 2003). Para evaluar la influencia del knockdown o de la inhibición en 50 % de los VDAC de la membrana externa, el modelo se analizó con el sistema de ecuaciones (1), (2), (3), (4), (5), (6), (7), (8) y (9), multiplicando la parte derecha de las ecuaciones (4) y (6) por el factor 0,5 (50 % de knockdown). El análisis del modelo con dicho factor evidenció una restricción del flujo metabólico (v) aún mayor (Figura 2, F en comparación con E, a) debido a la generación del potencial de la membrana externa en magnitudes altas (Figura 2, C en comparación con B, a).
La deshidrogenasa DHe de la membrana interna de las mitocondrias de plantas y levaduras se activa significativamente con el Ca2+ (Earnshaw, 1975). Se ha demostrado que la adición de 3 mM de EGTA dos a tres minutos después de la adición de 1 mM de NADH a la suspensión de mitocondrias de maíz causa una leve inhibición de la respiración, mientras que la adición de 3 mM de EGTA antes del NADH la inhibe por lo menos en 60-70 %.
Estos datos experimentales (Earnshaw, 1975) se pueden explicar con base en el modelo de generación del potencial de la membrana externa por la circulación de NADH(2-)/ NAD+(1-) a través de la membrana. Con el potencial negativo que se genera durante la oxidación del NADH (Figura 1A), el calcio del medio de incubación es capturado hacia el espacio entre las membranas mitocondriales y se mantiene allí en una concentración elevada, suficiente para mantener una gran actividad de la deshidrogenasa DHe de la membrana interna. Pero si el EGTA se agrega primero, la oxidación lenta del NADH generaría un potencial de la membrana externa de poco valor, el cual no es suficiente para mantener el Ca2+ cerca de la DHe en la concentración necesaria para la activación de esta enzima.
Lo más importante es que el modelo (Figura 1A) permite explicar también la inhibición de la respiración de la levadura S. cerevisiae con concentraciones altas de glucosa como un efecto de la supresión eléctrica del metabolismo mitocondrial en estas células (Lemeshko, 2017b; Díaz-Ruiz, et al., 2011).
Otro fenómeno bien conocido es que el ascorbato no se oxida en mitocondrias intactas, aunque el VDAC en su estado abierto debería ser permeable a este anión orgánico natural dependiendo de su tamaño y carga negativa. La oxidación del ascorbato se activa muy significativamente con el TMPD+ (Figura 1B). Como hipótesis, se puede suponer que el ascorbato, al oxidarse por acción del citocromo C en el espacio entre las membranas mitocondriales y producir dehidroascorbato (DHA) neutro, lleva a la generación del potencial negativo de la membrana externa de un modo similar a la oxidación del NADH externo (Figura 1A). Así, la inhibición de la oxidación del ascorbato podría explicarse por el mecanismo de retroalimentación negativa, o sea, por la generación de potencial negativo de la membrana externa y el cierre eléctrico del VDAC. En el caso de la presencia adicional de TMPD+, éste es reducido por el ascorbato en el medio exterior y luego circula a través de la membrana externa en sus formas neutra y positiva (Figura 1B), ya que el VDAC eléctricamente cerrado no restringe el paso de los cationes de este tamaño.
Generación del potencial de la membrana mitocondrial externa mediante la transferencia activa del grupo fosforilo a través de las membranas
Se conocen distintos mecanismos de transferencia del grupo fosforilo a través de la membrana externa mitocondrial (Brdiczka, et al., 2006). Uno de estos es el intercambio de ATP y ADP a través de los sitios de contacto entre las dos membranas mitocondriales formados por el antiportador ATP/ADP (ANT) de la membrana interna y el VDAC de la membrana externa (Figura 3A). Un segundo mecanismo se da por la acción de la enzima hexocinasa (HK), la cual forma un complejo con el VDAC (Figura 3B), o con el dúo ANT- VDAC (Figura 3C), y hace la transferencia del grupo fosforilo del ATP mitocondrial a la glucosa del citosol formando la glucosa-6-fosfato (G6P1-) externa (Wilson, 1997; Lemeshko, 2002, 2014, 2017a). El tercer mecanismo se basa en la participación de la creatina cinasa, la cual forma un complejo con el VDAC sin el ANT (Figura 3D) o con el ANT de la membrana interna (Figura 3E), transfiriendo el grupo fosforilo del ATP mitocondrial a la creatina citosólica, Cr, y produciendo el fosfato de creatina (CrP1-), o viceversa (Lemeshko, 2016, 2017a). Las mismas posibilidades existen para otras cinasas.
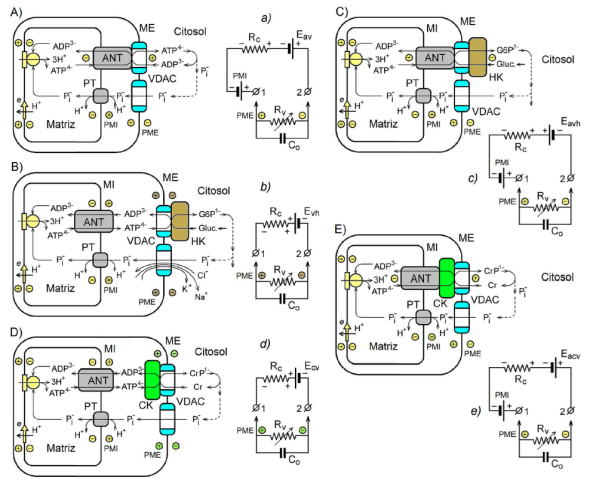
Figura 3 Posibles mecanismos de generación del potencial de la membrana externa mediante la transferencia activa del grupo fosforilo a través de las membranas mitocondriales (A-E), y los respectivos circuitos eléctricos equivalentes (a-e). A,a: mediante los sitios de contacto entre las membranas mitocondriales de tipo ANT-VDAC; B,b: mediante el complejo VDAC-HK; C,c: mediante los complejos ANT-VDAC- HK; D,d: mediante el complejo CK-VDAC; E,e: mediante los complejos ANT-CK-VDAC; MI: membrana interna; ME: membrana externa
La transferencia del grupo fosforilo al citosol en el estado estacionario del sistema, se acompaña con el regreso del fosfato inorgánico (Pi 1-) desde el citosol a través de los VDAC libres de la membrana externa para recuperar el ATP en la matriz mitocondrial. Los modelos mencionados se pueden presentar con circuitos eléctricos equivalentes (Lemeshko, 2002, 2014, 2016, 2017a, 2017b), como se muestra en la Figura 3, A-E.
Generación del potencial de la membrana externa mediante los complejos VDAC-HK. En las células cancerígenas, una gran cantidad de la hexocinasa (HK) está unida a la membrana externa mitocondrial y forma hasta 300 veces más complejos VDAC-HK que en las mitocondrias de las células normales (Marín-Hernández, et al., 2006; John, et al., 2011), con lo cual se lograría tener acceso preferente al ATP producido por las mitocondrias y facilitar el inicio de la glucólisis. Por otro lado, los complejos VDAC-HK, al transferir grupos fosforilo a través de la membrana externa, deben generar directamente su potencial (Lemeshko, 2002, 2014), el cual, a su vez, podría controlar eléctricamente la permeabilidad de la membrana externa a varios metabolitos cargados.
Se consideró un modelo computacional simplificado para el análisis termodinámico de este mecanismo de generación del potencial de la membrana externa (Figura 3B, b) en cuyo marco la totalidad de los VDAC en dicha membrana se presenta como la suma de varias fracciones: la fracción N vh de los VDAC que forman complejos con la hexocinasa (VDAC-HK), la fracción N vs de los VDAC libres sensibles al voltaje, y la fracción N ns de los VDAC libres que no son sensibles al voltaje.
La fracción N ns actúa como la fracción de la isoforma VDAC3, poco sensible al voltaje, y puede representar hasta el 10 % de todos los VDAC (Maldonado, et al., 2013). La cantidad total de los VDAC se normaliza a 1:
La permeabilidad P vs de la membrana externa al fosfato inorgánico Pi a través de la fracción N vs de los VDAC sensibles al voltaje, se presenta en función del potencial de la membrana externa (Lemeshko, 2014):
En esta ecuación S es el parámetro de la sensibilidad del VDAC al voltaje, tomado a S=40 V-1. El parámetro P c es la permeabilidad de los VDAC eléctricamente cerrados. Para los cálculos en este modelo se tomó un valor de P c =0,25.
La permeabilidad P vh de la fracción N vh de los VDAC que forman los complejos VDAC-HK, y la permeabilidad de la fracción P ns de la fracción N ns de los VDAC no sensibles al voltaje se presentan con las ecuaciones (12) y (13), respectivamente:
Así, las resistencias R c y R v en la Figura 3, b están dadas por R c =1/P vh y R v =1/(P vs +P ns ).
El complejo electrogénico VDAC-HK, que transfiere activamente el grupo fosforilo a través de la membrana externa, se puede considerar como una batería biológica, alimentada por la energía libre de Gibbs de la reacción de la hexocinasa (Lemeshko, 2014). El voltaje E vh generado por esta batería se presenta como:
donde ∆G h 0´ = -16,7 kJ/mol es la energía libre de Gibbs estándar de la reacción de la hexocinasa; [ATP]s y [ADP]s son las concentraciones del ATP y el ADP en el espacio entre las membranas mitocondriales, respectivamente; [G]c y [G6P]c son las concentraciones de glucosa y glucosa- 6-fosfato en el citosol; F es la constante de Faraday; R es la constante universal de los gases, y T=298 K es la temperatura del medio. Para los cálculos, la relación [G]c / [G6P]c se cambia en un rango amplio, de 1 a 100. Teniendo en cuenta que en condiciones fisiológicas [G6P]c =0,1 mM, aproximadamente, este rango corresponde a cambios de concentración de la glucosa de hasta 10 mM.
La relación [ATP]s /[ADP]s se define por la energía libre de Gibbs de la hidrólisis del ATP, ΔGa, la cual se mantiene por el proceso de la fosforilación oxidativa en las mitocondrias:
donde ΔGa o’ = -31 kJ/mol es la energía libre de Gibbs estándar para la reacción de la hidrólisis del ATP. Se sabe que para las células vivas en estado de reposo, ΔGa es igual a -61 kJ/mol, aproximadamente (Pinz, et al., 2008). Se consideró que la concentración del fosfato inorgánico para los cálculos era fija: [Pi -1]s =5 mM.
La circulación del grupo fosforilo, promovido por la energía libre de Gibbs de la reacción de la hexocinasa del complejo VDAC-HK, con el regreso del fosfato inorgánico al espacio entre las membranas mitocondriales, se puede presentar como la corriente eléctrica causada por el voltaje E vh . El valor de E vh depende del estado energético definido por las ecuaciones (14) y (15). Según la ley de Ohm, el potencial de la membrana externa generado se puede presentar como la caída de voltaje sobre la resistencia R v (Figura 3, b):
El sistema de ecuaciones (10), (11), (12), (13), (14), (15) y (16) se resolvió para distintas fracciones N vh de los VDAC que forman complejos VDAC-HK y para distintas concentraciones de la glucosa (de la relación [G]c /[G6P]c ), suponiendo que el potencial de fosforilación de las mitocondrias era fijo, ΔGa =-61 kJ/mol (ecuación 15).
En este caso simplificado, se considera que en todo el rango de las concentraciones de glucosa (relaciones [G]c / [G6P]c usadas para los cálculos), la actividad de la hexocinasa del complejo VDAC-HK no es un factor limitante para la transferencia del grupo fosforilo a través del complejo. Los cálculos demuestran (Figura 4) un comportamiento del modelo similar al caso en el que se consideraban también las características cinéticas de la HK (Lemeshko, 2014).
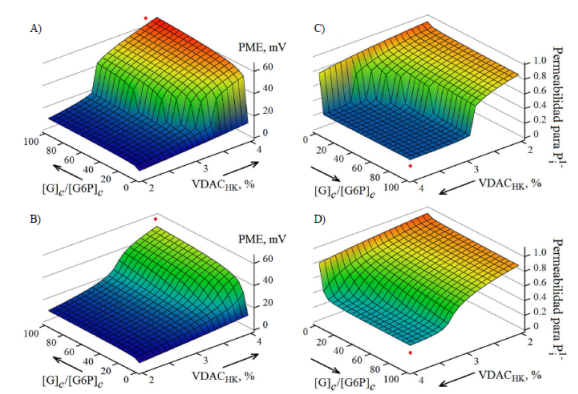
Figura 4 Evaluación computacional de los cambios del potencial de la membrana externa (A,B) y de la permeabilidad de la membrana externa al fosfato inorgánico (C,D) en función de la concentración de glucosa (de la relación [G]c /[G6P]c ) y del porcentaje de los VDAC que forman los complejos VDAC-HK en ausencia (A,C) y presencia de 10 % de los VDAC no sensibles al voltaje (B,D) en la membrana externa. S=40 V-1. Los puntos rojos indican que el potencial de mayor magnitud provoca un cambio más significativo de la permeabilidad de la membrana externa al fosfato inorgánico.
En ausencia de los VDAC no sensibles al voltaje, N ns =0, el valor del potencial de la membrana externa calculado según las ecuaciones (10), (11), (12), (13), (14), (15) y (16) depende del porcentaje de los complejos VDAC-HK (del VDACHK,%=N vh .100 %), y alcanza valores de más de 60 mV (Figura 4A). Según el modelo, la generación del potencial debe causar una profunda restricción de la permeabilidad de la membrana externa al fosfato inorgánico (Figura 4C), restringiendo de esta manera todo el flujo metabólico.
En el modelo se evidencia otro fenómeno interesante, un cambio brusco del potencial de la membrana externa y de su permeabilidad en función de la concentración de glucosa (de la relación [G]c /[G6P]c ) si el porcentaje de los VDAC que forman los complejos VDAC-HK es superior a 3 % (VDACHK >3 %) (Figura 4A, C).
Estos cambios del potencial y del flujo metabólico no fueron tan bruscos en presencia de los VDAC no sensibles al voltaje, a N ns =0,1 (10 %) (Figura 4B, D). Aunque los valores del potencial calculado para este caso son relativamente bajos (Figura 4B), la modulación eléctrica del flujo metabólico a través de la membrana externa puede ser todavía significativa (Figura 4D).
La generación del potencial de la membrana externa también sería posible con la contribución adicional del potencial de la membrana mitocondrial interna, cuando este se aplica a la membrana externa a través del complejo triple ANT-VDAC- HK (Figura 3C) o, incluso, solamente a través del complejo ANT-VDAC (Figura 3A) (Lemeshko, 2002, 2017a).
En la Figura 5 se comparan los mecanismos más simples de generación del potencial negativo de la membrana externa y del positivo. Según el análisis termodinámico (Figura 2, A-C), es de esperarse la generación del potencial negativo mediante la circulación de los nucleótidos de piridina, NADH(2-)/NAD+(1-), a través de la membrana externa (mecanismo del tipo de las levaduras) (Lemeshko, 2017b). El potencial positivo (Figura 4, A,B) debe ser generado directamente por los complejos VDAC-HK (mecanismo del tipo del cáncer) (Lemeshko, 2002, 2014). Con los dos mecanismos cabe esperar un incremento significativo de los valores del potencial de la membrana externa en concentraciones altas de glucosa en el citosol, con la posibilidad de la supresión eléctrica de la respiración de las mitocondrias debido al potencial generado (Lemeshko, 2002, 2014, 2015, 2017a, 2017b). La supresión de la respiración debida a los altos niveles de glucosa se conoce como efecto de Crabtree, pero no se sabe todavía si los procesos celulares responsables de esta inhibición (que es muy rápida, ocurre en segundos), son los mismos, o similares, para levaduras y las células cancerígenas (Hagman, et al., 2014; Pfeiffer & Morley, 2014; Hammad, et al., 2016).
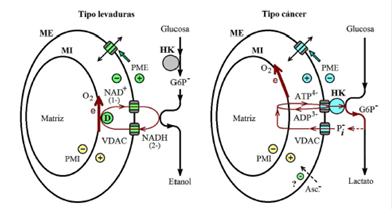
Figura 5 Posibles mecanismos de la supresión eléctrica de la respiración de las células mediante la generación del potencial negativo de la membrana externa acoplada a la circulación de NADH(2-)/NAD+(1-) a través de esta en la levadura S. cerevisiae, o mediante la generación del potencial positivo acoplada a la transferencia del grupo fosforilo a través de los complejos VDAC-HK de la membrana externa en células cancerígenas. Asc-.: se muestra que la oxidación del ascorbato en las mitocondrias de células cancerígenas podría causar una disminución del potencial positivo de la membrana externa generado por los complejos VDAC-HK.
En estudios recientes se ha confirmado el efecto anticancerígeno del ácido ascórbico en concentraciones altas (Sen, et al., 2017; Xia, et al., 2017; Mastrangelo, et al., 2017), aunque el mecanismo no es todavía claro. No se descarta que ello se deba a la tendencia a generar potencial negativo de la membrana externa por la oxidación de ascorbato, como se muestra en la Figura 1B. De esta manera, la superposición de dos potenciales, el negativo, generado por la oxidación de ascorbato, y el positivo, generado por los complejos VDAC-HK (Figura 5), podría resultar en una disminución o incluso la cancelación de la supresión eléctrica de la respiración de las células cancerígenas con los consecuentes efectos anti-Crabtree, anti-Warburg y, en general, anticancerígenos.
Generación del potencial de la membrana externa mediante los complejos CK-VDAC. En los cardiomiocitos, el ATP mitocondrial se usa para la producción del CrP a partir de la creatina. En el espacio entre las membranas mitocondriales la enzima creatina cinasa (CK) se encuentra unida a los VDAC, formando los complejos CK-VDAC (Figura 3D) y los ANT-CK-VDAC (Figura 3E).
En los cardiomiocitos y otras células, el intercambio rápido de fosfato de creatina con carga negativa y de creatina neutra entre las mitocondrias y los sarcómeros es primordial para la disminución de la resistencia de la ruta de suministro de energía durante la fase sistólica (Wallimann, et al., 2011; Simson, et al., 2016). La resistencia metabólica de esta ruta citosólica del intercambio CrP1-/Cr es mucho menor que la del intercambio por la electro-difusión del ATP4- y ADP3-, sobre todo en concentraciones bajas de ADP3- en el citosol (Wallimann, et al., 2011). Por otro lado, el flujo de los grupos fosforilo a través de los complejos CK- VDAC (Figura 3D, d) puede causar la generación directa del potencial de la membrana externa, con el cierre de los VDAC libres sensibles al voltaje, y, finalmente, llevar a una restricción de la permeabilidad de la membrana externa a los metabolitos cargados (Lemeshko, 2016) mediante el mecanismo de control de realimentación negativa (Lemeshko, 2017a).
En el modelo CK-VDAC, la fuente para la generación del potencial de la membrana externa es la batería E cv (Figura 3D, d), alimentada por la energía libre de Gibbs de la reacción de la creatina cinasa del mismo complejo:
donde ΔGCK o’ = -12,7 kJ/mol es la energía libre de Gibbs estándar de la reacción de la creatina cinasa; [Cr]c /[CrP]c es la relación de las concentraciones de creatina y fosfato de creatina en el citosol; [ATP]s /[ADP]s es la relación de las concentraciones de ATP y ADP en el espacio entre las membranas mitocondriales; F es la constante de Faraday; R es la constante universal de los gases, y T = 298 K es la temperatura del medio.
En este caso, el análisis termodinámico del modelo CK-VDAC (Figura 3C) se hizo usando el sistema de ecuaciones, incluida la ecuación (17) (Lemeshko, 2016), y teniendo en cuenta las características cinéticas de la enzima CK, con K m,Cr =10 mM. Para las evaluaciones se tomó la concentración total [Cr]+[CrP]=25 mM, y la relación [ATP]s /[ADP]s =500 o [ATP]s /[ADP]s=50.
Los cálculos del modelo CK-VDAC en función de la concentración de creatina en el citosol, inmediatamente cercana de la membrana externa, demuestran la posibilidad de generar un potencial de la membrana externa relativamente alto (Figura 6A,B), para controlar la permeabilidad de los VDAC de dicha membrana. El nivel de la creatina, en el rango conocido de los cambios de la relación [Cr]/([Cr]+ [CrP]) durante las fases de sístole y diástole del corazón (Lemeshko, 2016), se incrementa significativamente durante la fase sistólica debido al uso intensivo del CrP para recuperar localmente el ATP hidrolizado en los sarcómeros.
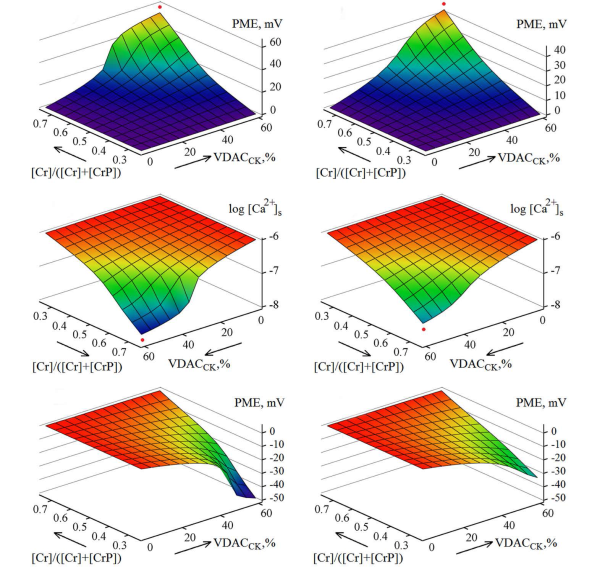
Figura 6 Evaluación computacional del potencial de la membrana externa (A,B,E,F) y del nivel relativo de Ca2+ en el espacio entre las membranas mitocondriales (C,D) en función de la concentración de la creatina (de la relación [Cr]/([Cr]+[CrP])) y del porcentaje de los VDAC que forman los complejos CK-VDAC. Se supone que en el medio exterior se tiene 1 μM de Ca2+; B,D,F: con 10 % de los VDAC no sensibles al voltaje; S=40 V-1; [Cr]+[CrP]=25 mM; A-D: [ATP]s /[ADP]s =500 (ΔGa =-61 kJ/mol); E,F: [ATP]s /[ADP]s =50 (ΔGa =-54 kJ/mol). Los puntos rojos indican que el potencial de la membrana externa de mayor magnitud lleva a un cambio más significativo del nivel de Ca2+ en el espacio entre las membranas mitocondriales.
En el caso de ausencia de los VDAC libres no sensible al voltaje en la membrana externa, el modelo demuestra una generación del potencial de hasta más de 50 mV (Figura 6A), tomando una permeabilidad de P c =0,1 al Pi -1 a través de los VDAC eléctricamente cerrados (Hodge & Colombini, 1997). El potencial de la membrana externa disminuye a valores de hasta 40 mV al considerar que 10 % de los VDAC en la membrana externa no son sensibles al voltaje (Figura 6B). Cabe resaltar que estos valores del potencial positivo se calcularon para el caso del potencial de fosforilación del ATP mitocondrial tomado a ΔGa = -61 kJ/mol (Pinz, et al., 2008).
Según las evaluaciones termodinámicas del modelo, el cambio del potencial de la membrana externa desde un valor de casi cero durante la diástole hasta más de 30 mV durante la sístole (Figura 6A, B), permite mantener la concentración de Ca2+ en el espacio entre las membranas mitocondriales a más de un orden de magnitud por debajo de su concentración en el sarcoplasma (Figura 6C, D). Esta función del potencial de mantener la concentración relativamente baja de Ca2+ en el espacio entre las membranas mitocondriales con respecto al citosol durante la sístole, parece ser importante para disminuir significativamente la velocidad de transporte de Ca2+ a la matriz mitocondrial y proteger de esta manera a las mitocondrias contra la apertura del poro de transición de permeabilidad mitocondrial (PTP).
Se sabe que la concentración de Ca2+ durante la sístole puede alcanzar hasta 1 μM en el sarcoplasma (Eisner, et al. , 2017), y hasta más de 10 μM en los microdominios entre las mitocondrias y el retículo sarcoplásmico adyacente (Rizzuto, et al. , 2012). En caso de que el potencial positivo de la membrana externa no se genere durante la sístole, la concentración de Ca2+ en el espacio entre las membranas mitocondriales debe alcanzar niveles de 1 a 10 μM. Con esto, el flujo de calcio a la matriz mitocondrial incrementaría por lo menos en un orden de magnitud, en comparación con el transporte durante la diástole, ya que la constante K m,Ca 2+ del transportador de Ca2+ en la membrana interna es de 5 a 10 μM (Carafolli, 2012). Aunque en la fase inicial de la sístole, cuando la relación [Cr]/([Cr]+[CrP]) y el potencial generado no alcanzan sus magnitudes máximas todavía (Figura 6A, B), la velocidad de acumulación de Ca2+ en las mitocondrias puede ser elevada. Por otro lado, la concentración estacionaria de Ca2+ en la matriz mitocondrial depende también de la capacidad del sistema de extrusión de Ca2+ desde la matriz mitocondrial, parte del cual es el antiportador Ca2+/Na+ de la membrana interna (Eisner, et al. , 2017).
El modelo también evidencia que en el caso de un potencial de fosforilación del ATP mitocondrial relativamente bajo (ecuación 15), del orden de ΔGa =-54 kJ/mol, o sea cuando la relación [ATP]s /[ADP]s equivale a 50 en vez de 500 en la ecuación (17), el potencial de la membrana externa calculado es negativo para la diástole, de (-30)-(-50) mV (Figura 6E, F), y llega a ser cero durante la sístole, debido al incremento del nivel de la creatina. Esto es indicativo del riesgo de la apertura del PTP por acción del Ca2+ sistólico, lo cual conlleva daños mitocondriales, cuando el potencial energético mitocondrial es relativamente bajo, como, por ejemplo, durante la hipoxia.
Para las mitocondrias de corazón y cerebro también se ha reportado la presencia de los complejos triples ANT- CK-VDAC, los cuales permiten transferir el grupo fosforilo desde el ATP de la matriz mitocondrial directamente a la creatina del citosol (Brdiczka, et al., 2006) a través de las dos membranas mitocondriales. El análisis termodinámico de este modelo (Figura 3E, e) ha mostrado que el potencial calculado, positivo o negativo, de la membrana externa depende del estado energético tanto del citosol como de las mitocondrias (Lemeshko, 2017a).
Observaciones experimentales a favor de la generación del potencial eléctrico de la membrana mitocondrial externa
Las restricciones significativas de los flujos de los metabolitos de carga negativa entre las mitocondrias y el citosol han sido reportadas por varios autores (Vander Heiden, et al., 2000; Lemasters & Holmuhamedov, 2006; Rostovtseva & Bezrukov, 2012; Simson, et al., 2016). Hasta el momento, la explicación más aceptada sobre el mecanismo de regulación de la permeabilidad de la membrana externa es el “taponamiento” molecular de los VDAC. Se supone que la generación del potencial de la membrana externa es imposible porque su permeabilidad es alta para iones pequeños, aunque se reconoce que la generación del potencial podría explicar varios casos de la supresión global de mitocondrias en células normales y cancerígenas (Lermasters & Holmuhamedov, 2006).
En este sentido, cabe resaltar que normalmente los iones de potasio, sodio y cloro no participan en procesos estacionarios en la membrana externa, y deben alcanzar su equilibrio electroquímico dependiendo del potencial de esta mantenido por un mecanismo estacionario (Figura 3) dependiente del metabolismo energético mitocondrial. Se puede considerar que el movimiento de los iones pequeños a través de la membrana externa (Figura 3B), o su escape, es el proceso de carga de un condensador electrolítico, Co , de dicha membrana (Figura 3B, b), causando un retraso en la generación del potencial. Para profundizar estos aspectos dinámicos, sobre todo en el caso de los cambios de las fases de diástole y sístole del corazón, se debe desarrollar un modelo más complejo, de tipo cinético.
La generación del potencial de la membrana externa puede afectar la monitorización experimental del potencial de la membrana interna con sondas iónicas fluorescentes, permeables a través de biomembranas. Hasta el momento, la posibilidad de la interferencia del potencial de la membrana externa, tan evidente en términos de la termodinámica (Figura 7), no se tiene en cuenta en varias aplicaciones de este método (Zorova, et al., 2017).
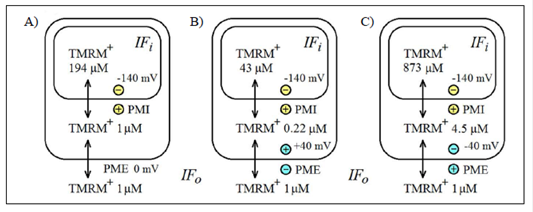
Figura 7 Posible influencia del potencial de la membrana externa (PME) sobre la acumulación de la sonda catiónica fluorescente TMRM+ en la matriz de las mitocondrias energizadas, con potencial fijo de la membrana interna (-140 mV). A: PME=0 mV; B: PME=+40 mV; C: PME=-40 mV
Sin embargo, se han reconocido ciertas dificultades para evaluar cuantitativamente el potencial de la membrana interna en células vivas (Lemasters & Ramshesh, 2007; Gerencser, et al., 2012), especialmente por la interferencia del potencial de la membrana plasmática con la monitorización en células vivas mediante microscopía óptica usando sondas iónicas de fluorescencia (Gerencser, et al., 2012).
Con el fin de evitar este problema, se ha propuesto medir la intensidad de la fluorescencia del catión permeable éster metílico de tetrametilrodamina (TMRM+) dentro de mitocondrias (IF i ) y en el espacio exterior de estas (IF o ) (Lemasters & Ramshesh, 2007), cuantificando el potencial de la membrana interna según la ecuación de Nernst:
Es muy obvio que la ecuación (18) es aplicable solamente cuando el potencial de la membrana externa es igual a cero (Figura 7A), y no así cuando es positivo (Figura 7B) o negativo (Figura 7C), ya que la concentración del catión TMRM+ en el espacio entre las membranas mitocondriales, con respecto a la de su medio externo, depende del signo y el valor de dicho potencial (Figura 7).
En general, cuando el potencial de la membrana externa es ≠0, se debería usar la ecuación de Nernst teniendo en cuenta ambos potenciales, el de la membrana interna y el de la externa:
Se ha demostrado que el knockdown de los VDAC1 y VDAC2 en células cancerígenas HepG2 lleva a una disminución de la intensidad de fluorescencia mitocondrial del TMRM+ de 42 y 58 %, respectivamente, sin cambio estadísticamente significativo de la intensidad de la fluorescencia de los nucleótidos de piridina NAD(P)H (Maldonado, et al., 2013). Dado que el nivel de los NAD(P)H en la matriz mitocondrial depende del potencial de la membrana interna (Lemeshko, et al., 2006a, Lemeshko, et al., 2006b), se puede suponer que este no cambia en estos experimentos. Por otro lado, la disminución o la inhibición de los VDAC libres en la membrana externa debe influir significativamente en la probabilidad de generación de su potencial, incrementando la resistencia Rv (Figura 3b). Los posibles cambios de dicho potencial se pueden evaluar en los experimentos mencionados (Maldonado, et al., 2013) aplicando la ecuación (19) antes y después del knockdown con el potencial de la membrana interna invariable. Por último, los cambios del potencial de la membrana externa se pueden estimar según la ecuación:
donde IF i y IF i,k,d son las intensidades de la fluorescencia mitocondrial del TMRM+ antes y después del knockdown. Según la ecuación (20), con IF i =100 %, los cálculos de IF i,k,d =42 % e IF i,k,d =58 %, ya mencionados, evidencian un incremento del potencial de la membrana externa de 15 mV y 23 mV, respectivamente.
Algunos tratamientos de las células HepG2 llevan al aumento de la concentración de la tubulina libre en el citosol, causando una disminución de 60 a 70 % en la intensidad de la fluorescencia mitocondrial del TMRM+ (Maldonado, et al., 2010), lo cual podría deberse a un incremento del potencial de la membrana externa de 24 a 32 mV, según la ecuación (20). El cambio de dicho potencial respondería (Figura 3, a-e) al incremento de la resistencia R v de la membrana externa debido al conocido “taponamiento” molecular de los VDAC con tubulina (Rostovtseva & Bezrukov, 2012; Maldonado, et al., 2013; Rostovtseva, et al., 2015), la cual, además, incrementa su sensibilidad al potencial de la membrana externa. Por otro lado, un tratamiento de las células que conlleve la disminución de la concentración de la tubulina libre en el citosol causa un efecto contrario, un incremento de 65 % en la intensidad de la fluorescencia mitocondrial del TMRM+ (Maldonado, et al., 2010). En este caso, según la ecuación (20), el aumento de los VDAC libres resultaría en una disminución de 13 mV del potencial de la membrana externa.
En general, y según el modelo VDAC-HK de generación del potencial de la membrana externa (Figura 3B), los factores que interactúan con los VDAC evitando la formación de los complejos VDAC-HK y disminuyendo de esta manera la probabilidad de generación de dicho potencial, deben causar el efecto anti-Warburg (Lemeshko, 2014, 2015, 2017a). Estas predicciones sustentarían la consideración del VDAC como un blanco importante para el desarrollo de nuevos medicamentos y tecnologías anticancerígenas (Camara, et al., 2017; Shoshan-Barmatz, et al., 2015, 2017).
Hemos desarrollado y patentado nuevos péptidos con actividad anticancerígena y antimicrobiana (Lemeshko, et al., 2006b; Orduz & Lemeshko, 2016), en tanto que en los ensayos preliminares con nuevos péptidos diseñados para impedir la formación de los complejos VDAC-HK, se ha demostrado también una elevada actividad anticancerígena en cultivos celulares. Los datos experimentales obtenidos concuerdan con los modelos propuestos de generación del potencial de la membrana externa (Lemeshko, 2002, 2014, 2015, 2017a) y con la actividad anticancerígena de esta clase de péptidos (Shoshan-Barmatz, et al., 2015, 2017).
En colaboración con el MD Anderson Cancer Center (Texas), se ha demostrado que las avicinas, triterpenoides naturales, hacen permeable la membrana externa (Lemeshko, et al., 2006a; Haridas, et al., 2007), lo que debería disminuir el valor de su potencial generado en células tumorales. Además, en estos estudios se ha visto que el grado de permeabilidad de la membrana externa a las avicinas puede ser tan elevado como para producir la salida del citocromo C desde las mitocondrias.
La generación del potencial de la membrana externa puede ser crucial en el control del estado energético del corazón. Se sabe que el valor de la K m,ADP aparente para activar la respiración de los cardiomiocitos permeabilizados es mucho más grande en ausencia de la creatina que en su presencia (Appaix, et al., 2003; Timohhina, et al., 2009; Saks, et al., 2010). Con la generación de un potencial positivo de la membrana externa en presencia de creatina (Figura 3D, E), la concentración de ADP en el espacio entre las membranas mitocondriales debe incrementarse significativamente con respecto al medio exterior (Figura 8), provocando la activación significativa de la respiración mitocondrial, a pesar de su concentración relativamente baja en el medio exterior. Por ejemplo, si la diferencia de las concentraciones de ADP en el espacio entre las membranas mitocondriales fuera de 10 veces en presencia de creatina, comparada con su ausencia, ello se debería a la generación de un potencial de la membrana externa de 20 mV (según la ecuación de Nernst) debida a la actividad de la creatina cinasa en presencia de creatina (Figura 8).
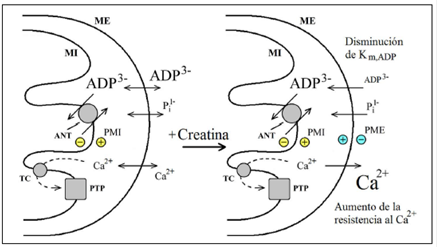
Figura 8 La generación del potencial positivo de la membrana externa en las mitocondrias de corazón en presencia de creatina puede ser un factor crucial para una disminución significativa de la K m,ADP aparente de la respiración mitocondrial y para una elevada resistencia al Ca2+ durante la sístole. ANT: antiportador ATP/ADP; PTP: poro de transición de permeabilidad mitocondrial; TC: canal de Ca2+
En mitocondrias aisladas de corazón incubadas con 1 μM de tubulina, se ha reportado que la K m,ADP aparente disminuye 14,3 veces en presencia de 20 μM de creatina (Timohhina, et al., 2009). Se puede esperar que mediante la actividad de la creatina cinasa en presencia de la creatina se genere un potencial de la membrana externa de aproximadamente 24 mV, causando la acumulación del ADP3- en el espacio entre las membranas mitocondriales y un incremento significativo de la respiración de las mitocondrias.
Como se ve en la Figura 8, la generación del potencial positivo de la membrana externa puede incrementar la resistencia de las mitocondrias frente a niveles altos de Ca2+. Se ha demostrado, por ejemplo, que la adición de 30 μM de Ca2+ a la suspensión de mitocondrias de corazón lleva a la activación del poro de transición de permeabilidad mitocondrial (Dolder, et al., 2003); para obtener el mismo efecto en presencia de creatina, se deben añadir 90 μM Ca2+ (Dolder, et al., 2003). Lo anterior se puede explicar por la extrusión de Ca2+ desde el espacio entre las membranas mitocondriales debida a la generación de un potencial positivo de la membrana externa de unos 15 mV.
El análisis de los datos experimentales permite plantear que la generación del potencial positivo de la membrana externa por el sistema VDAC-creatina cinasa o VDAChexocinasa podría ser crucial para la protección de las células contra la muerte en las condiciones de niveles tóxicos de calcio en el citosol. Es importante anotar que el valor y el signo del potencial de la membrana externa deben resultar de la superposición de los potenciales eléctricos generados mediante varios mecanismos. Las evaluaciones termodinámicas de los mecanismos descritos en este trabajo demuestran que hay una probabilidad alta de que se genere un potencial de la membrana externa con un valor suficiente (entre -40 mV y +40 mV) para modular profundamente la permeabilidad del VDAC frente a varios metabolitos con carga negativa. En general, la membrana mitocondrial externa puede tener un papel crucial en el control del metabolismo energético celular atendiendo a las propiedades de regulación del VDAC mediante el voltaje (voltage-gating) (Colombini & Mannella, 2012).
En los últimos años, diversos investigadores en este campo han considerado la posibilidad de generar el potencial de la membrana externa (Camara, et al. , 2017; Rostovtseva, et al. , 2017; Lemasters, 2017; Shoshan-Barmatz, et al. , 2018). Uno de los factores que puede favorecer la generación de dicho potencial es el “taponamiento” molecular de una fracción de los VDAC en la membrana externa con algunas proteínas (Lemeshko, 2017a) como la tubulina (Rostovtseva & Bezrukov, 2012), o la α-sinucleina (Rostovtseva, et al. , 2015), entre otras, lo que reviste gran interés para aclarar el papel del VDAC en varias enfermedades neurodegenerativas (Rostovtseva, et al. , 2015; Camara, et al. , 2017; Shoshan-Barmatz, et al. , 2018).
Conclusiones
Con los mecanismos propuestos para la generación del potencial eléctrico en la membrana mitocondrial externa de células normales y tumorales, y con las predicciones termodinámicas del posible rango de los cambios de dicho potencial, es posible explicar varios fenómenos de la regulación del metabolismo energético y de la resistencia a la muerte celular. Por ejemplo, los efectos de Crabtree y Warburg, que todavía no son claros, podrían estar asociados con la supresión eléctrica de las mitocondrias tanto en las células cancerígenas como en la levadura S. cerevisiae. Según el modelo de generación del potencial de la membrana externa por la acción de los complejos VDAC-hexocinasa, los cuales actuarían como una batería biológica, se puede predecir que aquellos factores que impiden la formación de estos complejos tendrían una actividad anticancerígena. Dadas las diversas posibilidades de generación del potencial de la membrana externa de manera dependiente del metabolismo, la membrana mitocondrial externa puede ejercer un control eléctrico del flujo metabólico entre las mitocondrias y el citosol mediante el mecanismo de realimentación negativa. Incluso cuando los niveles del potencial son relativamente bajos y no bastan para el cierre eléctrico de los VDAC, el potencial generado puede influir significativamente en las concentraciones de los metabolitos cargados y del Ca2+ en el espacio entre las membranas mitocondriales, modulando de esta manera el estado metabólico de las mitocondrias y la resistencia a la muerte celular bajo la influencia de varios factores adversos. El desarrollo de nuevos métodos para la confirmación experimental directa de la generación del potencial de la membrana externa en las células vivas es crucial para aclarar el papel fisiológico de las propiedades reguladoras del VDAC mediante el voltaje, las cuales se han conservado a lo largo de la evolución biológica (Colombini & Mannella, 2012).