Introducción
Los bosques inundables o humedales forestales cubren extensas áreas en las llanuras aluviales de los grandes ríos en Colombia y el neotrópico. El término incluye gran variedad de ecosistemas con diferente nivel y duración de la inundación, estacional o permanente, y comprende también bosques bajo la influencia de las mareas, como los manglares. Las características químicas del agua que las inunda, afectan de manera significativa la disponibilidad de nutrientes en los suelos. Además, la dinámica fluvial que desencadena diferentes procesos geomorfológicos y sedimentológicos que dan origen a un amplio espectro de geoformas y tiposde suelo, determinan en gran medida la estructura y composición florística de la vegetación, dando lugar a una amplia gama de tipos de bosque.
A los humedales forestales se les confiere gran importancia no solo por considerarse entre los mayores sumideros de CO2, alcanzando entre 830 y 1218 Mg C/ha (Donato, et al. 2012), sino también porque albergan una alta diversidad de fauna de vertebrados e invertebrados al suministrarles refugio y alimento, y generan gran cantidad de servicios ecosistémicos clave tales como la regulación de los ciclos, hidrológico, de nutrientes y, especialmente, de gases de efecto invernadero como el CO2 y el metano. Además, estos ecosistemas ofrecen gran cantidad de productos maderables y no maderables para las comunidades humanas asentadas a su alrededor, y por esta razón se encuentran altamente amenazados e inclusive algunos, en vía de desaparición.
En Colombia, se denominan cananguchales, a los bosques dominados por la palma M. flexuosa que crecen en las zonas mal drenadas de los planos de inundación y las terrazas bajas en la Amazonía, y se denominan morichales, a los ecosistemas también dominados por esta especie en las llanuras inundables de la Orinoquia. A pesar de la alta dominancia de M. flexuosa y tener un origen geológico similar, hace millones de años, estos ecosistemas evolucionaron de manera diferente y hoy son claramente distinguibles en sus características ambientales, estructurales y florísticas (Urrego, et al., 2013). Los cananguchales forman parte tanto de los bosques de várzea, inundados por aguas blancas de origen andino y de los de igapó, inundados por aguas negras o claras de origen amazónico (Prance, 1979, Wittman, et al., 2004).
Por otro lado, los manglares son bosques que crecen en el ecotono oceáno-continente, se presentan en las franjas tropicales y subtropicales en todo el mundo, y su composición florística, así como su estructura, están determinadas por la interacción de variables complejas como el ciclo y amplitud de las mareas, la posición geomorfológica, la precipitación y la dinámica de ríos que, a su vez, determinan la salinidad del sustrato y la ocurrencia de ciertas especies (Krauss, et al., 2008). En Colombia, el régimen de precipitación y la dinámica de las mareas tan contrastantes entre las costas Caribe y Pacífica, se refleja en las diferencias estructurales y florísticas de los manglares de ambas costas, con mejor desarrollo estructural y diversidad en la segunda que en la primera.
Dada la enorme distancia que presentan actualmente manglares y cananguchales en nuestro territorio, una comparación entre ellos no tendría sentido. Sin embargo, en la Amazonia brasilera, hacia la desembocadura de los grandes ríos en el Atlántico, ambos ecosistemas están distribuidos a lo largo del gradiente de inundación y de la influencia de las mareas, mientras que los cananguchales aparecen paulatinamente a medida que desaparecen la influencia mareal y los manglares (Pires y Prance, 1985).
Como se describe a continuación, estos bosques guardan similitud en cuanto a los factores ambientales que determinan su estructura y su riqueza de especies, asociados éstos a la dinámica fluvial y marina, a los patrones de inundación, así como a las adaptaciones morfológicas y fisiológicas de las especies a ambientes inundados y suelos anóxicos, tales como los neumatóforos y raíces fúlcreas presentes en algunas especies dominantes en ambos ecosistemas. Se analizarán posteriormente las respuestas de la vegetación a cambios ambientales y climáticos desde su establecimiento en el Holoceno hasta el presente.
Métodos
La relación entre los cananguchales y las características ambientales, se hizo con base en datos tomados en 10 parcelas de 1000 m2 distribuidas en la cuenca media del río Caquetá (Urrego, 1997) y, una parcela de una hectárea en la cuenca del río Calderón (Urrego, et al., 2013) en el trapecio Amazónico (Anexo 1), la que fue subdividida en 10 subparcelas de 1000 m2. En cada una de ellas se midieron e identificaron todos los árboles y palmas con diámetro a la altura del pecho (DAP) mayor o igual a 10 cm. En estas parcelas se midieron mensualmente el nivel de inundación o nivel freático, con una vara marcada (cm), y el drenaje según la clasificación de FAO (1977). En cada una de las parcelas se tomaron muestras al azar de los 25 cm superficiales del suelo a las que, posteriormente, se les hicieron análisis químicos estándar que incluyeron: capacidad de intercambio cambio catiónico, pH, porcentaje de materia orgánica y concentración de nutrientes mayores (Al, Ca, Mg, Na, K y P), así como análisis granulométricos (contenidos de arcilla, arena y limo). Estos análisis se realizaron en el laboratorio de suelos de la Universidad Nacional de Colombia, Sede Medellín.
En los manglares se establecieron parcelas de 500 m2 así: 86 parcelas en la isla de San Andrés (Urrego, et al., 2009a), 87 en el Golfo de Urabá (Urrego, et al., 2014), 12 en la bahía de Cispatá (Agudelo, et al., 2015) y 26 en La Guajira (Molina, 2009, Bernal, et al., 2016). En ellas, se hicieron las mismas mediciones que en los canaguchales. El número mínimo de parcelas sujetas a muestreo se estableció con base en un pre-muestreo de 5 parcelas por cada tipo de bosque, las que abarcaron la mayor variabilidad ambiental posible y contemplaron un error estadístico máximo de 15% (Lema, 2003). En todos los sitios, los tipos se manglares se establecieron con base en la clasificación fisiográfica de Lugo y Snedaker (1974).
En ambos casos la agrupación de las especies, su relación con las variables ambientales, y la asignación de los tipos de bosque se hizo con base en Análisis de Correspondencia Canónica utilizando el software CANOCO 4.5 (Ter Braak y Smilauer, 2002). En ellos se incluyeron matrices de datos florísticos y estructurales de todos los árboles con DAP>10 cm, y ambientales tomados en cada una de las parcelas muestreadas. En el caso de los cananguchales, la dominancia se midió con el índice de Simpson y la equidad con el índice de Shannon-Wiener (Krebs, 1998); este último índice se calculó al usar los datos de abundancia proporcional de especies, incluyendo y excluyendo M. flexuosa, con el fin de observar la influencia de esta especie dominante en la diversidad.
Para los análisis de la regeneración natural se establecieron 4 sub-parcelas cuadradas de 1 m2 en cada una de las parcelas de 0,1 ha, antes descritas. En ellas, se marcaron todas las plántulas con altura inferior a 1 m y se evaluaron semestralmente, las tasas de mortalidad, reclutamiento y supervivencia, durante año y medio en los manglares de la Bahía El Uno y la desembocadura del río Turbo, en el Golfo de Urabá (Hoyos, et al., 2013) y dos años en los cananguchales del plano de inundación del río Calderón en el trapecio amazónico (Galeano, et al., 2015). Adicionalmente, en cada medición y sub-parcela se midieron el drenaje, la tasa de sedimentación y nivel de inundación. Las relaciones entre los parámetros de la regeneración natural medidos y las variables ambientales se realizaron por medio de un análisis de redundancia con el software CANOCO 4.5 (Ter Braak y Smilauer, 2002).
La influencia de eventos climáticos extremos sobre los ecosistemas se llevó a cabo a través del análisis de la relación de éstos con la fenología reproductiva para los cananguchales (Urrego, et al., 2016) y con un índice de diferencia de vegetación normalizado (NVDI, por sus siglas en inglés) para los manglares (Galeano, et al. 2017). El registro de la fenología reproductiva de M. flexuosa se realizó mensualmente entre diciembre de 2010 y noviembre de 2012 en 154 palmas adultas marcadas en la parcela de 1 ha localizada en el plano de inundación del río Calderón en el trapecio amazónico. Junto a cada palma se midió mensualmente el nivel de inundación, usando una vara marcada (cm). A través de un análisis de redundancia realizado con CANOCO 4.5 (Ter Braak y Smilauer, 2002), se estableció la relación de las fenofases con estos niveles y con los valores diarios de las temperaturas máximas y mínimas y la nubosidad, y con la precipitación mensual medidas en estación meteorológica ubicada en el Aeropuerto Vázquez Cobo de Leticia (Amazonas), y suministrados por el IDEAM (2010- 2012). Las diferencias Interanuales en variables climáticas y la producción de frutos se estableció utilizando un ANOVA de un factor y pruebas de rango múltiple (MRT) en STATGRAPHICS (Centurión XV, Versión 15.1.02).
En los manglares de las Islas del Rosario, se realizó un análisis de imágenes satelitales entre 2002 y 2014, usando el NDVI y un análisis de series de tiempo de velocidad del viento, precipitación diaria, altura y período pico del oleaje, así como temperaturas máxima y mínima (Galeano, et al., 2017). Se identificaron los valores extremos (ecológicos y estadísticos) de estas variables y se correlacionaron con los valores de NDVI tanto de los manglares como de las coberturas vegetales vecinas (playas y el bosque seco). Los cambios de la vegetación a largo plazo se identificaron con base en análisis palinológicos de columnas de sedimentos, extraídas con una sonda rusa modificada tipo Macaulay (Traverse, 1988), de cananguchales, manglares y lagunas cercanas a éstos. La profundidad de cada una de ellas se limitó a los horizontes orgánicos y arcillo-limosos. De cada sección, en el laboratorio, se obtuvieron muestras de un volumen constante, cada 5 cm. La extracción del polen de cada muestra se hizo utilizando las técnicas estándar de laboratorio (Faegri e Iversen, 1989). Para todas las secciones se construyeron modelos de edad con base en dataciones con isótopos de 14C y 210Pb.
Resultados y discusión
La composición florística y estructural de los bosques asociada con la variabilidad ambiental a escala regional. En el medio Caquetá se identificaron seis tipos de cananguchales (Urrego, 1997) que difirieron en la posición geomorfológica dentro de la llanura aluvial, el drenaje, el espesor del horizonte orgánico en el suelo, y el porcentaje de materia orgánica y de intercambio catiónico en los suelos. El drenaje es función de la textura del suelo y expresa el número de meses durante los cuales el suelo permanece inundado, lo que, a su vez, rige la acumulación de materia orgánica y el pH del suelo. Se registraron dos tipos con drenaje moderado y cuatro en suelos mal drenados. Los primeros se desarrollaron principalmente en el plano aluvial con inundación estacional por ríos de agua blanca (Caquetá), con mayor diversidad de especies (entre 284 y 347 especies/ha) y árboles más altos (16-18 m en promedio y los dominantes entre 25 y 30 m). Los segundos se ubicaron en los sitios mal drenados en complejos de barras de cauce y terrazas bajas, y mostraron un gradiente de drenaje y de influencia de la inundación por ríos de agua negra de origen amazónico. A medida que el drenaje empeoró, se incrementó la profundidad promedio de la capa orgánica (de 5 a 58 cm), y la influencia de la inundación por aguas negras, y disminuyeron la disponibilidad de nutrientes, la altura del dosel (11-15 m en promedio y los árboles dominantes, especialmente palmas, entre 22 y 30 m), y la riqueza de especies arbóreas (entre 82 y 214 especies especies/ha en promedio). La dominancia de M. flexuosa disminuyó a medida que mejoró el drenaje y aumentó la riqueza de otras especies arbóreas (Urrego, 1997).
Los cananguchales de la terraza baja mal drenada del río Calderón, en el trapecio Amazónico (Urrego, et al., 2013a), mostraron relaciones similares con las variables ambientales (Figura 1); mayor diversidad y desarrollo en altura de los árboles en sitios mejor drenados, con menor acumulación de materia orgánica y pH más bajos en los suelos.
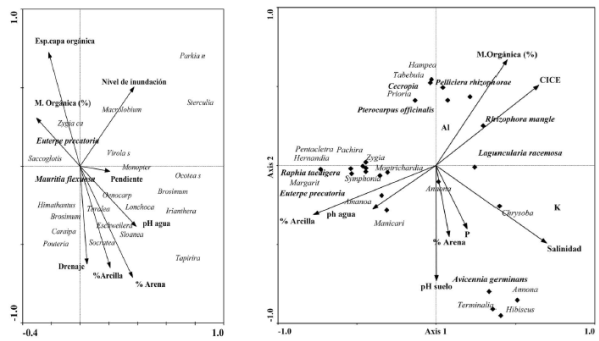
Figura 1 Biplots: resultado de los análisis de correspondencia canónica (CCA) entre el área basal por especie y variables ambientales medidas en cananguchales del trapecio Amazónico (izquierda) y bosques aluviales y manglares del Golfo de Urabá (derecha). Se observa mayor dominancia de las especies típicas de cananguchales asociadas con mayor inundación, a la profundidad de la capa orgánica (izquierda), y en los manglares se asocian a estas mismas variables, y a la salinidad (derecha).
Cuando los anteriores se compararon con los de la terraza baja mal drenada del río Caquetá, que alberga bosques semejantes, se encontró que los primeros son más diversos que los segundos, pero que en los últimos, cuando se excluyó M. flexuosa de los cálculos, la equidad fue mayor, lo que evidencia que en la cuenca media del río Caquetá muchas otras especies arbóreas pueden presentar alta dominancia. El área basal de M. flexuosa respecto a las demás especies, fue mayor en los cananguchales del río Calderón, mientras que el área basal de las otras especies arbóreas fue mayor en el medio Caquetá. La riqueza de especies en los cananguchales del río Calderón fue más del doble de la registrada en el medio Caquetá. Estas diferencias se relacionan con el drenaje, el nivel de inundación, y las propiedades físico-químicas de los suelos, así como con la presencia de especies de los bosques vecinos bien drenados, y la distancia hasta estos bosques. Por ejemplo, los cananguchales de la terraza baja mal drenada del medio Caquetá se acercaron a los bosques que crecen sobre arenas blancas (varillales) que son muy pobres en nutrientes, diversidad y desarrollo estructural. Por el contrario, los cananguchales del río Calderón se encuentran cerca de la transición con los bosques de tierra firme, lo que facilita la colonización de especies menos tolerantes a la inundación, lo que aumenta así la diversidad, como se ha registrado en otras partes de la Amazonia (Wittmann, et al., 2006).
En los manglares analizados en la Isla de San Andrés (Urrego, et al., 2009a), el Golfo de Urabá (Urrego, et al., 2014, Mira, et al., 2017), la bahía de Cispatá (Agudelo, et al., 2015) y La Guajira (Molina, 2009, Bernal, et al., 2016), se identificaron diferentes tipos de bosques cuya estructura y composición florística, más simplificada en términos de riqueza de especies en comparación con la de los cananguchales, se relacionaron con el drenaje y la textura de los suelos, el nivel de inundación, el contenido de materia orgánica en el suelo, la profundidad del horizonte orgánico y, especialmente, con la salinidad, como lo indicaron los análisis de correspondencia canónica. En general, el nivel de inundación fue muy variable (entre 11 y 70 cm), y se relacionó positivamente con el espesor de la capa orgánica (entre 5 y 25 cm). En todos los sitios se registraron al menos tres tipos de manglar (sensu. Lugo y Snedaker, 1974), manglares de borde ubicados a lo largo de la línea de costa con influencia directa de las mareas y dominados por mangle rojo, R. mangle, en el cual predominan suelos orgánicos con presencia de sedimentos finos (limos y arcillas), mayor nivel de inundación y espesor del horizonte orgánico, así como salinidad baja a intermedia. Un segundo tipo, denominado manglar de cuenca o de interior, alejado de la línea de costa, con alta salinidad y predominancia de suelos minerales arenosos o arcillo limosos, dominados por mangle negro, Avicennia germinans (L.). Sin embargo, en la isla de San Andrés estos últimos se registraron también cercanos a la línea de costa. Un tercer tipo de bosque denominado manglar mixto, que presentó salinidad intermedia, menor porcentaje de materia orgánica en los suelos que los anteriores, y en el que, además de estas especies, se presentan el mangle blanco, Laguncularia racemosa (L.) y el helecho Acrostichum aureum L. Ambas especies indicadoras de mayor disponibilidad de luz, asociada a bosques con un dosel más abierto y, relacionado en la mayoría de los casos, con la perturbación antrópica o natural. La disponibilidad de nutrientes especialmente cationes (Mg, Ca, Na y K) se incrementó con el aumento de la influencia marina, como la que se presentó en los manglares de borde de la isla de San Andrés, en el extremo nororiental del Golfo de Urabá y en la bahía de Cispatá.
En la estructura, se observó un descenso en la altura promedio (H) de los árboles y del área basal con el incremento en la salinidad y en la estacionalidad de la precipitación. Los manglares de la isla de San Andrés registraron mayor altura (entre 14 y 16 m en los menos salinos, y entre 8 y 10 m en los de mayor salinidad), y la Bahía de Cispatá, mientras que el menor desarrollo se ha observado en los manglares de La Guajira (3 a 7 m en promedio entre los menos y los más salinos, respectivamente) donde la estación seca es más amplia e intensa. Se debe anotar que en los sitios con mayor nivel de inundación, el valor máximo registrado, en promedio, alrededor de 40 cm en la estación lluviosa y, un mínimo de 10 cm en la estación seca, lo cual limita el desarrollo de la vegetación (Molina, 2009). Los manglares localizados en el Golfo de Urabá (Figura 1), a pesar de presentar la menor salinidad de todos los manglares estudiados, asociada con la fuerte influencia de los ríos que desembocan en el Golfo; éstos presentaron árboles de menor altura promedio, circunstancia asociada probablemente con la fuerte explotación a la que están sometidos como se ha registrado en varias investigaciones (Blanco, et al., 2012, Urrego, et al., 2014), y se refleja en la escasa presencia de árboles grandes en la mayoría de los bosques muestreados y en la cercanía de éstos a los centros poblados.
Al igual que en los cananguchales (Figura 1), en los manglares se presentó colonización de especies de los bosques vecinos, a medida que se mejoraron las condiciones de drenaje y de inundación, y que disminuyera la salinidad. En los manglares del Golfo de Urabá (Urrego, et al., 2014) se registraron especies del bosque aluvial inundado (e.g Raphia taedigera (Mart.) Mart., Cecropia peltata L., Pachira aquatica Aubl., Pterocarpus officinalis Jacq. Y Euterpe precatoria Mart.) y del bosque seco tropical, en los manglares de San Andrés (e.g. Annona glabra L., Ficus trigonata L., Phyllanthus acidus (L.), Bursera simaruba (L.) Sarg.) , lo que muestra la fuerte influencia de la vegetación regional, además de las condiciones ambientales, sobre la composición florística de los humedales forestales (Urrego et al., 2009a), tal como se registró en los cananguchales. Sin embargo, el porcentaje de la varianza en la composición de especies no explicado por las variables ambientales medidas, que según los análisis de correspondencia canónica oscila entre 2 y 35%, obedece tanto a la interacción con factores bióticos, como a la interacción entre las especies de plantas y de éstas con la fauna. En segundo lugar, los límites entre estos humedales y los de tierra firme no son discretos, las especies no se encuentran restringidas a bandas estrechas y en la medida en que las condiciones restrictivas disminuyen gradualmente, especialmente la inundación (incluida la de las mareas) y mejora el drenaje, aparecen las especies menos adaptadas a tales restricciones, lo que demuestra la plasticidad de muchas de las que están presentes en los ecotonos. Aunque estos bosques son comparables a los de otras partes del mundo, siempre habrá diferencias en la composición florística de cada uno de estos humedales forestales, derivadas ellas de la fuerte influencia de las especies provenientes de los bien drenados bosques vecinos (Ellison, 2002, Wittmann, et al., 2006) (Figura 1).
Manglares, cananguchales y los cambios ambientales/ climáticos en el mediano y largo plazo. Los primeros registros de polen fósil obtenidos de columnas de sedimentos, de Rhizophora en el Mioceno (Hoorn, 1994) en el norte de Surámerica, señalan que los sedimentos de manglar se depositaron en un ambiente fluvial de origen amazónico en épocas de alto nivel del mar, en las que la cordillera de los Andes aun en formación, permitía lazos con los océanos, y en las que el Golfo de Maracaibo, los Llanos Orientales y la Amazonia estaban todavía conectados. Estas condiciones y posibilitaron la alternancia de periodos dominados por Rhizophora con los dominados por Mauritia (Hoorn, 1994, Urrego, et al., 2013a) resaltando la prevalencia de la influencia marina en la dominancia de uno u otro taxón y su distribución a lo largo de un gradiente de inundación.
Según análisis palinológicos, la historia holocénica de manglares y cananguchales, está muy relacionada con el incremento en temperaturas, precipitación y niveles del mar (Hodell, et al., 1991, Haug, et al., 2001) que reemplazaron las condiciones frías, de aridez, y bajo nivel del mar que prevalecieron al culminar la última glaciación, 18.000 años Antes del Presente (AP), cuando se registraron parches aislados de ambos humedales (Woodroffe y Grindrod, 1991, Urrego, 1997). Alrededor de 11.000 años de AP, los incrementos en temperatura y precipitación, como resultado de la migración de la Zona de Confluencia Intertropical (ZCIT) (Haug, et al., 2001), elevaron los niveles de los ríos y de inundación, que combinados con el descenso en el nivel de mar, permitieron la colonización temprana de manglares, como se registró en la cuenca de Panamá (González, et al., 2006), y se inició el proceso de sucesión aluvial en la Amazonía (Urrego, 1997, Van der Hammen, et al., 1992).
En los cananguchales del medio Caquetá (Urrego, 1997), el descenso de la inundación, y la dinámica de erosióndeposición del río Caquetá, dieron lugar a la formación de extensas playas arenosas, inicialmente colonizadas por herbáceas (Cyperaceas, Poacaeas y Asteraceas), que contribuyeron al desarrollo de suelos y del bosque pionero de Cecropia. Posteriormente, el descenso regional de la precipitación y los niveles de los ríos asociados a un periodo seco entre 7000 y 8000 años AP, dieron lugar a la formación de diques cubiertos por bosques de várzea estacional (dominados por Ficus insípida Willd. y Cedrela ododrata L.). No obstante, las oscilaciones en la precipitación y altas temperaturas asociadas al Máximo Térmico Holocénico (MTH), dieron paso a la formación de playas, que precedieron al complejo de barras del río (diques) y aislamiento de basines y depresiones en los que se establecieron los actuales cananguchales, con acumulación de material orgánico y arcillas, que se consolidaron alrededor de 4000 años AP (Figura 2), época en la cual disminuyó la precipitación en la Amazonía occidental y en la cuenca del bajo Magdalena-Cauca-San Jorge, probablemente asociados al “mega ENSO” (Van der Hammen y Cleef, 1992, Van der Hammen, et al., 1992). Este patrón de formación de playas, diques y depresiones ocupadas por cananguchales, se repitió en varios sitios de la llanura aluvial, regidos por migraciones del lecho del río, inundaciones estacionales, alternancia de periodos secos (2700-2000, 1600, 700 años AP) y procesos de sedimentación, especialmente los que se asociaron a la Anomalía Climática Medieval (ACM) y a la Pequeña Edad de Hielo (PEH), desde 700 años Después de Cristo (DC), cuando se registró incremento en la acumulación de materia orgánica en los perfiles de suelos de los cananguchales, y descensos en la sedimentación y los niveles de inundación que continuaron hacia el presente.
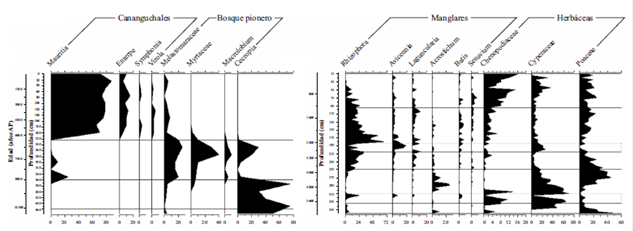
Figura 2 Diagrama de porcentajes del polen de las especies dominantes en columnas de sedimentos de cananguchales del Medio Caquetá (izquierda) y de la laguna Navío Quebrado (La Guajira). Se registran los cambios de la vegetación desde el holoceno medio cuando se establecieron ambos ecosistemas asociados a las fluctuaciones climáticas del máximo térmico holocénico.
Los procesos geomorfológicos asociados a la dinámica fluvial, las fluctuaciones en la precipitación y los niveles de inundación, asociados por igual con el “mega ENSO” (Van der Hammen y Cleef, 1992), fueron la causa más determinante en la formación y cambios en la composición florística en los humedales forestales de zonas bajas tanto de la Amazonía como del Pacífico colombiano (Berrío, et al., 2000, Vélez, et al., 2001, Urrego y Del Valle, 2002, Urrego, et al., 2006), los cuales describen un patrón de zonación desde el cauce de los ríos, bordeados de playas, hacia tierra adentro, con bosques diversos en las partes mejor drenados y rodales de palmas más homogéneos en basines y partes bajas, mal drenadas, detectable en los análisis palinológicos.
En los manglares del Caribe, las condiciones postglaciales no fueron tan distintas. Además de altas precipitaciones y temperaturas, se registraron altos niveles del mar. Al comienzo del Holoceno, la transgresión marina seguida por la disminución relativamente rápida de los niveles del mar, dio lugar a la formación de lagunas, estuarios, pantanos y humedales costeros (Raasveldt y Tomic, 1958, Urrego, et al., 2013), aptos para la colonización de manglares, especialmente durante el MTH entre 10.500 y 5400 años AP (Haug, et al., 2001), en el que se presentaron altas descargas de los ríos. Previamente a la expansión de los manglares, predominaron sedimentos marinos alóctonos y niveles oscilantes del mar (Carillo-Bastos, et al., 2010, Cohen, et al., 2016), representados por la secuencia de herbáceas típicas de marismas (Amaranthaceae - Chenopodiaceae, Cyperaceae y Poaceae), como se registró en la laguna Navío Quebrado (Figura 2) en la Guajira (Urrego, et al., 2013), entre 6280 y 3240 años AP, con escasa presencia de manglares dominancia de marismas como en las costas de Guyana y Venezuela alrededor de 7000 años AP (Van der Hammen, 1988, Rull, et al., 1999).
Sin embargo, los patrones de precipitación no fueron homogéneos durante el MTH. La ocurrencia de períodos secos relacionados con mayor variabilidad del “Mega” ENSO (Haug, et al., 2001), entre 8300 y 7800 años AP y alrededor de 5000 años AP (Mayewski, et al., 2004; Haug, et al., 2001) causaron la disminución de los niveles de los lagos en el Caribe, especialmente entre 6000-5000 años AP, que combinados con la disminución en las tasas de incremento del nivel del mar, facilitaron la expansión de los manglares alrededor de 6000 AP, en la laguna Navío Quebrado y en estuarios, lagos, deltas e islas del Caribe (Urrego, et al., 2013 y referencias incluidas en éste).
No obstante, se registró asincronía en la colonización de manglares con otros sitios del Caribe, derivada de la geomorfología local. En La Guajira el establecimiento pleno de los manglares en ambientes protegidos del impacto directo del oleaje, tuvo lugar entre 3840 y 1270 años AP, asociado a la estabilización de los niveles del Mar Caribe alrededor de 3000 años AP (Rull, 1999). No obstante, un periodo muy seco (Haug, et al., 2001) con disminución en la descarga de los ríos entre 2850 y 2450 años AP, causó una disminución de los manglares y el reemplazo de la dominancia de R. mangle por A. germinans, más tolerante a alta salinidad y menor inundación. Aunque los manglares se recuperaron con el incremento en la precipitación, la disminución de la insolación veraniega del hemisferio norte (Hoddell, et al., 1991) a partir de 2000 años AP, causó una disminución regional en la precipitación del Caribe, con aumentos en la salinidad, que redujeron los manglares, proceso que se acentuó con el incremento en la temperatura asociada a la ACM y con la intervención humana, reflejada en la dominancia de L. racemosa en los registros palinológicos (Urrego, et al., 2013).
Las secuencias palinológicas de los últimos 500 años en el Caribe (Figura 3) muestran cambios importantes en los manglares y la vegetación costera, que se asocian a la variabilidad geomorfológica, climática y de influencia antrópica. Entre 450 y 150 años AP, durante la PEH, el desplazamiento hacia el sur de ZCIT (Haug, et al., 2001) originó sequías, hipersalinización y deterioro de las condiciones para los manglares, y expansión de las herbáceas (Urrego, et al., 2013). No obstante, en San Andrés (González, et al., 2010) en las últimas décadas de la PEH se registró recuperación de los manglares asociada a condiciones más húmedas, requeridas para compensar el incremento en el nivel del mar.

Figura 3 Diagramas de porcentajes del polen de manglares correspondientes al último milenio en lagunas y manglares del Caribe colombiano. Nótese el aumento de manglares en los últimos 150 años en sitios cercanos a los deltas y a la desembocadura de los ríos. Nótese, igualmente, la disminución en sitios donde se registra erosión costera y perturbación antrópica.
Durante el Antropoceno (últimos 150 años), se ha registrado una tasa acelerada de incremento en el nivel del mar, que ha generado respuestas opuestas en el Caribe Colombiano (Urrego, et al., 2018). Los manglares se expandieron tanto en sitios con alto aporte de sedimentos (Figura 3) como en los deltas de los ríos Ranchería (Urrego, et al., 2013), Sinú (Castaño, et al., 2010), Atrato y Turbo (Suárez, et al., 2015), en los cuales la disipación de la energía del oleaje y la deposición de sedimentos gruesos compensaron el incremento en el nivel del mar, y mantuvieron el sustrato para el establecimiento de los manglares, como en otros sitios del Caribe (Parkinson, et al., 1994). En islas oceánicas, como San Andrés (González, et al., 2010), donde no hay aportes permanentes de agua dulce, el incremento en los manglares se asocia a la acreción de turba subterránea por incremento en la masa de raíces (Mackee, et al., 2007). Sin embargo, en sitios con impacto directo del oleaje sin aportes aluviales permanentes, se ha registrado fuerte erosión costera (Rangel y Anfuso, 2009) con pérdidas significativas de manglares como en Bahía Portete (Molina, 2009, Bernal, et al., 2016) y la laguna de Camarones (Urrego, et al., 2013), en la Guajira, y las bahías no protegidas del Golfo de Urabá (Suárez, et al., 2015).
La tasa de incremento actual en el nivel del mar en el Caribe colombiano (0,36 -0,56 cm/año, Torres, et al., 2006) está dentro los límites de la máxima tolerable para los manglares (0,09 -0,12 cm/año, Ellison y Stoddart, 1991), lo cual resalta la importancia de los aportes de sedimentos y agua dulce, y la geomorfología local en la conservación de los manglares ante el actual de Cambio Climático. Los manglares podrán colonizar tierra adentro, siempre y cuando cuenten con suficiente espacio de acomodación y existan los aportes de sedimentos y agua dulce necesarios. Un ejemplo claro se registró en las últimas décadas en el Golfo de Urabá (Suárez, et al., 2015), en el cual se observó la relación entre la dinámica fluvio marina y la expansión y contracción de los manglares. En el costado occidental del Golfo, altamente influenciado por el río Atrato, se depositaron nuevas áreas a lo largo de los brazos del río Atrato en zonas protegidas del viento y el oleaje, que fueron colonizadas por manglares (22%) de R. mangle, entre 1975 y 2009. En las zonas menos protegidas, en los extremos sur y norte del Golfo, se presentaron pérdidas de manglares asociadas a mayor energía y altura del oleaje en estas áreas, más acentuado en el costado oriental donde los manglares reciben mayor impacto del oleaje de fondo, olas de mayor altura, pero menor impacto de vientos fuertes, y mayor carga de sedimentos provenientes de la deriva litoral. También allí se registró incremento de áreas desnudas (500%) entre 1980 y 2009, y desplazamiento tierra adentro de la línea de costa (Suárez, et al., 2015). Los análisis anteriores muestran que la permanencia de ambos ecosistemas está determinada por un equilibrio entre los niveles de inundación y el aporte de sedimentos que pueda mantener el sustrato para la vegetación. Estos registros no solo reflejan la respuesta a los cambios climáticos sino también la influencia de la dinámica fluviomarina en la geomorfología y los suelos.
El polen como herramienta de análisis de los cambios ambientales en los manglares. La validación de la palinología como herramienta de análisis en la reconstrucción de los cambios de los manglares a largo plazo, se realizó con base en análisis de polen en muestras de sedimentos superficiales, y su relación con la vegetación en pie. El primero, se realizó en el complejo lagunar de Cispatá cercano al delta del río Sinú (Urrego, et al., 2009b) en el que se tomaron muestras de fondo de lagunas y sedimentos superficiales en manglares, y el segundo, de sedimentos superficiales de manglares de San Andrés. Se encontró una fuerte asociación de los porcentajes de polen de manglar con la composición y entornos geomorfológicos del manglar (Urrego, et al., 2009b). Los porcentajes más altos de Rhizophora (> 60%) se registraron en la zona litoral de Cispatá, donde se encuentran los manglares más viejos con árboles más grandes, y en San Andrés (Figura 4), donde se asociaron con altos niveles de inundación, distancias más cortas a la línea de costa (Urrego, et al., 2010) y crecimiento de los manglares in situ (Woodroffe, et al., 1985, Elenga, et al., 2000). Porcentajes entre 35 y 50% de polen de Rhizophora se registraron en manglares intervenidos o en estuarios, y valores < 25% caracterizaron manglares localizados en la transición hacia tierra firme (Van Campo y Bengo, 2004, Engelhart, et al., 2007, Urrego, et al., 2009a).
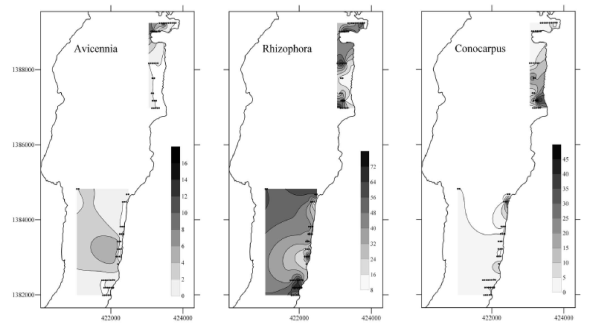
Figura 4 Distribución espacial del polen de tres especies de manglares, contenido en sedimentos superficiales de los manglares de San Andrés. Los mayores porcentajes se presentan en sitios donde la especie está creciendo in situ.
En contraste, el polen de Avicennia, aunque generalmente está poco representado en los registros, típicamente refleja ambientes más salinos (Urrego, et al., 2009b, 2010) y alejados de la línea de costa. Altas proporciones de polen de Laguncularia y del helecho A. aureum indican manglares intervenidos con doseles abiertos o en recuperación después de una perturbación, con salinidad moderada (Tomlinson, 1999, Medina, et al., 1990). El polen de Conocarpus erectus (L.) indica entornos supra-mareales y próximos a tierra firme con influencia estacional de las mareas, menor inundación y valores altos de pH del suelo (Tomlinson, 1999, Urrego, et al., 2010).
La presencia de polen de especies herbáceas, helechos y vegetación de marismas, indica procesos de colonización en playas, formación de deltas y lagunas, y diferente nivel de salinidad (González y Dupont, 2009) o inundación y, según la secuencia en la que se presentan, cambios acelerados en los niveles del mar (e.g. Amaranthaceae, Cyperaceae, Poacaece y Asteraceae). Son igualmente diagnósticas de sucesión temprana después de una perturbación o de eventos transgresivos marinos o aporte de material alóctono (González y Dupont, 2009, Urrego, et al., 2009b, González, et al., 2010). Por ejemplo, en la Isla Gorgona dos especies herbáceas caracterizaron la dinámica fluvio-marina de una playa. En un sector con mayor pendiente y elevación, y con tendencia a la acreción de arenas, dominó Rhynchospora polystachys (Turrill) H. Pfeiff. (Cyperaceae). En cambio, en sectores con forma convexa, menor elevación y tendencia a la erosión, domina Sphagneticola trilobata (L.) Pruski (Asteraceae) (Bernal, et al., 2016).
Respuesta de las especies dominantes de los humedales forestales a eventos climáticos extremos. Según el IPCC (2013), el actual cambio global representa una de las mayores amenazas para los ecosistemas naturales, si se considerando no solo los cambios en la variabilidad estacional de la precipitación y los niveles de inundación, sino también aquellos asociados a eventos extremos asociados al ENSO, representados por mayor la intensidad de las sequías, y vientos en algunas épocas y de mayor precipitación y nivel del mar, en otros. Estos cambios pueden afectar no solo los ciclos reproductivos de las especies y la productividad de los ecosistemas, sino también la dinámica de la materia orgánica en los suelos y los patrones de la regeneración natural, como se muestra a continuación y en el numeral 5.
El análisis de la fenología reproductiva de M. flexuosa entre diciembre de 2010 y noviembre de 2012 en el plano de inundación del río Calderón, en el trapecio amazónico (considerado un bosque de igapó), mostró sincronía anual en la floración y en la fructificación, y a través de un análisis de redundancia, una clara estacionalidad y estrecha relación con variables climáticas (Urrego, et al., 2016). El mayor índice de actividad de la floración se presentó con valores máximos de temperatura, mínimos de precipitación mensual y de niveles de inundación registrados de agosto a noviembre de 2011 y de 2012, siendo significativamente más acentuados en 2011 (Figura 5). Por el contrario, la formación de frutos fue significativamente mayor en 2012 y se asoció con los mayores valores de precipitación mensual y niveles de inundación. Aunque de julio de 2010 a mayo de 2011 una de las más fuertes anomalías de La Niña afectó el neotrópico (IDEAM, 2011), la cual usualmente causa incrementos en la precipitación y disminución en la temperatura (Poveda y Mesa, 1997), en la Amazonia colombiana se presentó el déficit más extremo de precipitación desde 1998, asociado al gradiente norte-sur del Atlántico tropical en la temperatura superficial del mar (Marengo, et al., 2011, 2013, Espinoza, et al., 2011, Xu, et al., 2011). En cambio, de julio a diciembre de 2011 la precipitación regional presentó un incremento significativo comparado con el mismo periodo de 2010. El déficit de precipitación, al igual que en otras especies amazónicas (Haugaasen y Peres, 2005, Sakai, et al., 2006), causó la iniciación temprana de la floración y los valores más altos del índice de actividad de esta fenofase, y una baja y temprana producción de frutos posterior a esta floración. Mientras que en el 2012 la producción de frutos fue significativamente más alta, asociadas a mayores valores de precipitación mensual y niveles de inundación (Figura 5). Sin embargo, la producción de frutos no solo mostró diferencias temporales importantes sino también regionales, cuando se compararon con datos preliminares de cananguchales de várzea del medio Caquetá (Urrego, 1987), cuya producción fue mayor.
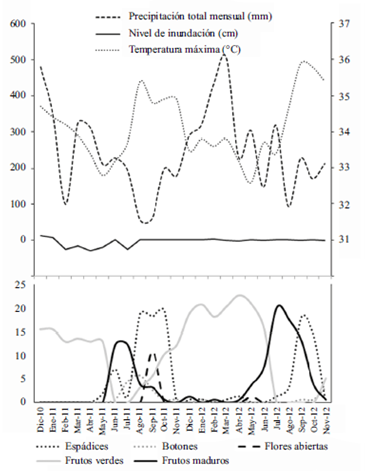
Figura 5 Variación en el índice de actividad de la floración y la fructificación de M. flexuosa en cananguchales del trapecio amazónico, entre diciembre de 2010 y noviembre de 2012, y su relación con la precipitación mensual y las temperaturas máximas. La mayor floración se presentó en asocio con la mayor sequía y la temperatura máxima, y la mayor fructificación con los valores más altos de precipitación.
De estos resultados se infiere que el incremento en las temperaturas (0,6 2°C) y la disminución de la precipitación (20-30%) proyectados para el 2100 (IPCC, 2013) para la Amazonia Central, podrían afectar la respuesta fenológica de M. flexuosa, que es una especie híper-dominante (Ter Steege, et al., 2013) y clave para la supervivencia de muchas especies animales en la Amazonia. Un déficit de precipitación podría causar disminución en la producción de frutos y afectar el establecimiento y supervivencia de las plántulas, y además promover la colonización de especies de tierra firme.
En los manglares en las Islas del Rosario, el análisis del NDVI y las series de tiempo de las variables climáticas (Galeano, et al., 2017), mostró que mientras los valores de NDVI y la extensión de las playas disminuyeron con el aumento en la frecuencia e intensidad de los vientos, los manglares se beneficiaron con el incremento en la frecuencia de eventos de sequía de corta duración, aunque el NDVI disminuyó cuando las sequías se hicieron más prolongadas. Los eventos extremos de sequía presentaron tendencia al aumento en duración desde 2009 y el análisis de series de tiempo mostró que, aunque su frecuencia en el Caribe es cíclica, la duración se incrementó en años donde la frecuencia de la sequía fue baja.
Los eventos extremos de sequía, se asociaron con las anomalías del ENSO y la oscilación decadal del Pacífico (PDO, por sus siglas en inglés), que tuvieron efectos más drásticos sobre la vegetación de playa y el bosque seco como lo mostraron los mínimos valores del NDVI registrados para el 2010 (Figura 6). Por el contrario, los manglares mostraron mayor resiliencia a tales sequías y fuertes vientos debido a su localización a lo largo de las bahías protegidas y alrededor de las lagunas internas dados los valores comparativamente más altos del índice (Figura 6). Esta respuesta de los manglares se relaciona con la disminución del nivel freático en los suelos, y el subsecuente aumento de la oxigenación, la disponibilidad de nutrientes y el uso más eficiente del agua para la fotosíntesis (Lovelock, et al., 2009), como se registra en otros bosques inundables (Wittmann, et al., 2004; Galeano, et al., 2015).
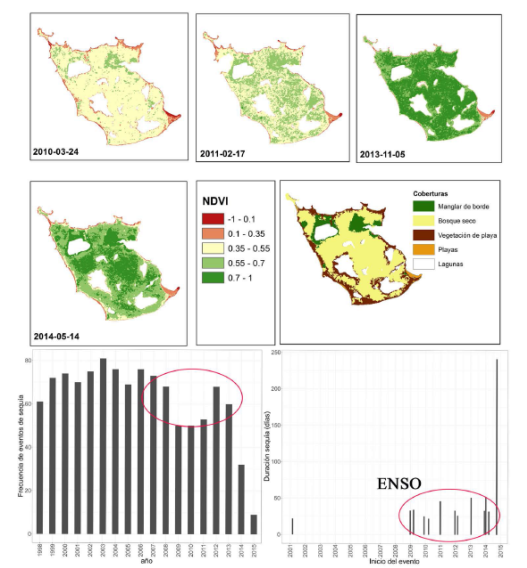
Figura 6 Cambios en el índice de diferencia de vegetación normalizado (NVDI) entre 2010 y 2014. En la fuerte sequía de 2010 asociada al ENSO, los manglares mantuvieron altos valores del índice, mientras en las otras coberturas estos índices disminuyeron significativamente.
A pesar de la capacidad de los manglares de disipar la energía del oleaje y la velocidad del viento (Alongi, 2008, Zhang, et al., 2012, Aung, et al., 2013, Vanegas, et al. 2017 ), eventos como huracanes y tormentas tropicales pueden afectar fuertemente su composición florística y su estructura, según la respuesta diferencial de las especies a estos eventos y las condiciones al momento del evento, tal como se registró en Bahía Portete (Guajira). Aunque R. mangle presenta mayor mortalidad de árboles adultos (Imbert, et al., 1996), es más resiliente al presentar pocos años después del evento, alto reclutamiento de plántulas (Baldwin, et al., 1992). Mientras A. germinans y L. racemosa son más resistentes debido a su capacidad de rebrote, explicando así cambios en la composición florística de los manglares de borde, especialmente de borde, después del paso de los huracanes Cesar (1996) y Lenny (1999) que, aunque no impactaron directamente la costa, causaron incrementos en la precipitación y las mareas de tormenta y disminución en las extensiones de los manglares (Bernal, et al., 2016) como en otros sitios del Caribe (Tanner, et al., 1991). De la misma manera, en la Isla de San Andrés se encontraron evidencias en los sedimentos y el polen de un fuerte huracán que en 1605 causó erosión y el reemplazo de los manglares por vegetación abierta (González, et al., 2010) y su recuperación después de medio siglo (Figura 3).
Patrones de regeneración natural asociados a la variación ambiental de menor escala
Las mediciones en la regeneración natural de M. flexuosa (Galeano, et al., 2015) mostraron una variación espaciotemporal característica. Además de la variabilidad geomorfológica a pequeña escala y mostraron diferencias en la textura del suelo, el espesor de la capa orgánica, el drenaje y el nivel de inundación, así como en el área basal de las palmas adultas cercanas, y la distancia al bosque de tierra firme. Como en otras poblaciones gregarias, la distribución espacial de las plántulas está estrechamente relacionada con la heterogeneidad espacial de los suelos y la estructura del dosel (Svenning, 1999). Las plántulas de M. flexuosa dominaron los sitios con mayor inundación y peor drenaje, mientras que en los sitios mejor drenados crecieron herbáceas como Calathea striata Huber y Adiantum latifolium Lam. Y abundante regeneración de plántulas de Lepidocaryum tenue Mart., palma típica del sotobosque del bosque de tierra firme.
En los tres periodos de medición se presentaron diferencias significativas entre la mortalidad, el reclutamiento y la supervivencia de las plántulas y en todos los casos la mortalidad fue mayor que la supervivencia, asociada negativamente con el área basal y la altura de los árboles de otras especies. Mientras que el reclutamiento de M. flexuosa se relacionó positivamente con los niveles de inundación y el pH del agua, pero negativamente con las mejores condiciones de drenaje y la altura de M. flexuosa en el dosel. La supervivencia de las plántulas fue menor en las zonas mejor drenadas.
Aunque la tasa de sedimentación anual medida no presentó relaciones claras con la dinámica de la regeneración natural, la tendencia entre 1960 y 1990 de las tasas de sedimentación en esta zona analizada por secciones de sedimentos, utilizando 210 Pb, fue decreciente en los sitios mal drenados y creciente hacia los sitios con buen drenaje. Sin embargo, desde 1990, estas tendencias se invirtieron mostrando mayor incremento en la sedimentación en las zonas mal drenadas, lo que podría afectar los patrones de la regeneración de M. flexuosa en el futuro cercano, teniendo en cuenta que no se encontraron plántulas de esta especie en los sitios mejor drenados.
Estos cambios en la sedimentación, están estrechamente relacionados con los cambios en los patrones estacionales de la precipitación y los aportes de los sedimentos aluviales, especialmente en lo que se refiere a su incremento en las épocas de mayores niveles de inundación y desborde de los cauces de los ríos sobre los bosques. De hecho, las mayores tasas de mortalidad de M. flexuosa se presentaron hacia el final del 2010 cuando predominaron las condiciones de El Niño y no se presentó inundación en sitios con drenaje moderado, mientras que el mayor reclutamiento se presentó a comienzos del 2012 cuando prevalecieron las condiciones de La Niña y se inundaron, inclusive, los sitios bien drenados, posterior a un periodo de abundante fructificación de la palma. Según el IPCC (2013) el Cambio Climático actual en la Amazonia está causando incrementos en la precipitación (y en las tasas de sedimentación, especialmente en zonas mal drenadas) y en la intensidad del ENSO, lo cual podría causar cambios en la geomorfología, la composición florística y la estructura de los bosques inundados (Whitmann, et al., 2010, Teixeira, et al., 2011).
A pesar de que en los tres tipos de manglar del Golfo de Urabá (Hoyos, et al., 2013) se registraron diferencias en la composición florística, asociadas a las variables ambientales (Urrego, et al., 2014), A. germinans fue la especie dominante en la regeneración natural (Figura 7) de todos los manglares. Mientras en los manglares de borde R. mangle fue la segunda especie en importancia, en los de cuenca y ribereños o mixtos, el segundo lugar lo ocupó L. racemosa, en proporciones similares a las de R. mangle. Según las mediciones de realizadas semestralmente entre agosto de 2009 y julio de 2010, R. mangle presentó la mayor supervivencia, L. racemosa la mayor mortalidad y A. germinans el mayor reclutamiento. Las altas tasas de sedimentación determinaron el reclutamiento de A. germinans, mientras la cantidad de luz que alcanza el sotobosque fue clave para la supervivencia de R. mangle. Como en otros manglares, en la época lluviosa se presenta un descenso en la supervivencia de las plántulas y en la época seca se favorece el balance entre el reclutamiento y la mortalidad. Estos manglares reciben una alta carga de sedimentos producto del impacto de la desviación del lecho principal del río Turbo en 1954, lo que afectó la dinámica fluvio-marina, al generar grandes aportes de sedimentos sobre los bosques, así como cambios en la textura, el drenaje y la materia orgánica en los suelos. De hecho, la mortalidad se relacionó inversamente con la distancia al río Turbo. Incremento en la carga de sedimentos depositados llevo al aumento de la mortalidad de plántulas en los manglares de las islas del Rosario (Galeano, et al., 2017).
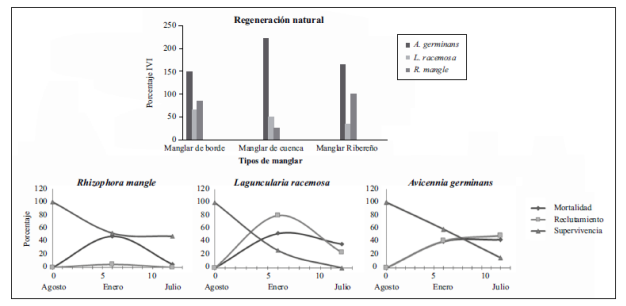
Figura 7 Índice de valor de importancia de las tres principales especies de manglares (superior) después de tres periodos semestrales de evaluación en los que predominó A. germinans en los tres tipos de manglares. Dinámica de la regeneración natural de estas especies en el manglar de borde (inferior). R. mangle presentó la mayor supervivencia, L. racemosa la mayor mortalidad y A. germinans el mayor reclutamiento.
La alta dominancia de A. germinans en la regeneración es reflejo, en primer lugar, de su dominancia en el dosel, la cual es generada por las altas tasas de aprovechamiento de los árboles de R. mangle (Blanco, et al., 2012), lo que a su vez - incrementa la cantidad de luz disponible para la regeneración. En segundo lugar, las altas tasas de acumulación de sedimentos, han llevado a elevar el nivel del sustrato, a disminuir los niveles de inundación y a incrementar la salinidad en el suelo por la alta evaporación, por ser A. germinans la más tolerante a tales condiciones (Hogarth, 2007).
En la segunda medición, se registró un cambio importante en la mortalidad y supervivencia de las plántulas de las tres especies asociado al mar de leva registrado en enero de 2009 (Lacambra, et al., 2003), el que incrementó los niveles de inundación, la velocidad del viento, la altura y la energía del oleaje en la costa Caribe, lo cual se consideró un factor importante en la mortalidad de las plántulas (Reyes de la Cruz, et al., 2002). No obstante, la mayor supervivencia tanto a la alta sedimentación, como a los altos niveles de inundación registrados durante el mar de leva, la presentaron las plántulas de R. mangle. El mayor tamaño de los propágulos de esta especie le permite adaptarse mejor a suelos inestables y altos niveles de inundación, y representa una ventaja competitiva respecto a las otras dos especies de manglar (McKee, 1995, Reyes de la Cruz, et al., 2002). La dinámica de la regeneración en ambos ecosistemas se vio influenciada por los eventos climáticos extremos asociados al ENSO en ambas anomalías, lo cual plantea un desafío para la supervivencia de las especies ante la intensificación del fenómeno, proyectada por el IPCC (2013), la cual se puede acentuar con la intensificación de las actividades antrópicas.
Impacto Antrópico
En los últimos siglos, los cambios en los humedales forestales y particularmente en los manglares, no se pueden desligar de los impactos de la actividad antrópica, si se tiene en cuenta que ambos ecosistemas han sido subestimados, a pesar de los servicios ecosistémicos que ofrecen. En el caso de los manglares, éstos fueron reemplazados por el auge de las plantaciones de palma de coco alrededor de 1850, en San Andrés (González, et al., 2010), en Isla del Rosario (datos no publicados) y en Cispatá alrededor de 1850 AD; algunos fueron reemplazados por cultivos de arroz (Castaño, et al., 2010). En algunos sitios los manglares han sido aprovechados para la extracción de madera para construcción de viviendas y barcos, especialmente R. mangle por la alta durabilidad y resistencia de la madera, y reemplazados por pastizales para ganadería (Urrego, et al., 2018) y zonas urbanizadas (Suárez, et al., 2015). Igualmente, la construcción de carreteras, represas y estolones alteran la dinámica fluviomarina, como, o la desviación de ríos y caños que dejan los bosques sin el insumo de agua dulce (e.g río Turbo, río Sinú, río Patía), con las consecuentes y graves repercusiones ecológicas. La cercanía a centros poblados en el Golfo de Urabá, el desarrollo estructural de los árboles de manglar refleja la influencia antrópica al disminuir la abundancia de plántulas y plantones de R. mangle con la cercanía a los centros poblados, y aumentar las de A. germinans, especie más tolerante a la salinidad y la sedimentación.
Conclusiones
A pesar de la marcada la influencia marina sobre los manglares, éstos guardan similitudes con los cananguchales. Su dominancia sobre los bosques vecinos obedece al deterioro del drenaje, al aumento de la inundación y al espesor del horizonte orgánico en los suelos. En ambos se incrementó la diversidad con la disminución progresiva de las condiciones de estrés a lo largo del gradiente ambiental, lo que facilita la colonización de especies de los bosques vecinos. Los cambios climáticos post-glaciales que determinaron la colonización de las especies dominantes (M. flexuosa y R. mangle), y los niveles de precipitación, inundación y temperatura del máximo térmico Holocénico posibilitaron el establecimiento y expansión de cananguchales y, con la estabilización de los niveles del mar, la de los manglares alrededor de 4000 AP. Los cambios climáticos registrados desde entonces causaron contracción o expansión de estos bosques. El actual cambio climático, especialmente las sequías asociadas al ENSO, han influido en la productividad y los patrones reproductivos de ambas especies dominantes, las cuales respondieron positivamente a eventos de sequía de corta duración. Igualmente, los incrementos en la sedimentación y la inundación, así y como los eventos del mar de leva en los manglares, han incidido en las tasas de mortalidad, reclutamiento y supervivencia de la regeneración natural en ambos ecosistemas. Las mayores pérdidas de manglares en las últimas décadas se asocian al Cambio Climático, especialmente a la erosión costera generada por el incremento en el nivel del mar y las actividades antrópicas. Las ganancias se asocian con la mayor inundación y deposición de sedimentos aluviales.














