Introducción
La ecología de la restauración es la disciplina que se encarga de proporcionar conceptos, modelos, experimentos y métodos de apoyo a la práctica de la restauración ecológica (Society for Ecological Restoration, SER, 2004). Para el caso de trabajos con ecosistemas ribereños, la restauración ecológica busca aumentar la cobertura vegetal nativa, mantener las relaciones ecológicas y mejorar la interacción de los componentes bióticos y abióticos (Jarro & Montoya, 2004). El bosque de ribera cumple varias funciones ecológicas de importancia crítica (Sievers, et al., 2017), entre ellas, la regulación de la temperatura, la filtración y la retención de nutrientes (Musetta, et al ., 2017) y la reducción de la escorrentía superficial (Chase, et al ., 2016); simultáneamente, proporciona el hábitat y facilita el tránsito de organismos silvestres entre parches de vegetación, tanto en ambientes fragmentados como continuos (Derugin, et al., 2016), gracias a que el ancho de estas áreas puede favorecer el establecimiento de fauna (Montilla & Pacheco, 2017).
Las aves son uno de los grupos faunísticos claves en procesos de regeneración de bosques por su papel en la dispersión de semillas (Marthy, et al ., 2017), pero algunas especies evitan visitar lugares degradados debido a la poca disponibilidad de frutos, la ausencia de sitios adecuados para descansar y la exposición a la depredación (McClanahan & Wolfe, 1993; Graham & Page, 2012), lo cual puede representar una barrera para la regeneración de los bosques (Holl, 1999; Renjifo, 1999; Wright, et al ., 2016).
Dadas las dificultades de las aves en el proceso de dispersión de semillas, las cuales les impiden llegar a lugares alejados de los parches de bosque (Holl, 1998; Holl, et al ., 2011), varios autores han propuesto las perchas artificiales como un mecanismo que puede aumentar la llegada de aves dispersoras de semillas en espacios abiertos y así enriquecer el banco de semillas del suelo (Vicente, et al ., 2010; Athiê & Dias, 2016). Estas estructuras pueden actuar con mayor eficacia si están cerca al borde de bosque, ya que algunos gremios de aves las utilizan durante el forrajeo, el descanso y el tránsito entre fragmentos (Holl, 1998; Graham & Page, 2012; Hooper, et al ., 2005; Vogel, et al ., 2016).
La eficacia de las perchas artificiales se ha probado mediante el registro de las aves que se posan en ellas (Velasco & Vargas, 2004; Vogel, et al ., 2016), aunque esta no es la única forma de comprobar su utilidad y actualmente se hace énfasis en su finalidad principal de reclutamiento de plántulas bajo ellas (Reid & Holl, 2013). El reclutamiento puede registrarse al inicio y al final del experimento y se le considera un indicador más apropiado de la efectividad de las perchas artificiales (Guidetti, et al ., 2016; Reid & Holl, 2013). Existen varios tipos y configuraciones de perchas artificiales (McDonnell & Stiles, 1983; Reis, et al ., 2003); generalmente, las más utilizadas por razones de costo, instalación y efectividad son las perchas artificiales de varas cruzadas, que han arrojado mejores resultados en cuanto al número de visitas, de semillas y de plántulas reclutadas bajo ellas, en comparación con las perchas de cables aéreos y plantas enredaderas (Graham & Page, 2012; Dias, et al ., 2014; Athiê & Dias; 2016; Vogel, et al ., 2016).
En la microcuenca del río La Vega bajo estudio hay problemas como la introducción de especies vegetales invasoras, el uso del suelo con fines agropecuarios y la minería a cielo abierto, actividades que conllevan la pérdida de funciones del ecosistema como la regulación (caudal y sedimentos del río, prevención de erosión e inundaciones) y la disponibilidad del hábitat para fauna y flora (De Groot, et al ., 2002; Gómez-Baggethun & de Groot, 2007).
En este sentido, el presente estudio tuvo como objetivo evaluar la eficacia de las perchas artificiales en la dispersión de semillas ornitócoras como estrategia de restauración en la ribera del río la Vega (Tunja, Boyacá), así como identificar las especies de aves dispersoras y las especies vegetales dispersadas en esta microcuenca.
Materiales y métodos
El estudio se extendió durante un año, desde septiembre de 2015 hasta agosto de 2016, en la microcuenca del río La Vega, localizada en la cordillera oriental colombiana, entre el municipio de Motavita y la ciudad de Tunja en el departamento de Boyacá, a una altitud de 2.700 msnm (5º 36’ 36” N - 73º 26’ 24” O), con una temperatura media anual de 13,2 °C, humedad relativa del 80 % y una precipitación media anual de 702,9 mm de régimen bimodal con picos en los meses de abril a mayo y de octubre a noviembre (Centro de Información Meteorológica-UPTC, 2015, 2016). Estas características permiten clasificarla como una zona de vida de bosque seco montano bajo (bs-MB) (Holdridge, 1987). El área de estudio corresponde a un pastizal ribereño dominado por Cenchrus clandestinus y, en menor proporción, por Holcus lanatus, Anthoxanthum odoratum, algunos arbustos de Dodonaea viscosa, Baccharis macrantha, y parches de retamo liso (Genista monsspesulana); a lo largo de la microcuenca se desarrollan actividades pecuarias, pero en el sitio del experimento el pastizal fue abandonado hace aproximadamente 10 años. Las coberturas vegetales cercanas corresponden a matorrales mixtos, con presencia de especies nativas como Croton purdei, Xylosma spiculifera, Hesperomeles goudotiana, Baccharis macrantha y Muehlenbeckia tamnifolia. También se presentan plantaciones de especies forestales (Acacia decurrens y Eucalyptus globulus) y una población mínima de alisos (Alnus acuminata).
Montaje experimental. Para evaluar la eficacia de perchas artificiales en el área de la ribera se elaboró un diseño con tres tratamientos: a) T0: sin perchas, b) T1: con perchas artificiales y c) T2: con perchas naturales (Figura 1). En cada tratamiento se instalaron 10 trampas para semillas (n=30). Las trampas se elaboraron con polietileno multicapa en forma piramidal, soportadas en una estructura de PVC de 60 cm de altura, y un área de 3.600 cm2. En la parte inferior de cada trampa se colocó un vaso de plástico para la retención de las semillas, con orificios laterales como sistema de drenaje (Gorchov, et al ., 1993; Graham & Page, 2012). Con el fin de ampliar el reclutamiento de plántulas, se escarificó una parcela de 1 m2 al lado de cada trampa de semillas. La escarificación consiste en retirar la capa de pastizal dejando el suelo expuesto y ‘descompactado’ hasta una profundidad de 36 cm (Barrera, et al., 2010; Reyes, et al., 2014). Cada parcela fue aislada con una zanja de 30 cm de ancho por 30 cm de profundidad para evitar la invasión de estolones, rizomas y retoños. Antes de la escarificación se hizo el registro de las especies presentes en las parcelas, de su cobertura y frecuencia, delimitando un área de 1 m2, (Mueller-Dombois & Ellenberg, 1974; Ramírez, 2006), y cada tres meses se registraron las mismas variables durante el año de estudio.
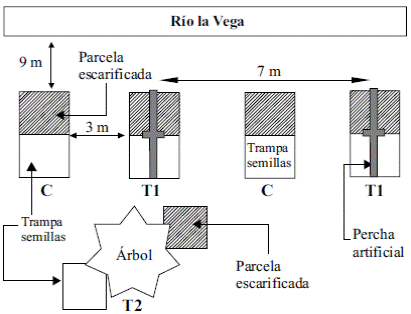
Figura 1 Vista de los tres tratamientos empleados. Se muestran dos réplicas del tratamiento con perchas artificiales, T1, dos réplicas del control, C, y una del T2. Las trampas están representadas por los cuadros blancos y las parcelas escarificadas por los cuadros rayados.
Las diez perchas artificiales elaboradas para el tratamiento T1 se ubicaron de forma paralela a una distancia de 9 m del cauce del río; constaban de postes de 2,5 m de alto y 4 cm de ancho y una vara cruzada con una longitud de 1,70 m y 3 cm de ancho unida en la parte superior de forma horizontal (Holl, 1998; Holl & Kappelle, 1999). Las diez perchas naturales (T2) fueron cuatro árboles de A. decurrens, tres de A. acuminata y tres de C. purdiei de más de 2 m de altura escogidos al azar de las especies presentes dentro de dos parches de vegetación cercanos.
El contenido de las trampas para semillas se recogió cada 20 días durante el año de estudio. Las semillas se recolectaron a partir de frutos maduros de las especies presentes en el área de estudio y se identificaron en el laboratorio con ayuda de un estereoscopio. Como respaldo se consultaron trabajos de recolección de semillas en áreas de bosque alto andino (Alarcón & Parada, 2009; Rosero, 2010). Para clasificar el mecanismo de dispersión de las semillas, se tuvo en cuenta si estaban envueltas en las excretas y se corroboró consultando la literatura especializada (Mahecha, et al ., 2004).
Identificación de aves dispersoras. Para las observaciones se utilizaron siete puntos de conteo intensivos (Ralph, et al., 1996) distribuidos dentro de los parches de vegetación aledaños y el pastizal del área ribereña (sitio de estudio); el tiempo de conteo fue de 15 minutos por punto desde las 06:00 hasta las 11:00 y de las 15:00 a las 17:00 horas durante cuatro días al mes a lo largo del año de estudio; se utilizaron binoculares de 10x50, grabadora, cámara digital y guía de campo especializada (Asociación Bogotana de Ornitología - ABO, 2000). Para identificar las semillas consumidas, se abrieron cuatro redes de niebla (12 x 2,6 m con ojo de malla de 30 mm), una por cada tipo de cobertura, pastizal, matorral y plantación forestal, entre las 6:00 y las 11:00 horas durante tres días al mes a lo largo del año de estudio (Villarreal, et al., 2004), las cuales se revisaban cada 20 minutos para prevenir muertes, lesiones o depredación (Villarreal, et al ., 2004). Una vez liberada de la red, el ave se introducía durante 20 a 30 minutos en una bolsa de tela de algodón para obtener sus excretas con las semillas (Gorchov, et al., 1993), y estas se identificaban utilizando la colección de referencia y trabajos previos sobre dispersión (Alarcón & Parada, 2009; Rosero, 2010); las aves capturadas fueron fotografiadas y seguidamente liberadas.
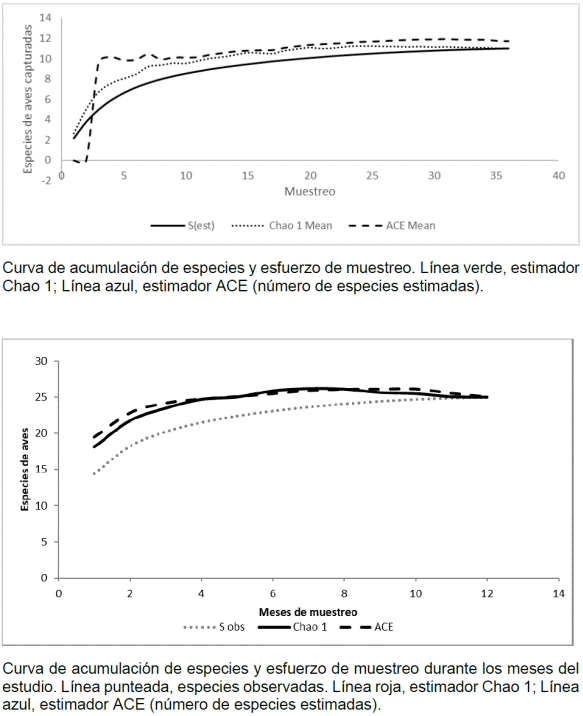
Análisis de datos. Para conocer la representatividad del muestreo y la riqueza de especies de aves en el área de estudio, se proyectaron curvas de acumulación agrupando los muestreos por meses (Villarreal, et al ., 2004). Se utilizaron los estimadores no paramétricos Chao 1 y ACE (anexo 1, https://www.raccefyn.co/index.php/raccefyn/article/downloadSuppFile/625/3000) para la estimación de la abundancia de las especies (Colwell & Elsensohn, 2014). Para evaluar la importancia de cada especie de ave como agente de dispersión se calculó un índice de importancia de dispersión (IID= (S * B) /1000) basado en la abundancia relativa de especies capturadas (B) y el porcentaje de muestras fecales con semillas obtenido de cada especie de ave (S). Las muestras que contenían por lo menos una semilla se contaron como un evento, aquellas con dos especies de semillas se contaron como dos, y así sucesivamente. Este índice oscila entre 0 y 10, el cero representa la ausencia de semillas en las excretas y el 10, una única especie de ave que dispersa todas las semillas (100 % de abundancia relativa). Este índice se tomó y se adaptó con base en los estudios de Aguilar, et al . (2014) y de Galindo, et al . (2000). Se aplicó la prueba de Shapiro-Wilk para comprobar el supuesto de normalidad y luego el test de Kruskal-Wallis, seguido de la prueba de U Mann-Whitney, para identificar diferencias por pares entre los tratamientos. Se utilizó la prueba de correlación de Spearman para evaluar el grado de correlación entre las semillas recolectadas en las trampas y las precipitaciones de la zona (datos obtenidos de la estación climatológica del IDEAM ubicada en la UPTC- Tunja, 2015-2016). Se obtuvieron índices de diversidad de Shannon que luego se compararon con la prueba T de Hutchenson y se aplicó el índice de Berger-Parker para calcular la dominancia. Para evaluar las diferencias en la cobertura de las parcelas escarificadas entre muestreos, se aplicó la prueba de Friedman. Los análisis de diversidad se hicieron con PAST 3.15 y todas las pruebas estadísticas y gráficas con el programa R Wizard, versión 3.4 (Guisande, et al. , 2014). Las curvas de acumulación se elaboraron con el programa EstimateS 9,1 (Colwell & Elsensohn, 2014)
Resultados
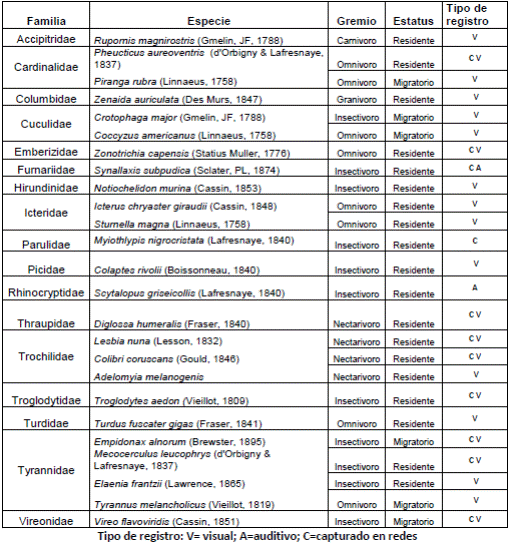
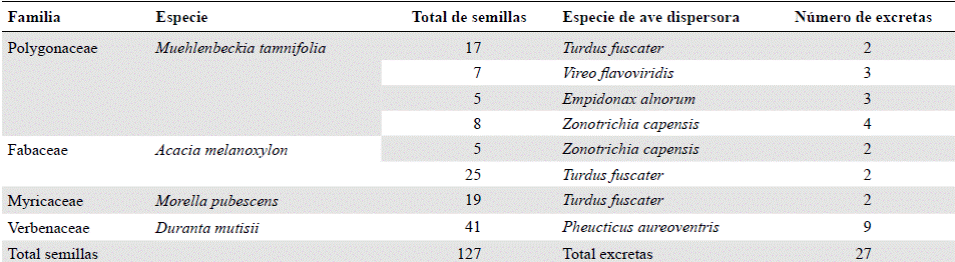
Identificación de aves y semillas. Mediante los registros visuales y auditivos, así como con las capturas, se reconocieron un total de 25 especies de aves pertenecientes a 17 familias (anexo 2, https://www.raccefyn.co/index.php/raccefyn/article/downloadSuppFile/625/3001), entre las cuales se destacaron Synallaxis subpudica, por ser endémica de los departamentos de Boyacá y Cundinamarca, y Empidonax alnorum, Coccyzus americanus y Vireo flavoviridis, por ser migratorias boreales (Naranjo, et al ., 2012). En las redes de niebla se capturaron 11 especies de aves de las cuales se obtuvo un total de 82 excretas, compuestas, en su mayoría, por partes de artrópodos y restos de hojas y ramas; solo 27 excretas depositadas por cinco especies de aves contenían semillas (Tabla 1).
Tabla 1 Semillas presentes en las excretas de las aves. Se identifican las especies de plantas a las que corresponden, las especies de aves dispersoras y el número de excretas con semillas por especie.
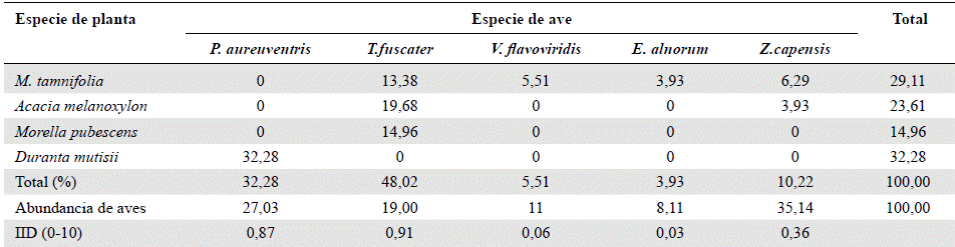
Índice de importancia de dispersión. Los registros evidenciaron que Turdus fuscater fue la especie que más semillas dispersó, con un índice de importancia de dispersión (IID) de 0,91, que corresponde al 48 % de las semillas totales; en sus excretas se encontraron: A. melanoxylon, Morella pubescens y M. tamnifolia. La segunda especie en importancia fue Pheucticus aureoventris con un IID de 0,87 y 32,2 % de semillas dispersadas; por su parte, Zonotrichia capensis, E. alnorum y V. flavoviridis tuvieron el IID más bajo (Tabla 2).
Tabla 2 Índice de importancia de dispersión (IID) de las especies dispersadas por aves en la microcuenca del río La Vega. Se muestra el porcentaje de semillas en las muestras (n=127).
Identificación y cuantificación de semillas en las trampas. Durante el año de estudio se recogieron 4.821 semillas en las trampas: 749 (16 %) en el tratamiento de control (sin percha), 1.313 (27 %) bajo las perchas artificiales y 2.759 (57 %) bajo las perchas naturales. El 20,24 % (976) de las semillas fueron dispersadas por aves y el resto mediante mecanismos de dispersión anemócora, barócora o varios mecanismos (policoria). Se descartó la quiropterocoria debido a que las especies reportadas en el área son insectívoras (Alcaldía de Tunja, 2013) y hay que tener en cuenta que los murciélagos evitan perchar y transitar en áreas abiertas (como las del sitio donde se instalaron las perchas artificiales), debido a la mayor probabilidad de depredación por aves rapaces (Estrada, et al ., 2007).
Para evaluar la eficacia de las perchas artificiales solo se consideraron las semillas ornitócoras (n=976). El test de Kruskal-Wallis (ji al cuadrado=47.08; df=2; p=5,979, e-11<0,05) evidenció diferencias significativas entre los tratamientos (Figura 2), en tanto que la prueba de U Mann- Whitney evidenció diferencias significativas entre el tratamiento con perchas artificiales y el de perchas naturales (W=390; p=1,818; e-07<0,05).
Se identificaron diez especies de semillas recolectadas en las trampas, pertenecientes a nueve familias, entre las que se destacaron la Betulaceae, con 1.949 semillas, seguida de la Fabaceae, con 1.857 semillas. Por otro lado, entre las semillas dispersadas por aves (n=976), las más abundantes fueron las de M. pubescens (41,2 %, n=402) y A. melanoxylon (30,6 %, n=299) (Tabla 3).
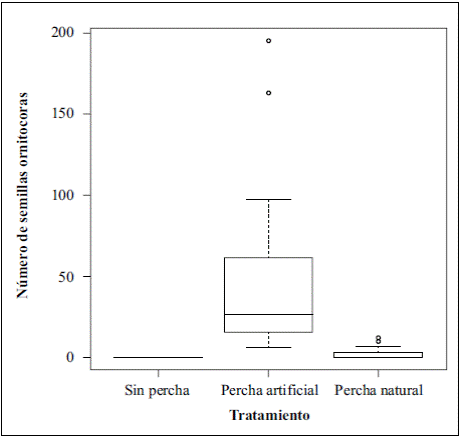
Figura 2 Diagrama de caja que evidencia las diferencias en el número de semillas ornitócoras recolectadas en las trampas de los tres tratamientos durante el año de estudio en la microcuenca del río La Vega.
Tabla 3 Cantidad de semillas dispersadas por aves encontradas en las trampas de los tres tratamientos
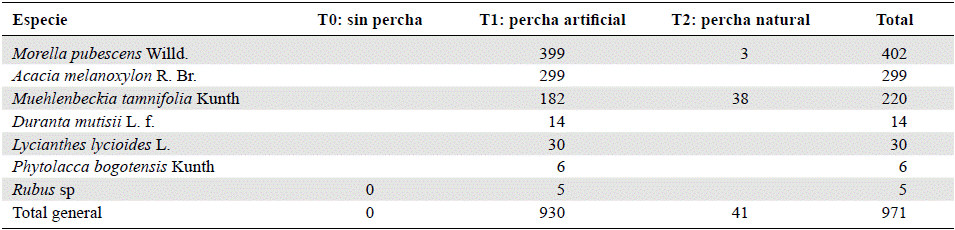
Correlación entre la precipitación y las semillas en las trampas. No se evidenció una correlación entre la precipitación y las semillas ornitócoras recolectadas en las trampas (prueba de Spearman: p=0,140). El número más alto de semillas se registró entre julio y agosto de 2016 (n=267 semillas), y el más bajo, en septiembre de 2015 (n=28 semillas); los meses con mayor número de semillas no coincidieron con el mes de mayor precipitación (abril de 2016, con 96,2 mm), ni con el mes de menor precipitación (febrero de 2016, con 3,1 mm). Se puede inferir que el número de semillas podría relacionarse con la fenología de las plantas ornitócoras más dominantes y no con la precipitación.
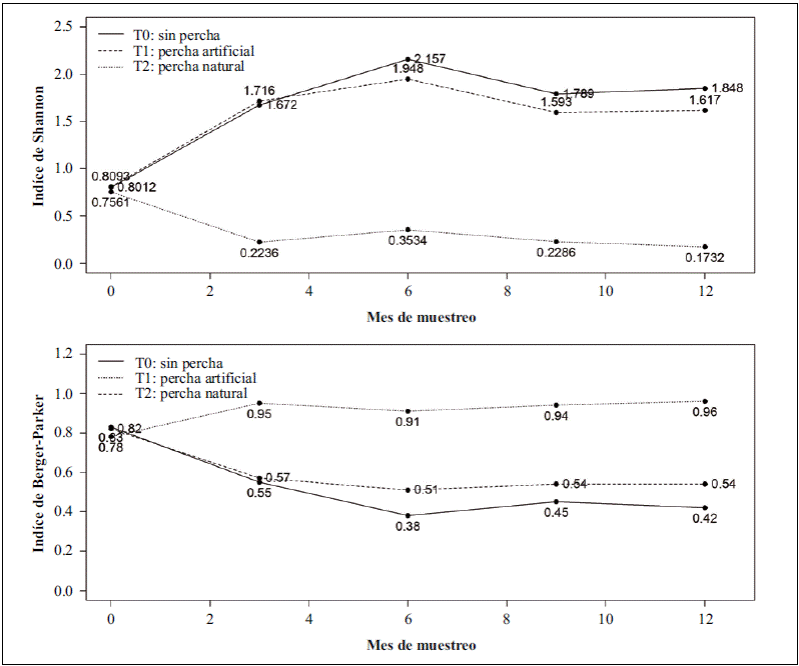
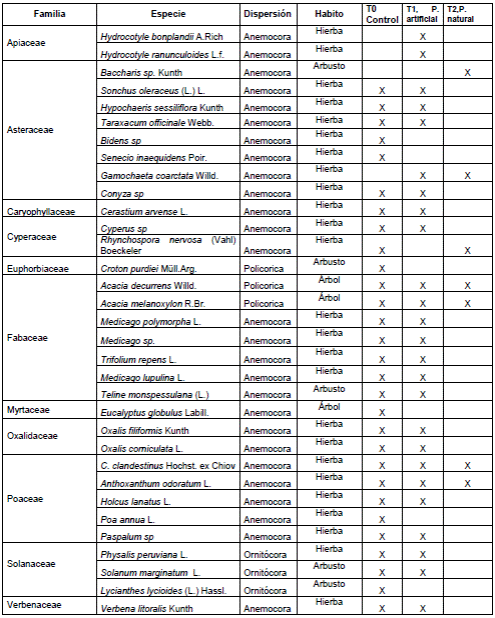
Reclutamiento y dinámica de la sucesión en las parcelas escarificadas. Durante los 12 meses de seguimiento de los tres tratamientos en las parcelas escarificadas se registraron 33 especies de plantas distribuidas en 11 familias (anexo 3, https://www.raccefyn.co/index.php/raccefyn/article/downloadSuppFile/625/3002). Las familias con mayor número de especies fueron: Asteraceae con ocho especies (24,2 %), Fabaceae con siete (21,2%), Poaceae con cinco (15,2%), Solanaceae con tres (10 %), Apiaceae, Oxalidaceae y Cyperaceae con dos especies cada una (5,9 %), y, por último, Caryophyllaceae, Myrtaceae y Verbenaceae, con una especie cada una. La mayoría de estas especies tienen mecanismos de dispersión anemócora (87,1 %), un 6,45 % corresponde a ornitócoras y el otro 6,45 % a especies polícoras. Tres especies nativas de la familia Solanacea con dispersión ornitócora germinaron en las parcelas durante el estudio: Physalis peruviana, Solanum crinitipes y Lycianthes lycioides. Al aplicar el índice de diversidad de Shannon (H’) por tratamiento en cada muestreo, se encontró que el tratamiento de percha natural presentó los valores más bajos con respecto a los otros tratamientos; por su parte el tratamiento de control y el de perchas artificiales presentaron índices similares a lo largo del estudio (Figura 3). Utilizando los valores del índice en el último mes, se aplicó la prueba T de Hutchenson entre tratamientos: T0-T1 (4,38=0,00001< 0,05); T0-T2 (37,33=0,0< 0,05), y T1-T2 (29,6=0,0< 0,05), con lo que se evidenciaron diferencias significativas. Por otra parte, los valores en el índice de dominancia de Berger-Parker evidenciaron diferencias significativas entre las parcelas de los tratamientos (Kruskal-Wallis: ji al cuadrado=8,6705; df=2; p=0,0131<0,05), específicamente entre el tratamiento de percha natural y el de control (U M-Whitney: p=0,021 <0,05). En la comparación de las coberturas entre los muestreos mediante la prueba de Friedman se comprobó que existieron diferencias durante los meses de estudio (ji al cuadrado=57,886; df=4; p=8,062, e-12<0,05).
Discusión
Las perchas artificiales incrementaron la deposición de semillas en el área de ribera tal y como se ha observado en otros estudios con estas estructuras (Graham & Page, 2012; McClanahan & Wolfe, 1993; Vogel, et al ., 2016). La deposición de semillas fue significativamente más alta debajo de las perchas artificiales en comparación con el control sin perchas, lo cual se debe a que las aves defecan más cuando se posan que durante el vuelo (Wunderle, 1997). Bajo las perchas naturales (árboles) se presentó menos deposición de semillas que bajo las perchas artificiales, en contraposición a lo que mencionan Athiê & Dias (2016), según los cuales las perchas naturales ofrecen recursos como frutas, insectos y protección que pueden contribuir a una mayor deposición. Por el contrario, en este estudio los árboles eran de dispersión anemócora y, por lo tanto, no brindaban frutos atractivos para las aves (Pedley, 1978; Salazar & Jøker, 2000; Solorza, 2012). En este tratamiento la escasa lluvia de semillas podría haber sido causada por la arquitectura de los árboles, puesto que las ramas y el follaje impedían la caída de algunas excretas en las trampas (Zwiener, et al ., 2014).
Las semillas de tres especies de plantas sobresalieron en las deposiciones recolectadas en las trampas: A. melanoxylon, M. pubescens y M. tamnifolia, plantas que se caracterizan por producir gran cantidad de frutos pequeños, algunos coloridos y jugosos, como M. tamnifolia, que atraen aves oportunistas (Snow, 1971; Solorza, 2012), pues su pulpa está compuesta de azúcares y agua y tienen bajo contenido proteico, lo que ayuda a una digestión rápida y promueve una mayor frecuencia de consumo (Levey, 1987; Restrepo, et al ., 1999). Se debe insistir en que M. tamnifolia ofreció frutos durante gran parte del estudio, lo cual se reflejó en las deposiciones recogidas en las perchas artificiales. Según Howe (2016), este tipo de especies dependen de la sobreabundancia de frutos para atraer dispersores. De todas maneras, el reclutamiento de plántulas de esta especie fue limitada en las parcelas escarificadas. Según Norden (2014), existen varios filtros ecológicos que restringen la regeneración natural de la mayoría de plantas en los bosques subtropicales; en el caso de M. tamnifolia, las variables ambientales y los factores edáficos pudieron impedir la germinación y posterior establecimiento de las semillas (Engelbrecht, et al ., 2007; Norden, 2014).
Por otra parte, A. melanoxylon, especie exótica de origen australiano, tiene semillas negras lustrosas y un funículo rojo que las rodea como principal recurso para atraer aves (Solorza, 2012), y sus semillas abundaron durante todo el año en las trampas de los tres tratamientos, lo cual concuerda con lo señalado por Pedley (1978) en cuanto a que la floración y fructificación de esta especie puede producirse durante todo el año, en especial en zonas con baja pluviosidad anual, como ocurre en el área de estudio. Las plantas exóticas invasoras generalmente producen frutos en tiempos de escasez para contrarrestar la competencia de los dispersores de especies nativas, facilitando así su propagación y la colonización de nuevos sitios (Gosper, et al ., 2005). Las semillas del laurel de cera, M. pubescens, fueron las más abundantes bajo las trampas del tratamiento con perchas artificiales durante los meses de junio y julio, lo cual concuerda con el periodo de fructificación reportado por Mahecha, et al . (2004). Esta planta ofrece frutos en abundancia y ha sido estudiada por su capacidad para asociarse con hongos y bacterias del suelo (Urgiles, et al ., 2014).
En los tres tratamientos propuestos fue constante y abundante el número de semillas de A. acuminata, especie dispersada por el viento y presente en un parche cercano al experimento. En este sentido, en varios estudios los autores concuerdan en que la presencia o ausencia de perchas artificiales no influye en la dispersión de especies anemócoras (Dias, et al ., 2014; Ingle, 2003). En las parcelas escarificadas no se encontraron plántulas de aliso, lo cual indicaría una baja capacidad de aporte a la regeneración natural (Norden, 2014). Además, las plantaciones de alisos se comportan más como un inhibidor de la regeneración natural que como un catalizador (Murcia, 1997).
Aves y semillas dispersadas en la microcuenca. Las especies de aves encontradas en la zona de estudio se han registrado en altitudes similares (Amaya-Villareal & Renjifo, 2010; Stiles & Rosselli, 1998), sin embargo, la avifauna del sitio se puede catalogar como empobrecida si se compara con los estudios llevados a cabo en bosque alto andino, como el de Amaya-Villareal & Renjifo (2010), en el cual se registraron 40 especies de aves. Algunas de las aves encontradas en el presente estudio son de hábitos generalistas, como la mirla negra (T. fuscater); no se encontraron tinamúes, pavas, trogones y tucanes, aves propias de los bosques andinos conservados (Kattan, et al., 1994; Renjifo, 2001). La mayoría de las aves que frecuentan las zonas perturbadas, como la estudiada, son omnívoras y basan su dieta en insectos y frutos de plantas pioneras y ruderales, comunes en los bordes de bosque y en sitios con vegetación secundaria (Jordano, et al ., 2006).
La familia más representada fue la Tyrannideae con cuatro especies (E. alnorum, Mecocerculus leucophrys, Elaenia frantzii yTyrannus melancholicus). Según Athiê & Dias (2016) y Vogel, et al. (2016), estas aves se alimentan tanto en los bordes de bosque como de plantas aisladas, y capturan insectos en áreas abiertas a donde llevan semillas de especies pioneras, acelerando la regeneración natural. La única especie de esta familia que pudo ser capturada en este estudio fue E. alnorum, también conocido como atrapamoscas alisero, en cuyas excretas se encontraron semillas de M. tamnifolia. Esta familia de aves utiliza las perchas para tener mayor visibilidad del espacio aéreo y capturar insectos en vuelo (Bocchese, et al ., 2008). Por su parte, T. fuscater registró el IID más alto, debido a que dispersó tres especies: M. tamnifolia, A. melanoxylon y M. pubescens, posiblemente por sus hábitos generalistas que le permiten forrajear consumiendo frutos enteros, aunque esta característica depende del tamaño y la accesibilidad del fruto (Renjifo, 1999), además, es una especie clave en la regeneración de sitios alterados (Velasco & Vargas, 2004) y por su condición generalista es recurrente en los ecosistemas alto andinos, adaptando su dieta y comportamiento al ambiente particular en el cual se encuentre (Rosselli, Zerda, & Candil, 2017; Stiles & Rosselli, 1998)
La especie más dispersada por aves fue M. tamnifolia, con cuatro dispersores, quizás por su oferta de frutos durante gran parte del año (Mahecha, et al ., 2004). El bajo peso, la forma, el color, el pequeño tamaño y la gran cantidad de sus frutos aumentan la preferencia de las aves y su dispersión, lo que los diferencia de los de otras especies que son de gran tamaño y no muy dispersadas porque su consumo es difícil para las aves de pico pequeño (Jordano, 2000). Por el contrario, una especie con frutos relativamente grandes (D. mutisii) se encontró en las excretas de P. aureoventris, un ave cuyo pico más fuerte y grande le permite alimentarse con frutos de mayor tamaño (Gosper, et al ., 2005). Algunos investigadores han relacionado las variaciones de forma y tamaño del pico como un mecanismo para reducir la competencia interespecífica por el aprovechamiento de recursos en los ensambles de aves (Eriksson, 2016; Pegman, et al ., 2016).
Los resultados muestran que la zona está dominada por especies de plantas exóticas que ofrecen recursos aprovechados por aves generalistas. Es probable que la falta de especies frugívoras especialistas se deba a su baja tolerancia para establecerse en áreas alteradas, como la zona de estudio (Gomes, et al ., 2008), de manera que el bajo número de especies dispersadas por aves sería el resultado de una limitada riqueza de plantas nativas productoras de frutos (Zahawi, et al ., 2013). Se puede decir que el área está transformada si se compara con la de estudios como el de Burgos, et al . (2003), donde las aves dispersaron otras plantas con frutos como Viburnum thryphyllum, Miconia squamulosa, Shefflera bogotensis y Hedyosmum bonplandianum.
En cuanto a los patrones de dispersión y precipitación, la deposición de semillas ornitócoras no tuvo relación con la época de lluvias, contrario a lo hallado para otros trabajos en los trópicos, en los cuales la dispersión por animales es más común durante la época húmeda y se ve influenciada por el patrón de fructificación de las plantas (Athiê & Dias, 2016; Zanini & Ganade, 2005). La poca correlación entre la cantidad de semillas encontradas y la precipitación pudo deberse a las estrategias utilizadas por algunas especies para disminuir la competencia por dispersores, tal y como se observó en A. melanoxylon y M. tamnifolia, que tienen frutos en las épocas secas (Solorza Bejarano, 2012; Pedley, 1978), pero podría haber mayor relación con la transformación de la vegetación del sitio, el cual aloja muy pocas especies nativas.
Reclutamiento en parcelas escarificadas. El bajo número de plántulas de especies con mecanismo de dispersión ornitócora reclutadas en las parcelas de los tratamientos (P. peruviana, S. crinitipes y L. lycioides) pudo deberse al tiempo de estudio (12 meses), ya que según Shiels & Walker (2003), hay que darle más tiempo a las semillas dispersadas para germinar y establecerse, sin embargo, los resultados de este estudio concuerdan con el de Graham & Page (2012), en el cual el reclutamiento de plántulas no fue representativo en 19 meses de seguimiento. Es oportuno recalcar que no se encontraron las semillas de estas especies (P. peruviana, S. crinitipes y L. lycioides) en las trampas de ninguno de los tratamientos y las encontradas quizás fueron producto del banco de semillas del suelo. Con respecto al bajo reclutamiento de plántulas, existen factores como la predación de semillas, la erosión, la escasez de nutrientes en el suelo, la falta de precipitaciones y la competencia con plantas ruderales y exóticas (Guariguata, 1990; Walker, 1994), que se caracterizan por ser fuertes competidoras e invasoras, tales como C. clandestinus y las fabáceas T. monspesulana y A. melanoxylon. La gran dominancia y la poca riqueza de especies evidenciada en las parcelas debajo de los árboles es atribuible a la sombra y la hojarasca que producen, lo cual impidió el establecimiento de especies pioneras heliófilas (Caluff & Fiallo, 2008). En contraste, las parcelas de los tratamientos de control y de perchas artificiales tuvieron una diversidad mayor, debido a que condiciones como la alta luminosidad y la escasez de hojarasca permitieron el establecimiento de las especies (Caluff & Fiallo, 2008). Según, Graham & Page (2012), el ambiente debajo de las perchas puede no ser apto para todas las especies dispersadas allí, ya que algunas plántulas de especies de etapas de sucesión avanzadas no toleran los espacios abiertos y sus condiciones microambientales.
Conclusiones
Los resultados permiten concluir que las perchas artificiales aumentaron la dispersión de semillas en la zona de ribera. Sin embargo, el establecimiento de especies ornitócoras de estados de sucesión avanzados fue mínimo, ya que la germinación de algunas de las semillas dispersadas por las aves pudo verse limitada por las bajas precipitaciones de la zona y la competencia con especies de sucesión temprana. Aunque varios estudios han encontrado las mismas debilidades en la técnica con perchas artificiales (de Almeida, et al ., 2013), estas siguen utilizándose como apoyo en los proyectos de restauración ecológica, pues las estrategias que involucran fauna son limitadas y los restauradores no escatiman herramientas para recuperar los ecosistemas. Por otra parte, las especies de aves más abundantes fueron generalistas, las cuales están bien adaptadas a las zonas alteradas y lograron demostrar su importancia como dispersores de semillas. Por último, la efectividad de la escarificación para aumentar el reclutamiento de plántulas propias de la sucesión del bosque de ribera fue mínima, aunque debe tenerse en cuenta para estudios más extensos y en otros ecosistemas, ya que podría ser válida para cambiar y dinamizar la trayectoria de la sucesión ayudando a la germinación de especies dispersadas por aves y activando el banco de semillas del suelo.