Introducción
Melina (Gmelina arborea) es una especie de planta que pertenece a la familia Verbenecea y tiene la capacidad de desarrollarse en distintos hábitats que varían desde los húmedos hasta los secos. Es nativa de los bosques tropicales de India, Birmania, Sri Lanka y el sur de China (Umana, et al ., 2015). Esta especie es de gran interés debido a su rápido crecimiento y a las excelentes propiedades físicas y mecánicas de su madera (Salas-Rodríguez, et al., 2016; Anuagasi, et al ., 2017).
Las plantaciones de melina se ven amenazadas por insectos, plagas y organismos patógenos (Wingfield & Robison, 2004; Balu, et al ., 2015). Se han reportado 34 especies de insectos que las afectan, de los cuales el hemíptero Tingis beesoni causa la mayoría del daño foliar, en tanto que los hongos son los principales microorganismos causantes de enfermedades en los fustes de G. arborea (Balu, et al., 2015; Umana, et al ., 2015), destacándose las especies Aspergillus flavus, Aspergillus niger, Apodachlya pyrifera, Botryodiplodia theobromae, Dacromyces deliquescens, Fusarium oxysporum, Phoma herbarum, Phomopsis gmelinae, Trichosporonoide oedocephalus, Graphium penicilliodes, Ceratocystis fimbriata y Thronectria pseudotricha (Umana, et al ., 2015; Murillo-Gamboa, et al ., 2016; Anuagasi, et al ., 2017). Se han encontrado pocos géneros de bacterias causantes de enfermedades en G. arbórea, pero se menciona Agrobacterium tumefaciens, especie que causa agallas en la base del fuste (Wingfield & Robison, 2004; Arguedas, 2004).
Se atribuye a las enfermedades que afectan el fuste las mayores pérdidas económicas debido a que causan cancros, necrosis, agallas y muerte vascular (Arguedas, 2004), lo que afecta significativamente la rentabilidad del producto aprovechable (Obregón, 2006).
En Colombia se conoce poco sobre las enfermedades de la melina, y la mayoría de las investigaciones se ha enfocado en su incorporación en sistemas agroforestales (Guillermo-Ramírez, et al ., 2017), el mejoramiento genético (Mariño & Rodríguez, 2010; Espitia, et al ., 2016), el manejo hídrico (Vergara, et al ., 2017) y la modulación del crecimiento (Barrios, et al ., 2011; Melo, 2015). Varias plantaciones de esta especie forestal en el departamento del Tolima (Colombia) han evidenciado signos de cancros, necrosis, decoloración de la médula y muerte parcial del tejido vascular, por lo que esta investigación se propuso aislar, caracterizar e identificar los posibles agentes causantes de las enfermedades asociadas con esta especie mediante el análisis de sus características fenotípicas, la identificación molecular y las pruebas de patogenicidad.
Materiales y métodos
Área de estudio y sitios de muestreo. Las muestras se recolectaron en plantaciones de melina en los municipios de Guamo, Armero-Guayabal, Espinal y Venadillo en el departamento del Tolima en una zona de formación de bosque seco tropical y en la franja altitudinal de 300 a 500 msnm, con una temperatura promedio entre 26 y 29 °C, humedad relativa entre 60 y 72 % y precipitación media anual entre 1.488 y 1.840 mm.
Obtención de la muestra. Se observó el estado fitosanitario de los árboles en las cuatro localidades; en cada zona se seleccionaron tres individuos con algún síntoma de enfermedad en el tejido vascular (cancros basales, necrosis, decoloración de la médula) (Figura 1) y se tomó una muestra por individuo. Se retiró la corteza y con un machete previamente desinfectado con hipoclorito al 5 %, se hicieron los cortes del tejido. Las muestras se almacenaron en bolsas de papel y de plástico marcadas con la fecha, el número del árbol y la localidad, y se transportaron en una nevera portátil a 4 °C hasta el Laboratorio de Microbiología y Micorrizas de la Universidad del Tolima para su procesamiento.

Figura 1 Sintomatología de los fustes enfermos de G. arborea evaluados en el departamento del Tolima. A. Necrosis, decoloración de la médula en la parte basal del fuste y muerte parcial del tejido vascular. B. Cancro basal. C. Decoloración de la médula en los entrenudos de las ramas
De cada ejemplar con síntomas de enfermedad se extrajeron 25 cortes de tejido de 3 a 5 mm en una proporción de tres muestras de material sano por cada muestra de material enfermo, luego se lavaron con agua destilada estéril (ADE), y se desinfectaron con hipoclorito de sodio al 2 % durante un minuto y en alcohol al 70 % durante otro minuto y, finalmente, se lavaron tres veces con agua destilada estéril (French & Hebert, 1980).
Aislamiento e identificación morfológica de las cepas fúngicas. Las doce muestras previamente desinfectadas obtenidas de tres árboles en cada una de las cuatro localidades se sembraron en (PDA) (extracto de papa: 4 g, dextrosa: 20 g y agar papa, dextrosa: 15 g, en un litro de agua destilada) para obtener cepas puras. Todos los aislamientos se caracterizaron microscópica y macroscópicamente, a las colonias se les evaluó el tipo de borde, la textura, las características de esporulación, el tamaño y la coloración según la tabla de Munssell (Agrios, 2005). Para inducir la esporulación se emplearon los medios agar extracto de malta (EMA) (agar: 20 g, dextrosa: 10 g, extracto de levadura: 3 g, extracto de malta: 3 g y peptona: 5 g en un litro de agua destilada) (Atlas, 2005); agar avena (AA)(avena en hojuelas: 40 g y agar: 20 g en un litro de agua destilada); agar enriquecido con ocho vegetales (V8) (200 ml de V8, 3 g de CaCO , 20 g de agar en un litro de agua destilada) (López-Cardona & Castaño-Zapata, 2013); agar agua con acículas de pino (AAAP) al 2 % (acículas de pino previamente esterilizadas con luz ultravioleta de onda larga durante 24 h); agar hojas de clavel (Carnation Leaf-piece Agar - CLA) al 2 % (hojas de clavel previamente esterilizadas con luz ultravioleta de onda larga durante 24 horas) (Atlas, 2005), los cuales se cultivaron a temperaturas entre 28 y 35 ºC, con ciclos de oscuridad total y fotoperiodo de 12 horas con luz negra (luz ultravioleta cercana). Otra parte del tejido se colocó en cámaras húmedas para favorecer la formación de estructuras reproductivas como ascas, picnidios, peritecios y conidias (French & Herbert, 1980; del Río & Castaño-Zapata, 1994). Posteriormente, las muestras se montaron para su visualización en el microscopio y su identificación mediante las claves de Hanlin (1990) y Barnett & Hunter (1998).
Aislamiento e identificación bioquímica de las colonias bacterianas. Las muestras desinfectadas se sembraron en medio agar nutritivo (AN): (5 g de peptona, 4 g de extracto de carne, y 15 g de agar en un litro de agua destilada) (Atlas, 2005), se incubaron en la oscuridad a temperaturas entre 26 y 28 ºC, y 24 horas después se evaluó el crecimiento. Se registró la forma de la colonia y se hizo la identificación bioquímica siguiendo el esquema de Schaad (2001), el cual incluyó los parámetros de tinción de Gram, reconfirmación del Gram con hidróxido de potasio (KOH) al 3 %, crecimiento en extracto de levadura, dextrosa y carbonato de calcio ( Yeast extract-dextrose-CaCO3 -YDC) (20 g de CaCO3, 20 g de glucosa, 15 g de agar, y 10 g de extracto de levadura en un litro de agua destilada), agar King B (KB) (20 g de peptona, 1,5 g de K2HPO4, 1,5 g de MgSO .7H2O, y 15 g de agar en un litro de agua destilada), y medio de Hugh y Leifson (2 g de peptona, 5 g de NaCl, 0,3 g de K2HPO4, azul de bromotimol al 0,2 %, 100 ml de solución de carbohidratos), con el fin de determinar el metabolismo oxidativo o fermentativo; se usó agar MacConkey (1,5 g de peptona de carne, 17 g de peptona de gelatina, 1,5 g de tripteína, 10 g de lactosa, 1,5 g de mezcla de sales biliares Nº 3, 5 g de NaCl, 0,03 g de rojo neutro, 0,001 g de cristal violeta, y 13,5 g de agar en un litro de agua destilada) como medio indicador de bacterias fermentadoras de lactosa, y agar hierro triple azúcar (Triple Sugar Iron - TSI) (20 g de peptona, 12 g de agar, 10 g de lactosa, 10 g de sacarosa, 5 g de NaCl, 3 g de extracto de carne, 3 g de extracto de levadura, 1 g de glucosa, 0,3 g de citrato férrico, 0,3 g de Na2S2O3, y 0,025 g de fenol rojo en un litro de agua destilada), el cual permite la diferenciación de enterobacterias con base en la producción de sulfuro de hidrogeno (SO2) y la fermentación de azúcares (Atlas, 2005). Se empleó la prueba de la catalasa para constatar si los microorganismos eran capaces de descomponer el peróxido de hidrógeno en agua y oxigeno) (Valdés, 2014), la pudrición de la papa mediante la inoculación de un aislamiento bacteriano en rodajas de papa para demostrar la producción de enzimas (Cortés, 2011), en tanto que la movilidad se verificó en medio SIM (Sulfide Indole Motility) (20 g de tripteína, 6 g de peptona, 0,2 g de sulfato de hierro y amonio, 0,2 g de tiosulfato de sodio, y 3,5 g de agar en un litro de agua destilada), el cual se emplea para diferenciar especies de la familia Enterobacteriaceae (Atlas, 2005).
Identificación molecular de hongos y bacterias. Las colonias puras de hongos en crecimiento durante ocho días en PDA a 28 ºC, se rasparon superficialmente y se maceraron con nitrógeno líquido. A esta mezcla se le adicionó tampón de extracción (SDS al 1 %, 25 mmol l-¹ de EDTA, 200 mmol l-¹ de tris- HCl pH 8,0, 250 mmol l-¹ de NaCl) y se incubaron a 60 °C durante 30 minutos, con una posterior centrifugación a 10.000 rpm durante 10 minutos. Las proteínas se removieron por extracción con cloroformo: alcohol isoamílico (24:1). El ADN se recuperó con isopropanol helado y se hicieron dos lavados con etanol al 80 %. El precipitado resultante se suspendió en 50 µl de agua MilliQ y se almacenó a 4 °C hasta su utilización (Glienke-Blanco, et al., 2002).
La extracción del ADN de las bacterias se realizó a partir del cultivo bacteriano en caldo de infusión cerebro corazón (Brain Heart Infusion - BHI) (200 g de infusión de cerebro de vacuno, 250 g de infusión de corazón de vacuno, 5 g de NaCl, 2 g de glucosa, 2,5 g de Na2HPO4, 2 g de glucosa, y 10 g de proteasa peptona en un litro de agua destilada) (Atlas, 2005), con un máximo de 24 horas de crecimiento. El cultivo se centrifugó a 7.400 rpm durante 10 minutos, y al precipitado se le adicionaron 50 µl de SDS al 10 % (p/v) y 50 µl de tampón de lisis (SDS al 0,1 %, 50 mM pH 8,0 de EDTA, 50 mM de tris-HCl pH 8,0, 50 mM de NaCl), se incubó a 37 °C durante 30 minutos, y se extrajo con dos volúmenes de fenol, una homogenización de 30 segundos y centrifugación a 1.200 rpm durante 10 minutos; a la fase acuosa se le adicionó un volumen igual de cloroformo, repitiendo la homogenización y la centrifugación, y se obtuvo una nueva fase acuosa a la cual se le adicionaron 2,5 volúmenes de etanol absoluto frío. El precipitado de ADN se suspendió en 50 μl de tampón TE (10 mM de tris-HCl pH 8,0 y 1 mM de EDTA pH 8,0) y se almacenó a 4 °C hasta su utilización.
La integridad del ADN se evaluó por electroforesis en gel de agarosa al 1 % (TBE 0,5X) en una cámara horizontal ENDURO™ de Labnet, a 120 V. Los geles se tiñeron con HydraGreen™ y se observaron en un transiluminador UV Spectroline®.
Se amplificó el ADN de la región del espaciador transcrito interno (internal transcribed spacer, ITS), con los iniciadores universales ITS1 (5’ TCC GTA GGT GAA CCT GCG G 3’) e ITS4 (5’ TCC TCC GCT TAT TGA TAT GC 3’) (White, 1990) para hongos, y con los iniciadores U1 (5’-CCAGCAGCCGCGGTAATACG-3’) y U2 (5’ATCGG(C/T)TACCTTGTTACGACTTC-3’) (Lu, et al ., 2000) para la amplificación del ARN ribosomal 16s en bacterias.
Las reacciones de amplificación se hicieron en un volumen total de 25 µl de una mezcla (Corpogen PCR-2x) que contenía solución tampón para PCR 1x (20 mM de tris- HCl pH 8,5, 100 mM de KCL), 400 uM de DNTP, 3 mM de MgCl 0,1 unidad/µl de polimerasa Taq ADN, 10 ng de ADN total, y una concentración final de 0,5 uM y 0,2 uM de los iniciadores de hongos y bacterias, respectivamente. Las amplificaciones se hicieron en un termociclador a 95 ºC durante 2 minutos, 30 ciclos a 94 ºC durante 30 segundos, a 53 ºC durante 45 segundos, a 72 ºC durante 1 minuto, y una extensión final a 72 ºC durante 7 minutos para los hongos, y a 95 º C durante 1 minuto, 35 ciclos a 95 ºC durante 1 minuto, a 54 ºC durante 1 minuto, a 72 ºC durante 1,30 minutos, y una extensión final a 72 ºC durante 10 minutos para las bacterias.
Una vez obtenidos los productos de la PCR se verificaron mediante electroforesis el tamaño de los fragmentos de 500 a 600 pb para hongos y de 970 a 990 pb para bacterias, los cuales se secuenciaron en Macrogen Inc. en Corea del Sur.
El análisis filogenético de las secuencias se inició con la edición utilizando Chromas Pro-versión 1.49 (http://www.technelysium.com.au/ChromasPro.html), seguida del alineamiento con la herramienta BLAST®n 2.8.1 del National Center for Biotechnology Information (NCBI) y la comparación con todas las secuencias de referencia de la base de datos del GenBank. Los árboles se hicieron mediante el programa Molecular Evolutionary Genetics Analysis (Mega), versión 7 (Kumar, et al., 2016), el alineamiento con el programa Muscle y el método de máxima verosimilitud sobre el modelo de Kimura 2 (Kimura, 1980), en tanto que para el soporte interno se utilizó el análisis de bootstrap con 1.000 repeticiones.
Pruebas de patogenicidad para hongos y bacterias. La patogenicidad se evaluó siguiendo los postulados de Köch (1876) bajo condiciones controladas en el Jardín Botánico “Alejandro Von Humboldt” de la Universidad del Tolima; se utilizaron cuatro repeticiones para cada una de las cepas fúngicas y bacterianas, obteniéndose así un total de 32 plantas de cuatro meses de edad para los aislamientos fúngicos (siete aislamientos y un control de PDA) y 16 plantas de dos meses de edad para los bacterianos (tres aislamientos y un control de agua estéril). Cada planta se aisló y se cubrió con una bolsa de polietileno transparente de 40 x 80 cm sostenida en un marco de alambre (aro y soporte de dos varillas) para evitar el contacto de la bolsa con la planta (Figura 2) (Kiraly, et al ., 1970).

Figura 2 Inoculación de hongos (A, B, C) y bacterias (D, F, G) para pruebas de patogenia en plantas jóvenes de melina. A. Inoculación de disco de micelio en cortes de tipo ventana en la base del tallo. B. Herida inoculada y cubierta con cinta de tela transpirable (esparadrapo). C. Plantas inoculadas y aisladas en una bolsa de polietileno transparente de 40 x 80 cm sostenida con un marco de alambre. D. Incrustación de tapón de caucho en aguja de jeringa de insulina. E. Inoculación de colonias bacterianas mediante el método de inyección en hojas. F. Cámaras húmedas para el desarrollo bacteriano.
Las cepas fúngicas se evaluaron con la técnica de herida en el cambium vascular de la parte media del tallo mediante cortes de tipo ventana, ubicándose en su interior un disco de micelio de 5 mm de diámetro cultivado durante siete días a 27 ºC en PDA; posteriormente, la herida se cubrió con cinta de tela transpirable (esparadrapo). Las plantas se evaluaron a los 15 y 30 días de la inoculación para observar la aparición de síntomas (Alama, et al., 2006; Ismail, et al ., 2012; Juárez-Palacios, et al ., 2013).
Las cepas bacterianas se incubaron en AN durante 24 horas, luego se ajustaron las muestras en ADE en una concentración de 9,0 x 108 UFC ml-1 en la escala de McFarland, y se inocularon en las hojas de las plantas de dos meses de edad con el método de inyección utilizando una jeringa de insulina de 1 ml en la cual se incrustó un tapón de caucho para permitir la distribución homogénea del inóculo (Figura 2) (Escalona & Contreras, 2011). La valoración se efectuó a los 10 y 20 días de la inoculación para observar la sintomatología (Cardona, et al ., 2012).
Los postulados de Köch se completaron con el reaislamiento de los microorganismos. Los hongos se evaluaron 30 días después a partir de los tejidos sintomáticos en medio PDA a 27 ºC durante siete días, y las bacterias, después de 20 días analizando el tejido previamente inoculado en medio AN a 37 ºC durante 24 horas (Cardona, et al ., 2012).
Resultados
Sintomatología en las plantas. En campo se encontraron árboles de melina sintomáticos en tres de las cuatro localidades. En el municipio del Guamo se observaron individuos con presencia de decoloración de la médula en la parte basal del fuste y muerte parcial del tejido vascular; en la plantación de Armero Guayabal se encontraron árboles con escarificación de la corteza y cancros basales en el fuste; en el municipio del Espinal se registró la decoloración de la médula en los entrenudos de las ramas, en tanto que el descortezamiento basal de las muestras de Venadillo no se consideró un síntoma asociado con un microorganismo, lo cual se verificó en el laboratorio sembrando el tejido en medio de cultivo PDA.
Caracterización e identificación de los hongos y bacterias asociados a melina. En la Tabla 1 se relaciona cómo siete de los 12 árboles evaluados presentaron crecimiento micelial a partir del tejido vascular sembrado en medio PDA. Las características fenotípicas (macroscópicas y microscópicas) de las cepas fúngicas aisladas se observan en la Figura 3.
Tabla 1 Caracterización fenotípica y molecular de los hongos aislados del tejido vascular de G. arborea Roxb
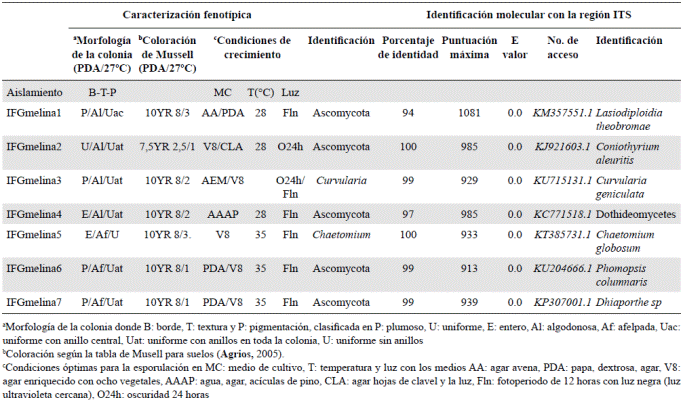
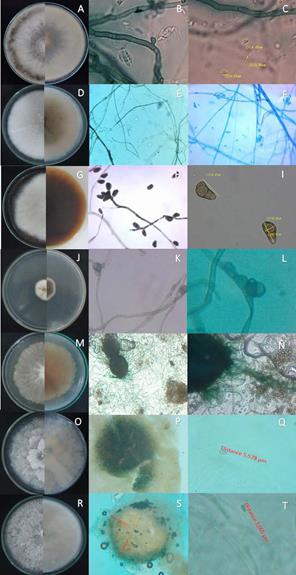
Figura 3 Características fenotípicas y cuerpos fructíferos de los aislamientos fúngicos en medio PDA a 27 ºC. A. Lapsiodiplodia theobromae, micelio de color blanco grisáceo por el frente y blanco con aro terminal de color verde al reverso. B. Hifas septadas, microconidias agrupadas, vista 60x. C. Medición de microconidias, vista 100x. D. Coniothyrium aleuritis, micelio color blanco por el frente y rosa claro por el reverso. E. Hifas septadas, vista 60x. F. Microconidias agrupadas, vista 100x G. Curvularia geniculata, micelio de color blanco en el frente y marrón oscuro al reverso. H. Hifa septada y conidióforo, vista 60x. I. Conidias en forma de bumerán con septas tritabicadas. J. Dothideomycetes sp, micelio de color blanco por el frente y marrón al reverso. K. Hifa septada con conidio, vista 60x. L. Conidia de color marrón bitabicada. M. Chaetomium globosum, micelio de coloración blanco rosáceo por el frente y rosa claro por el reverso. N. Peritecios grandes agrupados de dos en dos. Ñ. Ascosporas unicelulares agrupadas. O. Phomopsis columnaris, micelio de color blanco en el frente y blanco grisáceo al reverso. P. Conidióforo de color marrón, vista 60x Q. Microconidia, vista 100x. R. Diaphorte sp, micelio de color blanco en el frente y blanco grisáceo al reverso. S. Conidióforo de color marrón, vista 60x. T. Microconidia, vista 100x.
Se encontró que el medio de cultivo V8, las temperaturas entre 28 y 35 ºC y un fotoperiodo de 12 horas con luz ultravioleta cercana fueron las condiciones ideales para la esporulación de la mayoría de las cepas estudiadas, con excepción de las cepas 1 y 4 que presentaron mejor desarrollo en los medios AA y AAAP, respectivamente, aunque en ellos se evidenció crecimiento micelial sin que se observara esporulación de los hongos, a pesar de probar varios medios de cultivo y diferentes condiciones de luz y temperatura (Tabla 1) .
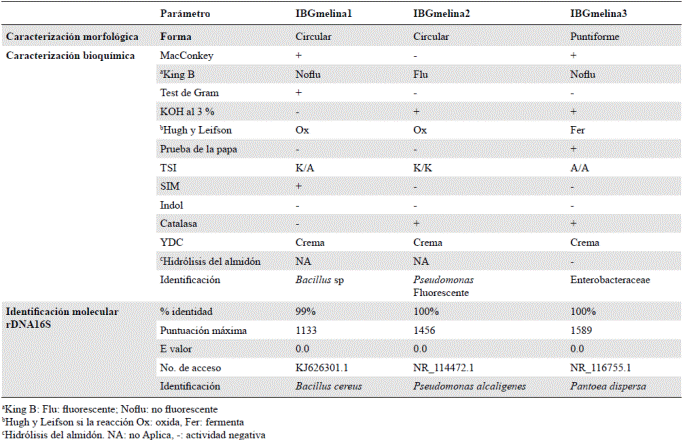
Se seleccionaron tres cepas de bacterias y se las caracterizó morfológica, cultural y bioquímicamente (Tabla 2), con lo cual se encontró que los tres aislamientos presentaban forma de bacilo, pertenecían a los géneros Bacillus y Pseudomonas, y que un aislamiento era de la familia Enterobacteriaceae.
Tabla 2 Caracterización fenotípica y molecular de las bacterias aisladas del tejido vascular de G. arborea Roxb
Análisis filogenético de hongos y bacterias asociados con los fustes de melina. La amplificación de la región ITS para los hongos y la 16S para las bacterias permitió obtener fragmentos de aproximadamente 500 a 600 pb y de 970 a 990 pb, respectivamente. Las secuencias generadas para el análisis filogenético permitieron la identificación del 85 % de las cepas fúngicas, cinco a nivel de especie, una a nivel de género y una última hasta el nivel de clase. Las secuencias obtenidas se depositaron en el GenBank con los números de acceso MH029137-MH029143.
El árbol filogenético para hongos presentó siete clados formados con Saccharomyces cerevisiae como grupo externo (Figura 4A); los clados I, III, IV, V y VI presentaron 100 % de similitud con Diaporthe sp.; Chaetomium globosum, Lasiodiplodia theobromae, Curvularia geniculata y Coniothyrium aleuritis, respectivamente. El clado II mostró 98 % de similitud con Phomopsis columnaris y el VII, un 89 % de similitud con la clase Dothideomycetes.
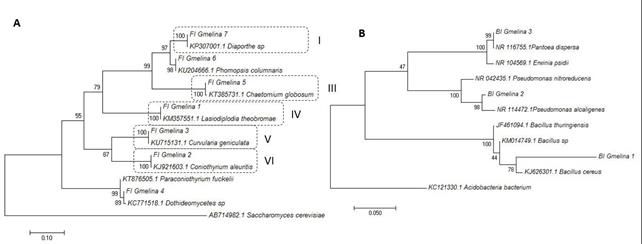
Figura 4 Análisis filogenético de hongos (A) y de bacterias (B) con base en el método de máxima verosimilitud, la prueba de filogenia bootstrap con 1.000 repeticiones, modelo Kimura 2
Entre las bacterias se escogió Acidobacteria bacterium como grupo externo; el árbol presentó tres clados (Figura 4B), con un 78 % de similitud con Bacillus cereus, 98 % con Pseudomonas alcaligenes y 99 % con Pantoea dispersa en los clados III, II y I, respectivamente. Las secuencias se depositaron en el GenBank con los números de acceso MG951480, MG951481 y MG984548.
Pruebas de patogenicidad. En la primera valoración de las 32 plántulas de cuatro meses de edad realizada a los 15 días, se observó que los aislamientos de L. theobromae y C. geniculata presentaban crecimiento micelial en tres y dos de las cuatro plántulas inoculadas, respectivamente; en la segunda valoración realizada a los 30 días, se observó que las mismas plantas presentaban decoloración de la médula en el tejido vascular, lo que permitió confirmar una incidencia de 75 y 50 %, respectivamente. Se ratificaron los postulados al hacer un nuevo aislamiento de los tejidos con decoloración de la médula en medio PDA durante siete días a 27 ºC y en oscuridad (Figura 5). Se obtuvieron colonias y cuerpos fructíferos típicos de L. theobromae y C. geniculata. Las bacterias evaluadas no produjeron lesiones en ninguno de los individuos inoculados.
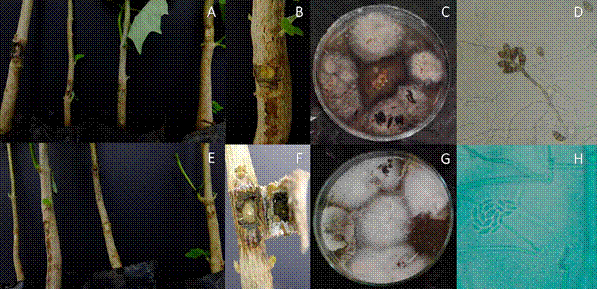
Figura 5 Pruebas de patogenicidad para Curvularia geniculata (A, B, C, D) y Lasiodiplodia theobromae (E, F, G, H) en plantas de melina. A. Plantas inoculadas con disco de micelio a los 30 días. B. Decoloración parcial de la médula. C. Colonias resultantes del aislamiento de tejido sintomático en pruebas de patogenia. D. Hifas septadas, conidias agrupadas, vista 60x. E. Plantas inoculadas con disco de micelio a los 30 días. F. Decoloración parcial de la médula. G. Colonias resultantes del aislamiento de tejido sintomático en pruebas de patogenia. H. Hifas septadas, microconidias agrupadas, vista 100x.
Discusión
La sintomatología de los fustes enfermos de melina fue diferente en cada plantación evaluada. En general, en campo se observaron cancros basales, necrosis y decoloración de la médula, en algunos casos con muerte parcial del tejido, descripción que concuerda con lo reportado por Arguedas (2004). L. theobromae y C. geniculata son dos nuevos reportes de hongos patógenos que afectan los fustes de melina en el departamento del Tolima. Asimismo, en el filoplano del fuste se encontraron otros hongos asociados como C. aleuritis, C. globosum, P. columnaris, Diaporthe sp., y un aislamiento de la clase Dothideomycetes que no causaron enfermedad en plantas jóvenes de melina bajo las condiciones del ensayo.
De los siete géneros de hongos aislados solo Lasiodiplodia y Phomopsis ya habían sido reportados como fitopatógenos en G. arborea, siendo las especies L. pseudotheobromae y P. gmelinae causantes de pudrición y muerte en el fuste, y P. micheliae, en plántulas y en hojas (Arguedas, 2004; Alves, et al ., 2008).
Lasiodiplodia theobromae ocasiona enfermedades en una amplia variedad de especies forestales como la acacia (Acacia mangium) (Halfeld-Vieira, et al ., 2006), el eucalipto (Eucalipto sp). (Roux, et al., 2001), los pinos (Pinus oocarpa y Pinus azadirachta) (Mohali, et al ., 2002), y en especies de interés agrícola como el melocotón (Prunus pérsica) (Gao, et al ., 2016), el mango (Mangifera indica) (Sandoval-Sánchez, et al., 2013), y la naranja (Citrus sinensis) (Zhao, et al., 2015), entre otras. Por su parte, C. geniculata se ha reportado en semillas de melina (G. arborea), teca (Tectona grandis) y acacia (A. mangium) (Álvarez, et al ., 2012) y, en algunos casos, en el estípite de las palmas de aceite (Elaeis guineensis) (Mestizo, et al ., 2012). Otras especies de este mismo género como C. lunata, provocan lesiones en las hojas del ocobo (Tabebuia rosae), el guayacén amarillo (Tabebuia chrysantha), la ceiba (Ceiba sp.), la teca (T. grandis) y el cedro blanco (Cupresus lindleyi) (Cibrián, et al ., 2008).
Las especies C. aleuritis, C. globosum, P. columnaris y Diaporthe sp no causaron enfermedades en los árboles de melina; sin embargo, varias especies de estos géneros sí son patógenos agresivos de árboles forestales, como Coniothyrium zuluense, Diaporthe cubensis y C. globosum, y de eucaliptos (Eucalypto sp) (Hodges, et al ., 1976; Gezahgne, et al ., 2005; Pérez-Vera, et al ., 2005).
Entre este último grupo de hongos se destaca el papel de C. globosum, que, a pesar de haber sido reportado como patógeno en diversas especies vegetales (Chavarriaga, 2011), es un microorganismo con capacidad de controlar Phytophthora nicotianae, Phytophthora infestans, Magnaporthe grisea y Puccinia recondita (Park, et al ., 2005; Shanthiyaa, et al ., 2013; Hung, et al ., 2015; Yang, et al. , 2016).
Un resultado similar se encontró con las especies de bacterias identificadas, puesto que ninguna de ellas fue patogénica en plantas jóvenes de melina, y por el contrario, se han reportado como agentes de biocontrol. B. cereus tiene efecto contra Phytophthora megasperma (Tejera-Hernández, et al ., 2011), Macrophomina phaseolina, Sclerotina minor, Fusarium oxysporum, F. solani y Phythium ultimum,en tanto que los aislamientos de P. alcaligenees lo tienen sobre Rhizoctonia solani (Amaíz, et al ., 2015), y los de P. dispersa sobre Xanthomonas albilineans (Zhang & Birch, 1997). Otro valor agregado de estos tres géneros de bacterias es su capacidad de ser promotoras de crecimiento vegetal en plantas de tabaco, arroz y trigo (Rives, et al ., 2007; Selvakumar, et al ., 2008; Dutta, et al ., 2013). Dichos resultados abren la posibilidad de evaluar el potencial de estas especies de hongos y bacterias para controlar los patógenos de melina hallados en este estudio.
Por otro lado, los resultados de este trabajo coinciden con los de García-Gonzáles (2018) y Cai, et al. (2011) en cuanto a la importancia de combinar técnicas de identificación, ya que en la mayoría de los aislamientos solo fue posible identificar el filo con los estudios morfológicos, culturales y bioquímicos, y con las técnicas basadas en el ADN se obtuvieron resultados más precisos.
Conclusiones
Los resultados de esta investigación permitieron identificar L. theobromae y C. geniculata como hongos patógenos de plántulas de melina. En los fustes enfermos se encontraron otros hongos y bacterias asociados que probablemente no causan enfermedades y, por el contrario, actuarían como controladores biológicos de los patógenos, por lo que se requerirían más estudios en esta área que permitan elucidar el papel de cada uno de estos microorganismos y su potencial en la creación de estrategias de biocontrol.














