Introducción
Los ríos son ecosistemas dulceacuícolas de gran relevancia, ya que albergan una abundante y diversa biota en la que se destaca la comunidad de algas perifíticas, las cuales son productoras primarias dominantes en los cursos de agua (Gómez, et al., 2009), presentan altas tasas de renovación y poseen estrategias oportunistas que les permiten establecerse con éxito en diversos hábitats (Goring & Biggs, 1996). Su importancia se atribuye a su capacidad para capturar la energía lumínica, a su papel como fuente de alimento de varios organismos acuáticos y a su transformación en compuestos orgánicos, característica que la posiciona en un nivel trófico importante (Roldán, 1992; Biggs & Smith, 2002).
Las algas perifíticas, principalmente las diatomeas, se caracterizan por su sensibilidad específica a una variedad de condiciones ecológicas, físicas y químicas en los arroyos y ríos (Lobo, et al., 2016), por lo tanto, pueden usarse para el monitoreo de la contaminación ambiental mediante la determinación de sus diferentes grados de tolerancia a partir de los valores tróficos (Lobo, et al., 2015), ya que responden de manera rápida a diferentes tensores ambientales y se establecen de forma fija en un sustrato (Masseret, et al., 1998; Wu, 1999; Smith & Smith, 2001; Harding, et al., 2005; Arcos & Gómez, 2006).
Debido a las dinámicas antropogénicas, el deterioro de los recursos hídricos es progresivo y pone en riesgo la biota que albergan. La expansión de la frontera agrícola y ganadera, el establecimiento y puesta en marcha de industrias de gran producción y la creciente densidad de la población humana, entre otros, han sido los factores más determinantes en la transformación del paisaje, pues afectan negativamente la estructura, la función y la composición de los ecosistemas lóticos mediante la alteración de sus características físicas y ambientales con la consecuente pérdida de su biodiversidad (Rivera, et al., 2010; Smucker & Vis, 2011).
De ahí la necesidad de realizar estudios sobre los ecosistemas acuáticos, su dinámica y la relación entre su diversidad y la capacidad de adaptación de las diferentes especies a los cambios estructurales o fisicoquímicos de origen natural o antropogénico, cuyo conocimiento es una herramienta relevante para comprender los mecanismos de respuesta de las comunidades ante posibles alteraciones del ambiente (Patrick, 1988; Rivera & Donato, 2008).
Dada la importancia del río Anchique para las poblaciones del municipio de Natagaima en el departamento del Tolima, pues constituye su principal fuente hídrica, y del papel del fitoperifiton en la dinámica de los ecosistemas dulceacuícolas, se propuso la presente investigación para evaluar la estructura y la composición de las microalgas perifíticas en esta importante cuenca andina. Los resultados obtenidos son un aporte importante para futuros estudios taxonómicos y de bioindicación y constituyen una información necesaria para el diseño de planes y programas de manejo y conservación de la cuenca, incluida su biota fitoperifítica. Además, establecen la línea de base de la taxonomía de las algas perifíticas en Colombia y contribuyen a determinar el estado ecológico de las cuencas andinas colombianas dando cuenta de su abundancia, densidad y diversidad.
Materiales y métodos
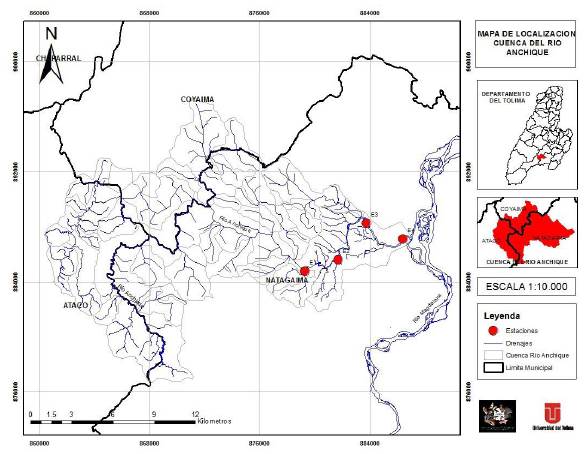
Area de estudio. Se seleccionaron cuatro estaciones de muestreo ubicadas a lo largo de la cuenca del río Anchique (E1: 03°33'11,7"; E2: 03°33'40,0''; E3: 03°35'10,1''; E4: 03°34'28,7'' N, y E1: 75°09'49,7''; E2: 75°08'31,2''; E3: 75°07'54,2''; E4: 75°05'59,1'' O), entre los 415 y los 333 m s.n.m. y con una distancia lineal entre ellas de 3 km aproximadamente (Figura 1). La estación E1 se ubica en la parte alta de la cuenca, caracterizada por ser un cuerpo de agua con poco caudal y alta incidencia de material alóctono; las estaciones E2 y E3 son balnearios y puntos empleados para lavar, en tanto que la estación E4 está en un punto de menor altitud muy intervenido, pues es un paso vehicular y de ganado. Se hicieron cinco muestreos durante un ciclo hidrológico: desde mayo del 2015 hasta julio del 2016, y se tomó la información de los registros históricos y de los últimos 20 años de las lluvias hechos por el Instituto de Hidrología, Meteorología y Estudios Ambientales (IDEAM) en la cuenca.
Toma de muestras biológicas. Para la recolección del material perifítico se seleccionaron dos tipos de sustratos naturales en inmersión (roca y tronco) en cada estación de muestreo mediante raspados de superficie en un área de 10 cm2 de cada sustrato con la ayuda de cepillos plásticos según la metodología recomendada por Tümpling & Friedrich (1999). Las muestras se fijaron con una solución preservante de formol al 10 % y lugol siguiendo la metodología recomendada por Weber (1968).
Los individuos se contaron usando la fórmula propuesta por Hauer & Lambert (2007) en la cual la densidad equivale al número de individuos por área de superficie (cm2). Para la identificación taxonómica de las algas se siguieron las claves de Needham & Needham (1978), Kramer & Lange-Bertalot (1979), Streble & Krauter (1987), Lopretto & Tell (1995), Ramírez (2000), Wehr & Sheat (2003) y Bellinger & Sigee (2011), así como las indicaciones de las publicaciones de Martínez & Donato (2003), Díaz-Quirós & Rivera-Rondón (2004), y Bicudo & Meneses (2006). Además, como respaldo de la determinación taxonómica de las algas se emplearon las bases de datos electrónicas Algaebase y Diatombase (Guiry & Guiry, 2013; Kociolek, et al., 2016).
Análisis bacteriológicos y fisicoquímicos. Se hicieron mediciones in situ de la temperatura del agua y del ambiente, de la profundidad y del ancho y la velocidad de la corriente; las descripciones geomorfológicas del cuerpo de agua y las características de la zona ribereña se registraron en fichas de campo. Posteriormente, se recolectaron muestras de agua superficial y en contra de la corriente en frascos plásticos con capacidad para 2.000 ml. Se analizaron el pH, la conductividad eléctrica ^S/cm), el oxígeno disuelto (mg O2/l), la turbidez (UNF), la alcalinidad total y la dureza (mg CaO3/l), los nitratos (mg NO3 /l), los fosfatos (mg PO4 /l), los sólidos totales (mg/l), la demanda química de oxígeno (DQO: mg O2 /l) y la demanda bioquímica de oxígeno (DBO5: mg O2 /l), el fosforo total (P) y los sulfatos (mgSO4/l) (American Public Health Association - APHA, American Water Works Association - AWWA, Water Environment Federation - WEF, 2012). Para la determinación de los parámetros bacteriológicos, se tomaron muestras de agua superficialmente y en contra corriente en frascos de vidrio con capacidad para 300 ml, las cuales se rotularon y preservaron en frío para el posterior análisis de coliformes totales (UFC/100 ml) y fecales (UFC/100ml) en el laboratorio de análisis químico LASEREX de la Universidad del Tolima (Roldán, 1992; Ramírez & Viña, 1998; Roldán & Ramírez, 2008) (Tabla 1).
Análisis de variables fisicoquímicas. Se utilizó la prueba de análisis de normalidad de Shapiro Wilks para evaluar la distribución de las variables fisicoquímicas a nivel espacial y temporal y, posteriormente, el análisis de varianza no paramétrico de Kruskal Wallis para determinar la existencia de diferencias significativas a nivel temporal y espacial. Las pruebas se hicieron con el programa estadístico InfoStat (Di rienzo, et al., 2013).
Análisis de correlación canónica. Se hizo el análisis de correlación canónica (ACC) para establecer la existencia y el grado de asociación entre las variables fisicoquímicas y la comunidad fitoperifítica del río Anchique con el programa Canoco, versión 4.5 (Braak & Smilauer, 2004).
Análisis estadísticos. Se determinó la densidad relativa a partir del número de individuos recolectados de cada género y su relación con el número total de individuos de la muestra; para establecer la diversidad se aplicó la serie de los números efectivos de Hill (1973). Se hizo un análisis de Shapiro Wilks para evaluar la distribución normal en los datos. Para la comparación de las medias de estos índices ecológicos se empleó un ANOVA de una vía para determinar si existían diferencias estadísticamente significativas entre los índices evaluados. Se utilizó la prueba de diferencia mínima significativa de Fisher para comparar entre muestreos y estaciones. Se aplicó el índice de similaridad de Bray Curtis para establecer una medida de la diferencia entre las abundancias de cada género en las diferentes estaciones de muestreo (Brower & Zar, 1984). En el análisis de escalamiento multidimensional no métrico (non-metric multidimensional scaling, NMDS) se implementó la distancia de Bray Curtis con el paquete Primer-6 (Clarke & Gorley, 2006) para evaluar el ensamblaje de las comunidades fito-perifíticas a nivel temporal y por sustratos.
Resultados
Se obtuvo una densidad total de 5,070 organismos/cm2 distribuidos en cinco divisiones, nueve clases, 24 órdenes, 43 familias y 59 géneros (Tabla 2). La división Bacillariophyta registró la mayor densidad relativa (59,88 %), seguida de Charophyta (16,24 %), en tanto que Euglenophyta tan solo registró un 0,07 % de representatividad (Figura 2). A nivel de género, Synedra tuvo la mayor densidad relativa (19,08 %), seguido de Surirella (12,3 %), Navícula (9,52 %), Cosmarium (9,6 %), Cymbella (7,13 %) y Oscillatoria (6,92 %), en tanto que géneros como Desmidium, Diploneis y Euastrum registraron las densidades más bajas (0,03 %).
Tabla 2 Composición taxonómica y densidad de las microalgas perifíticas en la cuenca del río Anchique
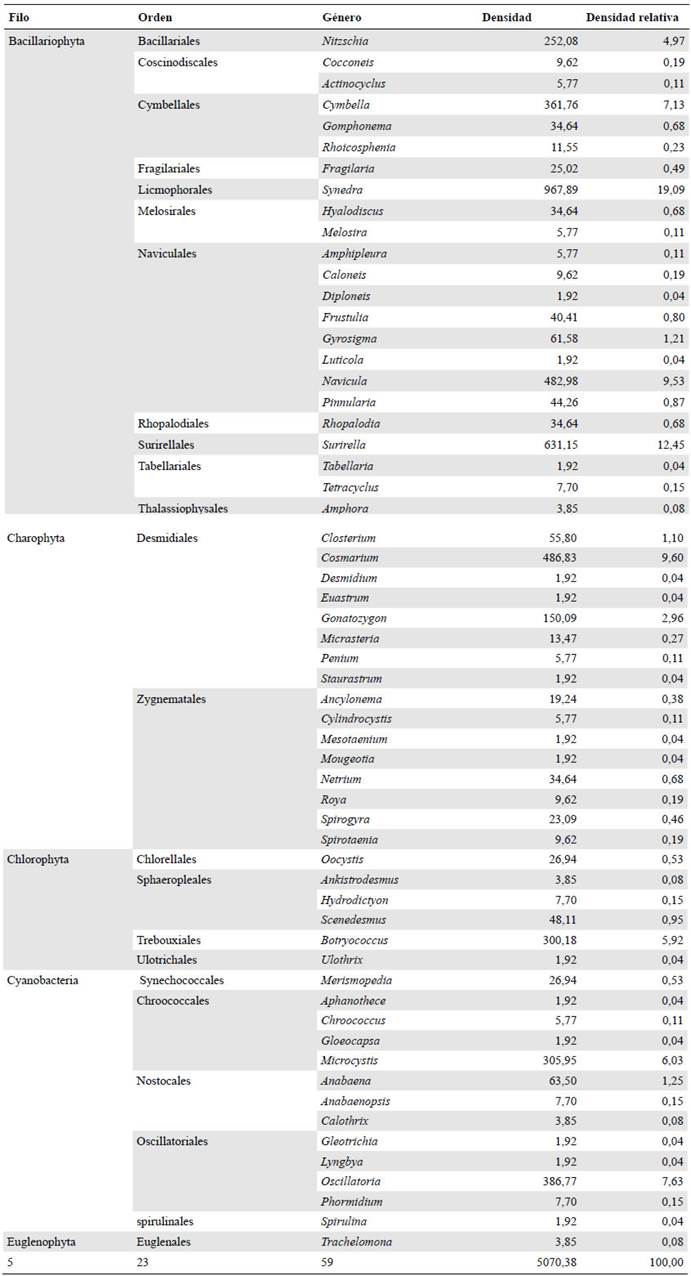
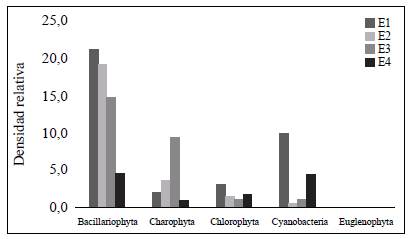
Figura 2 Densidad relativa de las divisiones del fitoperifiton presentes en las diferentes estaciones de muestreo
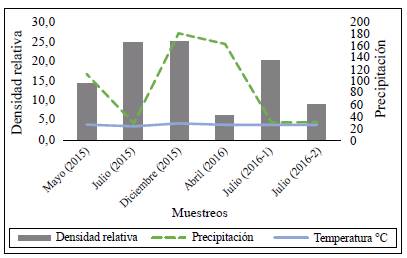
A nivel espacial la estación que presentó la mayor densidad relativa fue la E1 (nacimiento) con 36,31 %, seguida de E3 (puente) con 26,60 %, E2 (balneario) con 25,23 % y, por último, la E4 (desembocadura) con 11,84 %. En cuanto a la temporalidad es de resaltar que el mes de diciembre de 2015 fue el que presentó la mayor densidad relativa, con 27,47 %, seguido del mes de julio de 2015, con 27,24 %, es decir, en los meses de pocas precipitaciones, en tanto que en los meses con altas precipitaciones se presentaron las menores densidades relativas: 6,83 % en abril y 22,50 % en julio de 2016 (Figura 3).
En general, el sustrato de roca registró la mayor densidad relativa, con un promedio de 58,48 %, y el sustrato de tronco tuvo una de 41,51 %. Ambos sustratos obtuvieron una composición fitoperifítica cercana en cuanto al número de taxones, con 47 géneros en la roca y 46 en los troncos.
Variables fisicoquímicas. La mayoría de los datos fisicoquímicos evidenciaron normalidad (Shapiro Wilks: p>0,05), con excepción de los sólidos totales y los fosfatos en los muestreos, así como la turbidez, el porcentaje de saturación de oxígeno y el pH en las estaciones. Por otra parte, el análisis del ANOVA y la prueba de Kruskal Wallis no evidenciaron diferencias estadísticamente significativas entre los parámetros fisicoquímicos (p>0,9999).
Variables químicas. Entre las variables asociadas con concentraciones de partículas disueltas en esta cuenca (turbidez, sólidos totales y oxígeno disuelto), la turbidez presentó los mayores valores en las estaciones E2, E3 (106 y 103 UNT), en tanto que en la estación E1 se presentó el menor valor (2,55 UNT). El oxígeno disuelto fue mayor en las estaciones E1 (53,45 mg/L), E2 (59,42 mg/L) y E3 (59,46 mg/L), y en la estación E4 se presentó un menor valor (49,0 mg/L).
Las variables relacionadas con el proceso de óxido-reducción registraron los mayores valores de DQO y nitratos en las estaciones E3 y E4 , en la estación E2 se registraron altos valores de fosfatos, y en la estación E1 se presentó el mayor valor de DBO5.
Con respecto al proceso de mineralización, en la estación E1 se registraron los mayores valores de pH (8,18), conductividad eléctrica (416 μS/cm), alcalinidad (171 mg de CaCo3/l) y dureza (367 mg de CaCo3/l), en tanto que en las estaciones E2 y E3 se presentaron los menores valores.
Variables físicas. En las estaciones E2 y E3 se presentó la mayor velocidad de la corriente, con 0,70 y 0,64 m/s, respectivamente, así como los valores más altos de caudal (E2: 2,37 mVs y E3: 1,31 m3/s), ancho (E2: 19 m y E3: 9,86 m) y profundidad (E2: 0,18 m y E3: 0,21m), en tanto que en las estaciones E1 y E4 se registraron los valores más bajos en esas variables.
Parámetros bacteriológicos. Los valores obtenidos para coliformes fecales en las épocas de muestreo en el río Anchi-que oscilaron entre 98 UFC/100 ml y 12.100 UFC/100 ml. En promedio, el mayor valor lo registro el muestreo cinco (julio de 2016) (2774,5 UFC/100 ml), el cual coincidió con la temporada de bajas precipitaciones. El muestreo dos (julio de 2015) reflejó pocos coliformes fecales (1.000 UFC/100 ml), lo que coincidió con días de lluvia, mas no con una temporada completa. Según el Decreto 1594 de 1984, los valores promedios de coliformes totales y fecales en los muestreos realizados en la cuenca del río Anchique estaban dentro de los valores aceptables para el uso del agua con fines recreativos.
En cuanto a la variable de los coliformes totales, los valores oscilaron entre 1.400 UFC/100 ml y 6.700.000 UFC/100 ml. En el muestreo cinco (julio de 2016), se registró el mayor valor en promedio (1.950.000 UFC/100 ml). El menor valor para esta variable se registró en el muestreo dos (julio de 2015), con 4.250 UFC/100 ml.
Números efectivos. Los números de diversidad de Hill, o números efectivos, indicaron que, a nivel espacial y tem-poral, en la estación E1 se registró el mayor número de géneros (medida de riqueza, q: 0), con 44, en tanto que en la estación E4 se presentó el menor número con 27. A nivel temporal, en el muestreo dos (julio de 2015) se registró la mayor riqueza, con 44 géneros, y en el muestreo cuatro (abril de 2016), la menor, con 22 géneros. En cuanto a la medida de diversidad (q:1), que incluye todos los géneros y sus abundancias relativas, en la estación E1 se presentó una diversidad igual a la que tendría una comunidad teórica de 12 géneros. Por su parte, en las estaciones E2, E3 y E4 se registró una diversidad igual a la que tendría una comunidad de 11, 10 y 11 géneros efectivos, respectivamente. Al expresar estas equivalencias, fue evidente que en la estación E1 se registró 1,09 más diversidad de géneros que en la estación E2, 1,1 más que en las estaciones E2 y E4 y 1,2 más que en la E3. En la estación E3 se presentó el 83,3 % de la diversidad qregistrada en la E1.
A nivel temporal, la mayor diversidad de órdenes (q: 1) se registró en el muestreo dos (julio de 2015), con 14 géneros efectivos, y en el muestreo cinco se reportó la menor diversidad, con ocho géneros, es decir, tan sólo el 57,14 % de la diversidad presente en el muestreo dos. En cuanto a la medida de diversidad de los órdenes (q: 2), la mayor diversidad se registró en la estación E1, con siete géneros, en tanto que en las estaciones E2 y E3 se registró la menor diversidad, con seis géneros efectivos, y compartió el 85,71 % de la diversidad registrada en la E1. A nivel temporal, el muestreo dos (julio de 2015) presento la mayor diversidad de órdenes (q: 2), con nueve géneros efectivos, mientras que el muestreo cinco presentó la menor diversidad, con tan solo cinco géneros (Figura 4).
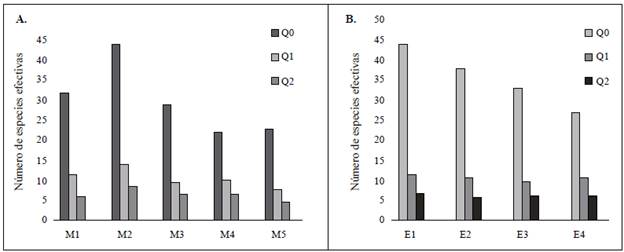
Figura 4 Índices de diversidad de Hill en las diferentes estaciones de muestreo y meses evaluados en la cuenca del río Anchique. (A) Estaciones; (B) Meses
Análisis estadístico. Debido a que los datos biológicos no presentaron normalidad (Shapiro Wilks, p<0,05), se hizo un análisis no paramétrico a nivel espacial y temporal en el cual se evidenció que las estaciones presentaron diferencias estadísticamente significativas entre sí (Kruskal Wallis: p<0,05). A nivel temporal no se registraron diferencias estadísticamente significativas (Kruskal Wallis: p<0,05). En este sentido, la prueba de comparación de diferencia mínima significativa de Fisher evidenció que los muestreos presentaron diferencias estadísticas significativas entre sí (p<0,05).
Los valores del índice de similitud de Bray Curtis revelaron que las estaciones E2 y E3 estaban más relacionadas, pues compartían el 64 % de los taxones, y que la estación E1 estaba relacionada con las estaciones E2 y E3 al compartir un 43 % con la E2 y un 37 % con la E3. La estación E4 presentó un menor grado de similitud con las demás estaciones, pues compartía el 26 %, el 32 % y el 31 % de su comunidad con las estaciones El, E2 y E3, respectivamente. Según el análisis de escalamiento multidimensional no métrico, no hubo un ensamblaje claro en la composición de las comunidades con las variables de tipo de sustrato, estación y muestreo. Con el análisis de similitud (analysis of similarities, ANOSIM) no se encontraron diferencias significativas en las variables de tipo de sustrato, muestreos y estaciones (p>0,05).
En cuanto a la relación de las variables biológicas, se evidenció que a nivel espacial el porcentaje de saturación de oxígeno, el pH y la temperatura del agua tuvieron, al parecer, algún grado de relación con los datos biológicos (prueba de Monte Cario: p<0,05). A nivel espacial, la estación El estaba muy relacionada con la variable del pH, mientras que la estaciones E2 y E3 parecían relacionarse con el porcentaje de oxígeno disuelto, pues los géneros Staurastrum, Luticola, Ankistrodesmus, Spirulina, Cosmarium y Desmidium presentaron relaciones cercanas (p<0,05). Al parecer en la estación E4 se estableción una mayor relación con los nitratos, los coliformes totales y los fecales (Figura 5), en los géneros Mycrocystis y Gyrosigma (p<0,05).
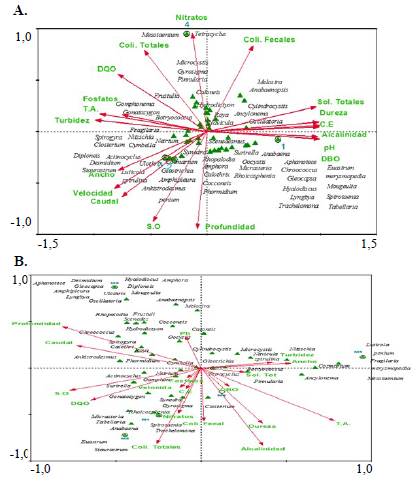
Figura 5 Análisis de correlación canónica entre las variables biológicas y las variables fisicoquímicas. (A) Estaciones; (B) Meses
A nivel temporal, el muestreo tres (diciembre de 2015) se relacionó con los géneros Luticola, Penium, Fragilaria, Merysmopedia, Mesotaenium y Cosmarium y con la variable de turbidez (Monte Carlo: p<0,05); los muestreos uno (mayo de 2015) y cinco (julio de 2016-1) tuvieron una mayor relación entre sí y compartieron géneros como Staurastrum, Euastrum, Trachelomonas, Spirotaenia y Anabaena y con las variables de coliformes totales, de coliformes fecales y de nitratos (p<0,05). Algunos muestreos como el dos (julio de 2015) no evidenciaron relaciones con las variables fisicoquímicas (Figura 5). A nivel temporal se evidenció algún grado de relación con la profundidad, los coliformes totales, el caudal y la temperatura del agua (p<0,05).
Discusión
A nivel estructural, en todos los muestreos la división Bacillariophyta fue la más abundante y la Euglenophyta, la de menor abundancia. Estos resultados concuerdan con los obtenidos por Montoya & Ramírez (2007), Bustamante, et al. (2008), Silva, et al. (2008), Pedraza & Donato (2011) y Gordillo & Reinoso (2013) en cuanto a que estas divisiones tuvieron una representatividad similar. Es muy probable que los organismos pertenecientes al filo Euglenophyta se encuentren de forma ocasional, ya que son característicos de ambientes con alto contenido de materia orgánica de origen natural, flujos y ambientes lénticos (Vilches, Casco, Giorgi, 2016), condiciones que se atribuyen principalmente a la estación E1, en donde la poca velocidad de la corriente y el material alóctono aportado por la vegetación ribereña crean las condiciones propicias para su establecimiento. La gran abundancia de la división Bacillariophyta podría estar relacionada con la segregación de estructuras mucilaginosas (Cymbella, Amphora, Cocconeis, Gomphonema, entre otros) que les permiten adherirse a diferentes sustratos y, así, mantenerse en las corrientes propias de un sistema lótico (Pinilla, 1998). Las diatomeas presentan diferentes tipos de movimientos según su morfología: las pennadas con rafe presentan movimientos espasmódicos, en tanto que la mayoría de las diatomeas céntricas y pennadas sin rafe rotan sobre un mismo punto, características que pueden generar procesos de deriva en la comunidad según cuán resistente sea su tipo de movimiento y adhesión (Allan, 1995). Además, tienen material silíceo en su pared celular (frústula), característica que les otorga mayor resistencia a cambios fisicoquímicos del medio (Bellinger & Sigee, 2011).
Los géneros de diatomeas Synedra y Navicula presentaron altas abundancias y densidades relativas en todos los muestreos y en la mayoría de las estaciones; asimismo, el género Cosmarium fue representativo de la división Clorophyta y el Oscillatoria, de las cianobacterias, resultados que fueron similares a los obtenidos por Gualtero & Trilleras (2001) en la represa de Prado. Estos autores establecieron que las mayores densidades poblaciones en la comunidad de algas estaba representada por las diatomeas, las clorofíceas y las cianofíceas, y que sus altas densidades podrían estar relacionadas con la naturaleza orgánica de diatomeas como Synedra y Navicula, las cuales presentan una frústula resistente (Bellinger & Sige, 2011). Además, son géneros generalistas y cosmopolitas (Novelo, 2012), al igual que Cosmarium y Oscillatoria, caracterizados por ser cosmopolitas y por hacer parte natural de las comunidades de rocas en los ríos (Bellinger & Sige, 2011).
El orden de riqueza (q:0) refleja que la riqueza fito-perifítica disminuye a medida que se avanza aguas abajo en el río; la medida de diversidad (q:1) evidencia el mismo comportamiento, siendo la estación E1 la que presentó la mayor diversidad, seguida de la estación E2, en tanto que hubo valores similares en las estaciones E3 y E4. Estos resultados evidenciarían cierto grado de intervención antrópica a medida que la altura disminuye, debido a que en sistemas con altas descargas y alteración del flujo, la diversidad y la riqueza tienden a disminuir (Clausen & Biggs, 1996).
Las estaciones E2 y E3 registraron una gran relación entre sí, con un 70 % de similitud, lo cual estaría asociado con la cercanía de cada punto y el grado similar de intervención antrópica, ya que estas dos estaciones son de uso recreativo y doméstico. Las estaciones E1 (nacimiento) y E4 (desembocadura) presentaron la mayor disimilitud entre ellas, sin embargo, la estación E4 (desembocadura) se diferenció de las demás, quizás porque esta zona presenta una gran influencia ganadera y vehicular a lo largo de su cauce, factores que modifican la química natural del agua y generan cambios en las dinámicas naturales de las comunidades perifíticas (Rivera, et al., 2010; Smucker & Vis, 2011; Castro & Pinilla, 2014).
Cabe resaltar que en este estudio, el análisis de escalamiento multidimensional no métrico (NMDS) demostró ser poco confiable en cuanto a su interpretación, probablemente por la diferencia en la naturaleza de las muestras tomadas, ya que los datos fisicoquímicos reflejaron una calidad de agua puntual, mientras que los datos biológicos fueron producto de cambios anteriores en la dinámica del cuerpo de agua, lo generó sesgo en los datos. En general, no se evidenció ningún tipo de asociación entre las comunidades biológicas y las variables ambientales.
Conclusiones
Se estableció que, a nivel temporal y espacial, hubo influencia del régimen hidrológico sobre las variables de porcentaje de saturación de oxígeno, pH, temperatura del agua, profundidad, coliformes totales y caudal en la cuenca del río Anchique, variables que pueden incidir de forma directa o indirecta en el desarrollo de las comunidades fitoperifíticas.
A nivel temporal, la densidad y el número de géneros encontrados se vieron influidos, en parte, por la dinámica hidrológica del cuerpo del agua. Se registró la mayor densidad de perifiton en épocas de aguas bajas, siendo la temporada climática un dinamizador de la biota fitoperifítica del río.
Es importante hacer futuras investigaciones para evaluar el papel del perifiton en la dinámica trófica del ecosistema, así como para analizar su respuesta frente a eventos de perturbación natural a partir de sus rasgos funcionales, lo cual ofrecería una base para llevar a cabo biomonitoreos de estrés hídrico con las consecuentes implicaciones para la conservación y los planes y programas de manejo.