Introducción
Los élmidos son escarabajos acuáticos de amplia distribución, con cerca de 1.500 especies descritas a nivel mundial que se distribuyen en 149 géneros (Slipinski, et al., 2011). Pertenecen al orden Coleoptera, el cual incluye cerca de 18.000 especies netamente acuáticas, distribuidas en aproximadamente 30 familias (Jach & Balke, 2008). En el Neotrópico la familia Elmidae tiene una amplia distribución y está representada por dos subfamilias: Elmidae, con 385 especies y 36 géneros, y Larainae, con 50 especies y 11 géneros (Manzo, 2013).
La diversidad de este grupo probablemente se deba a que ocupa un amplio espectro de microhábitats en ambientes lóticos y en algunos lénticos (White & Roughley, 2008), pues las larvas y los adultos pueden colonizar sustratos como plantas acuáticas, barro, raíces, troncos, piedras, hojarasca y, también, los márgenes de ecosistemas acuáticos o lo que se conoce comúnmente como el hábitat ripario (Ferreira-Jr, et al., 2014; Salles & Ferreira-Jr, 2014).
Durante su ciclo de vida, la mayoría de los élmidos se alimentan principalmente de algas y detritos (Brown, 1987) y presentan de cuatro a ocho estadios larvales seguidos de un estadio de pupa y el de adulto, aunque con diferencias entre las subfamilias Elminae y Laraine (Brown, 1987; White & Roughley, 2008). Son importantes en las cadenas tróficas de los ecosistemas acuáticos porque procesan la materia orgánica y, en alguna medida, son fuente de alimento de peces y aves acuáticas (Brown, 1987; White & Roughley, 2008).
En los últimos años, la investigación sobre los Elmidae neotropicales ha aumentado, no solo por su diversidad, sino por su potencial como bioindicador, pues las larvas y los adultos de la mayoría de las especies se encuentran en aguas corrientes bien oxigenadas y presentan baja tolerancia a la contaminación orgánica, lo que permite la formulación de índices de calidad ambiental en muchas corrientes neotropicales (Von Ellenrieder, 2007; Archangelsky, et al., 2009; Gutiérrez-Fonseca, 2010; Manzo, 2013; Braun, et al., 2014; Lozano, 2014; González-Córdoba, et al., 2015a).
En Colombia el estudio taxonómico y ecológico del orden Coleoptera ha sido muy escaso en comparación con el de otros órdenes de insectos como Ephemeroptera y Trichoptera (Roldán, 2016). Aunque se han publicado varios trabajos sobre este orden (González-Córdoba, et al., 2015a), su complejidad taxonómica y su poca abundancia no han fomentado el interés por estudiarlo. En el último año han aparecido algunos aportes con un alto rigor taxonómico que han enriquecido el conocimiento ecológico, taxonómico y de distribución de géneros y especies de la familia Elmidae en la regiones andina y pacífica, y en la Orinoquia (González-Córdoba, et al., 2015a, b, 2016a,b, 2019); sin embargo, deben aunarse esfuerzos para estudiar la riqueza genérica y de especies de la familia en otras regiones del país (González-Córdoba, et al., 2016b).
Específicamente en la Orinoquia, González-Córdoba, et al. (2015b, 2019) han registrado cinco especies (Neolimnius palpalis, Hinton 1939, Pilielmis apama, Hinton 1971, Hintonelmis opis, Hinton 1971, Hintonelmis sul, Hinton 1971 y Stegoelmis stictoides, Spangler 1990) y siete géneros (Hexacylloepus, Microcylloepus, Neoelmis, Stegoelmis, Xenelmis, Gyrelmis e Hyntonelmis). Teniendo en cuenta la multiplicidad de ecosistemas acuáticos, la variación altitudinal y las diferentes afectaciones antrópicas de esta región, existe la posibilidad de muchos hallazgos. En este contexto, el presente estudio se llevó a cabo en el área urbana y suburbana del río Ocoa, subcuenca del río Orinoco en Colombia, con el objetivo de determinar la distribución espacial y temporal de la familia Elmidae (Coleoptera) y establecer posibles relaciones de los géneros registrados con algunas variables físicas y químicas del agua, para así aportar al conocimiento de este grupo en la región de la Orinoquia.
Metodología
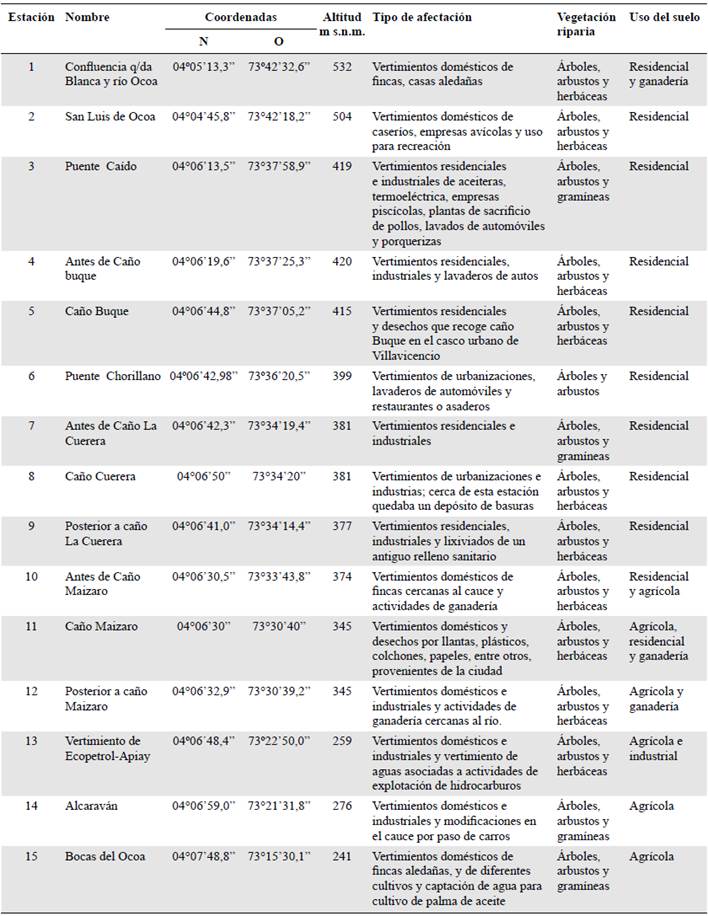
Area de estudio. Los muestreos se llevaron a cabo en un rango de altura de 241 a 532 m s.n.m. en un área urbana y suburbana de la cuenca hidrográfica del río Ocoa, con un área de 28.290 ha, ubicada en el municipio de Villavicencio, Colombia. El río nace en la vereda Samaria a 1.155 m s.n.m. y desemboca en el río Guatiquía, en el sector de Murujuy, a 225 m s.n.m. Al norte, la cuenca está delimitada por las estribaciones de la cordillera Oriental y la cuenca del río Guatiquía; al oriente con el municipio de Puerto López; por el sur con las cuencas de Caños Negros, Quenane, Pachaquiaro y Chocho, y por el occidente, con el río Guayuriba (Torres-Mora, et al., 2015).
Material biológico. El material biológico se recolectó en el marco del proyecto "Identificación de alternativas de manejo ambiental de los ríos Guayuriba y Ocoa y caños Quenane y Quenanito de la cuenca alta del río Meta, basado en estrategias educativas, investigativas y de proyección social", objeto del convenio marco de colaboración No. 5211592 suscrito entre la Universidad de Los Llanos y Ecopetrol.
Los muestreos se hicieron en dos periodos hidrológicos (de altas precipitaciones y de bajas precipitaciones), correspondientes a octubre de 2014 y febrero de 2015, en 15 estaciones a lo largo del río seleccionadas teniendo en cuenta la accesibilidad al lugar y la actividad antrópica (Tabla 1). En cada estación se tomaron siete muestras en sustrato rocoso con redes Surber (250 μπι de ojo de malla, 30x30 cm) y, posteriormente, se fijaron con alcohol (70 %).
El material así dispuesto se trasladó al Instituto de Ciencias Ambientales de la Orinoquia (ICAOC) y mediante el uso de estereoscopios los élmidos se limpiaron, se separaron y se determinaron hasta el mínimo nivel taxonómico posible empleando las claves de Archangelsky, et al. (2009), Manzo (2005), y González-Córdoba, et al. (2015b), y con el apoyo de consultas a los expertos.
Parámetros fisicoquímicos. Se midieron in situ siete variables: pH (unidades de pH), oxígeno disuelto (mgO2.L-1), porcentaje de saturación de oxígeno (% SAT. O2), temperatura (° C), conductividad eléctrica ^S.cm-1), caudal (m3s-1) y velocidad de la corriente (m.s-1). En el laboratorio se midieron 28 parámetros correspondientes a: aceites y grasas, amonio, arsénico, bicarbonatos, cadmio, cobre, cromo, demanda química de oxígeno (DQO - mgO2.L-1), demanda biológica de oxígeno (DBO5 - mgO2.L-1), fenoles totales, fósforo total (mgP.L-1), hidrocarburos aromáticos policíclicos, hidrocarburos totales, hierro, mercurio, níquel, nitratos (mgNO3.L-1), nitritos (mgNO2.L-1), nitrógeno total, ortofosfatos, pesticidas organoclorados, pesticidas organo-fosforados, plomo, sólidos totales disueltos (STD - ppm), sulfatos, turbidez (UNT), tensoactivos y zinc, así como dos parámetros bacteriológicos: coliformes fecales y coliformes totales.
Análisis de datos. Se calculó la abundancia relativa de cada género a nivel espacial y temporal. Para determinar la representatividad del muestreo de élmidos se utilizó la diversidad asintótica estimada de la riqueza (Chao, et al., 2014; Chao & Chiu, 2016) con el paquete iNEXT (Hsieh, et al., 2019) en el programa RStudio (RStudio Team, 2015). La relación entre los élmidos y las variables físicas, químicas y bacteriológicas se estableció mediante un análisis de correspondencia canónica (ACC) usando el programa CANOCO 4.56 (Braak & Smilauer, 2002; Leps & Smilauer, 2003), dado el comportamiento unimodal de los datos; además, con el fin de determinar si las variables ambientales explicaban la distribución de élmidos a lo largo del río, se hizo una prueba de permutación de Montecarlo con 499 iteraciones (Leps & Smilauer, 2003). Dichos análisis se hicieron únicamente con la información de los parámetros fisicoquímicos y bacteriológicos del periodo de baja precipitación; en el periodo de alta precipitación se registraron muy pocos taxones y, por ende, no se pudo hacer este análisis.
Asimismo, se empleó el índice de contaminación por materia orgánica (ICOMO) (Ramírez, et al., 1997) para determinar si la expansión urbana y la contaminación por aguas residuales reflejadas en el oxígeno disuelto (%), la demanda biológica de oxígeno y los coliformes totales tenían un efecto sobre la riqueza y la abundancia de la familia Elmidae.
Resultados
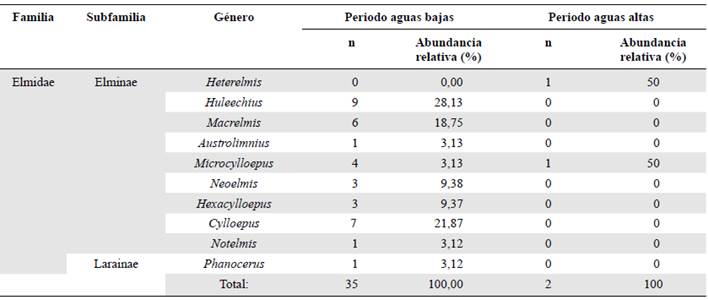
Se recolectaron 37 organismos pertenecientes a la familia Elmidae: 36 de la subfamilia Elminae y uno de Larainae. Los géneros más abundantes fueron Huleechius (nueve individuos), Cylloepus (siete individuos) y Macrelmis (seis individuos), y los menos representativos, con tan solo un individuo, fueron Astrolimnius, Heterelmis, Notelmis y Phanocerus (Tabla 2). En cuanto a la diversidad asintótica estimada para q0 a nivel espacial, se encontró que la representatividad del muestreo fue suficiente, pues estuvo entre 66 y 100 % (Tabla 3).
Tabla 3 Diversidad asintótica estimada de la riqueza para el ensamblaje de Elmidae a nivel espacial. Las estaciones no incluidas no registraron ningún género
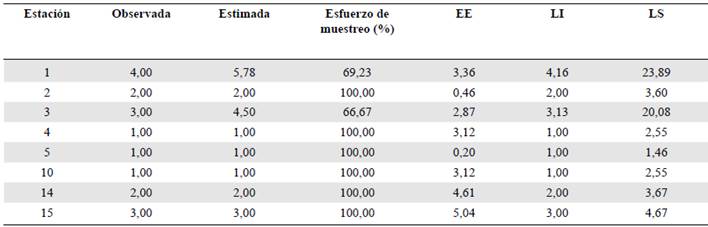
EE: error estándar; LI: límite inferior; LS: límite superior
Durante los meses de febrero y marzo (baja precipitación) se registró la mayor abundancia (94,59 %) y riqueza (nueve géneros), en tanto que en el mes de julio (alta precipitación) se registraron dos individuos (5,40 %) de los géneros Heterelmis y Microcylloepus (Tabla 2).
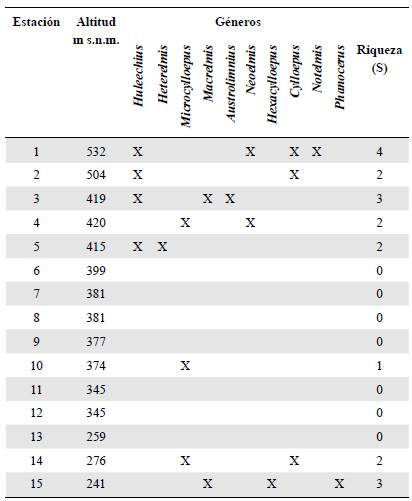
La estación 1 presentó la mayor riqueza, con cuatro géneros (Huleechius, Neoelmis, Cylloepus y Notelmis), seguida de las estaciones 3 y 15, con tres géneros. En siete estaciones (6, 7, 8, 9, 11, 12 y 13) no se registraron organismos de la familia y el género más frecuente a lo largo del río fue Huleechius, que se registró en cuatro de las 15 estaciones (Tabla 4).
En cuanto a la distribución altitudinal, la mayor riqueza se presentó entre los 415 y 532 m s.n.m., con ocho de los diez hallados. El género con mayor distribución fue Microcylloepus (420, 374 y 276 m s.n.m.), en tanto que Hexacylloepus, Notelmis y Phanocerus se registraron en una estación a 276, 532 y 276 m s.n.m., respectivamente (Tabla 4).
De las 28 variables físicas, químicas y bacteriológicas medidas ex situ tan solo 19 registraron cambios a lo largo del río (Tabla 5); en el resto, los valores estuvieron por debajo del límite de detección, por lo que se excluyeron del análisis. Es importante resaltar que variables como el pH y la temperatura exhibieron una reducida variación a lo largo de las estaciones, en tanto que los ortofosfatos, la turbidez, los coliformes totales, el oxígeno disuelto (%) y la DBO5, entre otros, presentaron coeficientes de variación muy altos (Tabla 5, Figura 1). Según el índice de contaminación por materia orgánica, las estaciones 4, 5, 6, 7, 8, 9 y 11 presentaron pésima calidad del agua (Figura 1).
Tabla 5 Medidas de tendencia de los parámetros físicos, químicos y bacteriológicos
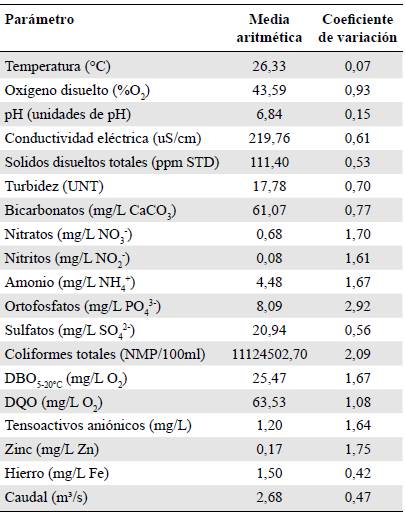
DBO: demanda biológica de oxígeno
DQO: demanda química de oxígeno
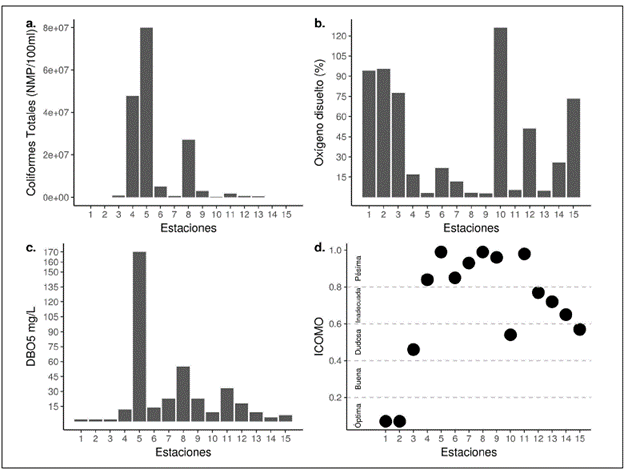
Figura 1 Valores de los registros de a. coliformes totales, b. oxígeno disuelto (%), c. DBO5, y d. índice de contaminación por materia orgánica (ICOMO), a lo largo de los diferentes puntos de muestreo
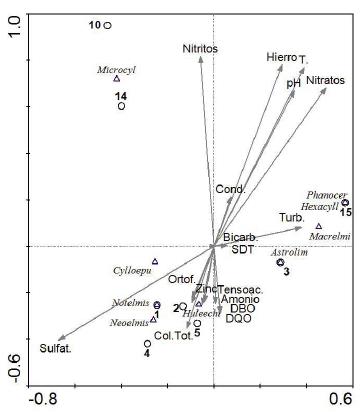
Según el análisis de correspondencia canónica (ACC), los parámetros fisicoquímicos y bacteriológicos explicaron el 61 % de la variabilidad biológica durante el periodo de aguas bajas. Las variables con mayor aporte fueron los nitratos, la temperatura, el hierro, los nitritos y el pH, sin embargo, ninguna fue lo suficientemente significativa para explicar el comportamiento de la familia Elmidae en el río Ocoa (prueba de Monte Carlo para el primero y todos los ejes canónicos: F=0,000; p=1,00).
A partir del diagrama de ordenación se pudo establecer que los géneros Huleechius, Notelmis y Neoelmis se asociaron con las estaciones 1, 2 y 5 y a parámetros como los coliformes totales, la DBO5, la DQO, los sulfatos y el amonio. Microcylloepus se relacionó principalmente con las estaciones 10 y 14, pero no se asoció claramente con ningún parámetro fisicoquímico. Los géneros Phanocerus, Astrolimnius, Macrelmis y Hexacylloepus se vincularon con las estaciones 3 y 15 y con la variable de turbidez, aunque la longitud del vector fue poca. Se observó una relación inversa entre el cuadrante I (hierro, nitratos, nitritos, temperatura y pH) con respecto al cuadrante III (DBO, DQO, amonio, coliformes totales y sulfatos (Figura 2).
Discusión
Todos los diez géneros de Elmidae encontrados en la cuenca del río Ocoa se encuentran registrados para Colombia en estudios realizados en los departamentos del Valle del Cauca, Antioquia, Norte de Santander, Chocó, Tolima y Caquetá, entre otros (Castellanos & Serrato, 2008; Posada-García, et al., 2008; Passos, et al., 2010; Llano, 2012; Aguirre-Pabón, et al., 2012; Sondermann, 2013; Zúñiga, et al., 2014; Segura, et al., 2013; González-Córdoba, et al., 2015a, b, 2016 a, b; Mosquera-Murillo & Córdoba-Aragón, 2015). En lo que respecta a la región de la Orinoquia, en el departamento de Arauca se han registrado 11 géneros (González-Córdoba, et al., 2015a), de los cuales siete se registraron nuevamente en el presente estudio (Heterelmis, Huleechius, Macrelmis, Astrolimnius, Microcylloepus, Cylloepus, Phanocerus), y cuatro no se encontraron (Hexanchorus, Onychelmis, Pseudodisersus y Xenelmis). En Vichada se reportaron recientemente los géneros Hintonelmis y Stegoelmis (González-Córdoba, et al., 2019), y en Meta se conocen diez géneros; Passos, et al., (2010) y Segura, et al., (2013) reportaron los géneros Disersus y Stegoelmis; González-Córdoba, et al., (2015 a,b) registraron Pilielmis, Neolimnius, Hexacylloepus, Micro-cylloepus, Neoelmis y Xenelmis, y González-Córdoba, et al., (2019) reportaron Gyrelmis e Hyntonelmis. En este trabajo se suman siete nuevos registros, lo que aumenta a 17 los géneros hallados en el departamento del Meta: Austro-limnius, Heterelmis, Cylloepus, Huleechius, Macrelmis, Notelmis y Phanocerus.
Estos registros evidencian que la riqueza genérica de Elmidae con inventario en los ríos de la región es amplia. Por ejemplo, en el río San Juan, departamento de Chocó, inicialmente Mosquera-Murillo & Córdoba-Aragón (2015) registraron cinco géneros (Heterelmis, Cylloepus, Phanocerus, Macrelmis, Disersus) y, posteriormente, González-Córdoba, et al. (2016b) ampliaron a 11 los géneros de Elmidae registrados (Austrolimnius, Hexacylloepus, Hexanchorus, Microcylloepus, Neocylloepus, Neoelmis). Algo parecido ocurrió en el Valle del Cauca, con muestras de los ríos Anchicayá, Cauca, Dagua y San Juan, y en las regiones naturales andina y pacífica, donde se documentaron 16 géneros en total (González-Córdoba, et al., 2015b). Lo anterior permite concluir que los esfuerzos orientados a registrar la diversidad en corrientes tropicales constituye un aporte efectivo al estudio de la fauna de insectos acuáticos dado que aún se desconoce gran parte de estos organismos en la Orinoquia y no hay información publicada o disponible.
Todavía son muchos los estudios necesarios sobre las fuentes hídricas de la región y el departamento, lo que implica que debe haber una gran riqueza por descubrir, sobre todo si se tiene en cuenta que con el estudio de una sola cuenca urbana se registraron diez géneros, de los cuales siete no se habían registrado antes en el departamento. En este sentido, es previsible que haya un aumento considerable de los registros de Elmidae si se llevan a cabo estudios en las seis grandes cuencas de la región de la Orinoquia: Arauca, Tomo, Vichada, Meta, Guaviare e Inírida, pues conforman un amplio mosaico de ambientes acuáticos naturales y reflejan la gran riqueza de los ecosistemas acuáticos y terrestres (Lasso, et al., 2014; Osorio-Ramírez, et al., 2015).
La gran abundancia y la riqueza del ensamblaje de élmidos en el periodo de aguas bajas puede deberse a las condiciones propicias para el establecimiento de los organismos: la ausencia de cambios bruscos en la estructura física del cauce (sustratos) y una oferta variada y estable de microhábitats (Arias-Díaz, et al., 2007; Lozano, 2014; Serna, et al., 2015; Vásquez, et al., 2014). Sin embargo, es necesario tener presente que la biota acuática soporta diferentes efectos adversos a lo largo de la cuenca (Terneus, et al., 2012; Bielmyer-Fraser, et al., 2017; Martins, et al., 2017; Moreno, et al., 2017; Van, et al., 2017), por ejemplo, la transformación del paisaje con la construcción de vías debida al desarrollo económico en la Orinoquia, y el enriquecimiento orgánico debido a la urbanización, la agricultura y la industrialización (Caicedo, 2016; Mora-Fernández, et al., 2015; Santana, 2010; Slava, 2015), lo que podría favorecer la aparición de organismos adaptados a estas condiciones. Estos efectos son evidentes durante la sequía (Auble, et al., 1994), lo que refleja que hay ensamblajes específicos frente a los diferentes afectaciones a lo largo del río, aumentando así la riqueza general (Bandyopadhyay & De, 2017).
Por otra parte, en el periodo de aguas altas los patrones de lluvia se manifiestan de manera intensa y prolongada, cambiando abruptamente la estructura física del cauce, los microhábitats y la biota (Arias-Díaz, et al., 2007; Vásquez-Ramos, et al., 2010; Terneus, et al., 2012; Aguirre-Pabón, et al., 2012; Serna, et al., 2015), lo cual se reflejó en la disminución de la riqueza de Elmidae con el registro de tan solo dos géneros capaces de soportar estas condiciones: Microcylloepus y Heterelmis.
Las características de cada una de las estaciones son de vital importancia para la estructura de los ensamblajes de coleópteros en los ecosistemas lóticos, pues factores como la altura, la intervención antrópica, la vegetación de ribera y la disponibilidad de sustratos, entre otros, determinan los ensamblajes (Velásquez & Miserendino, 2003; Caupaz-Flórez, et al., 2006; Giraldo, et al., 2014). En el presente estudio se encontró que las estaciones con mayor intervención antrópica y deterioro del hábitat exhibieron la menor abundancia o la ausencia de élmidos (estaciones 6 a 13). Algunos tramos dentro del casco urbano de Villavicencio reciben vertimientos de origen industrial, urbano y minero, entre otros, que podrían alterar la estructura y la composición de las comunidades de macroinvertebrados (Gamboa, et al., 2008; Lozano, 2014; Martins, et al., 2017).
En ese contexto, los géneros reportados se restringieron a ocho de las 15 estaciones, en especial en los primeros tramos del río. La mayor riqueza genérica se evidenció en las estaciones 1 (532 m s.n.m.) y 15 (241 m s.n.m.), lo cual puede atribuirse a que presentaban el menor número de afectaciones ambientales y de agentes contaminantes, ya que correspondían a zonas rurales de población reducida, cuyos arroyos son de aguas limpias y presentan una gran oferta de microhábitats, aspectos que favorecen el establecimiento de los coleópteros. Además, los primeros y últimos tramos aún conservan el margen ribereño, por lo que el bosque de ribera sería un componente fundamental de la biota del ambiente acuático y del terrestre, y todos los procesos que se derivan de su interacción (Naiman, et al., 1993; Vidon, et al., 2010).
En las estaciones 1, 2, 3, 4, 5,14 y 15, se registraron 36 individuos debido a una menor presión antrópica inicial sobre el río y al proceso de recuperación en los tramos más bajos cuando el río ha superado la ciudad y sus aportes de materia orgánica y contaminantes para pasar a zonas donde el uso del suelo es principalmente agrícola (Tabla 1).
Algunos tensores ambientales, como la elevada frecuencia de vertimientos domésticos provenientes de la ciudad, las fincas y las casas aledañas, generalmente tienden a disminuir la riqueza de los organismos acuáticos (Figueroa, et al., 2003). En las estaciones donde no se registraron élmidos (6, 7, 8, 9, 11, 12 y 13), tales afectaciones fueron evidentes y los valores del índice de contaminación por materia orgánica fueron altos (0,7 unidades, calificación "pésima" e "inadecuada"), debido principalmente al alto contenido de coliformes totales, los cuales están estrechamente asociados con la descarga de aguas residuales de las urbanizaciones (Osorio-Ramírez, et al., 2015), condición que parece incidir de manera directa en los elevados niveles de la DBO5 y la DQO.
Según Roldán (1999), en situaciones extremas de contaminación orgánica solo se encuentran microorganismos. Además, se ha documentado que factores como el tipo de perturbación antrópica, la naturaleza física del cuerpo de agua y sus condiciones físicoquímicas, tienen un papel crucial en la determinación de la densidad y riqueza de insectos acuáticos en las corrientes (Fossati, et al., 2001; Allan, 2004; Vásquez, et al., 2014). Parámetros como la altitud, el pH del agua, la concentración de oxígeno y la conductividad, así como el uso del suelo, son variables a las cuales los macroinvertebrados acuáticos a menudo responden positiva o negativamente (Ometo, et al., 2000; Arias, et al., 2007).
En los últimos años se han llevado a cabo varios trabajos sobre el orden Coleoptera (García & Fernández, 1994; Santiago-Fragoso & Sandoval-Manrique, 2001; Dos Santos, et al., 2011; Epele 6 Archangelsky, 2012; Manzo, 2013; González-Córdoba, et al., 2015 a,b, 2016 a,b, 2019; Mosquera-Murillo & Córdoba-Aragón, 2015), que han permitido abrir caminos de investigación orientados a establecer su potencial como indicadores de la calidad del agua. En el estudio de Dos Santos, et al., (2011) se concluyó que la familia Elmidae es sumamente sensible a la contaminación y Arias, et al., (2007) relacionaron la presencia de estos organismos con la baja tolerancia a la materia orgánica y las altas concentraciones de oxígeno. En el presente estudio se encontraron asociaciones puntuales entre Huleechius, Notelmis y Neoelmis y las bajas concentraciones de amonio, coliformes totales, sulfatos y DBO5, todas ellas indicativas de afectación por vertimientos urbanos (McGrane, 2016) y por actividades agrícolas y ganaderas (Bis, et al., 2000; Figueroa, et al., 2003; Egler, et al., 2012; McGrane, 2016).
Ello permitiría suponer que estos géneros no soportan tales condiciones físicas y químicas del agua y que, además, su presencia dependería de la oferta de alimento, los microhábitats y la estabilidad del sustrato dentro de la corriente. Es importante destacar que en las estaciones 1, 2, 3, 4, 5 y 15, en las que se registraron estos organismos, el amonio estuvo por debajo de 0,1 mg.L-1, en tanto que en las restantes el valor fue superior, probablemente por el uso de fertilizantes nitrogenados y la disposición de excretas y de desechos municipales e industriales (Pacheco, et al., 2002).
Asimismo, estos géneros se asociaron con valores bajos de sulfatos, los cuales se presentaron principalmente en las primeras y últimas estaciones, y fueron abundantes en varias de ellas. Los sulfatos en el agua pueden provenir de aguas residuales industriales (Severiche & González, 2012) o por drenajes mineros ricos en sulfatos. Zhao, et al., (2017) encontraron que concentraciones superiores a 100 mgL-1 representaban un alto riesgo para los macroinvertebrados y los ecosistemas acuáticos; en el presente estudio tales concentraciones fueron inferiores a 50 mg.L-1. No se encontraron otros estudios en los que se relacionara la presencia de la familia Elmidae y de los géneros que la conforman con estas u otras variables fisicoquímicas.
Asimismo, el porcentaje de saturación de oxígeno disuelto varió ampliamente a lo largo de los puntos de muestreo (entre 3 y 120 %), pero en las estaciones 6, 7, 8, 9, 11, 12 y 13 los valores no superaron el 30 %, por lo cual no se registraron élmidos. Estas estaciones corresponden propiamente a los tramos más impactados por la urbanización y cuyo grado de contaminación por materia orgánica, según el ICOMO, corresponde a aguas inadecuadas y pésimas (Figura 1). Esto coincide con lo reportado para la mayoría de los macroinvertebrados acuáticos, pues son sensibles a la reducción del oxígeno disuelto, lo que disminuye su riqueza y abundancia e, incluso, llevan a su desaparición (Jacobsen, et al., 2003; Jacobsen, 2008; Rostgaard & Jacobsen, 2005).
Es importante destacar que se registraron adultos de Huleechius, Heterelmis, Microcylloepus y Cylloepus en las estaciones 4, 5 y 14 cuyos valores de oxígeno disuelto oscilaron entre 3 y 26 % (Figura 1), contrario a lo sugerido por Arias, et al., (2007), quienes registraron la preferencia por corrientes con altos de porcentajes de saturación de oxígeno. Por otra parte, Huleechius y Heterelmis, dos de los géneros más abundantes y de mayor distribución de la familia Elmidae (Braun, et al., 2014; Lozano, 2014; González-Córdoba, et al., 2015b), responden de manera muy variada a las perturbaciones ambientales (Sajami & Huamantico, 2016; Arias, et al., 2007). Además, es importante resaltar que los adultos de estos cuatro géneros se caracterizan por su respiración por plastrón, pues toman el oxígeno atmosférico, se sumergen en el agua e intercambian el gas con el oxígeno disuelto en ella (Brown, 1987), lo cual los hace sensibles a la poca disponibilidad de oxígeno disuelto. Sin embargo, dichos géneros se registraron en las estaciones con tales condiciones (4, 5 y 14), lo que plantea nuevos interrogantes.
Por último, el hierro fue uno de los iones con los que ningún Elmidae presentó asociación, aunque registró valores variables a lo largo de la corriente, y únicamente en las estaciones 1 y 2 no sobrepasó los límites permisibles establecídos por el Decreto 1076 de 2015 (<1mgFeL-1) para la conservación de la vida acuática; las demás estaciones registraron valores entre 1 y 3 mgFeL-1. La carga de hierro ha aumentado en los ecosistemas acuáticos debido a la intensificación de la agricultura, los minerales enriquecidos y los usos silvo-pastoriles del suelo, y aunque sus efectos sobre los animales acuáticos son principalmente indirectos (osmorregulación, metabolismo, calidad de hábitat y alimentos), pueden actuar en conjunto con otros elementos tóxicos y tener fuertes efectos en la red trófica (Vuori, 1995). En algunos estudios como el de Rasmussen & Lindegaard (1988) se ha encontrado una correlación negativa entre el hierro disuelto en el agua y la abundancia y riqueza taxonómica de los macroinvertebrados acuáticos: con concentraciones superiores a 0,2 mgL-1 la riqueza disminuyó abruptamente y con >1 mgL-1, también la abundancia, en tanto que en concentraciones >10 mgL-1 dominaron las familias Chironomidae, Tipulidae (Diptera) y Tubificidae (Olichochaeta).
Por otra parte, Peters, et al. (2011) han sugerido que pueden haber varios grupos taxonómicos de macroinvertebrados potencialmente afectados por la exposición a bajos niveles de hierro, pues a pesar de que es un ion que se transforma a hidróxidos en condiciones de pH >7,0, estas no cambian significativamente con valores entre 6,5 y 7, lo que implica que los organismos siguen estando expuestos a la forma del ion. Sin embargo, se requieren más estudios para comprender el impacto ecotoxicológico de todos los factores y usos del suelo que pueden afectar los ecosistemas y los organismos.
Conclusiones
Se registraron diez géneros de la familia Elmidae en la cuenca del río Ocoa, siete de los cuales son nuevos registros para el departamento del Meta. Los organismos fueron sensibles a la contaminación de origen antrópico y se registró su disminución o ausencia en aquellas estaciones con altos valores de demanda bioquímica de oxígeno y altos contenidos de coliformes totales. Sin embargo, algunos organismos demostraron ser tolerantes a la disminución del oxígeno o al aumento de sulfatos, lo cual evidencia la utilidad de estudios como este para ampliar el conocimiento de la fauna acuática en los diversos ecosistemas acuáticos y aportar información que permita el desarrollo de herramientas de gestión de la biodiversidad en pro de la conservación de la gran riqueza hídrica de la región de los Llanos orientales.