La sobreexposición a la radiación solar en humanos constituye un problema de salud pública debido al efecto carcinógeno de la radiación ultravioleta (Linos, et al., 2009). El rango espectral ultravioleta de la radiación solar comprende los rayos UVA de onda larga (315-400 nm), los rayos UVB de onda media (280-315 nm) y los rayos UVC de onda corta (100-280 nm). Los rayos UVC son totalmente absorbidos por la capa de ozono, en tanto que entre 1 y 10 % de los rayos UVB y entre 90 y 99 % de los rayos UVA alcanzan la superficie terrestre. Por esto, se considera que solo los rayos UVB y UVA tienen una real importancia biológica (Ganesan & Hanawalt, 2016).
Los efectos biológicos nocivos de la radiación ultravioleta dependen de su energía e incluyen desde daños leves en la piel, como el eritema, hasta otros más graves como quemaduras, (Narayanan, et al., 2010). Tanto los rayos UVA como los UVB producen daños en el ADN, principalmente los dímeros de pirimidina ciclobutano (cyclobutane pyrimidine dimer, CPD) (Tewari, et al., 2012), los cuales causan mutaciones conocidas como huellas genéticas UV (Brash, 2015) que desencadenan procesos inflamatorios y causan inmunosupresión y cáncer de piel (Vink & Roza, 2001). Aunque en menor medida, los rayos UVB también producen niveles importantes de (6-4) pirimidina pirimidona (6-4PP) y los de UVA, bases oxidadas (8-oxo-7,8-dihidro-deoxiguanina, formamido-pirimidinas, roturas de cadena simples) (Tewari, et al., 2012).
Los CPD y la 6-4PP constituyen un obstáculo para la replicación del ADN y producen un bloqueo del ciclo celular (Yeeles, et al., 2013); dichos daños deben ser reparados para que la célula restaure la replicación de su genoma y sobreviva. En la mayoría de los seres vivos, los mecanismos de reparación del daño genético constituyen la primera barrera de defensa frente a los CPD y la 6-4PP, entre los cuales se destacan la fotorreactivación (Kneuttinger, et al., 2014) y la reparación por escisión de nucleótidos (Nucleotide Excision Repair, NER) (Schärer, 2013).
Además, las células expuestas a la radiación ultravioleta pueden activar diferentes respuestas dirigidas a restaurar la división celular y, en últimas, a garantizar la sobrevivencia del organismo. En las bacterias la radiación ultravioleta induce la respuesta SOS, una respuesta de emergencia celular que controla funciones como la reparación del ADN, la mutagénesis SOS o síntesis de translesión de ADN, la formación del septo celular, y la restauración de la replicación del genoma bacteriano, entre otras (Schlacher & Goodman, 2007). Una respuesta similar inducible por la radiación ultravioleta se ha descrito en células de la piel de los mamíferos (Eller, et al., 2008); en ella, los melanocitos y los queratinocitos responden a los CPD o a la exposición a los oligonucleótidos del dinucleótido del ADN timidina (pTpT), los cuales mimetizan la señal del daño genético por UV en la célula activando la proteína supresora de tumores 53 (p53) (Eller, et al., 1997). Esta proteína funciona como un factor de transcripción o efector de diferentes vías de señalización celular y permite la producción de melanina y la restauración de funciones esenciales inhibidas por la radiación ultravioleta, como la división celular y la reparación del daño genético (Figura S1, https://www.raccefyn.co/index.php/raccefyn/article/view/841/2548). La proteína p53 promueve la inducción de genes que incrementan la habilidad de la célula para sobrevivir al daño inducido por la radiación ultravioleta en futuras exposiciones a este agente (Mayer, et al., 2001). Entre estos genes se encuentran aquellos que codifican proteínas involucradas en la melanogénesis de la piel (tirosinasas, hormona estimuladora de melanocitos a), el control del ciclo celular (proteína efectora p21, antígeno nuclear de proliferación celular), la NER y la síntesis de translesión de ADN en humanos. Cuando esta respuesta de fotoprotección es inducida por oligonucleótidos de pTpT, reduce el número de melanomas inducido por la radiación ultravioleta en ratones (Arad, et al., 2008) y en humanos (Arad, et al., 2007). Por ello, el uso de oligonucleótidos de pTpT se ha propuesto como una estrategia preventiva de fotoprotección (Goukassian, et al., 2012). Los CPD también inician estados de inflamación e inmunosupresión (Figura S1, https://www.raccefyn.co/index.php/raccefyn/article/view/841/2548). En estos casos, a través de la vía de la señalización celular del factor de transcripción nuclear kB, se activan los genes de las interleucinas 8 y 10 y del factor de necrosis tumoral a, los cuales desempeñan un papel central en la inflamación cutánea y la inmunosupresión inducida por la radiación ultravioleta (Ullrich, 2005).
En contraste con todo el conocimiento sobre los efectos adversos producidos por los CPD, los estudios disponibles sobre el papel de las bases oxidadas del ADN en el cáncer de piel son contradictorios (Lund & Timmins, 2007). En estudios recientes se ha evidenciado que las oxidasas mitocondriales participan en la producción de las especies reactivas de oxígeno (ERO) inducidas por los rayos UVA (Schuch, et al., 2017), las cuales oxidan enzimas que reparan el ADN dañado, lo que podría comprometer la remoción de daños inducidos por la radiación ultravioleta (Brem, et al., 2017). Además, dañan componentes estructurales de la piel como la actina y el colágeno afectando así la integridad de la dermis y la epidermis (Yamaba, et al., 2016), lo cual se ha relacionado con el envejecimiento de la piel (Poon, et al., 2015).
Estos hallazgos respaldan el papel fundamental de los CPD y las ERO en el efecto inducido por la radiación ultravioleta en el desarrollo del cáncer y el envejecimiento de la piel, respectivamente. Si el nivel de los CPD en la célula supera su capacidad para repararlos, y estos persisten durante la fase S del ciclo celular, una polimerasa propensa a error puede polimerizar estos fotoproductos (Vaisman & Woodgate, 2017) produciendo las ya mencionadas huellas genéticas UV (Brash, 2015). Cuando estas mutaciones se acompañan de la pérdida de la función de los genes supre-sores de tumores, como el de la proteína p53 (Ziegler, et al., 1994), la célula pierde la capacidad de reparar el daño (Gatz & Wiesmuller, 2006) y de producir melanina (Cui, et al., 2007), dando lugar a procesos de expansión clonal de las células mutantes involucradas en las fases iniciales del cáncer de piel (Jonason, et al., 1996). Se ha establecido que alrededor del 90 % de los pacientes con carcinomas de la piel presentan mutaciones en el gen p53 (Ziegler, et al., 1994).
El riesgo de padecer cáncer de piel debido a la sobre-exposición a la radiación solar se ha evaluado principalmente mediante índices empíricos, tales como la dosis mínima de eritema (DME) (Parrish, et al., 1982). El eritema es un efecto inflamatorio agudo producido por los rayos UVB que se manifiesta como un proceso de enrojecimiento de la piel (Vink & Roza, 2001). Young, et al. (1998) evidenciaron la similitud en los patrones de CPD y del eritema para el rango espectral de 280 a 340 nm, lo que sugiere que los CPD son cromóforos del eritema (Figura S2, https://www.raccefyn.co/index.php/raccefyn/article/view/841/2549). Con base en esta concordancia, los autores propusieron usar índices DME como un sustituto de los componentes espectrales UVB (280-315 nm) y UVA" (315-340 nm) causantes de daño en el ADN de los melanocitos y queratinocitos de la piel (Ikehata, et al., 2013a).
La fotoprotección y su medición
La fotoprotección es una estrategia preventiva y terapéutica frente al cáncer y al fotoenvejecimiento de la piel (Chhabra, et al., 2017). La estrategia de protección más aceptada es el uso tópico de bloqueadores solares (cremas, lociones, emulsiones, barras, etc.). Estos bloqueadores solares contienen compuestos orgánicos o inorgánicos que actúan como filtros solares absorbiendo o refractando la radiación ultravioleta, con lo que se evita su absorción en el ADN (Jansen, et al., 2013). Recientemente, se han revisado las propiedades más relevantes de los filtros solares comúnmente usados en los bloqueadores solares comerciales (Wang, et al., 2017).
El factor de protección solar (FPS) in vivo (Sayre, et al., 1979) fue el primer método para evaluar la efectividad de dicha protección al indicar cuánto aumenta la capacidad de la protección natural de la piel contra el eritema. Sin embargo, los métodos in vivo para evaluar la efectividad de la protección solar son laboriosos y controvertidos por razones éticas (Bendová, et al., 2007). Por lo tanto, se han propuesto índices basados en los datos obtenidos in vitro sobre la absorción espectral de radiación ultravioleta y la radiación solar global productoras de eritema (Stanfield, et al., 2010), entre los cuales se destacan los siguientes: i) factor de protección solar (FPSin vitro), ii) factor de protección UVA (FP-UVA), iii) relación UVA/UVB (R), y iv) longitud de onda crítica (X). Algunos de estos índices se han incluido en las guías de la European Cosmetic, Toiletry and Perfumery Association (Colipa, 2011) y de la Food and Drug Administration de los Estados Unidos (FDA, 2011).
Infortunadamente, la prevención del eritema con bloqueadores solares no garantiza que no se generen fotopro-ductos del ADN epidérmico, ya que el efecto genotóxico de la radiación ultravioleta puede ocurrir con dosis más bajas que la DME (Young, et al., 1998). Por ello, se ha sugerido reconsiderar la evaluación del riesgo por exposición a la radiación ultravioleta basada en el eritema (Ikehata, et al., 2013a). Para superar estas limitaciones y mejorar el actual sistema de medición de la eficacia fotoprotectora de los bloqueadores solares, se han propuesto otros índices como el factor de protección inmunitario (Fourtanier, et al., 2005), el factor de protección de la piel de radicales libres (Herrling, et al., 2006), y el factor de protección genotóxico (Césarini & Demanneville, 2000). Este último permite medir la eficacia fotoprotectora directamente en el ADN (Schuch, et al., 2014), y con ello diferenciar moléculas que funcionan como filtros solares de otras que estimulan la capacidad celular para reparar el daño genético, como ya se indicó anteriormente.
En tal sentido, recientemente nos hemos propuesto el uso del SOS Chromotest (Quillardet, et al., 1982) para la bioprospección de plantas con potencial de fotoprotección (Fuentes, et al., 2017). Este ensayo mide la respuesta SOS en Escherichia coli, la cual relaciona el daño genético, la replicación del ADN y la división celular (Figura 1).
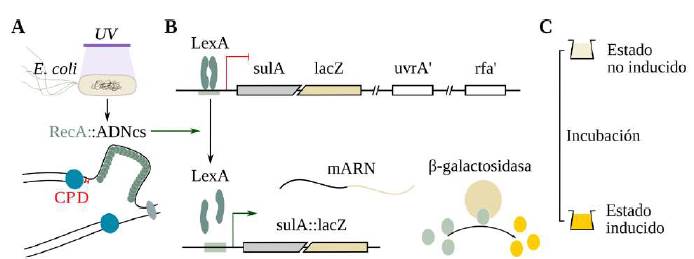
Figura 1 Fundamento del SOS Chromotest. El ensayo se fundamenta en la medición de un sistema inducible de emergencia celular (respuesta SOS), que relaciona la replicación del ADN y la división celular en Escherichia coli. Cuando las células de E. coli se exponen a agentes mutágenos que distorsionan el ADN (por ejemplo: los DNA-protein crosslinks, DPC), tal distorsión constituye un obstáculo para la replicación del cromosoma y, en consecuencia, se detiene la división celular. Con el fin de reparar los daños producidos en el ADN y restaurar la división celular, la célula induce la respuesta SOS. En la cepa E. coli PQ37, la inducción se inicia con la unión de la proteína RecA a regiones de ADN de cadena simple, próximas a la horquilla de replicación del ADN detenida por el daño (A). Esta forma activada de RecA promueve la auto-incisión del represor LexA que permite la transcripción de los genes SOS, incluida la fusión transcripcional sulA::lacZ (B). En presencia de un sustrato indicador, la enzima P-galactosidasa (producto del gen lacZ) produce color o fluorescencia que se mide utilizando un espectrofotómetro o fluorómetro, según sea el caso (C). La cantidad de color o fluorescencia producida es directamente proporcional a la cantidad de daño inducido.
Aunque el SOS Chromotest ha sido uno de los ensayos más usados para la evaluación genotóxica de sustancias químicas (Escobar, et al., 2013), poco se conocía sobre su sensibilidad a la radiación ultravioleta (Quillardet & Hofnung, 1984). Comparado con otros modelos experimentales (dosímetros de ADN, ensayo enzimático con endonucleasa V del bacteriófago T4, ensayo del cometa), el SOS Chromotest es el ensayo más sensible a la radiación ultravioleta que se conoce, pues detecta daños en las siguientes dosis mínimas de radiación ultravioleta: UVC (0,02 J/m2), UVB (10 J/m2) y UVA (5000 J/m2). Utilizando cepas mutantes isogénicas de E. coli (Prada-Medina, et al., 2016) , se ha estudiado el efecto de diferentes deficiencias genéticas en la sobrevivencia y la inducción de la respuesta SOS frente a la radiación UVB en este modelo experimental. Se evidenció que cinco mutaciones (uvrA > recB > recO > recJ > xonA) afectaron de manera importante la supervivencia celular. Además, en las mutaciones uvrA y recJ se registró una elevada inducción de la respuesta SOS en comparación con la cepa salvaje, incluso 240 minutos después de la irradiación. Las cepas con las mutaciones recO o recN no indujeron la respuesta SOS en E. coli. Un hallazgo importante fue constatar que para la supervivencia celular los mecanismos de recombinación homóloga del ADN son tan importantes como la NER, lo cual sugiere que tienen un papel durante la eliminación de los fotoproductos inducidos por la radiación UVB en el ADN celular. Además, en nuestro estudio se proponen nuevas funciones para los productos génicos de recO o recN en los procesos de inducción de la respuesta SOS en E. coli. Usando algunas cepas de este microorganismo (PQ30, PQ37, IN250, IN400), se estudiaron las fases del proceso de reorganización del nucleoide bacteriano después de la irradiación (Estévez-Castro, et al., 2018). El estudio postuló nuevas funciones para algunas proteínas de reparación del ADN (UvrA, RecJ y RecN) durante este proceso y estableció las bases experimentales para el uso de dichas cepas en estudios de fotoprotección. En resumen, los tres estudios mencionados permitieron consolidar el conocimiento básico que validó el uso eficaz de modelos experimentales in vitro, basados en una fusión transcripcional con genes SOS bacterianos en estudios de fotoprotección.
A continuación se señalan las razones que justifican el uso del ensayo SOS Chromotest para la bioprospección de compuestos fotoprotectores. Primero, se ha descrito en células de piel humana una respuesta fotoprotectora indu-cible por radiación ultravioleta similar a la respuesta SOS bacteriana que involucra la melanogénesis, la detención del ciclo celular, y la inducción de genes involucrados en la reparación del CPD y en la síntesis de translesión del ADN (Eller, et al., 2008). Por lo tanto, el ensayo SOS Chromotest, muy sensible a la radiación ultravioleta (Fuentes, et al., 2017) , debe predecir adecuadamente la fotoprotección en células de piel humana. Segundo, ya se ha probado la utilidad del ensayo para la evaluación de la actividad antigenotóxica de compuestos de origen vegetal (Vicuña, et al., 2010; López, et al., 2011; Quintero, et al., 2012). Tercero, como ya se indicó, se han identificado genes críticos para la supervivencia celular frente a la radiación ultravioleta y la inducción de SOS en este modelo experimental (Prada-Medina, et al., 2016; Estévez-Castro, et al., 2018). El uso simultáneo de estas cepas proporcionó información preliminar sobre los mecanismos de protección por los cuales los elementos constitutivos de las plantas reducen el efecto genotóxico de la radiación ultravioleta. Cuarto, el SOS Chromotest es un ensayo validado para la detección de efectos genotóxicos (White & Rasmussen, 1996) que, en comparación con otros métodos, permite un escrutinio de amplia cobertura (White, et al., 1996).
Las plantas como fuente de compuestos fotoprotectores
Las plantas son fuente de una gran diversidad de moléculas naturales útiles en la fotoprotección. Entre las más comunes se encuentran los terpenos, las flavonas, los carotenoides, las catequinas y las antocianinas. Algunas de estas moléculas naturales pueden actuar como filtros solares (Stevanato, et al., 2014) mediante el modo de acción ya descrito para este tipo de compuestos.
Además, la mayoría tienen propiedades antioxidantes (Saewan & Jimtaisong, 2013). Las moléculas antioxidantes fueron inicialmente usadas como un complemento de los filtros solares para reducir el estrés oxidativo producido por la radiación ultravioleta (Chen, et al., 2012). Hoy se sabe que los compuestos antioxidantes naturales pueden mitigar varios de los efectos biológicos adversos de la radiación ultravioleta que generan fotoenvejecimiento celular (Mukherjee, et al., 2011) y cáncer de piel (Montes de Oca, et al., 2017).
Dado que las plantas acumulan compuestos cuando están expuestas al componente UVB de la radiación solar (Zhang & Björn, 2009), pueden ser una fuente de compuestos foto-protectores útiles para prevenir las mutaciones celulares involucradas en el cáncer de piel mediante la regulación de la mutabilidad inducida por los CPD (Afaq & Katiyar, 2011). Este tipo de compuestos se conocieron inicialmente como antimutágenos (Kada & Shimoi, 1987); hoy se conocen como agentes quimiopreventivos que pueden prevenir o retardar la acción de los factores carcinógenos (Montes de Oca, et al., 2017).
Los efectos biológicos de la radiación ultravioleta susceptibles de ser modulados con el uso de esta clase de compuestos se resumen en la Figura S1. Así, los mecanismos de fotoprotección más comunes de estas moléculas son los siguientes: i) la actividad antioxidante frente a las ERO; ii) la absorción directa de fotones (filtros solares); iii) el bloqueo del ciclo celular o la estimulación de mecanismos de reparación del ADN, y iv) la estimulación de la melano-génesis, entre otros. La idea de desarrollar bloqueadores solares con base en compuestos naturales con propiedades antimutagénicas, antigenotóxicas o quimiopreventivas frente a la radiación ultravioleta suscita un interés creciente, dado que el estado de fotoprotección se logra estabilizando la integridad genómica (Ganesan & Hanawalt, 2016).
Los estudios en Colombia sobre el potencial fotoprotector de su flora son escasos y miden la fotoprotección usando criterios diferentes. Por ejemplo, el grupo del Dr. Osorio-Durango (Universidad de Antioquia, Colombia) demostró que el extracto de frutas de Passiflora tarminiana, así como su fracción polifenólica (flavonoides y procianidinas), tiene actividad antioxidante y reduce la degradación de colágeno inducida por la radiación ultravioleta en fibroblastos humanos estimulando su síntesis (Bravo, et al, 2017). Sus resultados coincidieron con los de otros autores en cuanto al efecto fotoprotector de compuestos vegetales en las proteínas estructurales de la piel (Chua, et al., 2012; Chandra-Pal, et al., 2015; Chiang, et al., 2015; Adam, et al., 2016). El grupo del Dr. Osorio-Durango recomendó el uso de los extractos de P. tarminiana en la formulación de cosméticos contra el envejecimiento de la piel.
Por otra parte, usando índices basados en datos de absorción espectral in vitro (FPS. in vitro , FP-UVA, UVA/UVB, λ), el grupo del Dr. Puertas-Mejía (Universidad de Antioquia, Colombia) demostró que las especies de plantas de alta montaña Baccharis antioquensis, Morella parvifolia y Pentacalia pulchella absorben la luz ultravioleta en los rangos UVA y UVB y por sus propiedades antioxidantes y fotoprotectoras recomendaron su uso como complemento de los bloqueadores solares comerciales (Mejía-Giraldo, et al., 2016ab; Puertas-Mejía, et al., 2018).
Con base en sus propiedades antigenotóxicas frente a la radiación ultravioleta, nuestro grupo evaluó el potencial fotoprotector de aceites esenciales obtenidos de especies del género Lippia (Quintero-Ruiz, et al., 2017). En dicho estudio se evidenció que cuatro aceites esenciales obtenidos de las especies Lippia alba (COL 512272), L. micromera (COL 516924) y L. origanoides (COL 512075 y COL 519799) tenían efecto antigenotóxico frente a la radiación ultravioleta (Tabla 1).
Tabla 1 Efecto antigenotóxico de los aceites esenciales obtenidos de diferentes especies de Lippia. Se presentan los compuestos mayoritarios de cada aceite, la mínima concentración con inhibición significativa (p≤0,05) de la actividad fosfatasa alcalina constitutiva (CAPSI) y la mínima concentración con inhibición significativa (p≤0,05) de los efectos genotóxicos (CIG) inducidos por la radiación ultravioleta en la cepa PQ37 de E. coli. Solo los valores de CIG ≤ 1 % se consideraron como concentraciones antigenotóxicas biológicamente relevantes. Además, se consideraron como promisorios los aceites esenciales que no mostraron citotoxicidad en el modelo experimental.
| Nombre de la especie | Principales elementos constitutivos† | CAPSI (%) | (CIG) |
|---|---|---|---|
| (voucher del HNC) | (%, v/v) | ||
| L. alba (COL 480750) | Carvona (38 %)/limoneno (32 %) | 1,7 ± 0,0 | 3,3 ± 0,0 |
| L. alba (COL 512272) | Neral (19 %)/geranial (23 %) | NI | 0,8 ± 0,0 |
| L. alba (COL 560257) | Myrcenona (63 %) | 1,7 ± 0,0 | 1,7 ± 0,0 |
| L. citriodora (COL 555845) | Neral (16 %)/geranial (19 %) | 0,8 ± 0,0 | 0,8 ± 0,0 |
| L. dulcis (COL 512079) | δ-cadineno (9 %)/trans-β-cariofileno (10 %) | 1,7 ± 0,0 | NI |
| L. graveolens (COL 555839) | Timol (70 %)/ρ-cimeno (9 %) | 0,2 ± 0,0 | 0,4 ± 0,0 |
| L. micromera (COL 516924) | Timol (29 %)/timol metil eter (15 %)/ρ-cimeno (13 %) | NI | 0,8 ± 0,0 |
| L. origanoides (COL 512075) | Carvacrol (46 %)/ρ-cimeno (11 %)/γ-terpineno (12 %) | NI | 0,4 ± 0,0 |
| L. origanoides (COL 519798) | α-felandreno (13 %)/ρ-cimeno (11 %)/trans-β-cariofileno (11 %) | 1,7 ± 0,0 | 3,3 ± 0,0 |
| L. origanoides (COL 519799) | Timol (54 %)/ρ-cimeno (10 %) | NI | 0,4 ± 0,0 |
HNC: Herbario Nacional de Colombia, NI: sin inhibición
†: según Stashenko, et al. (2008)
Citral = Neral (19 %)/geranial (23 %). En letra negrilla se resaltan los datos o valores promisorios.
Un análisis de la composición química de los aceites esenciales mediante cromatografía de gases acoplada a espectrometría de masas permitió constatar sus compuestos mayoritarios. Se evaluó la antigenotoxicidad frente a la radiación ultravioleta de estos compuestos mayoritarios y con base en sus valores de mínima concentración inhibitoria significativa (CIG), su potencial antigenotóxico fue el siguiente: p-cimeno (89 µg/mL) > carvacrol (140 µg/mL) > timol (202 µg/mL) > citral (267 µg/mL). Estos resultados relacionan el efecto antigenotóxico de los aceites esenciales con sus compuestos mayoritarios. Ademas, al estudiar las mezclas de los compuestos mayoritarios de la especie L. origanoides, se encontró sinergismo en las siguientes combinaciones: timol/carvacrol, timol/p-cimeno y carva-crol/p-cimeno, lo que indica que el efecto antigenotóxico detectado en los aceites esenciales, por lo menos en el de L. origanoides, puede ser el resultado de efectos aditivos o sinérgicos entre sus compuestos mayoritarios.
En un segundo trabajo (Fuentes, et al., 2017), se reportaron nuevas especies de plantas potencialmente útiles como fuentes de compuestos fotoprotectores. Estos estudios mostraron que los extractos obtenidos de 11 especies de plantas colombianas mediante el método de extracción de fluidos (CO2) supercrítico redujeron el daño producido en el ADN por la UVB con concentraciones biológicamente relevantes (CIG<125 (g/mL) (Cos, et al., 2006) con valores del porcentaje de inhibición significativa que oscilaron entre 52 y 100 % (Tabla 2).
Tabla 2 Estimación del efecto antigenotóxico y la eficacia fotoprotectora de extractos de plantas promisorios. Los extractos se obtuvieron mediante el método de extracción con fluido (CO2) supercrítico. Se presenta la concentración mínima que produce inhibición significativa (p ≤ 0.05) del efecto genotóxico (CIG) y el porcentaje de inhibición de dicho efecto (%IG) de cada extracto. Solo los valores de CIG ≤ 125 (g/mL se consideraron como concentraciones antigenotóxicas biológicamente relevantes (Cos, et al., 2006). Se presentan, además, los valores de la eficacia fotoprotectora basados en los índices de fotoprotección in vitro SPF in vitro . y λc.
| Nombre de la especie | Localidad | CIG ‡ | %IG ‡ | FPSin vitro | λc † |
|---|---|---|---|---|---|
| (voucher del HNC) | (provincia) | (μg/mL) | † | ||
| Achyrocline satureioides (COL 579420) | Zapatoca (Santander) | 125 ± 0 | 63 ± 5 | 192 ± 2 | 343 ± 0 |
| Baccharis nítida (COL) 559436) | Villanueva (Santander) | 16 ± 0 | 78 ± 4 | 17 ± 0 | 360 ± 0 |
| Chromolaena pellia (COL) 559437) | Los Santos (Santander) | 125 ± 0 | 58 ± 6 | 352 ± 16 | 367 ± 0 |
| Tagetes caracasana (COL) 559441) | Zapatoca (Santander) | 125 ± 0 | 52 ± 5 | 146 ± 1 | 360 ± 0 |
| Hyptis suaveolens (COL) 560241) | Umpalá (Santander) | 31 ± 0 | 67 ± 8 | 2 ± 0 | 340 ± 0 |
| Salvia aratocensis (COL) 560246) | Los Santos (Santander) | 125 ± 0 | 89 ± 5 | 173 ± 1 | 370 ± 0 |
| Persea caerulea (COL) 560247) | Charalá (Santander) | 31 ± 0 | 99 ± 1 | 165 ± 1 | 360 ± 0 |
| Psidium sartorianum (COL) 578359) | Zapatoca (Santander) | 125 ± 0 | 54 ± 6 | 3 ± 0 | 350 ± 0 |
| Piper eriopodon (COL) 578364) | Zapatoca (Santander) | 125 ± 0 | 55 ± 9 | 101 ± 1 | 350 ± 0 |
| Solanum crotonifolium (COL 560253) | Umpalá (Santander) | 16 ± 0 | 72 ± 4 | 11 ± 0 | 360 ± 0 |
| Lippia origanoides (COL) 560259) | Los Santos (Santander) | 62 ± 0 | 100 ± 0 | 299 ± 3 | 350 ± 0 |
HNC: Herbario Nacional de Colombia. * Valores de concentración mínima inhibitoria (CIG) del efecto genotóxico inducida por UVB previamente obtenida por Fuentes, et al. (2017). † La eficacia fotoprotectora (FPSin vtro y λc) se calculó según lo indicado en García-Forero, et al (2019). Diferentes categorías establecidas por la Food and Drugs Administration (FDA) de los Estados Unidos y por la European Cosmetic, Toiletry and Perfumery Association (COLIPA) para el índice FPSin vtro: protección baja (6,0 ≤ FPSin v¡t¡o < 14,9), protección media (15,0 ≤ FPSin v¡t¡o ≤ 29,9), protección alta (30,0 ≤ FPSin v¡tro ≤ 59,9) y protección muy alta (FPSin v¡t¡o ≥ 60,0). Las pautas de la FDA y COLIPA indican que un Xc ≥ 370 nm define la protección de amplio espectro. En letra negrilla se resaltan los datos o valores promisorios.
De las 11 especies que mostraron efecto antigenotóxico frente a los rayos UVB, siete (7) tuvieron una eficacia foto-protectora UVB consistentemente alta (FPS. in vitro ≥ 60,0). Esto sugiere que el 64 % de los compuestos mayoritarios de estos extractos funcionan como filtros solares que absorben o refractan la radiación ultravioleta. El extracto obtenido de la especie Salvia aratocensis registró un valor de Xc de 370 nm, lo que indica que la mezcla de compuestos de este extracto permite una fotoprotección de amplio espectro. El modo de acción (filtros solares) de los compuestos mayoritarios de estos extractos es similar al que exhiben los "desmutágenos" (Kada & Shimoi, 1987), una categoría de compuestos que inactivan el mutágeno antes de que este dañe el ADN. Por otra parte, algunas especies de plantas (Bacharis nitida, Hyptis suaveolens, Psidium sartorianum y Solanum crotonifolium) mostraron una elevada actividad antigenotóxica frente a los rayos UVB, pero su eficacia fotoprotectora frente a los UVB fue limitada (Tabla 2). Esto sugiere que los compuestos mayoritarios de estos extractos reducen el nivel de daño genético de manera similar a los "bioantimutágenos" clásicos (Kada & Shimoi, 1987), estimulando o facilitando la reparación de los fotoproductos de la irradiación.
En diferentes estudios se ha evidenciado que las plantas contienen compuestos que reducen el daño genético inducido por la radiación ultravioleta, ya sea evitando su formación o estimulando su eliminación. Por ejemplo, se ha señalado que los aceites esenciales de Calophyllum inophyllum (Said, et al., 2007) y de Bauhinia microstachya (Reis-Mansur, et al., 2016), así como los extractos de Jatropha curcas (Sundari, et al., 2013), Sechium edule (Metral, et al., 2018) y de las plantas antárticas Colobanthus quitensis, Deschampsia antárctica y Polytrichum juniperinum (Pereira, et al., 2009), reducen el estrés oxidativo producido por la radiación ultravioleta evitando los daños en el ADN. Asimismo, una fracción flavonoide de Araucaria angustifolia (Yamaguchi, et al., 2009) y una de antocianina de Fragaria ananassa (Giampieri, et al., 2012) evitan la formación de los CPD producida por la radiación ultravioleta. Por otra parte, se encontró que la fracción de antocianina de Vitis vinifera (Vaid, et al., 2010) y la fracción polifenólica de Phyllanthus orbicularis (Vernhes, et al., 2013) promueven la remoción de los CPD producida por la radiación ultravioleta al modular la NER en humanos.
En la Tabla 3 se presentan los resultados obtenidos al estudiar las formas puras de los compuestos mayoritarios de extractos promisorios previamente identificados por Stashenko, et al. (2013).
Tabla 3 Constituyentes de aceites esenciales y extractos promisorios con propiedades fotoprotectoras contra el daño genético producido por la radiación UV. Se presentan los correspondientes valores de la concentración mínima que produce inhibición significativa (p<0,05) del efecto genotóxico (CIG) y la actividad antioxidante medida mediante el método ORAC (Huang, et al., 2002). Se presentan los valores de absortividad molar (e) y los índices in vitro de fotoprotección SPFin vtt¡o y Xc de cada compuesto.
| Compuestos | CIG | Valor ORAC | ɛ295/315nm (Lmol-1cm-1) | FPSin vitro | λc |
|---|---|---|---|---|---|
| (μM) | (μmol Trolox®/g sustancia) | ||||
| Apigenina | 7 ± 0 | 24500 ± 615 | 2270 ± 13 / 2430 ± 13 | 38,3 ± 24.3 | 370,0 ± 0,0 |
| Carvacrol | 25414 ± 0 | 3410 ± 50 | 17 ± 0 / 1 ± 0 | 1,0 ± 0,0 | 280,0 ± 0,0 |
| β-xariofileno | 1911 ± 0 | 2800 ± 109 | 127 ± 0 / 121 ± 0 | 17,0 ± 0,2 | 380,0 ± 0,0 |
| Curcumina | 33 ± 0 | 4350 ± 77 | 19644 ± 11 / 18659 ± 12 | 5,9 ± 0,1 | 390,0 ± 0,0 |
| p-cimeno | 104151 ± 0 | 219 ± 2 | 1 ± 0 / 1 ± 0 | 0,2 ± 0,0 | 320,0 ± 0,0 |
| GEGC | 108 ± 0 | 13200 ± 531 | 6825 ± 3.15 / 1913 ± 2 | 5,0 ± 0,0 | 300,0 ± 0,0 |
| Naringenina | 38 ± 0 | 27600 ± 429 | 2764 ± 1 / 1473 ± 3 | 0,3 ± 0,0 | 320,0 ± 0,0 |
| Pinocembrina | 15 ± 0 | 20500 ± 128 | 13475 ± 11 / 5447 ± 4 | 14,8 ± 0,1 | 310,0 ± 0,0 |
| Quercetina | 26 ± 0 | 34000 ± 1531 | 2739 ± 8 / 2583 ± 8 | 2,4 ± 0,0 | 380,0 ± 0,0 |
| Timol | 8373 ± 0 | 2900 ± 103 | 32 ± 1 / 2 ± 0 | 1,0 ± 0,0 | 280,0 ± 0,0 |
NI: sin inhibición. NE: No evaluado. Diferentes categorías establecidas por la Food and Drugs Adminitration (FDA) de los Estados Unidos y por la European Cosmetic, Toiletry and Perfumery Association (COLIPA) para el índice FPSin ntro: protección baja (6,0≤FPSin vit≤14,9), protección media (15,0≤FPSin vitro 29,9), protección alta (30,0≤FPSin vtro ≤59,9) y protección muy alta (FPSin vitro≥60,0). Las pautas de la FDA y COLIPA indican que un Xc ≥ 370 nm define la protección de amplio espectro. En letra negrilla se resaltan los datos o valores promisorios.
La estimación del efecto antigenotóxico (CIG) de estos compuestos indica que los diferentes flavonoides estudiados, la curcumina y el GEGC fueron más activos que los compuestos terpenos, con valores de CIG más bajos (apigenina > pinocembrina > quercetina > curcumina > naringenina > GEGC > P-cariofileno > > timol > carvacrol > p-cimeno). Varios de los compuestos con elevado potencial antigenotóxico contra la radiación ultravioleta (por ejemplo, apigenina, GEGC, naringenina, pinocembrina y quercetina) presentan, además, una elevada actividad antioxidante según el método ORAC (Tabla 3). Sin embargo, un análisis de correlación indicó que la actividad antigenotóxica de todos estos compuestos se correlacionaba negativamente con su actividad antioxidante (R=- 0,55 y p<0,009 en una prueba de correlación productomomento), lo que sugiere que existen modos de acción diferentes para estos dos tipos de bioactividad (Fuentes, et al., 2017).
En la Tabla 3, se presentan, además, los datos de absortividad molar (ε) de los compuestos estudiados en longitudes de ondas relevantes en términos de fotoprotección: λ = 295 nm (Figura S2) y λ = 315 nm (Ikehata, et al., 2013b). Los valores de ε de cada compuesto fueron como sigue: curcumina > pinocembrina > GEGC > quercetina > naringenina > apigenina > β-cariofileno > timol > carvacrol > p-cimeno. En correspondencia con sus espectros de absorbancia (Figura S3, https://www.raccefyn.co/index.php/raccefyn/article/view/841/2550), la curcumina, la quercetina y la apigenina presentaron valores de e muy similares a λ = 295 nm y λ = 315 nm. Por el contrario, la pinocembrina, la GEGC y la naringenina registraron valores de ε superiores a λ = 295 nm que a λ = 315 nm. Los valores de ε calculados coincidieron con los reportados previamente para algunos de estos compuestos (Stevanato, et al., 2014).
Con base en los valores del índice FPS. in vitro , la eficacia fotoprotectora frente a los rayos UVB de los compuestos fue la siguiente: apigenina (alta) > β-cariofileno (medio) > pinocembrina (bajo). Por su parte, el índice λc indicó que la apigenina, el β-cariofileno, la curcumina y la quercetina son fotoprotectores de amplio espectro (λc>370 nm). El hecho de que estos compuestos con actividad antigenotóxica frente a los rayos UVB actúen como filtros solares respalda la hipótesis de que el efecto antigenotóxico de algunos de estos compuestos, detectado con el SOS Chromotest, está vinculado a su capacidad de absorción de radiación ultravioleta, lo que resulta en la inhibición de la formación de los CPD y, por ende, en la no inducción de la respuesta SOS (Figura 1). Esta hipótesis se vio respaldada, además, por el hecho de que la cepa microbiana usada en el SOS Chromotest (E. coli PQ37) es altamente sensible a la radiación ultravioleta (Prada-Medina, et al., 2016), dado que carece de la NER (uvrA) y porque esta no restaura la división celular después del tratamiento con radiación ultravioleta (Estévez-Castro, et al., 2018).
La hipótesis de que los componentes mayoritarios del tipo flavonoide actúan inhibiendo la formación de foto-productos se confirmó en un estudio in vitro usando el ensayo del cometa en células humanas (García-Forero, et al., 2019). En este estudio se usó una variante enzimática del ensayo del cometa que permitió la detección de los CPD en células tratadas con radiación ultravioleta y facilitó el estudio del efecto antigenotóxico de algunos compuestos flavonoides. En el estudio se determinó que los flavonoi-des apigenina, naringenina y pinocembrina, especialmente el primero y el último, reducían la formación de los CPD en células humanas tal como lo hicieron en bacterias. Este hallazgo, conjuntamente con los datos de la eficacia fotoprotectora, indica que actúan como filtros UV como se ha establecido en estudios previos (Saewan & Jimtaisong, 2013; Stevanato, et al., 2014). Con base en estos resulta dos, se puede concluir que la pinocembrina podría ser útil en la fotoprotección contra la radiación UVB, mientras que la apigenina podría considerarse un fotoprotector de amplio espectro.
Aunque el hallazgo en torno a la presencia de los compuestos flavonoides apigenina y pinocembrina en plantas colombianas y su actividad fotoprotectora no constituyen un nuevo descubrimiento para la ciencia, nuestros estudios aportan información sobre el potencial de la flora colombiana como una fuente de estos compuestos (Stashenko, et al., 2013; Stashenko & Martínez, 2018), en especial para el desarrollo de bloqueadores solares. Nuestros resultados sobre la prospección del potencial de fotoprotección de la flora colombiana son comparables con los obtenidos en Brasil (Velasco, et al., 2008; Nunes, et al., 2018), en India (Korac & Khambholja, 2011) y en Polonia (Jarzycka, et al., 2013).
Como se deduce de la Figura S1, los compuestos foto-protectores pueden modular diferentes funciones celulares mediante múltiples mecanismos de acción. Un patrón similar se evidenció en los extractos de algunas especies de plantas que resultaron promisorias en nuestro estudio. El mejor ejemplo, fue la especie Lippia origanoides, la cual tiene actividad antioxidante (Stashenko, et al., 2008), antiviral (Meneses, et al., 2009), antibacteriana (Bueno-Sánchez, et al., 2009), antiprotozoaria (Escobar, et al., 2010) , antigenotóxica (Vicuña, et al., 2010; López, et al., 2011) , fotoprotectora (Fuentes, et al., 2017; Quintero-Ruiz, et al., 2017) y antitumoral (Raman, et al., 2017, 2018). En un trabajo reciente (García-Bores, et al., 2017) se demostró que Lippia graveolens, una especie mexicana sinónimo de L. origanoides (Santamaría-Acevedo, et al., 2018) con alto contenido de pinocembrina, inhibió el desarrollo de tumores en ratón inducido por la radiación UVB. En su conjunto, estos estudios respaldan el uso de este quimiotipo de la especie L. origanoides en quimioprevención de la fotocarcinogénesis.
Futuros desarrollos
En resumen, los datos descritos aquí indican que varias plantas en Colombia contienen compuestos con potencial para el desarrollo de bloqueadores solares. Estos compuestos pueden presentar una variedad de efectos al actuar como filtros solares y poseer propiedades antioxidantes, antigenotóxicas, fotoprotectoras y antitumorales, las cuales son útiles en la fotoprotección. Sin embargo, antes de poder usarlas en la preparación de bloqueadores solares será necesario atender los siguientes temas.
Primero, se conoce poco sobre su toxicidad y efecto genotóxico. Por lo tanto, se deben desarrollar estudios de toxicidad crónica y subcrónica, de mutagenicidad, de irritabilidad usando diferentes ensayos efectivos para tales fines (Pfuhler, et al., 2014) y siguiendo los estándares internacionales para esta clase de productos (Eastmond, et al., 2009). Ya se ha probado la utilidad del ensayo SOS Chromotest desarrollado en formato de microplacas de 96 pozos para la evaluación de plantas medicinales (Sánchez-Lamar, et al., 2002, 2008; Fuentes, et al., 2006ab) y moléculas puras (Díaz-Durán, et al., 2015). Sin embargo, se requieren ensayos de evaluación genotóxica que midan el daño genético en diferentes niveles de expresión (por ejemplo, el del cometa, el de micronúcleo, las aberraciones cromosómicas). En este sentido, ya nuestro grupo de investigación probó la utilidad del ensayo del cometa para la evaluación genotóxica de biopesticidas (Valencia, et al., 2011; Meza-Joya, et al., 2013, 2017), pero será necesario desarrollar nuevas plataformas con este ensayo que permitan una mejor capacidad de escrutinio (Sykora, et al., 2018) y sean de utilidad en el marco de proyectos de bioprospección.
Segundo, algunos de los compuestos caracterizados en este estudio como promisorios en fotoprotección (por ejemplo, apigenina, trans-β-cariofileno, curcumina, pinocembrina y quercetina) son costosos en su forma pura. Por ello, el uso de fracciones vegetales enriquecidas con dichos compuestos puede ser una opción más factible y viable para el desarrollo de bloqueadores solares. Con ese propósito, se requerirá trabajar en la optimización de los métodos disponibles para la micropropagación de especies de plantas promisorias (Herrera-Moreno, et al., 2013; Naranjo-Gómez, et al., 2018), con el fin de asegurar una fuente permanente de materia prima para la producción de bloqueadores solares.
Tercero, con la excepción de la especie L. origanoides, se conoce muy poco sobre el modo de acción de las moléculas que componen los extractos de plantas promisorias en fotoprotección. En tal sentido, se requerirá profundizar en el estudio de la composición química de estas plantas y en el modo de acción de sus componentes químicos.














