Introducción
El metilmercurio (MeHg) es la forma orgánica más tóxica del mercurio y es la que más se acumula en el tejido de los peces (Kraepiel, et al., 2003). Se ha demostrado que el constante consumo de alimentos procedentes del mar pone en riesgo la salud de las personas, pues el MeHg perjudica principalmente el sistema nervioso central y también se comporta como una nefrotoxina e inmunotoxina (Bose-O'Reilly, et al., 2010).
Son diversas las actividades humanas que generan desechos con mercurio. La minería, la agricultura, la quema de combustibles fósiles, entre otros, son fuentes de emisión que se han sumado a las naturales y hacen que este metal sea hoy una amenaza para los seres humanos. En Colombia las fuentes contaminantes son muy variadas y hay un gran número de actividades como la minería en las que se manipula el mercurio de manera ilegal, perjudicando así los cuerpos de agua adyacentes y los recursos que estos proveen (Mancera & Álvarez, 2006). En los ecosistemas marinos el mercurio (Hg) se incorpora en compuestos inorgánicos y, posteriormente, es transformado en MeHg por la acción de diferentes microorganismos que constituyen el primer nivel de la cadena alimentaria mediante la cual el metal es transferido hasta llegar a especies que, como los tiburones del género Carcharhinus, ocupan los niveles superiores de las redes tróficas (Park, 2012).
El cazón antillano (Rhizoprionodon porosus) es un depredador común en los ecosistemas marinos de la costa Caribe colombiana y su pesca es una actividad frecuente en varios sectores de la región. Al tratarse de una especie exclusivamente carnívora que se alimenta de pequeños peces e invertebrados y que ocupa el nivel trófico 4.0 en los ecosistemas del Caribe (Froese & Pauly, 2019), el cazón antillano es un tiburón que acumularía y magnificaría el MeHg con facilidad, lo que implica un riesgo para la salud debido a la falta de información y de estudios que faciliten el control y determinen las características de los animales aptos para el consumo.
Teniendo en cuenta los hábitos de vida del tiburón cazón antillano, y con el fin de conocer más a fondo el estado de contaminación por MeHg del ecosistema en que este se desenvuelve, resulta de gran utilidad conocer su papel en el flujo del MeHg a través de las redes tróficas, así como determinar la concentración de MeHg en el tejido de estos animales, realizar comparaciones espacio-temporales de los valores y conocer la forma en que este metal es acumulado, lo que permitiría utilizar la especie como un buen modelo centinela. Además, este constituye un primer paso necesario para proponer medidas preventivas en las comunidades expuestas y las poblaciones mayormente asociadas con las fuentes de contaminación, con base en los criterios establecidos internacionalmente con respecto a los límites de consumo de MeHg. En este estudio se abordan dichos objetivos a partir de material recolectado en tres localidades del Caribe continental colombiano.
Materiales y métodos
Sitios de estudio
Se establecieron tres sitios de muestreo a lo largo de la costa Caribe colombiana (Figura 1). El primero fue Isla Fuerte, una isla pequeña, con poco menos de mil habitantes y un área de 3,25 km2 en el departamento de Bolívar, ubicada a 30 km de la desembocadura del río Sinú y a 150 km del río Atrato. La isla se caracteriza por su temperatura promedio de 27 a 28 °C y por albergar diferentes tipos de ecosistemas marinos (Ladino, 2014). Para la obtención de las muestras se monitorearon los arribos diarios a puerto de más de 30 lanchas de pesca de cordel con recorridos diurnos de 15 km de distancia desde la costa.
Aproximadamente 150 km más al norte, adyacente a Barranquilla (Atlántico), uno de los mayores centros urbanos e industriales de Colombia, se encuentra la desembocadura del principal cuerpo fluvial de Colombia, el río Magdalena; allí se ubica la comunidad pesquera de Las Flores, que representa el segundo punto de estudio establecido en este trabajo. Tratándose de la desembocadura de un río cuyo cauce se extiende a lo largo de 12 departamentos, el resultado de la pesca con palangre o líneas de anzuelos en Bocas de Ceniza, la cual se desembarca en Las Flores, fue de suma importancia para esta investigación. Allí la temperatura del agua tiene un promedio anual de 28,2 °C (Caiafa, et al., 2011). El Magdalena bajo, como se denomina este sector del río, presenta los menores caudales durante el período comprendido entre enero y marzo, los mayores de octubre a diciembre y caudales promedio de 7.200 m3 s-1 el resto del año, y arrastra 144 toneladas de sedimentos limosos y arcillosos al año (Restrepo, et al., 2016).
El tercer punto de muestreo fue Cabo de la Vela en La Guajira. El aislamiento social y la lejanía con respecto a los centros urbanos hacen de ésta una localidad bastante particular. La población más cercana es Uribia, ubicada a 60 km de distancia, mientras que el río Ranchería, aproximadamente a 100 km hacia el suroeste, constituye la principal descarga fluvial de la región. A pesar de las temperaturas ambientales altas que se registran, la temperatura promedio del agua es baja (<24 °C) como consecuencia de la surgencia (Páramo, et al., 2011). Las faenas de pesca se realizaron durante la noche a no más de 18 km de la costa y los palangres se ubicaron en diferentes puntos de la costa del Cabo, el parque eólico Jepírachi y Puerto Bolívar.
Obtención de muestras
Se hicieron tres visitas a cada uno de los sitios de estudio en tres épocas diferentes del año. La primera se llevó a cabo en noviembre de 2015 (época de lluvias), la segunda en abril de 2016 (época de sequía) y la última en agosto del mismo año (transición). Se extrajo una porción de aproximadamente 100 g del tejido muscular ubicado frente al origen de la aleta dorsal de los ejemplares y la totalidad del contenido estomacal. En cada período se recolectaron diez muestras por sitio de estudio, cinco correspondientes al tejido y cinco al contenido estomacal. Se muestrearon en total 45 individuos y los respectivos contenidos estomacales.
Tratamiento de las muestras
Una vez los animales se encontraban en puerto, se registraron el peso, la talla y el sexo de cada individuo. Utilizando un cuchillo cerámico se extrajo una porción de 100 g de tejido muscular de cada ejemplar y las muestras se almacenaron individualmente en un cuarto frío a -20 °C. El resultado de la disección del contenido estomacal de cada individuo se depositó en bolsas herméticas y separadas para su almacenamiento a -20 °C. Posteriormente, las muestras fueron transportadas en neveras de poliestireno con hielo al laboratorio; allí se secaron por liofilización para poder cuantificar el MeHg. Los procedimientos de preparación de las muestras y la determinación de MeHg se llevaron a cabo en el Laboratorio de Toxicología y Gestión Ambiental de la Universidad de Córdoba (Montería, Colombia).
Determinación de MeHg
Una vez liofilizadas, las muestras se maceraron en un mortero de porcelana. El contenido estomacal de cada individuo también fue secado por liofilización y posteriormente macerado y homogenizado. Para preparar cada muestra fue necesario realizar una extracción líquido-líquido empleando bromuro de hidrógeno (HBr), tolueno y L-cisteína. La cuantificación de las concentraciones de MeHg se hizo en un analizador directo de mercurio Milestone, modelo DMA 80 siguiendo las recomendaciones del método 7473 de la United States Environmental Protection Agency (EPA) y validado para determinación de mercurio total y MeHg. El principio fundamental de esta técnica es la descomposición térmica, la amalgamación y la espectroscopia de absorción atómica.
La exactitud de la determinación se evaluó como porcentaje de recuperación (%R), el cual se halló añadiendo a las muestras de los peces solución estándar en las concentraciones conocidas. Se manejó un %R entre 93,91 y 95,62 %. La precisión evaluada como repetitividad y reproducibilidad (coeficiente de variación, C.V.) de las muestras analizadas fluctuó en un rango de 1,94 a 3,68 y 1,92 a 4,07 %, respectivamente.
Análisis estadísticos
Todas las pruebas estadísticas se hicieron utilizando los programas R Project for Statistical Computing y SPSS Statistics. Las pruebas de Shapiro-Wilk, Barlett y Levene demostraron que los datos no eran normales ni de varianzas homogéneas, por lo que se procedió a realizar un análisis no paramétrico. Se empleó la prueba de Kruskal-Wallis para probar si existían diferencias en las concentraciones de MeHg y los factores de biomagnificación entre las épocas de muestreo y los diferentes sitios de estudio. La relación entre las variables se evaluó mediante la correlación no paramétrica de Spearman (p=0,05).
Resultados
Se analizaron 45 individuos, 31 hembras y 14 machos. En la figura 2 se presentan las concentraciones de MeHg en el tejido de los tiburones expresadas en peso húmedo (µg MeHg/kg(p.h.)) en las diferentes localidades y épocas de muestreo. Los contenidos de MeHg presentaron diferencias significativas (p=0,05) entre las estaciones de muestreo (Tabla 1), con los mayores contenidos en las estaciones de Las Flores e Isla Fuerte y los menores en el sector del Cabo de la Vela (Figura 2).
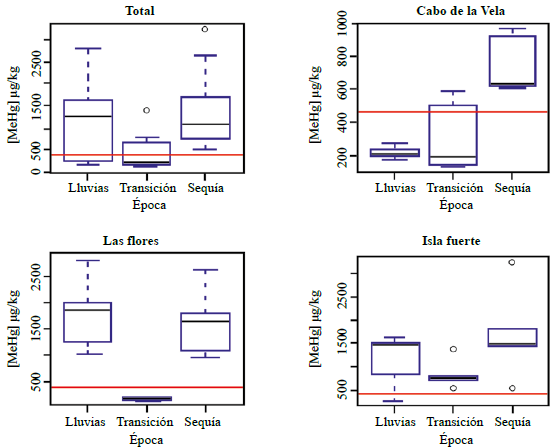
Figura 2 Contenido de MeHg en ug/kg (p.h.) en Rhizoprionodon porosus según la época en cada uno de los sitios de estudio. Debido a los valores obtenidos, el eje Y del gráfico perteneciente al Cabo de la Vela presenta una escala diferente a las demás. Línea roja indica la concentración máxima recomendada por la OMS (2000) para el consumo de alimentos.
Tabla 1 Valores promedio, medianas y significación asintótica de los contenidos de MeHg en µg /kg (p.h.) en Rhizoprionodon porosus según la prueba de Kruskal-Wallis
| Lluvias | Transición | Sequía | Significación | ||||
|---|---|---|---|---|---|---|---|
| Media | Mediana | Media | Mediana | Media | Mediana | ||
| Cabo de La Vela | 217,1 | 202,14 | 309,3 | 189,9 | 747,4 | 630,9 | 0,009 |
| Las Flores | 1809,9 | 1888,90 | 162,6 | 150,9 | 1637,0 | 1654,4 | 0,006 |
| Isla Fuerte | 1115,8 | 1483,10 | 848,2 | 782,1 | 1714,2 | 1516,3 | 0,215 |
| Caribe colombiano | 1111,5 | 1272,50 | 440,0 | 199,0 | 1366,2 | 1102,5 | 0,001 |
Con respecto a los períodos de muestreo, se observó que los valores máximos se presentaron en la época lluviosa en Las Flores y en la época seca en Isla Fuerte y en el Cabo de la Vela. Los valores más bajos en las concentraciones de MeHg en los tejidos de tiburón se presentaron, en general, durante el período de transición (julio a agosto).
Los niveles máximos admitidos por la Organización Mundial de la Salud (OMS, 2000) en alimentos son de 0,5 µg MeHg/g y un consumo máximo semanal de 1,6 µg de MeHg por cada kg de peso corporal (Poulin & Gibb, 2008). Para el análisis de riesgo del consumidor, en el presente estudio se estableció un supuesto según el cual una persona con un peso promedio de 70 kg consume aproximadamente 1.000 g de este tipo de tejido mensualmente. Con base en dicho supuesto, se estableció que los valores promedio de hembras y machos excedían los valores establecidos como seguros por la OMS (2000), es decir, un consumo mensual de 448 µg de MeHg para una persona con ese peso corporal.
Según el análisis de Kruskal-Wallis, en Las Flores y el Cabo de la Vela se presentaron las mayores variaciones entre las diferentes épocas (Tabla 2). Por su parte, en Isla Fuerte no se evidenció ninguna diferencia que pudiera atribuirse a la época en la que fueron capturados los animales. A pesar de que los valores máximos en el Cabo de la Vela fueron los más bajos, en la época de sequía se elevó allí el contenido de una manera drástica, superando los valores límites recomendados por la OMS (2000). En Las Flores se presentó el cambio más drástico en el período de transición, durante el cual ninguna muestra sobrepasó los niveles permisibles y la disminución en las concentraciones promedio llegó a ser más de diez veces en comparación con el resto del año, tal como lo evidenció el resultado del análisis de Kruskal-Wallis (Tabla 2). En Isla Fuerte, como lo indican los valores de significación, a pesar de apreciarse una disminución en la época de transición, no se presentaron diferencias significativas (p=0,05) y el MeHg excedió notablemente los niveles establecidos como seguros por la OMS (2000) durante todo el año, y en todas las muestras se registraron concentraciones altamente tóxicas (Figura 2).
Tabla 2 Valores promedio, medianas y valores de significación asintótica de los contenidos de MeHg en µg /kg(p.h.) en el contenido estomacal de Rhizoprionodon porosus según la prueba de Kruskal-Wallis
| Lluvias | Transición | Sequía | Significación | ||||
|---|---|---|---|---|---|---|---|
| Media | Mediana | Media | Mediana | Media | Mediana | ||
| Cabo de La Vela | 95,3 | 106,84 | 107,2 | 106,18 | 229,0 | 59,12 | 0,733 |
| Las Flores | 163,1 | 154,7 | 58,9 | 56,84 | 408,6 | 284,9 | 0,031 |
| Isla Fuerte | 96,9 | 92,8 | 130,6 | 127,1 | 86,8 | 93,7 | 0,640 |
| Caribe colombiano | 118,7 | 105,7 | 98,9 | 96,1 | 241,8 | 97,9 | 0,651 |
En la figura 3 se muestran las concentraciones de MeHg medidas en los contenidos estomacales, las cuales fueron, en general, bajas, a diferencia de los contenidos en el músculo. El máximo contenido se encontró en las muestras de Las Flores durante la época seca, en tanto que los valores más bajos se presentaron en Isla Fuerte; en el Cabo de la Vela el contenido fue semejante al hallado en el músculo. Solo en el segundo muestreo en Las Flores las concentraciones excedieron los valores de la OMS (2000) de 1,6 ug de MeHg por cada kg de peso. Según el análisis de Kruskal-Wallis (Tabla 2), solo en Las Flores se presentaron diferencias significativas (p=0,05) entre las épocas de muestreo y las concentraciones de los contenidos estomacales.
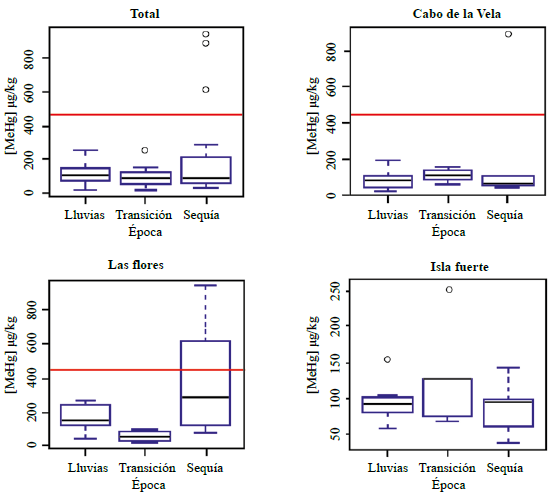
Figura 3 Contenido de MeHg en µg/kg(p.h.) contenido estomacal de Rhizoprionodon porosus según la época en cada uno de los sitios de estudio.
Factor de biomagnificación
A partir de las concentraciones de MeHg en el tejido y los contenidos estomacales de los tiburones, se determinó el factor de biomagnificación para cada uno de los sitios de muestreo (Figura 4). En cuanto al total de los datos del Caribe colombiano, la prueba de Kruskal-Wallis arrojó diferencias significativas (p=0,05) entre los valores de este factor en las diferentes épocas. Sin embargo, al hacer el análisis con los datos de cada sitio por separado, el único lugar en que hubo diferencias significativas entre las épocas fue la estación de Las Flores. En el Cabo de la Vela e Isla Fuerte la variación temporal no fue significativa, aunque al analizar los valores promedio de cada sitio en sus respectivas temporadas, estos coincidieron en cuanto al notable aumento durante la época seca (Tabla 3).
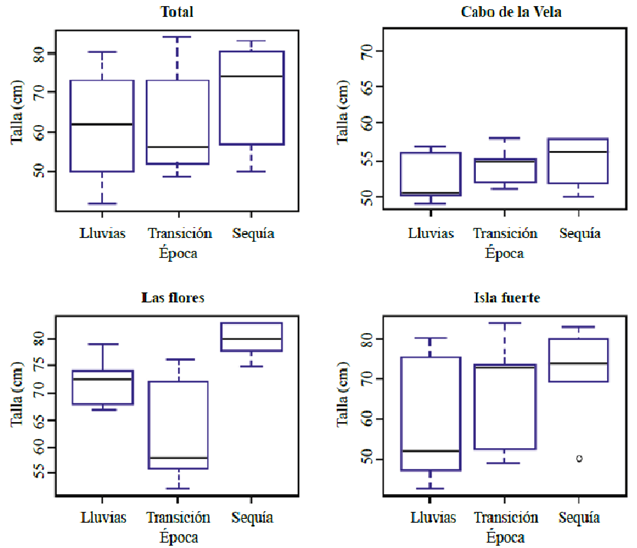
Figura 4 Factor de biomagnificación en Rhizoprionodon porosus según la época en cada uno de los sitios de estudio.
Tabla 3 Promedios, medianas y valores de significación asintótica de los factores de biomagnificación según la prueba de Kruskal-Wallis
| Lluvias | Transición | Sequía | Significación | ||||
|---|---|---|---|---|---|---|---|
| Media | Mediana | Media | Mediana | Media | Mediana | ||
| Cabo de La Vela | 3,43 | 2,12 | 6,37 | 6,01 | 10,00 | 10,67 | 0,379 |
| Las Flores | 53,04 | 66,35 | 3,48 | 2,70 | 11,10 | 11,70 | 0,006 |
| Isla Fuerte | 12,90 | 15,40 | 8,22 | 10,01 | 29,80 | 29,70 | 0,124 |
| Caribe colombiano | 23,40 | 11,45 | 6,02 | 6,01 | 17,00 | 13,51 | 0,045 |
Talla de los tiburones
Al comparar los tamaños de los tiburones capturados en los tres sitios, se obtuvo un valor de significación asintótica de 0,003, lo cual indica que se registraron diferencias notorias entre las tallas de los especímenes en las tres localidades (Tabla 4). Al analizar las muestras por separado, se evidenció que estas diferencias se debían a las tallas de las capturas en La Guajira, puesto que entre Las Flores e Isla Fuerte los tamaños promedio no presentaron grandes diferencias. Asimismo, y a pesar de que solo en Las Flores se presentó una variación significativa, en los tres sitios las capturas de mayor tamaño se registraron en el periodo de sequía. Los tamaños de los tiburones capturados en el Cabo de la Vela fueron los menores durante todo el año (Figura 5).
Tabla 4 Promedios, medianas y valores de significación asintótica de las tallas de Rhizoprionodon porosus según la prueba de Kruskal-Wallis
| Lluvias | Transición | Sequía | Significación | ||||
|---|---|---|---|---|---|---|---|
| Media | Mediana | Media | Mediana | Media | Mediana | ||
| Cabo de La Vela | 52,00 | 50,10 | 54,20 | 55,00 | 57,60 | 56,00 | 0,388 |
| Las Flores | 72,16 | 72,15 | 62,80 | 58,00 | 79,80 | 80,00 | 0,013 |
| Isla Fuerte | 59,70 | 52,10 | 66,40 | 73,00 | 71,20 | 74,00 | 0,414 |
| Caribe colombiano | 61,80 | 62,00 | 61,13 | 56,00 | 69,50 | 74,00 | 0,003 |
Los resultados demostraron un marcado incremento en las concentraciones de MeHg en los tiburones del Cabo de la Vela en la época de sequía, llegando a superar en más del 70 % los niveles establecidos como seguros por la OMS (2000). Es posible que esta diferencia entre la época de sequía y el resto del año esté ligada al fenómeno de surgencia que se da anualmente en esta región entre diciembre y marzo. Teniendo en cuenta que la mayor tasa de metilación del mercurio se da en áreas profundas (Roldán, et al, 2014), durante el período de surgencia grandes cantidades de MeHg pueden ser arrastradas a lo largo de la columna de agua y entrar a ser parte de las redes tróficas costeras y superficiales de forma acelerada.
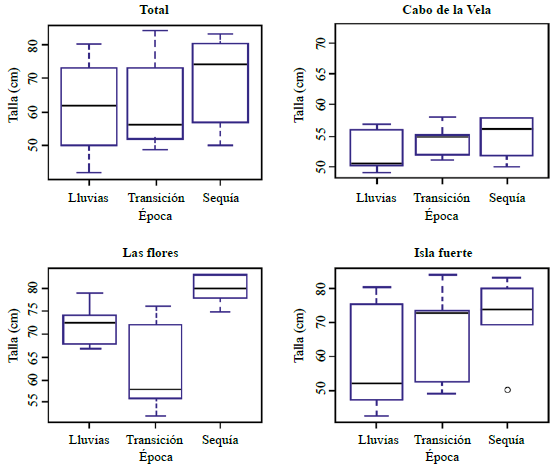
Figura 5 Talla (longitud) de los individuos de Rhizoprionodon porosus capturados según la época en cada uno de los sitios de estudio.
Línea roja indicando la concentración máxima recomendada por la OMS (2000). Nota: en Isla Fuerte todos los valores se encuentran por debajo de los límites establecidos por la OMS (2000), por ende, la escala del eje Y varía en sus valores.
Correlación de Spearman
Utilizando un intervalo de confianza de 99 %, en la prueba de Spearman se evidenció una correlación positiva en todos los sitios de estudio entre las concentraciones de MeHg en el tejido de R. porosus y la talla, el peso y el factor de biomagnificación (Tabla 5).
Tabla 5 Resultados de la correlación de Spearman (Rho).
| Talla | Tiburón | Peso | Presa | FB | |
|---|---|---|---|---|---|
| Talla | 1,000 | 0,437** | 0,916** | 0,268 | 0,225 |
| Tiburón | 0,437** | 1,000 | 0,615** | 0,272 | 0,632** |
| Peso | 0,916** | 0,615** | 1,000 | 0,292* | 0,359* |
| Presa | 0,268 | 0,272 | 0,292* | 1,000 | -0,171 |
| FB | 0,225 | 0,632** | 0,359* | -0,171 | 1,000 |
Tiburón: [MeHg[MeHg] en Rhizoprionodon porosus. Presa: en contenido estomacal. FB: factor de biomagnificación. n=45.
* La correlación es significativa en el nivel 0,05 (bilateral)
* * La correlación es significativa en el nivel 0,01 (bilateral)
Discusión
Los tres puntos estudiados en el Caribe colombiano presentaron una relación positiva entre la talla de los individuos de R. porosus y las concentraciones de MeHg en sus tejidos, lo cual evidencia el papel que éste cumple como bioacumulador en dichos ecosistemas. Sin embargo, los resultados de esta investigación presentan diferencias notables en el comportamiento de otras variables, como el factor de biomagnificación y las concentraciones de MeHg en los contenidos estomacales, por lo cual es pertinente un análisis por cada sitio de muestreo.
Cabo de la Vela
El Cabo de la Vela fue el sitio con menos problemas de contaminación por MeHg en el tejido de R. porosus. Probablemente por ser una zona desértica, alejada de la civilización, este no es un resultado inesperado. Sin embargo, un promedio anual de 424,3 µg MeHg/ g(p.h.) en el tejido de esta especie no es un valor deleznable, pues dicha concentración se encuentra en el límite de los valores establecidos como aptos para el consumo humano por la OMS (2000). Además, es importante enfatizar que en el Cabo de la Vela los tiburones capturados presentaron los menores pesos y tallas, por debajo de 60 cm, a excepción de un ejemplar. En R. porosus esas tallas corporales corresponden a una edad que no sobrepasa los tres años de vida (Lessa, et al., 2009), lo cual puede favorecer una menor concentración de MeHg en comparación con las otras dos localidades de estudio. Asimismo, el tipo, la cantidad y el tamaño de las presas que puede consumir un tiburón pequeño del género Rhizoprionodon son limitados, en tanto que los tiburones más grandes y longevos pueden alimentarse de peces robustos e, incluso, de algunos depredadores de los niveles superiores (Tagliafico, et al, 2015).
Además, este afloramiento anual viene acompañado no solo del ascenso del producto de la metilación del metal sino también de cianobacterias y fitoplancton que, al permanecer en aguas superficiales, llevan a cabo la inclusión del mercurio orgánico directamente a las redes tróficas pelágicas y mesopelágicas (Heimbürguer, et al., 2010). Asimismo, existe una concordancia entre el patrón de distribución del MeHg de los tiburones y sus contenidos estomacales a lo largo del año, pues en estos últimos los valores de mayor concentración también se presentaron durante la sequía (época de máxima surgencia).
El factor de biomagnificación promedio para el Cabo de la Vela fue de 6,7. Galván (2007) registró un valor de 4,4 para este factor en peces (Symbolophorus evermanni) y tiburones (Isurus oxyrinchus) en el sur de Baja California. Teniendo en cuenta que el estudio en California incluyó peces de aproximadamente 8 cm y tiburones que llegaban a medir hasta 4,5 m, se puede pensar que el factor de biomagnificación de 6,7 registrado en tiburones de 60 a 70 cm en el Cabo de la Vela sería crítico.
Es difícil establecer las probables fuentes de contaminación por MeHg en La Guajira debido a su locación desértica, alejada de centros urbanos y de actividad portuaria (Puerto Bolívar, un puerto para la exportación minera de carbón, se halla a cerca de 100 km de distancia) e industrial. Por otro lado, uno de los principales ríos de La Guajira, el Ranchería, se nutre de la descarga de diferentes arroyos, algunos directamente relacionados con la minería de carbón, lo que, a pesar de su lejanía del Cabo de la Vela, puede incidir en los valores hallados. En este sentido vale la pena señalar que en algunos de estos arroyos se ha encontrado carbón con trazas considerables de mercurio (Morales & Carmona, 2007). El flujo constante de embarcaciones de gran calado, los desechos de la quema de combustibles fósiles por parte de las locomotoras de transporte carbonero, el aporte directo de más de 100 lanchas de pesca artesanal y la descarga de algunos ríos, parecen ser los principales factores asociados con los niveles de MeHg detectados en R. porosus en el Cabo de la Vela.
Las Flores
En la localidad de Las Flores los individuos de R. porosus presentaron una talla promedio de 71 cm, lo que corresponde a individuos de aproximadamente cuatro años de edad (Lessa, et al., 2009). Allí la concentración promedio de MeHg en el músculo superó los 448 µg/Kg, lo que indica que el consumir raciones de 1.000 g de ese tejido se excedería el límite recomendado por la OMS. Sin embargo, se establecieron diferencias significativas entre la concentración de MeHg y el factor de biomagnificación y la época del año. Estas diferencias temporales pueden ser el resultado de diferentes factores asociados con esta localidad de estudio. Las Flores se encuentra influenciada por los ciclos de inundación del río Magdalena, cuyo caudal recibe los desechos provenientes de más de 12 departamentos de Colombia y que, además, recibe el aporte directo del río Cauca, fuente hídrica muy afectada por la explotación minera de oro (Olivero, et al., 2018) y que, según Cormagdalena (2016), tuvo un gran efecto sobre el caudal del río Magdalena a finales de 2015, momento en el que se realizaron los registros más altos de MeHg en el tejido del R. porosus en Las Flores.
Por otro lado, al incrementarse el caudal del río, aumenta la navegabilidad, siendo mayor el tamaño y la cantidad de botes que circulan en este sector del río, lo que provoca una mayor cantidad de residuos mercuriales (Ospina, 2008). Además, Las Flores se encuentra bajo la influencia directa de uno de los mayores centros urbanos e industriales de Colombia, la ciudad de Barranquilla, y es probable que durante la época de lluvia la cantidad de material orgánico que estaría arrastrando el río atrajera una mayor cantidad y diversidad de presas de R. porosus, razón por la cual se registró en esta localidad un factor de biomagnificación variable, con los registros más altos en la época de lluvia.
Isla Fuerte
En Isla Fuerte no se presentaron diferencias significativas entre las variables medidas en las diferentes épocas del año. No obstante, esa uniformidad probablemente está asociada con el estado crítico de la contaminación por MeHg registrado en el presente estudio. Todas las muestras de tejido de tiburón excedieron los límites postulados por la OMS (2000) para el consumo humano. Las mayores concentraciones de MeHg en R. porosus se determinaron en la época seca, seguidas por las muestras de las épocas lluviosa y de transición. De diciembre a abril en Isla Fuerte los vientos alisios provenientes del noreste generan un fuerte oleaje y la influencia de la pluma de sedimentos del río Sinú, en los que ya se han detectado niveles significativos de mercurio (Feria, et al., 2010), es más intensa que en el resto del año (Ladino, 2014).
Según Trudel & Rasmussen (2006), existe una relación directa entre la tasa y el costo metabólico y la concentración de mercurio en el tejido de los animales, como se ha demostrado utilizando modelos bioenergéticos en los cuales, al incrementarse la tasa metabólica en los peces, el mercurio se acumula de forma acelerada en sus tejidos. Asimismo, otros estudios han revelado que algunos tiburones de la familia Carcharhinidae del océano Atlántico presentan un aumento significativo en sus ritmos cardiacos durante el verano, lo que genera un costo energético más elevado (Dowd, et al., 2006).
Con base en lo expuesto, es posible plantear que las altas concentraciones de MeHg presentes en R. porosus en la época de sequía estarían directamente relacionadas con el incremento en la temperatura superficial del mar y su consecuente efecto metabólico. Sin embargo, hasta la fecha no hay registros bibliográficos que soporten esta hipótesis. Ahora bien, teniendo en cuenta la relación entre el gasto energético y la tasa de acumulación de MeHg ya mencionada, es innegable que el muestreo de verano en Isla Fuerte probablemente estuvo influenciado por este factor, pues las capturas en dicha época consistieron de cuatro hembras grávidas y un macho de talla considerable. El desarrollo de los embriones en una hembra tarda hasta 12 meses y es un periodo de tiempo en el que el gasto energético incrementa exponencialmente, haciéndolas más propensas a acumular MeHg en sus tejidos en relación con su peso.
Conclusiones
La región Caribe colombiana presenta sectores con alto grado de contaminación por metilmercurio y exhiben una clara variación espaciotemporal en las concentraciones de este metal. Los ejemplares usados como biomonitores en los tres sitios de estudio evidenciaron la tendencia del MeHg a bioacumularse y biomagnificarse en estas redes tróficas, lo cual podría resultar en un grave problema de salud pública para las distintas comunidades.