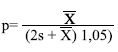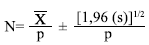Introducción
Colombia y Brasil son los países con mayor número de especies de crocodílidos en el mundo (King & Burke, 1989; Barahona, et al., 1996; Ross, 1998). De las aproximadamente 24 especies de este orden actualmente descritas, Colombia tiene seis, cuatro de los ocho géneros y dos de las tres familias (Grigg & Kirshner, 2015).
Debido a las bajas densidades poblacionales que presenta Crocodylus acutus Cuvier, 1807 (caimán aguja), y la reducción y fragmentación de sus poblaciones, está catalogada en el Libro Rojo de reptiles de Colombia como "en peligro" ("EN") (Morales-Betancourt, et al., 2015). La babilla, Caiman crocodilus fuscus (Cope, 1868), está clasificada como "en preocupación menor" (LC), aunque es la subespecie más empleada en el comercio de pieles (Morales-Betancourt, et al., 2013).
La información sobre la historia natural y las iniciativas de conservación de los crocodílidos colombianos después de los trabajos realizados hace más de 30 años (Medem, 1981, 1983) es escasa, se encuentra dispersa y, en ocasiones, es de difícil acceso (Morales-Betancourt, et al., 2013). Según Balaguera-Reina, et al. (2015), durante la última década C. acutus se ha muestreado debidamente solamente en el 37 % del territorio nacional y las evaluaciones de abundancia del caimán aguja se han hecho en los departamentos de La Guajira, Magdalena, Córdoba, Norte de Santander, Cesar, Boyacá y Santander. Por ello es importante retomar las investigaciones sobre los crocodílidos silvestres, con el fin de comprender su papel en los ecosistemas y adoptar las estrategias apropiadas para su protección (Balaguera-Reina, 2007). En este sentido, es indispensable y urgente determinar el estado poblacional de estas especies, así como diseñar y mantener un programa de monitoreo (Morales-Betancourt, et al., 2013).
El objetivo de este estudio fue evaluar el estado poblacional (distribución, estructura de tamaños y abundancia relativa) de C. acutus y de C. c. fuscus durante la temporada seca en los corregimientos de Puerto Badel (Arjona) y Correa (María La Baja) en Bolívar para contribuir al conocimiento de las poblaciones silvestres de crocodílidos en ese departamento y en el Caribe colombiano.
Materiales y métodos
Area de estudio
El área de estudio incluyó parte del complejo de humedales pertenecientes al bajo Canal del Dique, específicamente de los corregimientos de Puerto Badel, Arjona (10°7' N; -75°28' O; 10 m.s.n.m.) y Correa, María La Baja (10°2' N; -75°24' O). Ambos corregimientos tienen características rurales y agropecuarias con actividades de pesca, ganadería, cacería, agricultura y de la industria camaronera (Ahumada-Lagares & Penso-Martínez, 2014). Sin embargo, un grupo pequeño de habitantes gana su sustento únicamente de la explotación de la fauna silvestre y ve en las babillas y caimanes una oportunidad para resolver las urgencias económicas del momento (Fundación Biodiversa, 2004).
Muestreos
Se establecieron cuatro rutas de monitoreo, tres en Puerto Badel y una en Correa (Figura 1).
Ruta 1. (Inicio: 10°9'45.30"N/75°30'14.10"O; final: 10°5'52.70"N/75°30'11.90"O; 20 km recorridos). Comenzó en el caño Matunillo, el cual está conectado al Canal del Dique; siguió por la ciénaga Arroyo de Plata, abierta a aguas marinas, y las ciénagas de aguas salobres de Guaranao, Charco Grande, Bocona, Arroyo Hondo, Descocotao, Enea y Puerto Rey, y terminó en el caño La Zanja. Este complejo de ciénagas se caracteriza por presentar tres tipos de mangle: Rhizophora mangle (mangle rojo), Laguncularia racemosa (mangle bobo) y Avicennia germinans (mangle negro). Parte importante del recorrido está en cercanías de la granja camaronera C.I. OCEANOS S.A.
Ruta 2. (Inicio y final: 10°5'13.61"N/75°29'11.78"O; 12,3 km recorridos). Incluyó la ciénaga de Palotal, cuya vegetación está conformada principalmente por pajonales distribuidos por toda la orilla y, en menor proporción, por eneales (Typha dominguensis), bijao (Talia geniculata), taruya o buchón de agua (Eichhornia sp.), anón de agua (Annona glabra), cantagallo (Erythrina fusca) y oreja de ratón (Salvinia auriculata). En ella se desarrolla una importante actividad pesquera artesanal, especialmente de las comunidades de los corregimientos de Rocha y Puerto Badel.
Ruta 3: (Inicio: 10°6'54.20"N/75°28'23.50"O; final: 10°5'38.18"N/75°28'2.98"O; 20 km recorridos). Incluyó las ciénagas de Dolores, Bohórquez, Juan Gómez y Ranchito. Entre la vegetación acuática se destacan R. mangle (mangle rojo) y Conocarpus erectus (mangle zaragoza) y, en menor proporción, el helecho matatigre (Acrostichum aurens), eneales (T. dominguensis), arepuelas (Nymphea sp.), buchón de agua (Eichhornia sp.), anón de agua (A. glabra) y cantagallo (E. fusca). Especial mención merecen las grandes extensiones de "majate", el cual sirve como refugio y alimento para los peces y tortugas. De este sistema cenagoso se abastece el acueducto de la ciudad de Cartagena de Indias.
Ruta 4: (Inicio: 10°2'40.14"N/75°24'17.55"O; final: 10°0'54.21"N/75°25'37.50"O; 6,6 km recorridos). Incluyó el caño Correa y la ciénaga del Rosario. Caño Correa presenta comunidades vegetales herbáceas, graminoides y arbustivas y parcelas aledañas utilizadas para la siembra de plátano, yuca y maíz; tiene tránsito permanente de los habitantes de las poblaciones cercanas. La ciénaga del Rosario tiene una vegetación dominada por el mangle rojo (R. mangle), el mangle zaragoza (C. erectus) y el mangle bobo (L. racemosa). La presencia de eneas (T. dominguensis), matatigre (A. aurens) y oreja de ratón (S. auriculata) proporciona un hábitat natural a las babillas y caimanes, además de poseer una fauna y una flora muy conservadas.
Entre noviembre de 2015 y marzo de 2016 se realizaron 15 recorridos nocturnos en las cuatro rutas utilizando un bote de fibra de vidrio de aproximadamente 4 m de largo por 1 m de ancho, impulsado por remos, que se desplazaba a una velocidad aproximada de 5 km/h en caños y ciénagas y variaba en los sectores con densa vegetación.
Los muestreos se hicieron en luna nueva o en los días anteriores o posteriores (Medem, 1981). Los conteos se iniciaban a las 19:00 y la hora final dependía del largo de la trayectoria. En la ruta 1 se hicieron tres conteos en una distancia recorrida de 20 km cada uno; en la ruta 2 fueron cuatro conteos en una distancia promedio de 12,2 km (mínimo 12 km y máximo 12,3 km). En la ruta 3 se hicieron cuatro conteos en una distancia de 20 km cada uno, y en la ruta 4 fueron cuatro conteos en una distancia de 6,6 km cada uno.
Los conteos nocturnos se efectuaron utilizando lámparas frontales (Chabreck, 1966; Sánchez, et al., 2011) para reconocer y ubicar a los caimanes y babillas. Se emplearon lámparas LED de 150 lumens, cuya luz, al incidir sobre el tapetum lucidum de los animales permitió detectarlos hasta aproximadamente 200 m de distancia. Tal como lo menciona Salas-Araya (1985), se asumió que cuando se reflejaban tonalidades rojo-amarillentas, la especie correspondía a C. acutus, y si eran rojizas, a C. crocodilus. Cuando fue posible acercarse a los ejemplares la identificación se corroboró con la morfología de la cabeza y la presencia de la cresta ósea interocular en C. c. fuscus y su ausencia en C. acutus. La longitud total (LT) de los ejemplares se estimó visualmente en función del tamaño de la cabeza y de los ojos.
La estructura poblacional se estableció agrupando los ejemplares avistados en clases, con lo que se buscaba reducir el error en la clasificación de los tamaños de los individuos avistados, ya que, por basarse en la estimación visual, la descripción del tamaño varía mucho según la experticia del observador. De esta manera se establecieron las siguientes clases de C. acutus: clase I, menos de 60 cm; clase II, de 61 a 120 cm; clase II, de 121 a 180 cm; clase IV, de 181 a 240 cm, y clase V, más de 240 cm (Seijas, 1981). Los individuos de C. c. fuscus se agruparon según la clasificación de Ayarzagüena (1983) en: clase I, de 50 cm o menos; clase II, de 50,1 a 120 cm; clase III, de 120,1 a 180 cm; clase IV, de 180,1 cm o más. Los individuos que se sumergieron antes de poder estimar la longitud total se registraron como "sólo ojos" (Messel, et al., 1981). Tanto los conteos como la estimación de los tamaños estuvieron a cargo del mismo investigador.
Se estimó la abundancia relativa, es decir, el número de individuos avistados por kilómetros recorridos (avistamientos/km) en cada una de las rutas (Cupul-Magaña, 2009).
Para determinar la fracción visible (que serviría para estimar el tamaño de la población total que fue posible observar), se utilizaron dos métodos. El primero fue el de King, et al. (1990):
dónde p es la fracción visible, x̄ es el valor promedio del número de ejemplares observados y s es la desviación estándar. El segundo fue el propuesto por Messel, et al. (1981), es decir, el promedio de las observaciones en los cinco meses de muestreo se dividió por el mayor número de avistamientos registrados para obtener la fracción visible observada: p = x̄ / valor mayor de avistamientos durante los muestreos.
El tamaño poblacional (n) se estimó mediante la fórmula propuesta por Messel, et al. (1981):
dónde x̄ es el valor promedio del número de cocodrilos observados, p es la fracción visible y s es la desviación estándar. Se utilizaron los valores obtenidos a partir de los dos métodos de la fracción visible para calcular el tamaño poblacional, seleccionando el menor (subestimación de la población).
Resultados
En las cuatro rutas en el bajo Canal del Dique se recorrieron 14 ciénagas y diez caños y se abarcaron aproximadamente 215 km (X=14,3 ± 5,9 km), con un esfuerzo de 71 horas de muestreo nocturno a lo largo de los cinco meses de muestreo (Tabla 1). Se hicieron 332 avistamientos, 306 de C. c. fuscus y 26 de C. acutus.
Tabla 1 Abundancia de las dos especies de crocodílidos registrada en los corregimientos de Puerto Badel y Correa, departamento de Bolívar.
| Mes | Especie | Clases | Número de individuos observados | ||||
| Ruta 1 | Ruta 2 | Ruta 3 | Ruta 4 | Total | |||
| Noviembre | C. c. fuscus | I, II | 2 | - | - | - | 2 |
| C. acutus | II | 2 | - | - | - | 2 | |
| Diciembre | C. c. fuscus | I, II, III, IV | 15 | 29 | 82 | 129 | |
| C. acutus | I, II, III, IV, V | 3 | 0 | 0 | 4 | 7 | |
| Enero | C. c. fuscus | I, II, III | 15 | 14 | 11 | 38 | 78 |
| C. acutus | III, IV, V | 1 | 0 | 0 | 6 | 7 | |
| Febrero | C. c. fuscus | I, II, III | 15 | 38 | 58 | ||
| C. acutus | II, IV, V | - | 0 | 0 | 10 | 10 | |
| Marzo | C. c. fuscus | I, II, III | 12 | 24 | 39 | ||
| C. acutus | - | - | 0 | 0 | 0 | 0 | |
| Total | C. c. fuscus | I, II, III, IV | 20 | 37 | 67 | 182 | 306 |
| C. acutus | I, II, III, IV, V | 6 | 0 | 0 | 20 | 26 | |
| 26 | 37 | 67 | 202 | 332 | |||
(*): no se hizo recorrido.
Crocodylus acutus
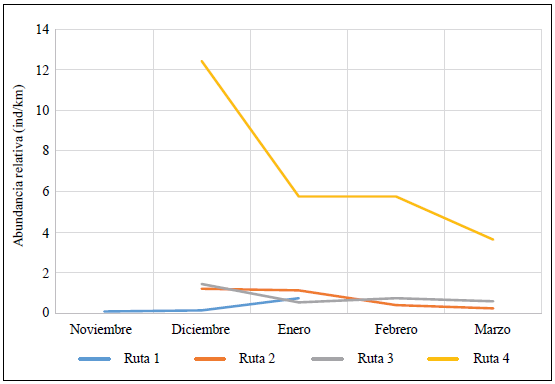
Durante el período de estudio la abundancia relativa promedio de C. acutus en el bajo Canal del Dique fue de 0,12 avistamientos/km. En noviembre se obtuvo el valor más bajo de abundancia (0,10 avistamientos/km), en tanto que en febrero se registró el valor máximo (0,26 avistamientos/km), el cual disminuyó drásticamente en marzo (Figura 2).
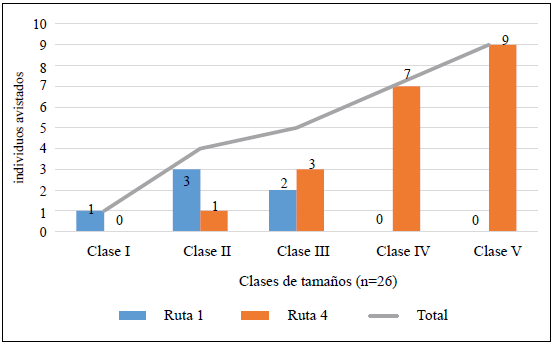
Se registraron individuos de todas las clases de tamaño, siendo los de clase V los más avistados (nueve avistamientos), y los de clase I, los menos avistados (un avistamiento).
En cuanto a las rutas, solo hubo avistamientos de C. acutus en las rutas 1 y 4. En la ruta 1 se registraron, en promedio, 0,13 avistamientos/km (mínimo 0,1 y máximo 0,2 avistamientos/km), siendo diciembre el mes con mayor abundancia relativa (0,2 avistamientos/km); solo se registraron avistamientos de ejemplares de la clase I (un avistamiento, 17 %), de la clase II (tres avistamientos, 50 %) y de la clase III (dos avistamientos, 33 %) (Figura 2). En la ruta 4 la abundancia relativa promedio fue de 0,75 avistamientos/km (mínimo 0 y máximo 1,5 avistamientos/km), siendo febrero el mes con el valor más alto (1,52 avistamientos/km) y diciembre el del valor más bajo (0,61 avistamientos/km); no se registraron avistamientos de individuos de la clase I, hubo un avistamiento de la clase II (5 %), tres de la clase III (15 %), siete de la clase IV (35 %) y nueve de la clase V (45 %).
La fracción visible calculada con el método de King, et al. (1990) fue de 0,37 y el tamaño de población estimado fue de 14,07 ± 7,67. Con el método de Messel, et al. (1981) la fracción visible fue de 0,52 y el tamaño poblacional estimado, de 10 ± 5,45. Por lo tanto, subestimando la población, el tamaño poblacional (n) de C. acutus osciló entre 5 y 15 ejemplares (n=10 ± 5,45) en la zona estudiada del bajo Canal del Dique durante el período de noviembre de 2015 a marzo de 2016.
Caiman crocodilus fuscus
La abundancia relativa promedio de C. c. fuscus durante los cinco meses de muestreo fue de 1,42 avistamientos/km. En noviembre se registró el valor más bajo (0,1 avistamientos/ km) y en diciembre el máximo registrado durante el estudio (3,81 avistamientos/km) (Figura 3). Se encontraron las cuatro categorías de tamaño establecidas para esta especie; el mayor número de ejemplares se registró en la clase II (149 individuos, 48,7 %), seguida de la clase III (14 individuos, 4,6 %), en tanto que de la clase I se avistaron 138 individuos (45,1 %) y de la clase IV, un solo individuo (0,3 %); cuatro babillas se incluyeron en la categoría "solo ojos" (1,3 %).
En cuanto a las rutas, enla ruta 1 el máximo valor se obtuvo en enero (0,75 avistamientos/ km) y el más bajo en noviembre (0,10 avistamientos/km). La clase dominante fue la II (27 avistamientos, 73 %), luego la I (9 avistamientos, 24 %) y la clase III (1 avistamiento, 3 %); no se observaron individuos de las clases IV y V. En la ruta 2 hubo una abundancia relativa promedio de 0,76 avistamientos/km, con el mínimo en marzo (0,25 avistamientos/km) y el máximo en diciembre (1,22 avistamientos/km); en la clase I se registraron 16 avistamientos (24 %), en la II, 46 (68 %), en la clase III se registraron 3 (5 %); a dos ejemplares no se les pudo estimar la longitud total y se incluyeron en la categoría "solo ojos" (3 %). En la ruta 3 el promedio de la abundancia relativa fue de 0,84 avistamientos/km, con el mínimo en enero (0,55 avistamientos/km) y el máximo en diciembre (1,45 avistamientos/km); la clase dominante fue la II (18 avistamientos, 90 %), seguida de la clase I (dos avistamientos, 10 %); no se avistaron individuos de las clases III y IV Por último, en la ruta 4 el valor máximo de abundancia relativa se obtuvo en diciembre (12,42 avistamientos/km) y el más bajo en marzo (3,64 avistamientos/km), con un promedio de 6,89 avistamientos/km. En la clase I se obtuvo el mayor número de avistamientos (111 avistamientos/km, 61 %), seguida de la II (58 avistamientos, 32 %), la III (10 avistamientos/km, 5 %); hubo un avistamiento de la clase IV (1 %) y dos de "solo ojos" (1 %).
Con el método de King, et al. (1990) la fracción visible fue de 0,37 y el tamaño poblacional estimado de 163,24 ± 25,64. Con la fórmula de Messel, et al. (1981) la fracción visible fue de 0,47 y el tamaño poblacional de 129 ± 20,26. Subestimando la población de C. c. fuscus en el bajo Canal del Dique, el tamaño poblacional estimado durante el período de noviembre de 2015 a marzo de 2016 osciló entre 109 y 149 ejemplares (n=129 ± 20,26).
Discusión
Este estudio aporta información sobre la abundancia, la distribución y la estructura de las poblaciones de caimanes aguja y babillas del bajo Canal del Dique, la cual es fundamental para su conservación a nivel local y regional.
La abundancia relativa promedio de C. acutus (0,12 avistamientos/km) es una de las más bajas registradas en el país. En el Caribe colombiano los mayores valores se han encontrado especialmente en parques nacionales: 7,78 individuos/km en el Parque Natural Nacional Vía Isla de Salamanca, Magdalena (Balaguera-Reina & González-Maya, 2009); 5,17 individuos/km en el de Paramillo, Córdoba (Viloria-Lagares, et al., 2017) y en zonas con por lo menos un sector de manejo especial: 1,37 avistamientos/km en bahía Portete, Guajira (De la Hoz-Villareal, et al., 2008), y 1,09 avistamientos/km en bahía de Cispatá, Córdoba (Ulloa-Delgado & Sierra-Díaz, 2006). La abundancia también fue más baja que la encontrada en el interior del país: 1,30 avistamientos/km en Norte de Santander (Ulloa-Delgado, 2011), y 1,07 avistamientos/km en el río Ermitaño, en Boyacá y Santander (Barrera, 2004). La mayor cantidad de avistamientos de C. acutus se presentó en y cerca de la ciénaga del Rosario, en Correa, un área poco intervenida y de complicado acceso. Estas condiciones de aislamiento y poca circulación humana parecen favorecer el resguardo de muchas especies de fauna silvestre, incluidos los crocodílidos (Ulloa-Delgado & Sierra-Díaz, 2012), especialmente por la desarrollada vegetación manglárica (Ulloa-Delgado & Sierra-Díaz, 2012).
Durante los meses de muestreos se recogieron en repetidas ocasiones los comentarios de pescadores artesanales y trabajadores de las empresas (C.I. OCEANOS S.A.) en el sentido de que los ejemplares adultos y subadultos de C. acutus se desplazaban desde las ciénagas y caños en estudio a las piscinas de engorde de camarón de las empresas camaroneras ubicadas en el centro de la ruta número 3 (Figura 1), posiblemente en búsqueda de alimento, como ya lo habían reportado Ulloa-Delgado & Sierra-Díaz (2002) en la camaronera Agrosoledad, en la zona de Cispatá.
La estructura de clases de C. acutus en toda el área de estudio incluyó todos los tamaños, con un 62 % de la población total para las clases V y IV; en menor medida se registraron subadultos (35 % de las clases III y II) y juveniles (4 % de la clase I). El bajo registro de subadultos avistados puede deberse a que este grupo posee altas tasas de crecimiento, alta mortalidad natural de juveniles o ciertos niveles de marginación por la acción de los adultos (Thorbjarnarson, 1989; Sasa & Chávez, 1992; Brandon-Pliego, 2007) y, además, los juveniles pueden haberse quedado escondidos en la vegetación manglárica y escapar de la detección durante los conteos (Platt & Thorbjarnarson, 2000); esto contrasta con lo registrado por Ulloa-Delgado (2011) en Norte de Santander donde avistó un mayor porcentaje de individuos de las clases I, II y IV.
El tamaño poblacional de C. acutus en el área de estudio osciló entre 5 y 15 ejemplares, con una abundancia absoluta de 26, lo cual se acerca al reportado por Barrera (2004) en el río Ermitaño entre Boyacá y Santander (14 individuos); por Balaguera-Reina & González-Maya (2009) en la Vía Parque Isla de Salamanca (14 individuos); por Farfán-Ardila (2013) en el PNN Tayrona (34 individuos), y por Viloria-Lagares, et al. (2017) en el PNN Paramillo (37 individuos), aunque más bajo que lo reportado por Ulloa-Delgado (2011) en cuatro ríos de Norte de Santander (196 individuos); por Hernández-Hurtado, et al. (2011) en los sistemas estuarios de San Blas, Nayarit, México (333 individuos), y en la Reserva de la Biósfera La Encrucijada (2011) (1,023 individuos).
La abundancia relativa promedio de C. c. fuscus para las zonas de estudio en el bajo Canal del Dique (1,42 avistamientos/km) fue semejante a la de poblaciones aprovechadas e impactadas en la zona norte del embalse El Guájaro, departamento del Atlántico (2,32 individuos/km) (Agudelo & Vergara, 2005), en Vía Parque Isla de Salamanca (1,37 ± 1,22 individuos/km) (Balaguera-Reina & Gonzalez-Maya, 2009), en la ciénaga de Zapatosa (0,56 ± 0,42 individuos/km) (Balaguera-Reina, 2012) y en ciénaga de Costilla, departamento del Cesar (2,60 ± 1,64 ind/km) (Balaguera-Reina, 2012), lo cual puede ser el resultado de su aprovechamiento ilegal.
Se observó una diferencia en la abundancia relativa promedio por mes entre las cuatro rutas estudiadas. En las rutas 1, 2 y 3, cercanas a Puerto Badel, no se registraron valores promedios de abundancias que alcanzaran la unidad; por otra parte, en la ruta 4 se encontraron valores mensuales de abundancia relativa considerablemente más elevados, con el pico más alto en diciembre (12,42 avistamientos/km). En el período en el que se realizaron los muestreos se presentó el fenómeno de El Niño 2015-2016 (IDEAM, 2015) con una de las mayores intensidades que se hayan documentado, lo que ocasionó que los niveles de agua bajaran en todos los sitios de monitoreo. En Puerto Badel, los caños y ciénagas son transitadas casi a diario por pescadores del corregimiento y otros pueblos aledaños. Así pues, el contacto constante con lanchas, ruido de motores, pescadores y cazadores, genera cambios en el comportamiento de los ejemplares que, de alguna manera, afectan la determinación poblacional porque se tornan huidizos y difíciles de avistar (Ron, et al., 1998). Por otro lado, en el caso de la ciénaga del Rosario (ruta 4), donde ha habido poca presión de caza, los animales son más fáciles de contar (Ron et al., 1998).
La estructura poblacional de C. c. fuscus en toda la zona de estudio fue similar a la registrada en el Caribe y la cuenca del Magdalena por otros autores, quienes también observaron una estructura de tamaños típica de poblaciones sujetas a aprovechamiento, en la que prevalecen individuos de tallas menores (clases I y II), algunos ejemplares de la clase III pocos o ningún individuo de la clase IV (Barahona, et al., 1996; Ulloa-Delgado & Cavanzo-Ulloa, 2003; Agudelo & Vergara, 2005; Forero-Medina, et al., 2006; Ardila-Robayo, et al., 2009; Balaguera-Reina, et al., 2010; Moreno-Arias, et al., 2013). Asimismo, la estructura poblacional registrada coincide con lo encontrado para toda el área del Caribe por Rodríguez-Melo (2000), que, según los criterios establecidos por Velasco & Ayarsagüena (1995), corresponde a la típica de poblaciones explotadas. La poca presencia de individuos de las clase III y IV en las rutas 1, 2 y 3 podría indicar cierta presión de caza sobre las tallas comercialmente aptas (60 a 130 cm), como lo menciona Balaguera-Reina (2012). El hecho de que en la ruta 4 se encontraron en mayor proporción ejemplares de la clase I indica que la especie se reproduce exitosamente y demuestra que condiciones favorables de hábitat y alimentación para la reproducción (Forero-Medina, et al., 2006).
La población de C. c. fuscus en toda el área de estudio fluctuó entre 109 y 149 ejemplares, con una abundancia absoluta de 306 avistamientos en el área de estudio en el bajo Canal del Dique. Moreno-Arias, et al. (2013) detectaron 464 babillas durante todo el muestreo en las zonas del río Magdalena en el departamento de Cundinamarca; Balaguera-Reina, et al. (2010), por su parte, registraron 226 ejemplares en el río Atrato en el Chocó. Además, el valor obtenido en la zona de estudio fue mayor que el registrado por Viloria-Lagares, et al. (2017) en el PNN Paramillo (12 individuos), por Balaguera-Reina (2012) en la ciénaga de Zapatosa (35 individuos) y en la ciénaga de Costilla (81 individuos) en el departamento del Cesar, y por Balaguera-Reina & González-Maya (2009) en la Vía Parque Isla de Salamanca (82 individuos).
Se considera que las poblaciones de crocodílidos sujetas a extracción permanente tienen cierta tendencia a localizarse en los sitios más alejados y ocultos para el hombre, por lo que su observación es difícil (Medem, 1981; Ulloa-Delgado & Cavanzo-Ulloa, 2003), por ello se pudo encontrar una población más grande tanto de babillas como de caimanes en la ciénaga del Rosario que en el caño Correa y la población en las rutas 1, 2 y 3 de Puerto Badel, donde, a pesar de tener características óptimas para el desarrollo de los individuos, se reduce su presencia, principalmente de adultos, por el constante flujo humano (Medem, 1981; Ulloa-Delgado & Cavanzo-Ulloa, 2003).
Se puede afirmar que hay diferencias en la abundancia relativa de las poblaciones de C. c. fuscus y C. acutus en las rutas y sitios de muestreo, aparentemente determinada por la diferencia de tamaño de las rutas, la cercanía de los asentamientos humanos, la cacería y la oferta trófica, entre otros.
En la estructura poblacional de C. acutus en la ruta 4 del municipio de Correa predominaron los adultos (clases V y IV), por lo que es probable que se presente un aumento progresivo en el tamaño poblacional cuando se den los procesos reproductivos en el grupo de adultos. Sin embargo, es fundamental continuar monitoreando con métodos de captura y recaptura para determinar el sexo de los individuos y establecer la dinámica de esta población. En general, no es posible estimar de forma precisa el estado la población de C. acutus en el área de estudio debido a los pocos registros (26) en una extensión tan amplia de espejo de agua (215 km) y a la escasez de individuos de todas las clases de tamaño.
Los corregimientos de Correa y Puerto Badel presentan las condiciones propicias para el desarrollo de las poblaciones de crocodílidos por su la alta disponibilidad de hábitats y de afluentes hídricos, lo que influye en los cuerpos de agua.