Introducción
Durante la explotación minera los minerales sulfurados presentes en el suelo entran en contacto con el agua y el oxígeno del ambiente generando drenajes de mina que pueden ser corrosivos, tóxicos e, incluso, radioactivos. Se clasifican como drenajes ácidos de mina (DAM) si el pH es <4,5 o como drenajes neutros de mina (DNM) cuando el pH se encuentra entre 4,5 y 7,5. Los DAM presentan un alto contenido de sulfatos y metales disueltos, como Mn2+, Fe3+, Al3+, Cd2+, Cu2+, Ni2+, Pb2+ ,Zn2+y As (III/V), en tanto que los DNM contienen menor concentración de sulfatos disueltos pero pueden contener Cd2+, Ni2+, Mn2+ y Zn2+ (Nordstrom, et al., 2015).
Las características fisicoquímicas de los drenajes de mina y la forma en que son dispuestos sobre el suelo producen efectos negativos sobre la composición de las comunidades microbianas asociadas con los ciclos biogeoquímicos (Pereira, et al., 2015). Los metales presentes en los DAM son bioacumulados a nivel celular generando toxicidad por la obstrucción del sitio activo de algunas enzimas, así como afectación en la síntesis del ADN y las proteínas (Jaishankar, et al., 2014). Por otra parte, aun cuando los DNM contienen menor concentración de metales y sulfatos, estos ocasionan la precipitación de minerales que incrementan la salinidad del suelo y tienen un impacto en la diversidad y la abundancia de las comunidades microbianas (Pereira, et al., 2014). También se ha encontrado que los drenajes de mina favorecen la presencia de géneros de bacterias acidófilas, oxidadoras y reductoras de hierro y azufre como las bacterias sulfato reductoras, que pueden subsistir en condiciones de alta concentración de metales, poca concentración de nutrientes, pH ácido y sulfatos (Méndez-García, et al., 2015) cambiando la composición microbiana original.
En el primer trimestre del 2018 se reportó en Colombia la explotación de 19.000 millones de toneladas de carbón. El Distrito Minero de Zipa-Samacá es uno de los conglomerados mineros más importantes del país cuya producción estimada de drenaje de mina es de 74.000 m3 al mes, con alta concentración de metales disueltos, como Fe+2, Mn+2, Zn+2, Ca+2 y Mg+2 (164,4 ± 92,6; 29,2 ± 14,5; 14,3 ± 11,0; 230,5 ± 14,4, y 130 ± 63,2 mg L-1, respectivamente), de sulfato (2.345 ± 208 mg L-1), y un pH entre 3,0 y 8,0 (Vásquez, et al., 2016). Aunque el gremio minero y algunas universidades han desplegado esfuerzos para mitigar y remediar el impacto de los drenajes sobre las fuentes de agua, aún no hay reportes sobre el impacto de estos vertimientos en el suelo.
En estudios previos se ha logrado determinar el efecto de los drenajes de mina sobre las comunidades microbianas y cómo afectan los ciclos biogeoquímicos (Pereira, et al., 2015; Méndez-García, et al., 2015; Da Costa, et al., 2016), por lo que dicho impacto puede determinarse a partir de la actividad enzimática de las P glucosidasas, ureasas y fosfatasas ácidas y alcalinas, las cuales están vinculadas con la descomposición de materia orgánica y los ciclos de nutrientes como el carbón, el nitrógeno y el fosforo (Vallejo, 2012). Las enzimas son bioindicadores de la calidad y la fertilidad del suelo, ya que se relacionan con la catálisis del ciclo de nutrientes, la composición microbiana y los nutrientes disponibles en el suelo. Asimismo, las enzimas están involucradas en la mitigación de los efectos de los componentes tóxicos en el suelo durante la remediación (Gunjal, et al., 2019; Dotanilla, et al., 2019).
Las enzimas deshidrogenasas y celulíticas son generalistas, ya que son indicadores del flujo energético, la respiración microbiana y la biomasa microbiana total en diversos sustratos (Brkljača, et al., 2019). Además, son constituyentes de las rutas metabólicas de fosfatos como la gliceraldehído-3-fosfato deshidrogenasa (GAPDH) y la glucosas-fosfato deshidrogenasa (G6PDH), del metabolismo del nitrógeno, como el glutamato deshidrogenasa, y del carbono, como el monóxido deshidrogenasa y la alfa-cetoglutarato deshidrogenasa. Por lo tanto, cuantificar la actividad enzimática de los microorganismos del suelo permite evaluar las perturbaciones ocasionadas por un contaminante.
En estudios anteriores se ha concluido que la presencia de drenajes de mina en suelos disminuye la disponibilidad de compuestos orgánicos y aumenta la presencia de los grupos sulfato, lo cual afecta la actividad enzimática relacionada con el ciclo de nutrientes y aumenta otros ciclos biogeoquímicos (Bott, et al., 2012; Da costa, et al., 2016), en tanto que los metales y el pH pueden inhibir una enzima o favorecer su actividad (Chen, et al., 2018).
En este estudio se evaluó el efecto de los drenajes ácidos y neutros de mina de carbón sobre la actividad de las enzimas β-glucosidasa, ureasa, fosfatasa ácida y alcalina, deshidrogenasa y celulolítica en el suelo. Además, mediante una librería de clones, se identificaron los géneros bacterianos y se correlacionaron con los parámetros fisicoquímicos y los ciclos biogeoquímicos utilizando un suelo de bosque de roble como control.
Materiales y métodos
Area de estudio
Las muestras se recolectaron en los canales excavados en el suelo por donde circulan los drenajes de la mina de carbón La Jabonosa, perteneciente al gremio Uniminas Ltda., del municipio de Guachetá (5° 22' N, y 73° 40' O), distrito minero de Zipa - Samacá. En la mina, el DNM es bombeado a la superficie cada ocho horas y se almacena en un tanque de sedimentación para luego ser liberado a través de un canal excavado en el suelo (~50 cm de ancho, 30 cm profundidad y 5 m de largo), que llega hasta una pastura donde el DNM se percola en el suelo. Por otro lado, en la misma área hay tres depósitos de residuos estériles de carbón expuestos a la intemperie que lentamente lixivian DAM, el cual sigue varios caminos a través del suelo llegando a una pastura donde se encuentra ganado vacuno, y allí se percola. Por último, como control se utilizó el suelo de la reserva forestal El Robledal (5° 27' N, y 73° 40' O) en cercanías del municipio de Guachetá, declarada área protegida por la CAR en 1981 dada su cercanía a la laguna de Fúquene y por los servicios ecosistémicos que presta (Rubio, 2016). En dicha reserva predominan robles y vegetación secundaria.
Recolección de muestras
Para la recolección de las muestras se tuvo en cuenta la posición de la fuente de drenaje y las condiciones climáticas. Las muestras de suelo con vertimiento de drenaje neutro (sDNM) y de drenaje ácido de mina (sDAM) se tomaron con un barreno manual plástico de las paredes y el fondo de los canales por donde circula el drenaje; en cada uno se tomaron 10 muestras que se mezclaron en pesos iguales hasta obtener una sola muestra compuesta que fue dividida en tres partes: la primera para la caracterización fisicoquímica, la segunda para la actividad enzimática, y la tercera para los ensayos moleculares. Las muestras se preservaron en tubos y bolsas estériles mantenidas en hielo hasta la llegada al laboratorio; la primera y la segunda muestras se refrigeraron en nevera a 4 °C, y la tercera se preservó a -20 °C (Pereira, et al., 2014).
La muestra de control se recolectó en un cuadrante de 10 x 10 m de bosque subdividido en cuatro áreas iguales y en cada una de ellas se tomaron cuatro muestras periféricas y una central de 8 cm de profundidad. Posteriormente, se tomó un peso igual (200 g) de cada muestra y las porciones se mezclaron para obtener una muestra compuesta de la cual se retiraron manualmente los objetos extraños (hojas, raíces, piedras). Todas las muestras se recolectaron por duplicado.
Análisis fisicoquímicos de las muestras de suelo
Los parámetros fisicoquímicos se determinaron in situ a lo largo de los canales donde circulaba el DAM y el DNM; se sumergió una sonda multiparamétrica (HI 9828, Hanna® Instruments; Woonsocket, RI) para medir el pH, el potencial de óxido-reducción (ORP), el oxígeno disuelto (OD) y la salinidad; en el suelo de bosque no se tomaron estas medidas porque las muestras se tomaron lejos de fuentes de agua. Cada muestra de suelo se analizó por duplicado en los laboratorios de suelo de la Universidad Central y los resultados se corrigieron por contenido de humedad y se expresaron en peso seco. El pH se midió con un medidor de pH (Lab 870, Schott, Mainz, Germany) usando una relación de 1:1 de suelo y agua desionizada según el método 4972-0153 (American Society of Testing Materials-ASTM, 1995). La humedad se determinó por la diferencia de peso entre suelo húmedo y suelo seco (ASTM, 1995), los sólidos totales volátiles (STV) se determinaron a 250 °C durante 2 h (American Public Health Association-APHA, 2005), el nitrógeno orgánico total (NOT) con el método 4500-Norg (APHA, 2005) y el carbono orgánico total (COT) según el método de titulación (Schumacher, 2002). Los metales totales presentes en el suelo se liberaron por digestión ácida y se cuantificaron por absorción atómica (Varian, 240 FS, Agilent Technologies, Santa Clara, CA), usando el método 7000B (Unied States Environmental Protection Agency-USEPA, 2001). El contenido de ceniza se determinó en mufla a 750 °C (método D2974) (ASTM, 1995), el sulfato soluble se extrajo con HCl (38 %, v/v) según el protocolo de Sobek, et al. (1978) y se cuantificó mediante el método turbidimétrico. Por último, los sulfuros ácidos volátiles (SAV) se liberaron con el método de purga y trampa descrito por Di Toro, et al. (2005) y se cuantificaron con el método de azul de metileno.
Determinación de la actividad enzimática
Para evaluar cómo los drenajes de mina afectan la actividad enzimática de las comunidades microbianas, se utilizó suelo seco al aire por 24 horas y cada análisis se realizó por duplicado. La actividad de las enzimas deshidrogenasas y celulolíticas se cuantificaron utilizando 1 g de suelo según el protocolo descrito por Serra-Wittling, et al. (1995), que emplea como aceptores de electrones el cloruro de 2,3,5-trifeniltetrazolio y la carboxi-metilcelulosa, respectivamente. La cuantificación de estas enzimas permite evaluar la respiración celular y la reducción de azúcares en el suelo. La actividad de las enzimas β-glucosidasas, fosfatasa alcalina y fosfatasa ácida se determinó con 0,3 g de suelo, para las β- glucosidasas se utilizó como sustrato p-nitrofenil-β-glucopiranósido, el cual genera la liberación enzimática de glucosidasa p-nitrofenol. Para las fosfatasas se utilizó como sustrato p-nitrofenil fosfato tetrahidratado, el cual participa en la catálisis del p-nitrofenol, lo que permitió la medición de la concentración enzimática. Para la actividad de la enzima ureasa se utilizaron 0,15 g de suelo siguiendo los métodos modificados por Vallejo (2012), en los cuales se utiliza la urea como sustrato para la liberación y cuantificación del amonio durante la actividad enzimática.
Análisis moleculares
Para la identificación de las comunidades bacterianas presentes en suelos afectados por los drenajes y en los de control, se construyó una librería de clones del gen 16SrRNA. El ADN metagenómico fue extraído con el estuche NucleoSpin® Soil (Macherey-Nagel). En la amplificación de 900 pb del gen 16S rRNA se utilizaron los iniciadores diseñados por Wang (1999) a una concentración final de 0,3 µM,1x de tampón KCl, 2mM de MgCl2 0,2mM de dNTPs , 0,5 U/ul de Taq polimerasa (Thermo Scientific), 2 µl de ADN cuantificado por Nanodrop® y 3mg/L de BSA como estabilizador bajo las siguientes condiciones: desnaturalización inicial a 95 °C durante 5 minutos, 25 ciclos a 95 °C por 40 segundos, a 53 °C por 30 segundos y a 72 °C por 1 minuto, y una extensión final a 72 °C por 10 minutos. El producto de la PCR se purificó con el estuche UltraClean® PCR Cleanup (MO BIO Laboratories, Inc.) siguiendo el protocolo del fabricante. Posteriormente, se hizo la clonación comenzando por la ligación de los productos de la PCR purificados al vector del estuche TOPO™ TA Cloning™ Kit (Invitrogen), y la transformación de las células competentes One Shot®Topo10 (Invitrogen). De las librerías genómicas de cada muestra de suelo se seleccionaron al azar 50 clones, a los cuales se les verificó la correcta inserción mediante PCR. Por último, se escogieron 32 clones para cada tipo de suelo, a los cuales se les extrajeron los plásmidos con el estuche Zyppy™ Plasmid Miniprep (Zymo Research), que luego fueron secuenciados con el método Sanger en el Instituto de Genética de la Universidad Nacional.
La edición manual de las secuencias se realizó con el programa Geneious (Bio-matters Limited) y la identificación con la herramienta BLAST del National Center for Biotechnology Information (NCBI). En el análisis se tuvo en cuenta un porcentaje de similitud de > 99 % y se logró identificar las secuencias hasta el nivel taxonómico de género. Por último, con el fin de relacionar los géneros encontrados con los ciclos biogeoquímicos del suelo, se construyó una red biológica utilizando la aplicación Cytoscape (v 3; Cytoscape Consortium).
Análisis estadísticos
Inicialmente, se hizo la normalización y homogenización de los datos fisicoquímicos y de actividad enzimática para llevar a cabo un análisis de varianza de una vía (ANOVA), lo que permitió establecer las diferencias estadísticamente significativas entre las variables evaluadas. Posteriormente, se hicieron pruebas de comparaciones múltiples (Tukey) y correlaciones de Pearson para buscar las variables fisicoquímicas que se correlacionaban linealmente. Los análisis se procesaron mediante el programa SPSS Statistics 19. Para evaluar la correlación entre variables fisicoquímicas y la actividad enzimática con los géneros bacterianos identificados y las muestras, se hizo un diagrama de ordenación (triplot) con base en un análisis multivariado de correspondencia canónica (ACC; número de permutaciones = 999 y α = 0,05) usando el programa CANOCO (Braak & Smilauer, 1998), después de estandarizarlas con la ecuación ((x+1)/DE).
Resultados
Caracterización fisicoquímica de las muestras de suelo
Las variables fisicoquímicas evaluadas in situ en los canales del suelo por donde circulaba el drenaje mostraron diferencias significativas (ANOVA, p≤0,05). El DAM presentó un pH de 3,28 ± 0,70 con una salinidad de 4,30 ± 0,60 mg L-1, un ORP de 357,8 ± 40 mV y OD de 1,15 ± 0,23 mg L-1. Por otro lado, el DNM tenía un pH de 7,20 ± 0,80, con salinidad de 2,50 ± 0,30 mg L-1, ORP de -27,6 ± 7,0 mV, y no se registró OD.
En el laboratorio se analizaron las muestras de suelo (sDAM, sDNM y del bosque) y se encontraron diferencias significativas (ANOVA, p≤0,05) en la mayoría de sus propiedades fisicoquímicas, con excepción de los STV, el Ca y la humedad (Tabla 1). El análisis de Pearson evidenció una correlación positiva de las cenizas con los metales (Zn 0,987; Pb 0,974; Mn 0,955; Fe 0,931, y Cd 0,972; p=0,01) y negativa con el COT (- 0,979; p=0,01), y, además, una correlación positiva de los metales Zn, Mn y Pb con los SAV (0,923, 0,894,0,840; p<0,05 respectivamente), en tanto que el sulfato se correlacionó de manera negativa con el pH y el NOT (- 7,40 y - 0,880; p<0,05, respectivamente), el Fe mostró una correlación positiva con el Mn, el Pb y el Cd (0,982, 0,995,0,832; p=0,01, respectivamente) y negativa con el Zn y el NOT (- 0,951 y - 0, 887; p=0,01, respectivamente). Se observó, asimismo, una correlación positiva entre el COT y el NOT (0,984 y 0,835; p<0,05).
Tabla 1 Parámetros fisicoquímicos de los tres tipos de suelo evaluados en el estudio
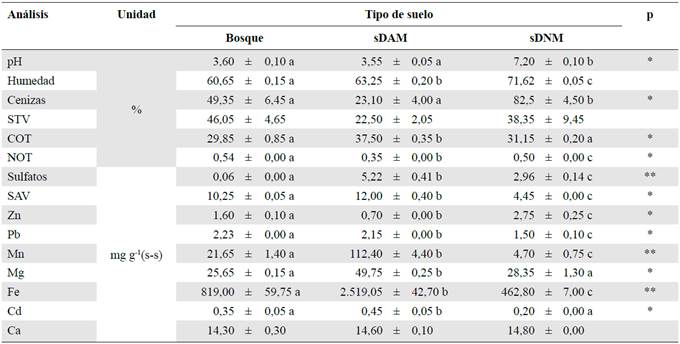
Los resultados se expresaron como promedio ± desviación estándar. Las letras iguales en sentido horizontal indican que las medias no difieren significativamente parap<0,05 (*) y para p<0,01(**).
sDAM: suelo impactado por drenaje ácido de mina; sDAM: suelo impactado por drenaje neutro de mina; STV: sólidos totales volátiles; COT: carbono orgánico total; NOT: nitrógeno orgánico total; SAV: sulfuros ácidos volátiles; (s-s): suelo seco
Determinación de la actividad enzimática
La actividad enzimática (β-glucosidasa, fosfatasa ácida y alcalina, DHS y celulolítica) registró diferencias estadísticamente significativas entre los tres tipos de suelo evaluados (ANOVA, p≤0,05). La mayor actividad de las enzimas β-glucosidasa, fosfatasa ácida y alcalina se observó en el suelo de bosque; en el caso de la enzima ureasa no se encontró actividad significativa en ninguno de los suelos evaluados. En el caso de las enzimas DHS y celulolítica, su actividad fue mayor en el sDAM. La actividad de la enzima DHS mostró una correlación positiva (Pearson) con los sulfatos (0,967; p=0,001) y negativa con la actividad de la enzima β-glucosidasa y el NOT (-0,963 y -0,921; p<0,05, respectivamente). En el caso de sDNM, no se encontraron diferencias significativas en ninguna de las enzimas (Figura 1).
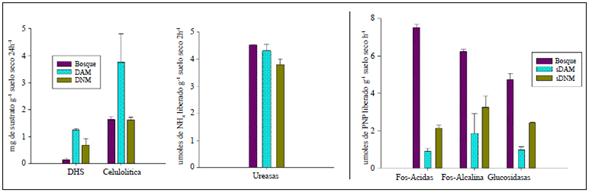
Figura 1 Actividad enzimática de microorganismos en los tres tipos de suelo evaluados. El sustrato para la actividad DHS corresponde a 1,3,5-cloruro de tetrazolio y para la actividad celulolítica se utilizó carboximetilcelulosa.
La actividad de la enzima celulolítica se correlacionó positivamente con el COT, el Mn y el Fe (0,936, 0,935 y 0,942; p<0,05, respectivamente) y negativamente con el NOT (-0,928; p<0,05), en tanto que la actividad de las enzimas fosfatasa ácida y alcalina presentó correlación negativa con la humedad (- 0,935; p<0,05). Por último, la actividad de la β-glucosidasa presentó correlación positiva con la actividad de enzima ureasa y el NOT (0,902 y 0,973; p<0,05) y correlación negativa con la actividad del DHS, los sulfatos y el COT (- 0,963, -0,959 y -0,938; p=0,01; respectivamente).
Composición taxonómica y su relación con los parámetros fisicoquímicos
Las secuencias obtenidas del inserto dieron como resultado la identificación de 47 géneros bacterianos; 18 géneros en suelo del bosque, 11 géneros en el sDAM y 18 géneros en el sDNM; algunos se hallaron en más de una copia: Terriglobus, Gemmata, Paludibacum, Occallatibacter y Rhodoplanes en el suelo de bosque, Acidithiobacillus, Desulfosarcina, Romboutsia e Ignavibacterium en sDNM y Micromonospora, Parabacteroides y Povalibacter en sDAM. Según la descripción fisiológica reportada en la literatura especializada, estos géneros están correlacionados funcionalmente con los ciclos biogeoquímicos, lo que crea una red biológica en la que se observó que los ciclos del carbono y el nitrógeno predominan en el suelo de bosque y el sDAM, en tanto que en el sDNM prevalece el ciclo del hierro y el del azufre (Figura 2).
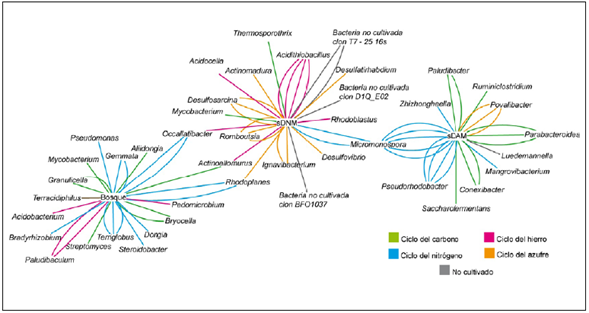
Figura 2 Red biológica de los ciclos biogeoquímicos entre los taxones encontrados y las actividades metabólicas de los microorganismos reportados en la literatura especializada. Las líneas de colores se repiten de acuerdo con el número de copias del clon encontrado.
Con el fin de relacionar los géneros bacterianos identificados, la actividad de las enzimas y las variables fisicoquímicas con los tres tipos de suelos evaluados, se hizo un ACC (Figura 3). El análisis evidenció que las variables fisicoquímicas y su relación con los géneros bacterianos presentaron una varianza del 91 % (eje 1: 56,2 % y eje 2: 34,5 %), por lo tanto, el 9 % restante respondía a las variables no medidas. Además, el ACC reveló tres subgrupos correspondientes al tipo de suelo evaluado y correlacionado con las características fisicoquímicas y a la comunidad bacteriana.
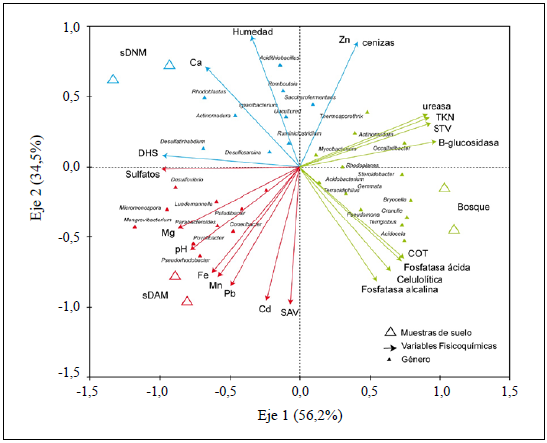
Figura 3 Análisis de correspondencia canónica (ACC) (triplot) entre géneros bacterianos y actividad enzimática con respecto a las variables fisicoquímicas y las muestras de suelo. La diferencia de colores representa los subgrupos generados por el análisis ACC, los cuales corresponden a los tres tipos de suelo.
El primer subgrupo que emergió del ACC fue el de bosque, en el que las muestras se correlacionaron positivamente (Pearson: p<0,05) con el NOT, el COT, los STV y una mayor actividad de las enzimas ureasa, fosfatasa ácida y alcalina, celulolítica y β-glucosidasa. En este subgrupo se incluyeron bacterias de los géneros Paludibacter, Acidobacter, Pseudomonas, Acidocela, Mycobacter y Actinomadura. El segundo subgrupo correspondió a las muestras de sDAM, en las que Mn, Fe, Pb, Cd, Mg y SAV fueron las variables ambientales que afectaban la variación de la comunidad bacteriana, siendo también los sulfatos encontrados en este tipo de suelo una variable significativa para algunos géneros bacterianos como Desulfovibrio y Povalibacter. Otros géneros identificados en este grupo fueron Micromonospora, Parabacteroides, Zhishongheella, Luedemannella y Povalidacter. Por último, el tercer grupo lo conformaron las muestras de sDNM, en las que se encontró que la humedad, el Zn y el Ca eran las variables ambientales que afectaban la comunidad bacteriana y la actividad de las enzimas DHS en mayor medida. Los géneros Desulfosarcina, Actinomadura, Rhodoblastus y Desulfatirhabdium se agruparon donde el Ca tiene mayor efecto, y los géneros Romboustia, Acidothiobacullus, Thermosporothix y Saccharofermentans se agruparon cerca a la humedad, el Zn y las cenizas.
Discusión
En este estudio se evaluó el efecto de los drenajes ácidos y neutros de mina sobre los parámetros fisicoquímicos, la actividad enzimática y la composición taxonómica bacteriana del suelo. Los análisis determinados in situ evidenciaron que los DAM y DNM presentaron propiedades fisicoquímicas distintas. Los drenajes ácidos presentaron un pH<4,5 con altos valores de salinidad y ORP, en tanto que los neutros tenían un pH>7,0 con baja salinidad y ORP negativo. Estos coinciden con los reportes previos de los drenajes en el distrito minero de Zipa-Samacá (Vásquez, et al, 2016). Las características fisicoquímicas de los DAM indican que los minerales sulfurados presentes en los residuos estériles de la escombrera se oxidan generando un bajo pH con la consecuente disolución de minerales que incrementan la salinidad y el ORP. Por otra parte, los DNM son comunes en la zona minera dada su geología rica en calcita (CaC03), ankerita [Ca (Fe,Mg,Mn)(C03)2] y la dolomita [CaMg(C03)2], las cuales neutralizan el pH favoreciendo la precipitación de los metales y la reducción de la salinidad.
En el laboratorio se analizaron las muestras de dos tipos de suelos afectados por drenajes (sDAM y sDNM), además de un control de suelo de bosque andino, y se encontraron diferencias significativas en los parámetros evaluados. La correlación positiva entre los metales y el porcentaje de cenizas puede deberse a la presencia de minerales en los suelos cuando estos han estado en contacto con los drenajes por largo tiempo. Además, se ha encontrado que las cenizas en el suelo pueden determinar el nivel de especiación y distribución de los metales (Vásquez, et al, 2016). También se encontró una correlación positiva entre el Fe, el Mn, el Zn, el Pb y los SAV, lo cual es común en los suelos de regiones mineras debido a la formación de minerales sulfurados, los cuales precipitan con facilidad debido a su baja constante de solubilidad (Kps ) (Biais, et al., 2008). También se encontró una correlación positiva entre el Fe, el Mn, el Pb y el Cd, la cual puede deberse a la formación de óxidos e hidróxidos de Fe y Mn que contribuyen con la coprecipitación de otros metales como el Pb y el Cd cuando hay oxígeno disponible (Li, et al., 2003). Por último, se encontró una correlación negativa entre el pH y los sulfatos, lo que se debe a la liberación de ácido sulfúrico provocada por la oxidación de los sulfuros durante la formación de los drenajes de mina que ocasionan el descenso del pH. Estos resultados concuerdan con reportes anteriores en los que la concentración de los sulfatos fue mayor en el sDAM por la oxidación de pirita (Campaner, et al., 2014).
Con el fin de evaluar el efecto de los DAM y los DNM sobre la actividad de las comunidades microbianas presentes en los suelos, se analizó la actividad de las enzimas ureasas, β-glucosidasa, fosfatasa ácida y alcalina, DHS y celulolíticas. La actividad enzimática se utiliza como indicador de la calidad del suelo, ya que los microorganismos controlan la mineralización de los compuestos naturales y xenobióticos (Irfan, et al., 2014 ). Por lo tanto, era de esperarse que la actividad fuera superior en el suelo de bosque, como ocurrió con la β-glucosidasa y la fosfatasa ácida y alcalina, sin embargo, no se observó lo mismo para las DHS y las celulolíticas. Se concluyó, así, que la actividad de las enzimas relacionadas con el ciclo de nutrientes puede presentar una inhibición producida por los metales y sulfatos presentes en los drenajes de mina, en tanto que las enzimas generalistas indicadoras de biomasa, que pueden encontrarse en diferentes condiciones de sustrato, no presentaban disminución.
La actividad de las enzimas DHS fue mayor en los sDAM, probablemente por la presencia del estiércol de vaca en la pastura donde se formaban los canales de lixiviación de las escombreras. La presencia de una fuente de nutrientes como el estiércol favoreció la actividad de las DHS, como se ha reportado previamente (Serra-Wittling, et al., 1995), debido a que la presencia de materia orgánica como el COT favorece el incremento de la biomasa microbiana (Adak, et al., 2014), además, este se relacioná con la reducción y la oxidación de elementos fuentes de carbón (Cordas, et al., 2019; Jeoung, et al., 2018). Asimismo, se encontró una correlación positiva de la actividad del DHS con el sulfato, lo que se asociaría con la actividad de las enzimas formiato deshidrogenasas, las cuales están presentes en las bacterias sulfato reductoras que son abundantes en suelos mineros (Keller, et al., 2014). Se ha encontrado que esta enzima realiza la reacción reversible de la producción de formiato según la disponibilidad de sulfato como aceptor de electrones (Pereira, et al., 2011). Por lo tanto, la presencia de una fuente de carbón permitió mayor concentración del COT: 37,50± 0,35b (Tabla 1), lo cual pudo favorecer la actividad de DHS en el sDAM, a pesar de su toxicidad fisicoquímica, lo que da un indicio de su importancia como enmienda en la remediación.
La correlación positiva de la actividad celulolítica con el Fe encontrada en este estudio es opuesta a lo reportado por Wang, et al. (2013), quienes registran la inactivación y restricción de la actividad enzimática en presencia de metales. Sin embargo, la activación o reducción de la actividad celulolítica por la presencia de Mn y Fe puede variar dependiendo del microorganismo que produce la actividad, como lo registraron Azadian, et al. (2017), ya que algunos géneros de hongos productores de enzima celulolítica pueden verse favorecidos en la producción enzimática en presencia de metales, los cuales son precursores durante la actividad y favorecer así los resultados obtenidos en el sDAM. Por otro lado, se encontró una correlación negativa entre la actividad celulolítica y el NOT, lo que podría explicar la baja actividad de esta enzima en el suelo de bosque. En estudios previos se ha reportado que la presencia de carbón y nitrógeno mineralizados afectan la actividad enzimática celulolítica ralentizándola, ya que estos compuestos son difíciles de metabolizar (Chen, et al., 2018). Además, se ha reportado que en algunos microrganismos las fuentes de nitrógeno orgánico, como la L-cistina, la L-cisteína y la L-tirosina, inhiben la producción de enzimas lignolíticas afectando su sitio activo debido a su configuración o concentración (Chauhan, 2019). Las enzimas lignolíticas, a su vez, se relacionan con la actividad celulolítica al ser las primeras descomponedoras que permiten fuentes más asequibles de carbono, lo cual ralentiza la actividad enzimática cuando existe inhibición (Irfan, et al., 2014; Prasher, et al., 2015). La actividad celulolítica permitió evidenciar la capacidad adaptativa de algunas bacterias en condiciones de pH ácido, presencia de sulfato y disponibilidad de metales.
La actividad de las enzimas β-glucosidasa y fosfatasa ácida y alcalina, las cuales utilizan el nitrógeno en su metabolismo, fue superior en el suelo de bosque, en donde la concentración de NOT fue mayor en comparación con las de los sDAM y sDNM. También se ha reportado en otros estudios la afectación de las fosfatasas por factores como la humedad, el pH y la salinidad (Bolaños, 2006), lo que explica la correlación negativa encontrada entre la actividad de las enzimas y estos parámetros fisicoquímicos. En estudios previos se ha descrito que el incremento de la humedad y su paso a través de la porosidad del suelo reduce la actividad enzimática por ser estas exoenzimas (Tapia-Torre & García-Oliva, 2013). Para concluir, las variables fisicoquímicas en suelos afectados por el drenaje disminuyen la actividad enzimática de los microorganismos que participan en los procesos del ciclo de nutrientes esenciales para la conservación y calidad del suelo.
Con el fin de evaluar el efecto de los drenajes de mina sobre la composición bacteriana del suelo, los géneros identificados se relacionaron con los ciclos biogeoquímicos a través de una red biológica, así como con las muestras y las variables fisicoquímicas mediante un ACC. En los suelos de bosque y los sDAM prevalecieron los taxones con actividad metabólica relacionada con ciclos de carbono y nitrógeno, mientras que en el sDNM prevalecieron los microorganismos afines a los ciclos de hierro y azufre. Esta observación se vio corroborada por los resultados del ACC, en el que las muestras y los parámetros fisicoquímicos se separaron en tres grupos según el tipo de suelo. En el suelo de bosque los parámetros de mayor impacto fueron los STV y el NOT, los cuales incrementan la actividad enzimática y favorecen la presencia de géneros que participan en el ciclo del nitrógeno como Gemmata, que oxida el amonio (N0- 4) hasta su forma de gas nitrógeno (N2) (Sanabria, et al., 2009), Terriglobus, que reducen el nitrato (N0- 3) hasta nitrito(N0- 2), siendo, a su vez, transportadoras y metabolizadoras de carbohidratos (Kielak, et al., 2016), Aliidongia, taxón cuya actividad fosfatasa y ureasa cataliza la hidrolisis de la urea (CO(NH2)2) convirtiéndola en NH3 y dióxido de carbono (CO2) (Vallejo, 2012; Chen, et al., 2017). Este género se considera parte fundamental del ciclo del nitrógeno en las fases de amonificación y nitrificación, siendo este último proceso el paso del amoniaco (NH3) a nitrito (NO2-) y luego a nitrato (NO3-) biodisponible para la vegetación (Aristizábal & Cerón, 2012).
En el suelo de bosque también se encontraron géneros importantes del ciclo del carbono y el fósforo como Granulicella y Occallatibacter, los cuales presentan actividad de la β-glucosidasa y favorecen la hidrólisis de celulolíticas hasta monosacáridos, así como actividad de fosfatasas, las cuales están vinculadas con la catálisis de la mineralización de fósforo orgánico convirtiéndolo en ortofosfatos, además de la catálisis de la hidrólisis del ácido fosfórico para la producción de fosfato libre (Vallejo, 2012;). Otro taxón identificado fue Bryocella, el cual se ha vinculado con las enzimas glucosidasa y fosfatasa y con la oxidación del metano (CH4) a CO2 (Dedysh, et al., 2012; Kielak, et al., 2016). Por otra parte, también se encontraron taxones vinculados con los ciclos del azufre y el hierro, como es el caso del género Pedomicrobium, el cual puede bioacumular óxidos de hierro y manganeso, además de estar relacionado con el ciclo del nitrógeno. Otros de los géneros identificados fue el Paludibaculum, que se ha relacionado con el ciclo del hierro (Kulichevskaya, et al., 2014), así como Actinoallomurus y Rhodoplanes, que se relacionan con el ciclo del azufre (Guo, et al., 2015). Las características fisicoquímicas del suelo de bosque, así como los géneros identificados, evidencian la importancia de la actividad microbiana en los ciclos biogeoquímicos.
En suelo DAM prevaleció la presencia de SAV y de metales (Mn, Fe, Pb, Cd, Mg), variables que produjeron un mayor impacto sobre la comunidad bacteriana según el ACC. Esto explicaría la presencia de taxones relacionados con el ciclo del azufre como Povalibacter, capaz de generar ácido sulfhídrico (H2S) a partir de tiosulfato (S2O3 2-) (Nogi, et al., 2014), y Micromonospora, involucrado en la actividad deshidrogenasa reductasa, además de la reducción del nitrato, la fijación del nitrógeno y la reducción del sulfato de amonio en condiciones de escasez de nitrógeno (Trujillo, et al., 2010). Sin embargo, en los sDAM prevalecieron los taxones relacionados con el ciclo del carbono y el nitrógeno, como Parabacteroides, degradador y metabolizador de carbohidratos complejos, además de presentar actividad enzimática malato DHS y glutamato DHS (Sakamoto & Benno, 2006), Paludibacter, que participa en la fermentación de glucosa produciendo acetato, propionato y succinato, además de ser metanogénica (Ueki, et al., 2006), Zhinzhongheella, vinculado con la reducción del nitrato a nitrito y la fermentación de la glucosa (Dong, et al., 2014), Saccharofermentans, que fermenta glucosa produciendo ácido acético, lactato y fumarato (Chen, et al., 2010), y Mangrovibacterium, vinculado con la fijación de nitrógeno y la fermentación de xilosas y ribosas (Huang, et al., 2014).
También se ha reportado con anterioridad que géneros microbianos como Conexibacter, identificado en este estudio, presenta interacción con los metales durante la desasimilación del Fe (Bryan & Johnson, 2008). En resumen, las propiedades fisicoquímicas del DAM tienen impacto en las comunidades bacterianas favoreciendo la adaptación de géneros con resistencia a los metales y los sulfuros. Por otra parte, la presencia del estiércol de vaca en el suelo posiblemente permitió la disponibilidad de materia orgánica como carbono y nitrógeno, favoreciendo la prevalencia de taxones involucrados en estos ciclos biogeoquímicos, lo que evidencia la importancia de las fuentes orgánicas como enmiendas en suelos contaminados con drenaje ácido.
El último grupo revelado por el ACC estaba conformado por las muestras de sDNM en que la humedad y el Ca son las variables ambientales que afectan en mayor medida la comunidad bacteriana. En este grupo se identificaron géneros de bacterias sulfato reductoras y otras relacionadas con el ciclo del Fe. Algunos géneros identificados fueron Acidithiobacillus, el cual es oxidada por el hierro y el azufre utilizándolos como aceptores de electrones hasta generar ácido sulfúrico en condiciones aerobias (Pronk, et al., 1991); Romboutsia, relacionado con la reducción del sulfato en sulfuro liberando acetato y formato (Gerritsen, et al., 2014); Desulfosarcina, reductor de azufre utilizando el sulfito como aceptor de electrones (Gerritsen, et al., 2014), e Ignavibacterium, relacionado con la actividad DHS piruvato y 2-oxoglutarato y la actividad de polisulfuro reductasas (Liu, et al., 2012), además de géneros como Desulfovibrio, el cual es conocido por su capacidad para acumular metales y su actividad sulfato reductora (Da Silva, et al., 2013); Rhodoblastus, que se relaciona con la asimilación del sulfato y el uso de H2 como donador de electrones (Kulichevskaya, et al., 2006); Acidocella, relacionado con la capacidad desasimilatoria del Fe3+ y la resistencia a metales (Coupland & Johnson, 2008); Desulfosarcina y Desulfatirhabdium, que utilizan el acetato como donador de electrones (Balk, et al., 2008). En los sDNM también se identificaron tres géneros bacterianos no cultivados hasta la fecha y registrados como BFO1037, vinculado con la fijación de carbono (Lynn, et al., 2016), D1Q_E02, afín con resistencia a disolventes orgánicos (Kysela, et al., 2009) y T7-125 16S, relacionado con la resistencia de metales (Xie, et al., 2009).
Los microorganismos identificados en este trabajo fueron similares a los encontrados por Pereira, et al. (2015) en suelos afectados por DNM utilizando técnicas de pirosecuenciación. Los géneros pertenecían al filo Proteobacteria con géneros como Acidocella, Desulfosarcina, Acidithiobacillus, Desulfatirhabdium, Rohodoblastus, y Desulfovibrio, al filo Firmicutes con géneros como Rombutsia y Ignavibacterium. Sin embargo, Da Costa, et al. (2016) encontraron que en suelos impactados por DAM prevalecen las bacterias sulfato reductoras. Fue posible encontrar bacterias relacionadas con el ciclo de carbón y nitrógeno por la enmienda de carbón en presencia de estiércol de vaca. Esto ratifica que los cambios fisicoquímicos de los drenajes de mina afectan directamente la estructura, composición y actividad de las comunidades microbianas del suelo y, consecuentemente, los ciclos biogeoquímicos.
Conclusiones
Los drenajes ácidos y neutros de mina producen efectos negativos en el suelo reduciendo la concentración de nutrientes e incrementando la concentración de metales, sulfatos y sulfuros. Estos cambios afectan la actividad de las enzimas como las β glucosidasas, ureasas, fosfatasas ácidas y alcalinas, que están directamente relacionadas con los ciclos biogeoquímicos del carbono y el nitrógeno.
Por otra parte, los factores fisicoquímicos de los suelos afectados por los drenajes registraron mayor concentración de elementos tóxicos e inhibidores enzimáticos, condiciones a las que la composición bacteriana se adapta, registrándose en este caso bacterias involucradas en los ciclos del azufre y el hierro como las bacterias sulfato reductoras, las acidófilas y las oxidadoras de azufre, lo cual se evidenció en el suelo afectado por el drenaje minero neutro. Sin embargo, cuando hay materia orgánica disponible es posible la conservación de bacterias involucradas con el ciclo de nutrientes, lo que permite la eventual enmienda mediante el proceso de biorremediación. Por lo tanto, las propiedades fisicoquímicas de los drenajes producen un efecto directo sobre la estructura, composición y actividad de las comunidades bacterianas del suelo con los consecuentes efectos sobre la condición del ecosistema y su calidad.















