Introducción
Históricamente, los ríos y embalses han sido las principales fuentes de agua potable, alimentación, transporte, irrigación y generación de energía, así como los sistemas de remoción de desechos orgánicos e inorgánicos (Kelly, 1998). Sin embargo, la intervención antrópica ha generado efectos adversos en la calidad del agua de los sistemas acuáticos naturales y artificiales.
Según Roldán & Ramírez (2008), en los centros poblados de la zona andina de Colombia hay aproximadamente 28 embalses cuyas concentraciones de fósforo y nitrógeno presentan un gradiente de estados tróficos que van desde condiciones oligo-mesotróficas hasta hipereutróficas (Servicios Ambientales y Geográficos - SAG, 2015; Universidad Católica de Oriente, 2015). Este gradiente se ve influenciado por el estado de las diferentes cuencas aportantes, el cual varía según la geología de los suelos, las actividades industriales y agropecuarias y los vertimientos de núcleos poblados. En el caso puntual de los embalses analizados, las cuencas de sus principales afluentes, los ríos Guatapé, Nare, La Miel y Porce, evidencian importantes diferencias en cuanto al uso del suelo, la cobertura vegetal y los impactos antrópicos (Vélez, 2007; Arango & Montes, 2009; Arteaga-Carrera, et al., 2011; Centro de Tecnología de Antioquia - CTA & Agencia Suiza para el Desarrollo y la Cooperación - COSUDE, 2013; Consorcio Pomcas Oriente antioqueño, 2017).
La presión antrópica en los ríos colombianos ha aumentado aceleradamente por la creciente urbanización del territorio, la ampliación de las fronteras agropecuarias, las malas prácticas en el uso de agroquímicos y, especialmente, las falencias en el cumplimiento de las normas sobre el tratamiento de las aguas vertidas (Vélez, 2007; Consorcio Pomcas Oriente antioqueño, 2017), lo que ha generado diversas afectaciones en los sistemas lóticos y en los lénticos asociados con ellos, como los embalses, los cuales presentan procesos de acumulación, reciclaje y exportación de material en suspensión y disuelto (nutrientes y contaminantes).
Estos sistemas pueden actuar como lagunas de oxidación, pues una parte de los contaminantes se procesa y no continúa aguas abajo (Hackbart, et al., 2015). La eutrofización es el principal problema en las aguas represadas y el fósforo es el elemento clave para su control (Fraile, et al., 1995). El exceso de nutrientes que llega a los embalses desde las fuentes aportantes favorece el crecimiento de organismos que al morir generan descomposición de materia orgánica, malos olores y la apariencia nauseabunda de las aguas. Además, el proceso de descomposición requiere del consumo de gran cantidad de oxígeno disuelto y las aguas dejan de ser aptas para la vida de los organismos autóctonos del ecosistema (Wang, et al., 1999). Otro problema asociado con el proceso de eutrofización es el aumento de la turbidez y la disminución de la transparencia del agua, causados, entre otras razones, por un exceso en la concentración de fitoplancton (principalmente por floraciones de cianobacterias) y la consecuente disminución de la densidad de otros organismos necesarios para mantener el equilibrio del ecosistema (Giesen, et al., 1990).
La eutrofización puede medirse utilizando diferentes indicadores de calidad del agua y valores numéricos y en función de variables fisicoquímicas o biológicas. En este sentido, el uso de índices ha permitido clasificar y medir el grado de contaminación y eutrofización de lagos y embalses a partir de parámetros estandarizados y modelos estadísticos (Toledo Jr., et al., 1983; Salas & Martino, 1991; Moreno & Ramírez, 2010; Cunha, et al., 2013). En las últimas décadas se han intensificado los esfuerzos para construir modelos que permitan explicar y predecir el impacto de la eutrofización en las comunidades hidrobiológicas (fitoplancton y zooplancton, entre otras) y en las características fisicoquímicas propias de estos sistemas (González, et al., 2011).
Para comprender cómo las comunidades hidrobiológicas (fitoplancton y zooplancton) responden a los cambios en la calidad del agua, especialmente por los procesos asociados a la eutrofización, es necesario crear aproximaciones metodológicas basadas en monitoreos constantes, así como la aplicación de modelos estadísticos multivariados para calcular el nivel de eutrofización a partir de indicadores biológicos o fisicoquímicos de los ecosistemas acuáticos (Tundisi & Matsumura-Tundisi). También es importante considerar la naturaleza de las variables y la heterogeneidad del ecosistema, ya que cada cuerpo de agua y sus particularidades requerirá un modelo que explique la calidad del agua y el nivel de eutrofización. En los embalses estos modelos pueden ser diferentes a los establecidos en ecosistemas naturales debido al efecto del control del pulso de inundación y a la abundante masa de agua que puede actuar como un amortiguador, por lo que los cambios en la condición trófica de dichos sistemas son menores que los observados en sus efluentes en intervalos cortos de tiempo (Álvarez-Góngora & Herrera-Silveira, 2006).
En ese contexto, en el presente estudio se postuló que a partir de variables físicas, químicas y biológicas se podían generar modelos que explicaran el estado trófico de cinco embalses de la zona andina en Colombia.
Materiales y métodos
Fuente de los datos
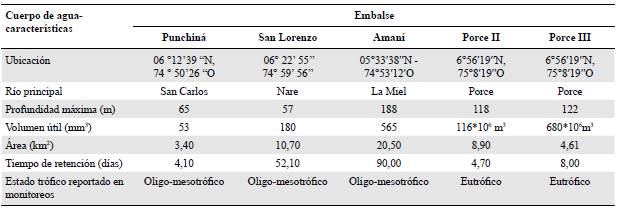
Se analizaron los datos de muestreos realizados entre el 2010 y el 2015 en la zona fótica de la región limnética cercana a la presa de embalses en la zona andina colombiana construidos para la generación hidroeléctrica: Punchiná, San Lorenzo, Amaní, Porce II y Porce III (Tabla 1). Se seleccionó esta región dentro de los embalses, por sus características lacustres y porque sus aguas determinan las características de las que corren después del represamiento.
Los datos suministrados por ISAGEN y Empresas Públicas de Medellín se compilaron en cuatro bases de datos en Excel, las cuales contenían información sobre la densidad de fitoplancton y zooplancton, la concentración de clorofila a y las variables fisicoquímicas. Utilizando el concepto de minería de datos y el paquete dplyr de R, se integraron válidamente las cuatro matrices con el fin de unir toda la información en un archivo plano. Este procedimiento permitió identificar correctamente 11.562 entradas y validar el comportamiento de 22 variables entre cualitativas y cuantitativas.
Indice de estado trófico
Para la determinación del estado trófico de los embalses se empleó el modelo desarrollado por Salas & Martino (1991) para sistemas cálidos tropicales a partir de la concentración de fósforo total. Esta clasificación se considera una de las más adecuadas para determinar la condición trófica de sistemas lénticos tropicales (Cunha, et al., 2013). Dado que el modelo cuantifica la distribución de la probabilidad de ocurrencia de un estado trófico, algunos estados de clasificación se definieron como intermedios, es decir, la probabilidad de ocurrencia entre un estado y otro.
Diseño y análisis estadístico de los datos
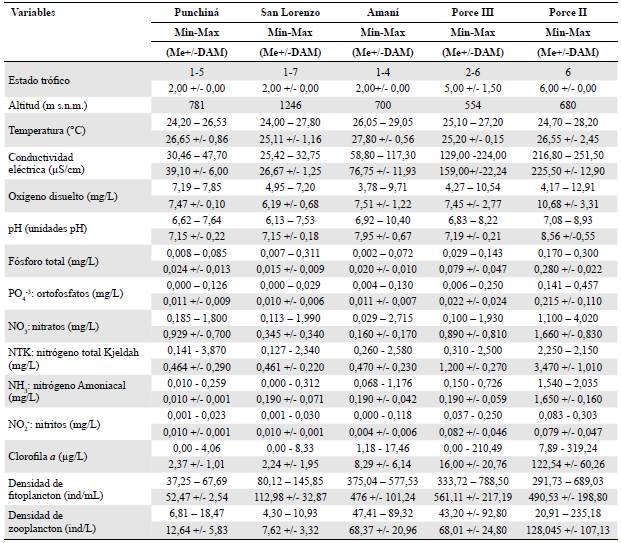
Se hizo un estudio transversal, observacional, descriptivo y retrospectivo (Szklo & Nieto, 2003) con los 8.144 registros válidos. El muestreo no fue equilibrado, pues el número de datos obtenido para cada embalse fue diferente. Se consideraron variables cualitativas (independientes y dependientes) y cuantitativas. La variable cualitativa independiente fue el embalse (1: Punchiná, 2: San Lorenzo, 3: Amaní, 4: Porce II, 5: Porce III) y la variable dependiente cualitativa ordinal, el estado trófico de menor a mayor (1: ultraoligotrófico; 2: oligotrófico; 3: oligomesotrófico; 4: mesotrófico; 5: meso-eutrófico; 6: eutròfico y 7: hipereutrófico). Entre las variables cuantitativas independientes se analizaron las densidades de fitoplancton y zooplancton, la temperatura del agua, la concentración de oxígeno, la conductividad eléctrica, la altura sobre el nivel del mar y las concentraciones de clorofila a, nitratos (NO3), ortofosfatos (PO4 3) y fósforo total (P). Para la presentación final de resultados se seleccionaron aquellas categorías de variables que lograron explicar cerca del 90 % del nivel de eutrofización de los embalses, así como los valores atípicos a partir del criterio de Me +/- 3*IQR (Gotelli & Ellison, 2004)
La relación de las variables se evaluó mediante los rangos de correlación de Spearman. Como variable dependiente se definió el nivel de eutrofización de los embalses y se seleccionaron las variables físicas, químicas y biológicas que presentaron una relación significativa (p<0,05) con la variable de respuesta. Estos análisis se hicieron con el paquete Performance Analytics de R (Peterson, et al., 2014). Las diferencias entre grupos se analizaron mediante pruebas de Kruskall-Wallis y post-hoc de Dunn, con un 95 % de confianza. Todos los análisis estadísticos se ejecutaron en el programa R stats y los paquetes PlotsR, StatR y DOE (Guisande & Vaamonde, 2012).
Para determinar las variables que más influían en el estado trófico, se ejecutó un análisis exploratorio de los datos utilizando un método factorial de componentes principales (ACP). Se seleccionaron las variables que explicaron por lo menos un 80 % de la varianza del ACP en las dos primeras dimensiones y con ellas se construyó un discriminante canónico para encontrar las relaciones lineales entre las variables ambientales que mejor clasificaban los niveles de estado trófico y los embalses (Guisande & Vaamonde, 2012).
Se generó un modelo logistico multinomial (Nizami & Prasad, 2017) para calcular la probabilidad de que un embalse tuviera un determinado nivel de eutrofización, el cual se categorizó de 1 a 7, siendo 7 el nivel máximo. Para el cálculo de los coeficientes del modelo se utilizaron las dos terceras partes de los datos correctamente parametrizados (5.430 datos escogidos al azar) y con el restante tercio (2.714) se hizo la respectiva validación. Además, se optimizó el modelo utilizando el criterio de información de Akaike (AIC). A partir de un árbol de clasificación y regresión (ACYR) se determinaron las variables que discriminaron el 100 % de los casos analizados en los embalses según su estado trófico.
Resultados
A partir de los valores de las medianas, los embalses analizados se clasificaron entre ultra-oligotróficos (1) e hipereutróficos (7), con medianas de fósforo total entre 0,015 y 0,280 mg/L, ortofosfatos entre 0,010 y 0,215 mg/L y conductividad eléctrica entre 26,67 y 225,50 uS/cm, valores registrados en los embalses de San Lorenzo y Porce II, respectivamente. Para una mejor comprensión de los rangos de medianas y la variación de los datos, la Tabla 2 presenta algunas variables fisicoquímicas y bióticas complementarias.
Tabla 2 Valores mínimos, máximos, mediana (Me) y desviación estándar (DAM) de las variables físicas, químicas y biológicas de los embalses estudiados. Estado trófico 1: ultraoligotrófico; 2: oligotrófico; 3: oligomesotrófico; 4: mesotrófico; 5: meso-eutrófico; 6: eutrófico y 7: hipereutrófico
Las correlaciones de Spearman (Figura 1) resultaron significativas y directas del estado trófico y la concentración de fósforo total (r=0,88), los ortofosfatos (r=0,67) y la conductividad eléctrica (r=0,56) y, aunque con correlaciones más bajas pero significativas, también con la concentración de clorofila a (r=0,47), los nitratos (r=0,31), la altitud (r=0,12) y la densidad de zooplancton (r=0,043) (Figura 1).
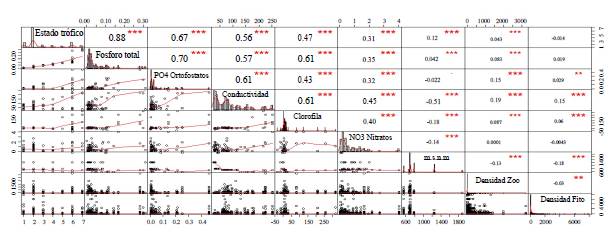
Figura 1 Matriz de coeficientes de correlación de Spearman y valores de p que explican los efectos significativos entre las variables. Los números indican los coeficientes de correlación de Spearman. ***: nivel de significación entre las variables con valores de p<0,05. Los paneles inferiores indican la dispersión entre los dos pares de variables.
Las concentraciones de algunas variables reflejan diferencias significativas entre los estados tróficos (Figura 2A). El oxígeno disuelto fue significativamente menor en el estado hipereutrófico (7), en el que las concentraciones de nutrientes y la conductividad eléctrica fueron significativamente mayores. La clorofila a y la densidad del zooplancton fueron significativamente mayores en los estados mesoeutrófico, eutrófico e hipereutrófico (5, 6 y 7), en tanto que la densidad fitoplanctónica no presentó un patrón claro de diferencia entre los estados tróficos.
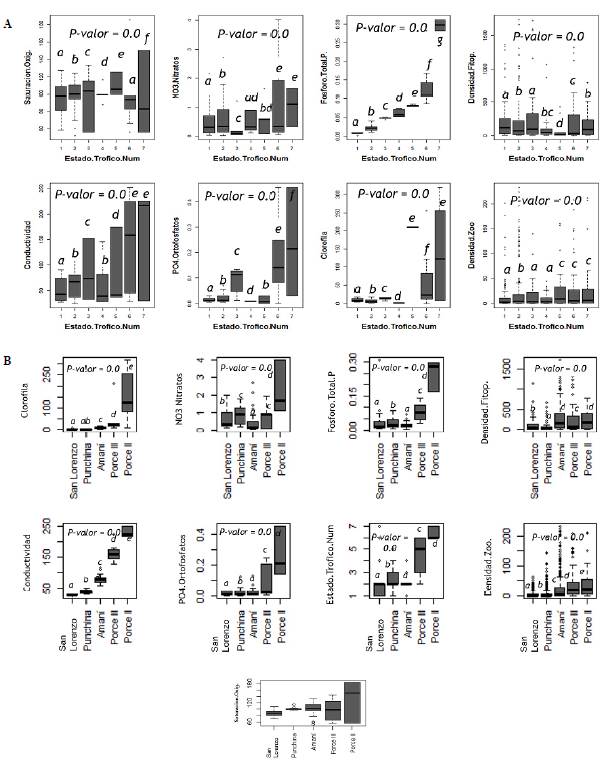
Figura 2 Diagrama de cajas y bigotes que relaciona las variables fisicoquímicas y biológicas cuantitativas con el estado trófico (A) y al embalse analizado (B). Las letras diferentes denotan diferencias significativas entre los estados tróficos.
Los embalses también presentaron diferencias significativas en todas las variables analizadas (Figura 2B), incluida la categoría de estado trófico, en la cual todos presentaron una clasificación diferente. Según las medianas y las desviaciones estándar, San Lorenzo, Punchiná y Amaní se clasificaron como oligotróficos (2), pero con variaciones desde el estado ultraoligotrófico (1) hasta el hipereutrófico (7) en el caso de San Lorenzo, el mesoeutrófico (5) para Punchiná y el mesotrófico (4) para Amaní, en tanto que en Porce II predominó el estado hipereutrófico (7) con variaciones hacia el eutròfico (6) y en Porce III, aunque se clasificó como mesoeutrófico, varió entre oligotrófico y eutròfico (Tabla 2).
Las medianas de las concentraciones de oxígeno disuelto fueron superiores en el embalse de mayor estado trófico, Porce II (10,68+/-3,31), seguido de Amaní (7,51+/-1,22), Punchiná (7,47+/-0,10) y Porce III (7,45+/-2,77). Los embalses de mayor estado trófico, Porce II y Porce III, presentaron concentraciones de ortofosfatos y fósforo total significativamente superiores a las de los demás embalses (Tabla 2).
En los embalses de menor estado trófico, Punchiná y San Lorenzo, se registraron concentraciones significativamente menores de clorofila a y menores densidades de fitoplancton y zooplancton, en tanto que en los de mayor estado trófico, Porce II y Porce III, así como en el embalse Amaní, la clorofila a y estas comunidades fueron más abundantes.
No hubo relaciones significativas entre la densidad del fitoplancton y del zooplancton, pues los modelos de regresión lineal, logarítmico, logistico, de potencia grado 2, exponencial, cuadrático e inverso presentaron coeficientes de correlación inferiores a 0,001.
Según el análisis canónico discriminante, entre las categorías de estado trófico (varianza explicada en el primer eje=93,80 % y validación cruzada=75,05 %), los mayores valores de las variables fósforo total, ortofosfatos, conductividad eléctrica, nitratos y clorofila a lograron explicar el aumento en el estado trófico, en tanto que ni la densidad de fitoplancton ni la de zooplancton tuvieron un efecto significativo en dichos análisis (Figura 3A).
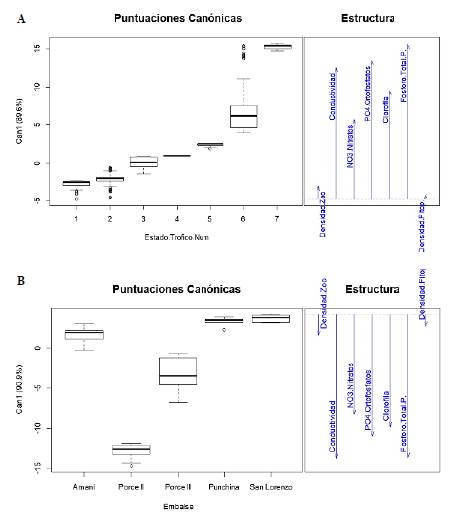
Figura 3 Clasificación de los diferentes estados tróficos (A) y embalses (B) con respecto a las variables fisicoquímicas y biológicas
El discriminante canónico calculado con los datos de los embalses presentó una varianza explicada del 90,9 % en el primer eje y logró identificar correctamente el 86,86 % de los casos estudiados. Dicho análisis arrojó tres grupos: en el primero discriminó el embalse Porce II con el mayor nivel de eutrofización y mayores valores de conductividad eléctrica, fósforo total, ortofosfatos, clorofila a y nitratos. En el segundo separó el embalse Porce III que, aunque con un estado trófico similar a Porce II, presentó valores intermedios de estas variables y, por último, agrupó los embalses Amaní, Punchiná y San Lorenzo, cuyos niveles de eutrofización fueron bajos y presentaron los menores valores de dichas variables (Figura 3B).
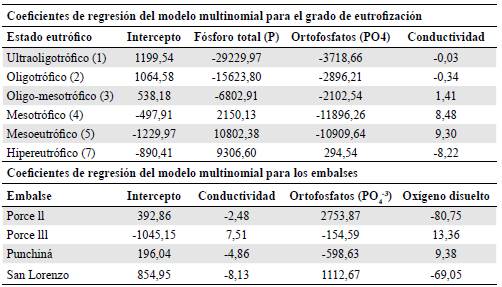
Con el modelo multinomial optimizado bajo el criterio AIC se clasificaron los diferentes estados tróficos en función de los valores de las variables fisicoquímicas con un R2 de 95 %, una validación cruzada del 97,80 % y un AIC de 48,07. Este mismo modelo logró clasificar correctamente el 100 % de los embalses a partir de las principales variables fisicoquímicas, con un AIC óptimo de 40,01 y un R2 de 94 % (Tabla 3). Como en el caso de los análisis de varianza, este modelo evidenció las mayores diferencias entre el nivel eutrófico y el hipereutrófico comparado con las demás clasificaciones de estado trófico.
Tabla 3 Coeficientes de regresión del modelo multinomial para la predicción de la probabilidad de que un embalse se encuentre en un determinado grado de eutrofización a partir de las variables de fósforo total, ortofosfatos y conductividad eléctrica (cuatro iteraciones para un AIC óptimo de 48,07 en el grado de eutrofización y un AIC de 40,01 en el embalse)
El árbol de clasificación y decisión ACYR (Figura 4) evidenció que el modelo podía clasificar el embalse con casi 100 % de probabilidad a partir de los valores de la conductividad eléctrica y de la concentración de oxígeno disuelto. Del 100 % de las muestras analizadas, las que registraron valores de conductividad eléctrica mayores o iguales a 53,00 μS/cm correspondieron a los embalses Amaní, Porce II y Porce III, y en Porce II los resultados fueron superiores o iguales a 225,00 μS/cm. Entre los demás embalses, en Punchiná se presentaron concentraciones de oxígeno mayores a 7,3 mg/L, en tanto que en San Lorenzo se registraron menores concentraciones.
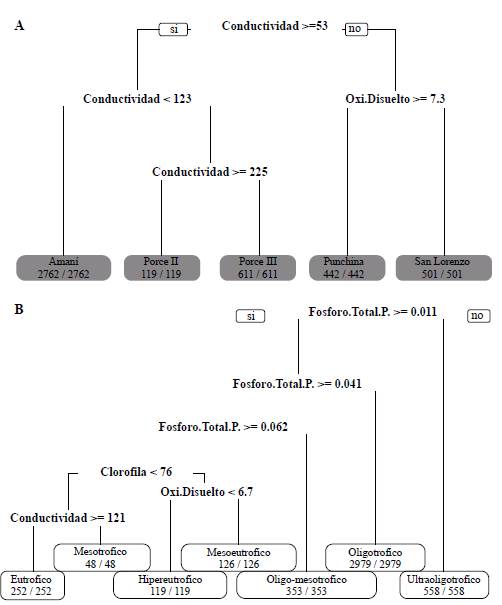
Figura 4 Árbol de clasificación y regresión (ACYR) que permite identificar los estados tróficos (A) y los embalses (B) analizados a partir del modelo multinomial
Asimismo, el modelo estimó con casi un 100 % de certeza el estado trófico de los embalses a partir de las concentraciones de fósforo total, clorofila a, oxígeno disuelto y conductividad eléctrica (Figura 4). Las concentraciones de fósforo total menores a 0,011 mg/L correspondieron a los embalses ultraoligotróficos, aquellas iguales o mayores a dicho valor y menores a 0,041 mg/L, a embalses oligotróficos y las menores a 0,062 mg/L pero iguales o mayores a 0,41 mg/L, a sistemas oligomesotróficos. En el caso de los embalses con concentraciones de fósforo a partir de 0,062 mg/L, valores de cloroila a mayores o iguales a 76 μg/L y concentraciones de oxígeno disuelto superiores o iguales a 6,7 mg/L, se asumió un estado meso-eutrófico, pero si el oxígeno disuelto era menor, se clasificaron como sistemas hipereutróficos, en tanto que las concentraciones de fósforo iguales o superiores a 0,062 mg/L y de clorofila a menores a 76 μg/L correspondieron a sistemas mesotróficos, siempre y cuando la conductividad eléctrica fuera menor a 121 μS/cm, o a sistemas eutróficos cuando la conductividad eléctrica era igual o mayor a dicho valor.
Discusión
El fundamento del manejo de los cuerpos de agua consiste en encontrar las relaciones entre las funciones de fuerza y las variables de estado y usar tal conocimiento para cambiar las funciones de fuerza controladas y lograr el estado deseable del ecosistema (Jorgensen & Vollenweider, 1988). Las propiedades físicas, químicas y biológicas de estos ecosistemas, así como la predictibilidad de sus mecanismos de funcionamiento, deben basarse en información científica y técnica adecuada. Por todo ello, el conocimiento del funcionamiento del ecosistema y la aplicación de la teoría ecológica son cuestiones de interés económico, social y científico (Tundisi & Straskraba, 1999).
Es posible inferir que la carga de nutrientes y la conductividad eléctrica de los principales afluentes de los embalses estudiados determinan en gran medida sus respectivos estados tróficos. Tundisi (1987) considera que los embalses son concentradores y digestores de contaminantes químicos provenientes de la vertiente, así como archivos de información de los eventos ecológicos ocurridos en su área de captación. Por su parte, Román-Botero, et al. (2013) han señalado que en los embalses neotropicales los afluentes naturales condicionan su comportamiento físico y químico, por lo que puede asumirse que el nivel tróico de los principales afluentes de los sistemas analizados determina en gran medida su eutrofización.
El proceso de los aportes desde la cuenca se evidencia claramente en las fuentes abastecedoras de los embalses analizados. Las cuencas de los ríos Guatapé y Nare, que surten a los embalses Punchiná y San Lorenzo, respectivamente, están sujetos a una gran presión por la suburbanización y el desarrollo industrial, agroindustrial y floricultor (Consorcio Pomcas Oriente antioqueño, 2017; Benjumea-Hoyos, et al., 2018). En la cuenca del río La Miel, que abastece el embalse Amaní, se han dado en las últimas décadas procesos de deforestación, colonización y ampliación de la frontera agrícola que han afectado gran parte del área boscosa (Arango & Montes, 2009).
Sin embargo, la presión demográfica sobre estas cuencas es mucho menor que la evidenciada en la cuenca del río Porce, principal abastecedor de los embalses Porce II y Porce III, que recibe las aguas del río Medellín o río Aburrá, una de las corrientes urbanas más afectadas por vertimientos de tipo doméstico e industrial, lo cual le confiere características fisicoquímicas y bióticas clasificadas como de mala calidad (González, et al., 2012; Posada, et al., 2013; Área Metropolitana del Valle de Aburrá, et al., 2016). Esta cuenca recibe corrientes urbanas muy intervenidas y está sometida a gran cantidad de actividades antrópicas a lo largo de su recorrido. Diversos autores han reportado los procesos de deterioro y los aportes de distintas formas de nutrientes en estas corrientes (Giraldo, et al., 2010; Arteaga-Carrera, et al., 2011; CTA & COSUDE, 2013; Posada, et al., 2013). Además, desde hace años las vegas del río Porce (tramo bajo del río Aburrá) se han visto muy afectadas por la explotación minera sin regulación alguna (Otálvaro & Victoria, 2005).
En este sentido, la problemática de los vertimientos y la ausencia de plantas de tratamiento de aguas residuales adecuadas ha resultado en la categorización de las aguas de varios de los ríos del país como peligrosas para uso recreativo, consumo, riego y hábitat de flora y fauna incluso antes de la construcción de los embalses. Ello se evidencia claramente en el Estudio Nacional del Agua, según el cual el caudal de aguas residuales tratado en las plantas de tratamiento a nivel nacional solo llega a un 42,2 % (Instituto de Hidrología, Meteorología y Estudios Ambientales-IDEAM, 2019), plantas que en su gran mayoría presentan deficiencias en los procesos de tratamiento, principalmente de nutrientes elementales como nitrógeno y fósforo, que tan marcada influencia tienen en los procesos de eutrofización.
La Organización para la Cooperación y Desarrollo Económico (OCDE) ha definido la eutrofización como el "enriquecimiento de sustancias nutritivas del agua que generalmente provoca el aumento en la producción de algas y otras plantas acuáticas y el deterioro de la calidad del agua". Así, el incremento de la clorofila a debido al aumento de los nutrientes contribuye al deterioro de la calidad del agua, pues un aumento drástico de la biomasa de productores primarios puede ocasionar el aumento de la turbidez y la consecuente disminución de la transparencia, lo que, en ocasiones, incluso llega a impedir el paso de la luz a los estratos inferiores causando condiciones anóxicas resultantes del consumo de oxígeno que afectan los procesos de descomposición aeróbica, entre otros.
La transparencia, la concentración de clorofila a y las concentraciones de fósforo total, ortofosfatos y nitrógeno total, se consideran como las variables directamente relacionadas con el estado trófico de los sistemas acuáticos, lo cual ha permitido la elaboración de diferentes índices para su cuantificación (Carlson, 1977; Organisation for Economic Cooperation and Development-OECD, 1982; Carlson modificado por Toledo, et al., 1983; Salas & Martino, 1991), ya que se ha establecido claramente que el enriquecimiento con nutrientes, la turbidez y el aumento excesivo del fitoplancton o las macrófitas acuáticas son algunas de las principales causas del deterioro de la calidad del agua (Moreno & Ramírez, 2010). Existen además algunosíndices basados en diferentes atributos del zooplancton como el de Thummark & Nigaard (1949) de Ramírez (2000) y estudios en los cuales se ha logrado relacionar directamente la densidad, la biomasa y la estructura del fitoplancton y el zooplancton con el nivel trófico de algunos embalses tropicales (González, et al., 2002, 2003, 2011; Merayo & González, 2010; Villabona-González, et al., 2015).
Otro resultado relevante en la clasificación del estado trófico de los embalses considerados en este estudio y corroborado por este análisis, es el hecho de que Porce II presenta un nivel trófico mayor que Porce III, pues, por tratarse de embalses en cadena, se puede deducir que Porce II actúa como una trampa de nutrientes, que la turbulencia que ocasiona su operación puede incrementar el oxígeno disuelto en el río, favoreciendo una mayor oxigenación en Porce III, y que la carga de material alóctono y de sedimentos provenientes del río es mayor en Porce II, tal como lo han señalado Toja (1982) y Fraile, et al. (1995) con respecto a embalses en cadena de España y en línea con el planteamiento de Petrere (1996) de que la construcción de embalses en cadena (o cascada) en ríos altamente contaminados (como el río Porce) mejora las condiciones aguas abajo. Resultados similares también fueron registrados por Tundisi, et al. (1991) y Barbosa, et al. (1999) en la cadena de embalses a lo largo del curso medio del río Tietê en Brasil.
Aunque la abundancia de la comunidad planctónica se ha empleado en numerosas ocasiones para evaluar cambios en el estado trófico de los embalses, o como un indicador de dicho estado (Gomes Nogueira, 2000; Calijuri, et al., 2002; De León & Chalar, 2003; González, et al., 2003; Pinto-Coelho, et al., 2005; Seeligmann & Tracanna, 2009), en algunos estudios también se han obtenido resultados similares a los de este. Perbiche-Neves, et al. (2017) hallaron que la densidad de cladóceros no presentó ninguna correlación con el estado trófico de diferentes embalses brasileros y García-Chicote (2015) no halló correlación significativa de la densidad de especies zooplanctónicas con los estados oligotróficos y mesotróficos. Asimismo, Gómez-Luna, et al. (2010) encontraron densidades fitoplanctónicas mucho mayores que las esperadas en embalses con bajas concentraciones de nitrógeno y fósforo total (clasificados como oligotróficos).
El hecho de que las comunidades de fitoplancton y zooplancton no explicaran significativamente el estado trófico de los embalses puede deberse, entre otras razones, a que se usaron datos de densidad y no de biomasa. Esto introduce un sesgo importante en las estimaciones debido al amplio rango que presentan los tamaños celulares en una misma población (variabilidad intraespecífica) o comunidad (variabilidad interespecífica) en ambos grupos (Matsumura-Tundisi, et al., 1989; Echenique & Estévez, 2002). No obstante, aunque no significativa, hubo una tendencia a registrar mayores valores de densidad total de fitoplancton y zooplancton en los sistemas eutróficos e hipereutróficos (Porce III y Porce II), lo que coincide con lo descrito por numerosos autores en las dos últimas décadas en sistemas lénticos tropicales con estados tróficos avanzados (Gomes Nogueira, 2000; González, et al., 2002 y 2003; Calijuri, et al., 2002; Merayo & González, 2010; González, et al., 2011; Gómez-Márquez, et al., 2013; Villabona-González, et al., 2015; López-Muñoz, et al., 2017), por lo que podría sugerirse que un aumento en la densidad, sobre todo en la biomasa, y el predominio de determinadas especies, pueden asociarse con estados de eutrofia e hipereutrofia (Torres-Orozco & Zannatta, 1998).
Los modelos de regresión no evidenciaron relaciones significativas entre las densidades de fitoplancton y zooplancton y, pese a que este resultado se obtuvo con valores de densidad y no de biomasa (que reflejan más adecuadamente la asociación trófica entre estas comunidades), la falta de correlación coincide con lo reportado por Gliwicz (1969) y López-Muñoz, et al. (2016) en sistemas eutróficos (como los embalses Porce II y Porce III) donde el fitoplancton está dominado por componentes que normalmente no son aprovechados directamente por el zooplancton. Asimismo, los vínculos entre el fitoplancton y el zooplancton se hacen más débiles en los sistemas eutróficos (McQueen, et al., 1986), por lo que la relación no es directa, como la observada en la mayoría de los sistemas oligotróficos, en los que las interacciones sí son significativas. Así, al aumentar el estado trófico de los sistemas dulceacuícolas, aumenta la importancia de la red trófica del detritus del que el zooplancton se alimenta en mayor proporción (Gliwicz, 1969; Lampert, 1987).
Conclusiones
Los modelos generados en el presente estudio pudieron utilizarse para establecer el nivel de eutrofización de embalses tropicales tomando como referencia el de mayor grado (Porce II) y desafío ambiental, o el de menor grado (San Lorenzo y Punchiná), cuya contaminación es menor. Así, es posible inferir que los rangos hallados para las variables de conductividad eléctrica (entre 129 y 251,5 μS/cm), fósforo total (entre 0,029 y 0,30 mg/L), ortofosfatos (entre 0,006 y 0,457 mg/L), nitratos (entre 0,1 y 4,02 mg/L) y clorofila a (entre 7,89 y 319,24 μg/L) en los embalses Porce II y Porce III, pueden considerarse claros indicadores de un estado trófico avanzado en otros embalses tropicales andinos con características similares a los analizados. Aunque las variables biológicas explicaron en menor medida el estado trófico, la tendencia a un incremento en la densidad planctónica a medida que aumenta el enriquecimiento permite sugerir que una densidad de fitoplancton entre 291,73 y 788,50 ind/mL, y de zooplancton entre 20,91 y 235,18 ind/L, puede encontrarse en embalses tropicales andinos con estados eutróficos e hipereutróficos como Porce III y Porce II. Sin embargo, puede haber excepciones de embalses principalmente oligotróficos, como Amaní, con rangos similares a estos.
Los modelos estadísticos generados en el presente trabajo permitieron explicar y predecir el estado trófico de los cinco embalses de la zona andina colombiana estudiados, evidenciando que la conductividad eléctrica y los nutrientes, particularmente el fósforo, son los mejores predictores de la eutrofización. Es necesario validar estos modelos en otros embalses tropicales para generar predicciones a una escala más global.
Por último, debe tenerse en cuenta que los datos utilizados provienen de la zona lacustre de los embalses (la más cercana a la presa), que se caracteriza por presentar mayor tiempo de residencia, menores concentraciones de nutrientes y de materiales abiogénicos suspendidos, mayor transparencia del agua y mayor extensión de la zona eufótica, lo que genera una menor productividad primaria volumétrica y mayor tasa de reciclaje de nutrientes, en comparación con las zonas de cola e intermedias. Debe considerarse, entonces, que el estado trófico definido según los parámetros fisicoquímicos y biológicos usualmente cambia desde una condición más "eutrófica" hasta una más "oligotrófica" a lo largo del gradiente de las zonas fluvial, de transición y lacustre de los embalses.
Como recomendación general se sugiere realizar muestreos sistemáticos de las variables fisicoquímicas, especialmente aquellas que resultaron ser las mejores en la predicción del estado trófico de los embalses. Además, es prioritario enfocar los esfuerzos y estudios conjuntos de universidades, empresas y Estado en las cuencas aportantes para recopilar, diagnosticar y modelar información sobre los efectos de los vertimientos que llegan a los afluentes de estos embalses y comparar su situación con la capacidad y efectividad de los tratamientos de vertimientos existentes, con el fin de valorar las cargas de contaminantes producidos, las tratadas, las vertidas y las acciones de las autoridades competentes, entre otros aspectos. Esta información permitirá enfocar los esfuerzos y las inversiones de autoridades y empresas en el manejo adecuado y sustentable de las cuencas y los embalses, lo que redundará en el mejoramiento de la salud de los ecosistemas acuáticos del país y de sus diferentes usuarios.