Introducción
Las cianobacterias, también conocidas como "algas verde-azules" son microorganismos procariotas Gram negativos cuyas numerosas adaptaciones morfológicas y fisiológicas les han permitido colonizar tanto ecosistemas terrestres como acuáticos y ambientes extremos (Svrcek & Smith, 2004; Paerl & Huisman, 2009; Scholz, et al., 2017). Tales adaptaciones comprenden la habilidad de regular su flotabilidad a través de vesículas gaseosas denominadas aerótopos (Kaplan-Levy, et al., 2010), lo que les permite migrar hacia zonas con mayor incidencia de luz o nutrientes o menor penetración de rayos ultravioleta. Además, las masas de cianobacterias flotantes pueden interferir con la radiación del medio acuático y la disponibilidad de CO2, compitiendo con otras algas (Carey, et al., 2012; Huisman, et al., 2018). Debido a su capacidad de fijar nitrógeno a través de células especializadas, denominadas heterocistos, pueden prosperar en ambientes con pocos nutrientes. Algunos géneros unicelulares o filamentosos carentes de heterocisto pueden fijar el nitrógeno en ausencia de oxígeno, lo que les permite obtener el nitrógeno para sus procesos metabólicos en ambientes muy extremos (Litchman, et al., 2010; Srivastava, et al., 2013). Tienen la capacidad de almacenar fósforo intracelularmente y de producir fosfatasas para asimilarlo a partir de compuestos orgánicos (Carey, et al., 2012; Huisman, et al., 2018). Algunas cianobacterias pueden producir células de resistencia (acinetos) que les permiten sobrevivir bajo condiciones desfavorables (Kaplan-Levy, et al., 2010).
Ciertos grupos de cianobacterias pueden producir metabolitos secundarios nocivos o tóxicos llamados cianotoxinas (Svrcek & Smith, 2004; UNESCO, 2009). Algunos de estos compuestos también actúan como sustancias alelopáticas que afectan el desarrollo del fitoplancton y de las plantas acuáticas (Evangelista, et al., 2008).
La biomasa de las cianobacterias puede aumentar significativamente con respecto a la densidad inicial hasta hacerse predominantes en el ecosistema acuático y formar lo que se conoce como una floración algal. El crecimiento rápido de las cianobacterias puede aumentar las concentraciones de metabolitos indeseados y causar cambios en las características físicas y químicas del agua: disminución de la transparencia, disolución de CO2, aumento del pH, y cambios en el color, olor y sabor del agua (Sukenik, et al., 2015; Carmichael & Boyer, 2016; Petcheneshsky, et al., 2017; Huisman, et al., 2018). La floración de especies productoras de toxinas puede ocasionar daños importantes, e incluso la muerte, a una gran diversidad de organismos en el ecosistema, incluido el ser humano (Rastogi, et al., 2015; Huisman, et al., 2018), pues las cianotoxinas pueden acumularse en los vertebrados e invertebrados acuáticos que las han ingerido (Buratti, et al., 2017). La exposición puede darse por el consumo de agua o comida contaminada, la inhalación, el contacto con la piel y la ingestión como parte de la dieta (Svrcek & Smith, 2004; Rastogi, et al., 2015).
Las floraciones de cianobacterias, especialmente las floraciones nocivas, constituyen un problema importante por sus implicaciones para los ecosistemas y la salud. El primer registro mundial de sus efectos tóxicos ocurrió en 1878 en Australia, a raíz de la mortandad de animales que habían tomado agua del lago Alexandria, donde había una floración de Nodularia spumigena Mertens ex Bornet & Flahault (McGregor, et al., 2012). También se han reportados casos de muerte de personas por ingestión directa de aguas con toxinas (Azevedo, et al., 2003).
En algunos estudios se ha evidenciado el aumento progresivo de los problemas asociados con las floraciones de cianobacterias durante los últimos años (Ndlela, 2016), con el consecuente incremento en el número de investigaciones relacionadas con la identificación de toxinas y el efecto sobre los ecosistemas y la salud humana (Carmichael & Boyer, 2016). Los países de la Unión Europea, Estados Unidos, Australia y Argentina cuentan con protocolos para su manejo (Huisman, et al., 2018; Autoridad Interjurisdiccional de las Cuencas de los Ríos Limay Neuquén y Negro, 2014). En Colombia, a pesar de la gran diversidad de ecosistemas acuáticos, no existe un registro sistemático de las floraciones de este tipo de algas, como tampoco normas estatales que permitan reportar los casos e implementar y hacer seguimiento de medidas de control y manejo. En este sentido, el objetivo de esta revisión fue analizar el estado actual del conocimiento sobre las floraciones tóxicas de cianobacterias en el país y las expectativas ante el cambio climático global.
Principales tipos de toxinas
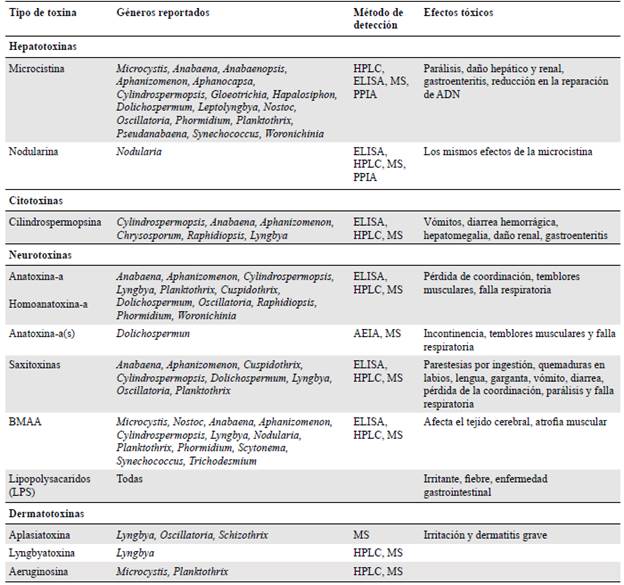
Las cianotoxinas se clasifican químicamente en péptidos cíclicos, alcaloides y lipo-polisacáridos (Kaebernick & Neilan, 2001), pero se conocen y clasifican principalmente por su efecto toxicológico (Tabla 1) en: 1) hepatotoxinas, que atacan el sistema hepático y pueden ocasionar la muerte en horas o días; 2) neurotoxinas, que afectan la transmisión neuromuscular y pueden provocar la muerte por parálisis muscular y falla respiratoria, y 3) dermatotoxinas, que causan irritación en la piel (Elliott, 2012; Merel, et al., 2013; Carmichael & Boyer, 2016; Cantoral-Uriza, et al., 2017). A continuación, se describen algunas de las toxinas que potencialmente están presentes en Colombia.
Microcistinas
Las microcistinas son heptapéptidos cíclicos, hidrosolubles, y hepatotóxicos de gran diversidad química, por lo que no se sabe con precisión la cantidad de variedades existentes; las registradas actualmente son 279 (Bouaicha, et al., 2019). Una cepa de una especie de cianobacteria puede producir más de una variante a la vez, la más común y letal es la microcistina-LR (Vela, et al., 2007; Zaccaroni & Scaravelli, 2008; Buratti, et al., 2017; Funari, et al., 2017; Silva, et al., 2018). La microcistina-LR es producida principalmente por Microcystis, una cianobacteria de amplia distribución causante de la mayoría de las floraciones tóxicas alrededor del mundo. Sin embargo, otros géneros de algas planctónicos y bentónicos pueden producir esta toxina, aunque en niveles más bajos (Almanza, et al., 2016; Mendoza, 2016). Microcystis forma densas masas macroscópicas en la superficie del agua gracias a sus aerótopos (Vela, et al., 2007; Almanza, et al., 2016). En los seres humanos esta toxina puede causar síntomas como vómito, diarrea, debilidad, dificultad para respirar y temblores musculares (Svrcek & Smith, 2004; Roegner, et al., 2014).
Anatoxinas-A
Es un alcaloide bicíclico neurotóxico que imita la acción de la acetilcolina. Es producida comúnmente por Anabaena, Dolichospermum, Cuspidothrix, Phormidium, Oscillatoria, Tychonema y Cylindrospermum (Ballot, et al., 2018). La exposición a la anatoxina-a produce pérdida de coordinación, salivación profusa, temblores y convulsiones y puede ocasionar la muerte por parálisis muscular y falla respiratoria (Svrcek & Smith, 2004; Testai, et al., 2016; Petcheneshsky, et al., 2017).
Cilindrospermopsina
Es un alcaloide tricíclico soluble en agua y citotóxico que bloquea la síntesis de proteínas. Es producido principalmente por Cylindrospermopsis raciborskii (Woloszynska) Anagnostidis & Komárek, una cianobacteria tropical ampliamente distribuida (Zaccaroni & Scaravelli, 2008). Podría tener actividad mutágena y carcinógena y tiene efectos tóxicos en una gran variedad de organismos, incluidos protozoos, plantas, invertebrados y vertebrados. Sus principales síntomas son vómito, diarrea hemorrágica, dolor abdominal, y daño hepático y renal, y actúa sobre los tejidos del sistema vascular, los músculos y el tracto intestinal (de la Cruz, et al., 2013; Petcheneshsky, et al., 2017; Huisman, et al., 2018).
Factores que promueven el desarrollo de floraciones de cianobacterias
Aunque los eventos de floración de cianobacterias se reportan desde hace más de 130 años, han aumentado en las últimas décadas (O'Neil, et al., 2012). Inicialmente se consideró que se debían principalmente a la eutrofización, sin embargo, en la última década se ha documentado que las floraciones son controladas por múltiples factores: incremento en la temperatura del agua, cambios en la estructura de la cadena trófica, aumento del CO2 y modificaciones en la dinámica hidráulica de los ecosistemas. Todos estos factores son potenciados por los efectos del cambio climático global que influyen directamente en la frecuencia, intensidad y duración de las floraciones (Paerl & Huisman, 2009; Paerl & Paul, 2012; Chapra, et al., 2017). La mayor parte de los estudios se centra en las cianobacterias planctónicas, no obstante, las cianobacterias bénticas pueden desarrollar extensas floraciones con potencial tóxico y los factores que las modulan están relacionados principalmente con los nutrientes y la temperatura (Catherine, et al., 2013).
Incremento de la temperatura del agua
Hay evidencias de que el calentamiento se relaciona con el aumento de casos de floraciones de cianobacterias (Paerl & Huisman, 2009; Sukenik, et al., 2012; Paerl, 2014; Hamilton, et al., 2016; Chapra, et al., 2017). Varias especies logran su máxima tasa de crecimiento a temperaturas superiores a los 25 °C (Paerl, 2014; Huisman, et al., 2018), por lo que pueden proliferar durante olas de calor (Jöhnk, et al., 2008). Más allá de la relación entre la temperatura y la tasa metabólica de las cianobacterias, el aumento de la temperatura promueve una estratificación más marcada y prolongada, así como una mayor estabilidad en la columna de agua, facilitando el desarrollo de las cianobacterias. Incluso en lagos polimícticos, la poca velocidad del viento en algunos momentos del año puede tener un papel más decisivo que la temperatura al favorecer largos periodos de estabilidad térmica (Huber, et al., 2012). Por otro lado, las temperaturas más altas disminuyen la viscosidad del agua, lo que a su vez aumenta la difusión de nutrientes hacia la superficie de la célula, favoreciendo el desarrollo algal (Peperzak, 2003).
Varios taxones de cianobacterias potencialmente tóxicas han expandido sus rangos geográficos debido al aumento de la temperatura (Sukenik, et al., 2015). Las cianobac-terias pueden colonizar nuevos ambientes y expandirse fácilmente debido a varios de sus rasgos funcionales. Uno de los ejemplos mejor registrados es el de Cylindrospermopsis raciborski, una especie de regiones tropicales que ha colonizado zonas templadas (Paerl & Huisman, 2009). Las especies de Nostocales formadoras de floraciones también tienen una capacidad invasiva muy alta por su habilidad de fijación de nitrógeno (Sukenik, et al., 2012).
Eutrofización
El aporte de nutrientes a los ecosistemas acuáticos es, tal vez, el principal factor asociado con la incidencia de floraciones por cianobacterias (O'Neil, et al., 2012). En un gran número de estudios se ha demostrado la relación entre los procesos de eutrofización y la frecuencia y magnitud de los eventos de floración (Jõhnk, et al., 2008; Paerl & Huisman, 2008; Rigosi, et al., 2014; Paterson, et al., 2017). Aunque el fósforo se considera el principal nutriente limitante de la productividad primaria, tanto este como el nitrógeno pueden inducir florecimientos algales. Las concentraciones elevadas de fósforo favorecen floraciones de géneros fijadores de nitrógeno, en tanto que los medios ricos en nitrógeno y fósforo favorecen a los géneros sin heterocistos, por ejemplo Microcystis y Planktothrix (Paerl & Otten, 2013).
El principal causante de eutrofización es el vertimiento directo de aguas enriquecidas provenientes de zonas urbanas o de actividades industriales y agropecuarias. El exceso de nutrientes en la cuenca y el clima pueden interactuar para potenciar las floraciones. Así, los eventos climáticos con precipitaciones intensas movilizan nutrientes desde la cuenca, los cuales enriquecen los cuerpos de agua y favorecen el desarrollo de floraciones (Huisman, et al., 2018). Las sequías prolongadas disminuyen la carga de nutrientes por arrastre desde la cuenca, pero pueden promover condiciones para que estos sean reciclados desde el fondo del ecosistema. Los periodos prolongados con hipoxia en las capas de agua profundas favorecen la liberación de fósforo desde el sedimento, razón por la que en lagos con historias de eutrofización, la reserva de nutrientes en los sedimentos puede mantener las floraciones algales, aunque los vertimientos estén controlados (Zapata, et al., 2009). En lagos profundos, el crecimiento de las cianobacterias generalmente lleva a un agotamiento de las formas solubles de los nutrientes, por lo que estas acumulan en su biomasa los nutrientes y reducen la posibilidad de ser desplazadas por otros grupos de algas.
Estabilidad física de la columna
Las variaciones hidráulicas y el tiempo de residencia del agua pueden controlar de forma importante la dominancia de cianobacterias en los sistemas lénticos (Paerl & Huisman, 2008; Wagner & Adrian, 2009; Mihaljevic & Stevic, 2011). Los cambios en la tasa de renovación hídrica podrían mitigar las floraciones (Bakker & Hilt, 2016).
Las cianobacterias que usualmente desarrollan floraciones tienen estrategias muy definidas para ser exitosas en ambientes físicamente estables. Por esta razón, los cambios repentinos en la tasa de retención hídrica pueden controlar el desarrollo de las floraciones.
Una de las consecuencias del cambio climático es el cambio en la estacionalidad de lluvias en el Neotrópico (Marengo, et al, 2010). Las sequías prolongadas ocasionan el aumento en el tiempo de residencia del agua, promoviendo el desarrollo de floraciones (Romo, et al., 2012; Jeppesen, et al., 2015; Brasil, et al., 2016). El desarrollo de las floraciones no necesariamente requiere una elevada estabilidad física. Algunas especies de cianobacterias pueden desarrollar florecimientos incluso en ambientes sometidos a fuertes vientos y con baja profundidad (Zapata, et al., 2009). En otros casos, en ambientes moderadamente inestables y turbios también puede haber florecimientos debido a los rasgos biológicos de las especies. Así, por ejemplo, Cylindrospermopsis y Planktolyngbya pueden adaptarse a ambientes muy turbios (Soares, et al., 2013), en tanto que Microcystis prefiere aguas bien estratificadas y con gran disponibilidad de luz (Johnk, et al., 2008).
Aumento de CO 2
Las cianobacterias poseen varios mecanismos para asimilar el bicarbonato y el dióxido de carbono. El incremento del CO2 atmosférico puede promover la proliferación de ciano-bacterias en la superficie de un cuerpo de agua, pues lo pueden tomar directamente de la atmósfera aunque se reduzca la concentración en el agua, desplazando por competencia a otras especies (McGregor, et al., 2012). La gran demanda de CO2 también puede causar que el pH supere las 10 unidades, condición a la que algunas especies de cianobacterias también pueden adaptarse gracias a que utilizan el bicarbonato como fuente de carbono (Paerl & Paul, 2012; Visser, et al., 2016; Huisman, et al., 2018).
Cambios en la red trófica
Los cambios en el control de arriba hacia abajo (top-down) de las algas por el zooplancton pueden ocasionar un aumento de la biomasa de las cianobacterias (Pick, 2016). Las cianobacterias son seleccionadas negativamente por los filtradores, posiblemente por su baja calidad nutricional (Pick, 2016), y por la producción de toxinas (Paerl & Paul, 2012), favoreciendo el desarrollo de las floraciones (Newell, 2004; Paerl & Otten, 2013). Por otro lado, los organismos zooplanctívoros pueden disminuir la población de herbívoros y aumentar, por lo tanto, las densidades de algas (Paerl & Paul, 2012). El aumento en la temperatura del agua también puede promover cambios en la interacción trófica y facilitar el crecimiento de las cianobacterias. Así, el aumento de la temperatura permite que los rotíferos sean más vulnerables a las anatoxinas (Gilbert, 1996).
Floraciones de cianobacterias en ecosistemas intertropicales
Aunque cada vez hay más información que permite entender las floraciones de cianobacterias, la información sobre los ecosistemas de la zona intertropical es escasa en comparación con la de las zonas templadas (Mowe, et al., 2015; Cantoral-Uriza, et al., 2017). En América del Sur las floraciones se han subestimado debido a la falta de registros y del monitoreo deficiente, aunque la mayoría de fuentes de agua potable proviene de aguas superficiales sometidas a presiones de eutrofización (Dorr, et al., 2010).
Uno de los casos más relevantes de intoxicación por floraciones de cianobacterias ocurrió en Caruaru (Brasil) en 1996, cuando 52 pacientes de diálisis murieron debido a que el agua usada en el procedimiento se encontraba contaminada con microcistinas (Azevedo, et al., 2003). Otro caso importante ocurrió en Palm Island (Australia) en 1979, donde 148 personas sufrieron hepatoenteritis porque el agua contenía grandes cantidades de C. raciborskii (Hawkins, et al., 1985). Estos casos obligaron a Brasil y Australia a desarrollar estudios sobre los florecimientos tóxicos (Mowe, et al., 2015) y a formular protocolos para su seguimiento y manejo. En la zona intertropical, las floraciones más frecuentes son de Microcystis y Cylindrospermopsis. En África y Asia Microcystis es más frecuente, en tanto que en Australia Cylindrospermopsis es más frecuente y en América ambos géneros presentan frecuencias semejantes (Mowe, et al., 2015).
La formación y mantenimiento de floraciones de cianobacterias en la zona intertropical podría seguir patrones distintos a los de zonas templadas debido a las características térmicas y lumínicas (Chorus & Bartram, 1999). En la zona ecuatorial las cianobacterias tienden a ser abundantes y dominan en aguas con altas temperaturas (Duong, et al., 2013; Dalu & Wasserman, 2018) y permanecen durante todo el año (Petcheneshsky, et al., 2017). La causalidad entre el enriquecimiento por nitrógeno y fósforo y la relación estequiométrica entre estos dos nutrientes es un tema que aún no se ha dilucidado en zonas tropicales. La mayor temperatura y el alto déficit de oxígeno en los ecosistemas tropicales resultan en que el nitrógeno sea el nutriente limitante (Lewis Jr., 2000; Moss, et al., 2013), por lo que los medios ricos en fósforo contribuyen a que aumenten las densidades de cianobacterias fijadoras de nitrógeno (Moss, et al., 2013; Brasil, et al., 2016). No obstante, en los lagos tropicales la eutrofización suele estar más influenciada por la fertilización en las cuencas y tanto el nitrógeno como el fósforo ingresan en exceso al ecosistema, por lo que las especies dominantes en las floraciones responden principalmente a la turbulencia y la disponibilidad de luz (Reynolds, et al., 2002). La forma en que las cianobacterias responden a estos condicionantes físicos y químicos en lagos tropicales es un tema que debe resolverse pronto, especialmente teniendo en cuenta que en el futuro estos ecosistemas estarán más expuestos a una marcada estacionalidad de las lluvias (Marengo, et al., 2010; Sarmento, et al., 2013).
Estado del conocimiento en Colombia
Algunas revisiones sobre las floraciones en Sudamérica y el trópico revelan que la información disponible para los países de Latinoamérica y Colombia específicamente, es escasa (Dôrr, et al, 2010). Aunque en el país hay registros de varios géneros potencialmente tóxicos en el Global Biodiversity Information Facility (GBIF) y en el Sistema de Información de Biodiversidad (SIB), hay pocos registros oficiales, publicaciones científicas y estudios relacionados con su toxicidad (Mancera & Vida, 1994; Zapata, et al., 2009; Puyana, et al., 2015). Si bien existen más reportes en trabajos de pregrado y posgrado no publicados (Tabla 1S, https://www.raccefyn.co/index.php/raccefyn/article/view/1050/2740), en general son muy pocas las investigaciones adelantadas en Colombia, seguramente debido a las dificultades taxonómicas, la falta de recursos y de grupos de investigación dedicados a estudiar su ecología y los riesgos potenciales para la salud humana y del ecosistema. Uno de los primeros casos bien documentados en Colombia fue el de la mortandad de peces en la Ciénaga Grande de Santa Marta en 1994 (Mancera & Vidal, 1994). En ese año se presentaron tres eventos de mortandad entre julio y agosto, los cuales se correlacionaron con una floración de cf. Anabaenopsis sp. Los autores también citan los estudios de Mercado (1971) y Bula (1985) en los que se reportan eventos similares en la Ciénaga Grande asociados con la gran abundancia de Anabaena circinalis Rabenhorst ex Bornet & Flahaulty Nostoc commune Vaucher ex Bornet & Flahault. Más recientemente, en el 2014 y el 2015, ha habido registros de floraciones de cianobacterias y mortandad de peces en la Ciénaga Grande (Ibarra, et al, 2014; INVEMAR, 2015a, 2015b).
La mayor parte de los avances e investigaciones sobre floraciones de cianobacterias en Colombia se han realizado en el departamento de Antioquía, en los embalses de Ríogrande II, Abreo-Malpaso, El Peñol-Guatapé y Playas. El embalse Ríogrande II provee de agua al 40 % de la población de Medellín (Palacio, et al., 2015a; Palacio, et al., 2015b). En este embalse se registró por primera vez en zona tropical la cianobacteria potencialmente tóxica Dolichospermum lemmermannii (Richter) P.Wacklin, L.Hoffmann & J.Komárek, asociada con D. lemmermannii. También se registran otras especies potencialmente tóxicas de los géneros Aphanocapsa, Woronichinia y Microcystis. A partir de los estudios en este embalse se han implementado técnicas moleculares para la detección de cianobacterias (Hurtado-Alarcón & Polanía-Vorenberg, 2014) y se ha evaluado la reducción de la microcistina-LR a través de sistemas sedimentarios (Herrera, et al., 2015). Recientemente se hizo un estudio en los embalses Abreo-Malpaso, El Peñol-Guatapé y Playas en el que se registraron los géneros potencialmente tóxicos Woronichinia, Aphanocapsa y Oscillatoria, además del complejo Microcystis y la especie Radiocystis fernandoi. En el estudio se categorizan los embalses según los niveles de riesgo por la proliferación de cianobacterias y se sugiere el establecimiento de medidas de control y prevención de floraciones (Palacio, et al., 2019).
En ecosistemas acuáticos de montaña el seguimiento más completo se hizo a una floración prolongada de Woronichinia fusca (Skuja) Komárek & Hindák en el humedal Juan Amarillo (Bogotá), entre el 2004 y el 2007 (Zapata, et al., 2009). Pese a la poca profundidad y la alta exposición al viento, en este humedal se presentan valores muy altos de fósforo que promueven el dominio de las cianobacterias. En el embalse La Regadera (Bogotá) se registró el predominio de Dolichospermum solitarium (Klebahn) Wacklin, L.Hoffmann & Komárek durante el periodo de máxima estabilidad térmica en el 2004 (León, et al., 2012).
En cuanto a los ecosistemas marinos, se han reportado floraciones de cianobacterias bénticas y planctónicas en los sistemas de arrecifes de la isla Providencia (Puyana, et al., 2015). En muestreos realizados en el 2009, el 2010 y el 2012, se reportó que las cianobacterias cubrían hasta 4,2 Km2 de los complejos de arrecifes, con un cubrimiento entre un 18 y 72 % de los sustratos.
Los otros estudios desarrollados en Colombia corresponden a investigaciones de la dinámica del fitoplancton con predominio del grupo de las cianobacterias en los que se registró algún tipo de floración y se dio cuenta de su rol importante dentro del ecosistema, como es el caso de la Ciénaga Grande de Santa Marta y los humedales de la depresión momposina (De la Hoz, 2004; Plata-Díaz & Pimienta-Rueda, 2011). En el caso de la depresión momposina (departamento de Bolívar) se reportaron algunos humedales con gran abundancia de C. raciboskii (Plata-Díaz & Pimienta-Rueda, 2011). Asimismo, en la ciénaga de Ayapel (departamento de Córdoba), en épocas de aguas bajas, las ciano-bacterias aumentan sus densidades y llegan a formar floraciones, especialmente de C. raciboskii y Planktolyngbya limnetica (Lemmermann) Komárková-Legnerová & Cronberg (Jaramillo-Londoño & Aguirre-Ramírez, 2012; Montoya-Moreno & Aguirre, 2013). Otros trabajos se han centrado en identificar las cianobacterias potencialmente tóxicas en los humedales del antiguo delta del río Sinú (Mogollón, et al., 2014), o en sistemas de tratamiento de aguas residuales (Rivera González & Gómez Gómez, 2010).
Discusión y conclusiones
Las floraciones de cianobacterias son un problema que afecta a ecosistemas acuáticos en todo el mundo debido a su estrecha relación con los factores asociados al cambio climático global. Entre estos factores, la eutrofización y el aumento de la temperatura del agua son problemas crecientes en Colombia. Al revisar la distribución espacial de los escasos reportes de la presencia de algas potencialmente formadoras de floraciones tóxicas en el país, estos coinciden con las zonas del país con un mayor índice de presión de fósforo (IDEAM, 2015) en las aguas superficiales (Figura 1). Según el mapa de presión de fósforo, existen muchas áreas con un alto potencial de desarrollo de floraciones algales en las cuencas de los ríos que transcurren a través de áreas urbanas, pero también en áreas de desarrollo agrícola y ganadero.
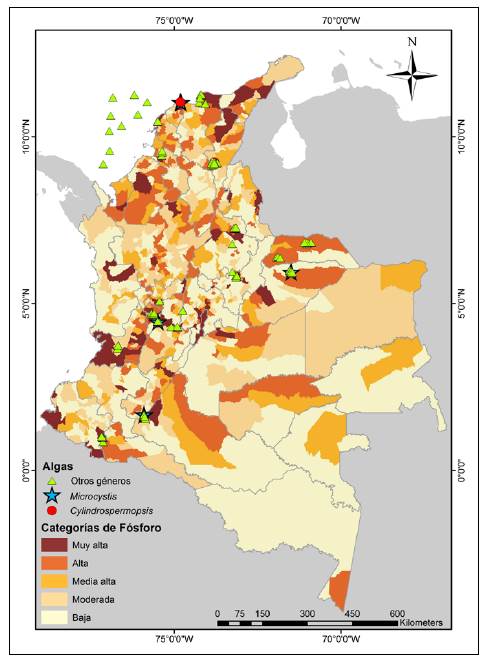
Figura 1 Mapa de presión estimada de fósforo total (adaptado de IDEAM, 2015) con el registro de géneros potencialmente tóxicos presentes en Colombia (Microcystis, Cylindrospermopsis, Anabaena, Aphanocapsa, Leptolyngbya, Lyngbya, Nostoc, Oscillatoria, Phormidium, Planktothrix, Pseudanabaena, Raphidiopsis, Scytonema, Synechococcus)
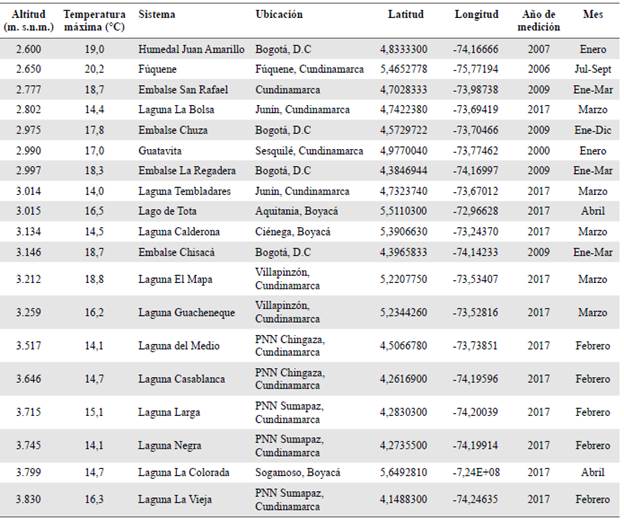
La temperatura media ambiental en la mayor parte de Colombia es alta, condición que favorece el desarrollo de floraciones en casi todas las tierras bajas del país. No obstante, las zonas de montaña también están expuestas a un gran riesgo debido al aumento proyectado en la temperatura. En la zona andina colombiana, en la franja altitudinal entre los 2.500 y los 3.500 m s.n.m., se espera que en el año 2100 la temperatura aumente entre 3,5 y 4 °C (Bradley, et al., 2006). Cuando se analizan los actuales valores de temperatura del agua superficial de ecosistemas acuáticos de montaña durante el periodo de mayor radiación (Tabla 2), se observa que un incremento de 4 °C podría llevar a que en muchos de ellos se superen los 20 °C. A partir de este valor, muchas de las especies potencialmente generadoras de floraciones tóxicas presentan tasas de crecimiento elevadas y una gran capacidad competitiva.
Tabla 2 Valores de temperatura máxima superficial del agua registrada en lagos de montaña de la Cordillera Oriental. Valores tomados de varias fuentes: López, et al., 2012; Rivera-Rondón, et al, 2008; Zapata, et al, 2006; Zapata, et al, 2009) y de datos inéditos de los autores
Otro aspecto a tener en cuenta es la respuesta de las cianobacterias a la radiación UV. En varios estudios se documenta que la exposición a la radiación UV tiene implicaciones sobre los organismos fotosintéticos, y las cianobacterias han desarrollado diversos mecanismos que les permiten tolerar y sobrevivir a este tipo de estrés, lo que las hace más competitivas en ambientes con alta radiación. Algunas de las estrategias que exhiben incluyen la motilidad, la formación de densas masas, los cambios en su morfología, la síntesis de polisacáridos extracelulares, así como los cambios en su metabolismo para producir moléculas antioxidantes, la síntesis de sustancias de protección como las micosporinas, scitoneminas, los mecanismos de activación de la reparación del ADN y la síntesis de proteínas, entre otros (Srivastava, et al., 2013; Rastogi, et al, 2014; Rastogi & Madamwar, 2015; Pattanaik, et al., 2007). En el caso de Colombia se debe tener en cuenta que por su ubicación en la zona tropical la incidencia de rayos UV es más alta, especialmente en las zonas de alta montaña (IDEAM, 2017). Estas condiciones podrían favorecer a las cianobacterias con respecto a otros grupos de algas.
El énfasis en el estudio de este tipo de factores contribuirá de manera significativa a entender mejor el comportamiento de las floraciones algales y a crear mejores estrategias de gestión de los ecosistemas afectados. El monitoreo frecuente, o por lo menos un estudio espacialmente amplio sobre la relación entre la calidad del agua y la presencia de cianobacterias en el territorio colombiano, es una prioridad. Las repercusiones de este tipo de floraciones van más allá de la afectación directa del agua destinada al consumo. Las floraciones tóxicas de cianobacterias pueden afectar comunidades de peces y otros organismos y, por ende, la productividad pesquera modificando la estructura trófica de los ecosistemas acuáticos.
Otro de los problemas que requiere una solución prioritaria es la falta de un sistema de registro de los casos de floraciones. Si bien cada día existe una mayor conciencia sobre los problemas de la calidad del agua en el país, el reconocimiento en los medios de comunicación de los casos de floraciones y la identificación de estas aún es incipiente (Tabla 2S, https://www.raccefyn.co/index.php/raccefyn/article/view/1050/2741). Debido a las implicaciones en la salud humana en el corto y largo plazo (acumulación de toxinas), la opinión pública debería estar informada; en este sentido, los pequeños acueductos son los más vulnerables por la desinformación. La educación ambiental tiene un papel muy importante frente al cambio climático global. El desarrollo de un protocolo estatal que oriente sobre la identificación de las especies y la evaluación del riesgo de toxicidad podría garantizar un rápido avance en la investigación y el desarrollo de medidas que permitan reducir el impacto de las floraciones, pero, sobre todo, apoyaría la formulación de una política integral del recurso hídrico en Colombia que permita un adecuado manejo de este problema.