Introducción
Las comunidades de fitoplancton son muy diversas y difíciles de predecir en Kruk, et al. (2009); constituyen, además, una fuente importante de alimento y un excelente modelo para interpretar procesos ecológicos como la fotosíntesis, la productividad, el ciclo del oxígeno, el carbono y las relaciones asociadas con la transferencia de energía (Hutchinson, 1967; Reynolds, 1984; Harris, 1986; Sommer, 1985; Sommer, 2012; Hilton, et al, 2006; Qu, et al., 2019; Ptacnik, et al., 2008; Rousseaux & Gregg, 2014), que se abordan principalmente a partir de la taxonomía, la diversidad del tamaño y la morfología (Huszar & Caraco, 1998; Bonilla, et al., 2005; Borics, et al., 2007; Rosati, et al., 2017).
En particular la diversidad morfométrica puede estar relacionada con las adaptaciones fisiológicas y la disponibilidad de recursos y energía (Margalef, 1958; Devercelli, 2006; Menezes, 2010; Soares, 2010). La conformación de grupos morfológicos funcionales asociados con base en diversas condiciones ambientales fue propuesta por Hutchinson (1961) y ampliada por Reynolds (1984, 1984a, 1988, 1995, 1997) y Reynolds, et al. (2002). Este enfoque se basa en aspectos de la vegetación terrestre que agrupan a las especies según su capacidad para captar la luz y adquirir y conservar los recursos minerales (Grime, 1979; Menezes, et al., 2010; Garnier & Navas, 2012; Kattge, et al., 2011; Violle, et al., 2014). Estos aspectos se han asociado con variaciones morfométricas (volumen, superficie, relación superficie-volumen y dimensión lineal máxima), características fisiológicas tales como las tasas metabólicas y de crecimiento, la cinética de incorporación de nutrientes y la captación de luz, con aspectos evolutivos relativos al tipo de estrategia selectiva utilizada (r-seleccionado y k-seleccionado), y con las características ambientales (patrón de mezcla, situación latitudinal y altitudinal, y estado trófico, entre otras).
En las escalas espacial y temporal la asociación de especies puede darse como un consorcio de genotipos con propiedades bioquímicas o fisiológicas diferentes (Kruk, et al., 2002; Reynolds, et al., 2002; Huszar, et al., 2003; Abonyi, et al., 2014; Salmaso, et al., 2007). Bouvy, et al. (2006) consideran que un enfoque funcional basado en propiedades morfológico-ecológicas puede utilizarse como un método cuantitativo para describir los aspectos sucesionales del ensamblaje fitoplanctónico.
Dado que el fitoplancton se dispersa relativamente bien en el espacio, hasta el punto de que sus especies se consideran cosmopolitas, se espera que los grupos se formen principalmente como resultado de las perturbaciones locales de frecuencia e intensidad, las cuales se convierten en filtros selectivos de especies que comparten características adaptativas similares; dichos grupos superan las fronteras taxonómicas y filogenéticas.
Se puede concluir que los rasgos morfológicos constituyen un enfoque de alto potencial para el estudio del fitoplancton y la clasificación ecológica de los cuerpos de agua en donde habitan. Los grupos funcionales pueden complementarse con el uso de herramientas analíticas adecuadas y abordar grupos de especies características de cualquier tipo de ambiente. En este estudio se explora dicha posibilidad en seis sistemas lénticos de diferentes características ubicados en tres ecorregiones de Colombia.
La clasificación de grupos funcionales basados en la morfología (GFBM) desarrollada por Kruk, et al. (2010) no requiere el conocimiento de los rasgos fisiológicos, ni del acondicionamiento ambiental o la filiación taxonómica. En su lugar, utiliza rasgos fácilmente observables, como el volumen y la presencia de mucílago, entre otros. En este trabajo se planteó la siguiente interrogante: ¿los grupos funcionales basados en la morfología reflejan las características del ensamblaje del fitoplancton y su desempeño ecológico en respuesta a diferentes condiciones ambientales, según los criterios postulados por Kruk, et al. (2010) Se esperaba determinar si estos criterios permitían analizar la adecuación biológica de grupos de organismos según las características ambientales de los sistemas analizados, es decir, predominancia de los grupos III, V y VII, caracterizados por una alta relación superficie-volumen (S/V) y rasgos especializados como flagelos, aerótopos y mucílago, en ambientes someros, turbios, cálidos y potencialmente mezclados; en contraste, los grupos II y IV, caracterizados por un menor tamaño y poca presencia de rasgos categóricos o especiales dan cuenta de su distribución en ambientes profundos, claros y de menor temperatura. El objetivo del estudio fue establecer si estos grupos reflejaban las características necesarias para analizar la estructura y la distribución de los patrones funcionales del fitoplancton conforme a diferentes condiciones ambientales y según los criterios postulados por Kruk, et al. (2010).
Materiales y métodos
Area de estudio
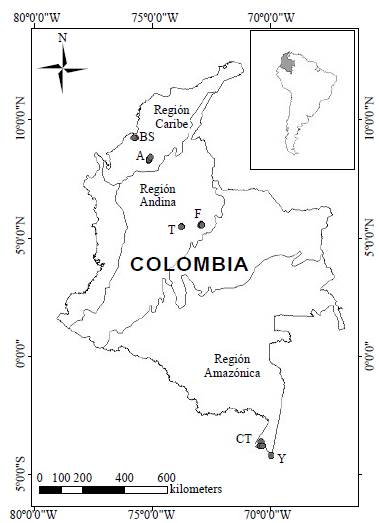
Los seis sistemas estudiados pertenecen a las regiones amazónica, andina y caribe de Colombia (Figura 1) y se distribuyen de la siguiente manera: los de la zona más septentrional del país se localizan en la región Caribe, específicamente en los lagos de inundación o ciénagas de Ayapel en el departamento de Córdoba (8° 18'57,3" N & 75° 07' 34,5" O) y el Bajo Sinú (9°13'26,89" N & 75°46'31,44" O), asociadas a los ríos San Jorge y Sinú, respectivamente. Estos ambientes, ubicados a 20 m s.n.m. registran una profundidad media de 5 metros y una temperatura media anual superior a 30 °C. En la región andina, en el centro del país (departamento de Boyacá), a 3.015 y 2.543 m s.n.m., respectivamente, se localizan el lago Tota (5°32'99" N y 72°55'42" O) y la laguna Fúquene (5°27'94" N & 73°45'19" O); ambos son sistemas naturales de montaña de origen tectónico-glaciar, con profundidades máximas medias de aproximadamente 60 y 6 m, respectivamente, y una temperatura media anual de 12 °C. Por último, al sur del país, en Leticia (Amazonas), a 82 m s.n.m., se incluyeron los lagos de inundación Correo-Tarapoto (3°47'30, 6" N y 70°25' 51" O) y Yahuarcaca (4° 11' 48" N y 69° 57' 19" =), asociados a la depresión de la llanura de inundación formada por el río Amazonas, cuyas profundidades máximas medias son de 7 metros y la temperatura media anual es de 26 °C.
Diseño de muestreo
En la zona limnética del espejo principal de cada sistema se monitorearon entre dos a ocho estaciones durante tres a cuatro períodos climáticos en series anuales entre el 2005 y el 2007. Las muestras para los análisis físicos, químicos y de clorofila a se recolectaron en la subsuperficie en una botella de tipo Van Dorn de 2,5 1, a la altura de la profundidad Secchi y a tres veces dicha profundidad.
Variables ambientales
La información mensual de precipitación, brillo solar y radiación ultravioleta (banda de 305 nm) se obtuvo de los mapas y el banco de datos del Instituto de Hidrología, Meteorología y Estudios Ambientales (IDEAM). En cuanto a las variables fisicoquímicas, en cada sistema se midieron in situ la profundidad máxima (m), la profundidad Secchi (m), la temperatura del agua (°C), el oxígeno disuelto (mg/l), el porcentaje de saturación, el pH y la conductividad eléctrica (μS/cm). Además, se recolectaron muestras de agua para el análisis de nitrato (NO3 -), nitrito (NO2 -), amonio (NH4+), ortofosfato (PO4 -3), silicatos (SiO2) y clorofila a (μg/l). El análisis de nutrientes se efectuó con un autoanalizador BRAN + LUEBBE AAIII (Norderstedt Stadt, Alemania). El análisis de clorofila se llevó a cabo en muestras liofilizadas resuspendidas en metanol al 95 % mediante cromatografía líquida de alta resolución (high performance liquid chromatography, HPLC) en una columna simétrica Cs de 150 x 4,6 mm y un tamaño de poro de 100 Á.
Análisis de las muestras
Las muestras de fitoplancton se preservaron en solución de Lugol al 10 % y el fitoplancton, excepto el picoplancton, se contó en un microscopio invertido enumerando campos aleatorios (Uehlinger, 1964) mediante la técnica de sedimentación (Utermohl, 1958). Las muestras se observaron con 400X y se contaron hasta 30 campos para confirmar la asíntota de la curva de rarefacción. Para la aplicación de los grupos funcionales según Kruk, et al (2010), las colonias, los cenobios, los filamentos y las células individuales se consideraron como unidades de conteo. Se midieron el volumen, la superficie y la dimensión lineal máxima de cada morfotipo. El biovolumen se estableció según lo propuesto por Hillebrand, et al. (1999). En total se analizaron 243 muestras y en cada una de ellas se midieron 10 individuos de cada morfotipo, con el fin de obtener las dimensiones promedio de volumen, superficie y dimensión linear máxima. Los morfotipos presentes en cada una de las muestras se clasificaron y tabularon en un grupo morfológico según sus rasgos numéricos (dimensiones) y categóricos (caracteres especializados).
El biovolumen individual (um3/l) se estimó multiplicando el biovolumen (μm3) por la concentración de individuos (ind/l). Según Kruk, et al. (2010), para las formas coloniales con mucílago, el cálculo de volumen y superficie incluye el mucílago dentro de la dimensión de cada colonia. Se consideró la presencia de rasgos especializados como los aerótopos, los flagelos, el mucílago, los heterocitos, los acinetos y los frústulos silíceos para cada organismo. En Kruk, et al. (2010) se encuentra la clave que permite determinar la filiación de una especie fitoplanctónica a un grupo morfofuncional determinado según sus características morfológicas y especializadas. Además de esta información, se encuentra la concerniente al desempeño ecológico en términos de la adquisición de recursos y evasión de procesos de pérdida (consumo y sedimentación).
Procesamiento y análisis de la información
Los datos se organizaron y codificaron en dos matrices: una biológica, que incluyó los morfotipos del fitoplancton, y una explicativa compuesta por las variables ambientales. La significación de las diferencias de los rasgos morfológicos entre los GFBM se probó mediante un ANOVA. Se aplicó la prueba de Duncan para validar los conjuntos homogéneos de los GFBM en cuanto al volumen, la relación superficie-volumen y la dimensión linear máxima. Este análisis se efectuó en el programa Statistica para Windows, versión 7.
Los taxones identificados se incluyeron en uno u otro GFBM utilizando una plantilla diseñada por Kruk & Segura (2011). La pertenencia a los grupos se estableció a partir de las dimensiones morfológicas medias y la presencia de los rasgos especializados de cada taxón.
Para establecer el grado de relación entre los GFBM, los rasgos funcionales y el grupo de parámetros ambientales se hizo un análisis de correspondencia canónica-(CCA) usando el programa R después de comprobar que en el análisis de correspondencia sin tendencia (DCA) la longitud del gradiente en el primer eje fuera superior a 1,5 (Ter Braak & Ŝmilauer, 1998). La significación de las variables ambientales que explicaron la varianza de los GFBM en el CCA se determinó mediante la prueba de Monte Carlo con 499 permutaciones (Ter Braak, 1995). Las variables consideradas en el análisis presentaron un valor de p < 0,05 y un factor de inflación < 20. Las matrices se estandarizaron y transformaron a log10 (x +1). Los análisis de ordenación incluyeron la profundidad máxima, la profundidad del disco de Secchi, la temperatura, la precipitación, la radiación UV, el pH, la conductividad eléctrica, las formas de nitrógeno inorgánico disuelto (nitratos, nitritos y amonio), los ortofosfatos y la sílice como posibles factores explicativos de la distribución de los grupos morfológicos. La concentración de clorofila a se utilizó como variable suplementaria.
Resultados
Rasgos morfológicos
En la tabla 1 se observa que mientras los mayores valores medios de la dimensión lineal máxima y de la relación superficie-volumen se registraron para el fitoplancton de las planicies de inundación del Caribe, los volúmenes y superficies más grandes se calcularon para los sistemas de la región andina. La frecuencia de aparición de rasgos especiales como acinetos, aerótopos y heterocitos fue especialmente importante en el fitoplancton de las planicies de inundación del Caribe. Los flagelos estuvieron presentes en todos los sistemas, pero fueron especialmente notables en el ensamblaje fitoplanc-tónico de los lagos de inundación amazónicos y en la laguna Fúquene, considerado un cuerpo de agua somero y de montaña según la clasificación de Donato (2008). La mayor frecuencia de mucílago se encontró en el lago Tota, catalogado como un lago profundo y de montaña en este estudio. Las estructuras silíceas estuvieron presentes en la mayoría de los sistemas, pero fueron de gran relevancia en la planicie de inundación de la ciénaga de Ayapel (Tabla 1).
Tabla 1 Rasgos morfológicos y especializados del fitoplancton en cada sistema en estudio
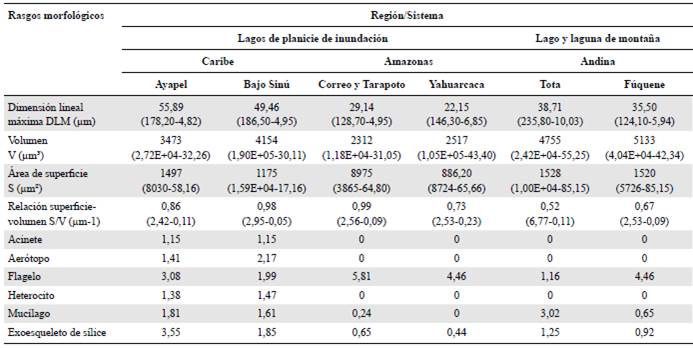
* Las variables morfológicas continuas (MLD, V, S y S/V) incluyen el valor medio y, entre paréntesis, el máximo y el mínimo. Las variables morfológicas categóricas (acinete, aerótopo, flagelo, mucílago y exoesqueleto de sílice) incluyen la frecuencia media en cada sistema.
Caracterización de los rasgos funcionales definitorios de los grupos basados en la morfología
Se observaron seis de los siete GFBM descritos originalmente por Kruk, et al. (2010) (Figura 2). El grupo I no se reportó, ya que no se pudo hacer el análisis de epifluorescencia necesario para cuantificar y medir los organismos de este grupo, los cuales son los más pequeños, con un promedio de 7 |im de dimensión lineal máxima. Esto no generó subestimaciones importantes si se consideran los resultados asociados con el análisis pigmentario de la clorofila en Hernández, et al. (2011), en donde se corroboró una alta relación entre el biovolumen cuantificado y el pigmento. En el grupo II (pequeños flagelados con estructuras silíceas: Chrysophyceae) se incluyeron organismos pequeños, con razones reducidas de superficie-volumen y poca dimensión lineal máxima, y motilidad por la presencia de flagelos y espinas silíceas. Los miembros del grupo III (grandes filamentos con aerótopos) incluyeron filamentos grandes de cianobacterias con aerótopos y heterocitos con bajo volumen y una alta dimensión lineal máxima y relación superficie-volumen. Los organismos del grupo IV (tamaño medio y ausencia de rasgos especializados) se caracterizaron por su pequeño tamaño, su elevada relación superficie-volumen y su reducida dimensión lineal máxima. El grupo V (flagelados unicelulares de tamaño medio a grande) incluyó organismos de tamaño moderado y baja relación superficie-volumen. Los integrantes del grupo VI (organismos no flagelados y con exoesqueletos de sílice: diatomeas) presentaron tamaños grandes y bajos valores de relación superficie-volumen y de dimensión lineal máxima. Por último, el grupo VII (colonias mucilaginosas con los lípidos y aerótopos) incluyó organismos caracterizados por presentar propiedades de control de la flotación con presencia de mucílago, volumen grande, y reducidas relación superficie-volumen y dimensión lineal máxima (Figura 2).
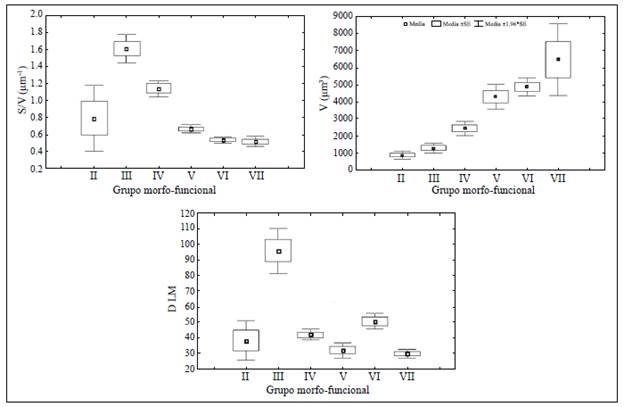
Figura 2 Valores medios ± 1.00 de error estándar e intervalo de confianza del 95 % de los rasgos morfológicos de volumen (V), relación superficie-volumen (S/V) y dimensión lineal máxima (DLM) en cada grupo funcional basado en la morfología Los rasgos presentaron diferencias significativas entre grupos (ANOVA: p<0,05)
Distribución ambiental de los GFBM
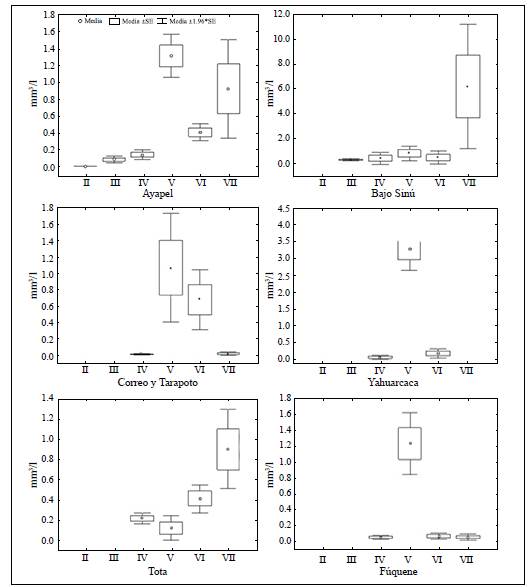
Los grupos IV, V y VI se encontraron en los seis sistemas (Figura 3). Con excepción del lago de inundación amazónico Yahuarcaca, el grupo VII se registró en todos los ambientes, pero especialmente en las llanuras de inundación del Bajo Sinú. El grupo III, aunque con poco biovolumen, estuvo presente en los dos lagos de la llanura de inundación de la región Caribe, en tanto que el grupo II se halló en poco biovolumen en la llanura de inundación de la ciénaga de Ayapel. El mayor número de GFBM se encontró en los lagos de la llanura de inundación de la región del Caribe, con seis de los siete grupos propuestos por Kruk, et al. (2010). Los grupos V y VII dominaron en las ciénagas de Ayapel y del Bajo Sinú en la región Caribe. En los lagos de inundación de la Amazonia se registró el menor número de GFBM y el grupo V presentó el mayor biovolumen. Aunque en los lagos andinos de montaña se registró la presencia de los grupos IV, V, VI y VII, el biovolumen de los grupos fue diferente, con predominio del grupo VII en el lago Tota y del grupo V en la laguna Fúquene (Figura 3).
Rasgos morfológicos y variables ambientales
En las correlaciones por rangos de Spearman se destacaron la asociación de la profundidad máxima y la transparencia con la razón superficie-volumen y la frecuencia del mucílago. Otras correlaciones de interés se dieron entre las concentraciones de nitrógeno y ortofosfato y la presencia de flagelos y mucílago. Sin embargo, la asociación más importante se halló entre la relación superficie-volumen y la temperatura (r=0,59; α<0,001) (Tabla 2).
Tabla 2 Correlaciones significativas por rangos de Spearman entre rasgos morfológicos y variables ambientales. * Valores a < 0,001
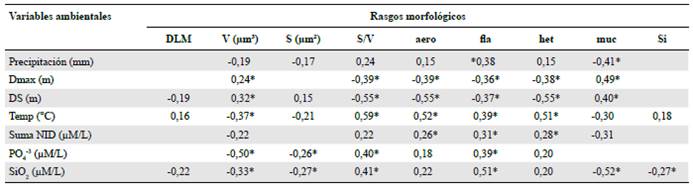
Dmax: profundidad máxima; DS: transparencia; Temp: temperatura del agua; DLM: dimensión lineal máxima; V: volumen; S superficie; aero: aerótopo; fia: flagelo; muc: mucílago; si: exoesqueleto de sílice
Relación entre los GFBM y las variables ambientales
Los resultados del CCA generaron un porcentaje de varianza total explicado del 44,1 % (α=0,002), lo que sugiere que la correlación entre los GFBM y las variables ambientales fue importante. Las variables significativas según los valores lambda, la significación y el porcentaje de varianza explicado por el test de Monte Carlo, derivado del análisis de correspondencia canónica, indicaron que la profundidad máxima, la profundidad del disco de Secchi, la precipitación, la radiación UV, la temperatura, la conductividad, el pH y las concentraciones de nitratos, nitritos, amonio, ortofosfatos y sílice y la radiación UV tuvieron la mayor proporción de la varianza total (10,9 y 8,4, respectivamente).
En el biplot del CCA (Figura 4) el primer eje canónico (0,47) registró en el área positiva una importante relación con el amonio y el fósforo soluble y en su parte negativa, con la radiación UV Por su parte, la porción positiva del segundo eje (0,33) se asoció con la temperatura, la sílice y la precipitación, y en la parte negativa, con la profundidad máxima, la transparencia y la clorofila a (variable suplementaria). En el cuadrante I (relacionado con PO43-, NH4+ y la temperatura) se situaron los lagos de inundación del complejo cenagoso del Bajo Sinú y de Ayapel, a los que se asociaron los GFBM de los tipos II, III y VII, este último compartido con el lago Tota. Por su parte, los lagos amazónicos (Correo-Tarapoto y Yahuarcaca), así como la laguna somera de montaña (Fúquene), se relacionaron con la presencia del GFBM V y se localizaron en el cuadrante II, asociado con la radiación UV, la sílice y la precipitación. El lago de montaña (Tota) se situó en el cuarto cuadrante, determinado por la profundidad máxima y la transparencia; en este sistema se presentaron los GFBM correspondientes a los grupos IV, VI y VII.
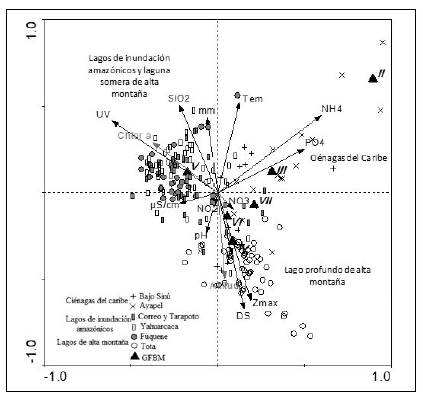
Figura 4 Análisis de correspondencia canónica (CCA) entre sistemas, grupos funcionales basados en la morfología (GFBM), variables ambientales y puntos de muestreo. Los puntos representan los seis sistemas, los triángulos negros, los grupos morfológicos, las líneas negras simbolizan las variables ambientales y la línea gris la variable de carácter suplementario
Discusión
En los ambientes acuáticos tropicales los patrones estacionales de las lluvias y vientos tienen un importante papel en la variación de la biomasa del fitoplancton (Duque & Donato, 1992; Lewis, 1976; Dobson & Frid, 1998). Sin embargo, a pesar de que en el trópico no se registran cambios temporales importantes en la temperatura, sí hay cambios térmicos por las variaciones altitudinales (22 a 3.015 m s.n.m.). En este estudio las diferencias ambientales estuvieron ligadas a variables como la temperatura, la profundidad y la transparencia del cuerpo acuático, factores gobernados por la localización de los sistemas en tres regiones geográficas de diferente altitud y relieve, lo que promueve características morfométricas distintas en el fitoplancton. Aunque las condiciones de luz y temperatura son relativamente constantes en el trópico, varían en función del origen y la ubicación geográfica de los lagos, lo que a su vez incide en las tasas metabólicas de los organismos; el gradiente térmico en el que osciló este estudio corresponde a un rango de 18,1 y 31,8 °C y representa un marco de referencia que afecta las condiciones físicas y químicas de los sistemas acuáticos analizados y, en consecuencia, de las diferencias ecológicas encontradas en el fitoplancton, las cuales se exploraron mediante la clasificación morfológica y funcional.
La clasificación de rasgos y grupos morfológicos de Kruk, et al. (2010) demostró ser objetiva y la cuantificación de los rasgos continuos y categóricos de los organismos en cada ambiente fue coherente con los supuestos que definen los grupos morfológicos. Ejemplo de ello fue que el grupo VII con mayor volumen registró la menor relación superficie-volumen y el grupo III con una mayor dimensión lineal máxima presentó, a su vez, la mayor relación superficie-volumen. En este contexto, los organismos filamentosos del grupo III representan formas de adaptación interesantes en las planicies de inundación, a pesar de que su crecimiento lento y su alta relación superficie-volumen les confiere una mayor tolerancia a condiciones limitantes de luz (Naselli-Flores, et al., 2007). Su baja tasa de sedimentación está asociada a la presencia de aerótopos y a la elevada superficie de exposición en proporción al volumen, lo cual también facilita el acceso a los recursos (Ferber, et al, 2004). Un gran tamaño (Lehman, 1991) y la potencial toxicidad asociada con la producción de metabolitos secundarios (Dow & Swoboda, 2000) otorgan a este grupo resistencia a la herbivoría (Kruk, et al., 2010).
Los rasgos morfológicos numéricos o continuos presentaron un patrón consistente para las dimensiones lineales máximas y para la razón superficie:volumen. Los mayores valores se registraron en las planicies de inundación, especialmente en las ciénagas del Caribe, en ambientes turbios, someros y cinéticos de alta temperatura. Descy, et al., (1994) denominan ambientes cinéticos a aquellos turbulentos o activamente mezclados y someros; en buena medida estos lagos se insertan en lo que Lewis cataloga como sistemas polimícticos cálidos continuos. En este sentido, la mayoría de los lagos analizados se ajusta a esta clasificación, con excepción del lago Tota. La principal característica de estos lagos es la constancia relativa de la mezcla y, aunque la fuerza del viento no sea el factor principal para el movimiento, el movimiento residual y la convección impiden cualquier estratificación prolongada. En palabras de Reynolds, citado por Descy, et al. (1994), esto quiere decir que "siempre serán influenciados por energía cinética".
En los ambientes cinéticos y turbios las formas largas y delgadas garantizan una mayor superficie de exposición y constituyen buenas antenas para captar la luz. Por ello, dichas formas en estos ambientes tienen las mejores posibilidades adaptativas para proveer una buena antena de luz en un clima óptico deficiente, porque el pigmento fotosintético debe colocarse en la máxima sección cruzada del campo de luz, efecto que las células pequeñas, las formas aciculadas y los filamentos logran (Kirk, 1994; Reynolds, 1988; Descy, et al., 1994). Casi todas estas formas tienen razones de superfiie:volumen altas, tal como ocurre en los lagos de planicies de inundación, especialmente en las ciénagas del Caribe, tal como le plantean Zabala, et al. (2019) en su análisis morfológico del fitoplancton de una de las planicies de inundación analizadas en el presente trabajo y que demuestra que las estrategias morfológicas relacionadas específicamente con el cambio de la predominancia del grupo III al V, evidencia una adecuación de formas filamentosas a formas flageladas, así como el cambio de una estrategia ecológica r a una primariamente adquisitiva como la k.
Los rasgos morfológicos variaron considerablemente entre los sistemas y los rasgos categóricos más destacables fueron el flagelo, el mucilago y la pared de sílice, siendo más frecuente el flagelo en los lagos someros y turbios. Varios autores consideran que la perturbación generada por la mezcla en los sistemas someros y cinéticos deja de ser un factor de estrés y se convierte en un recurso para los organismos; en este sentido, el grupo V, constituido por flagelados unicelulares de mediano a gran tamaño, sobresalió en los sistemas amazónicos y en Fúquene (laguna somera y turbia de montaña). Los organismos pertenecientes al grupo V, gracias a su movilidad y tendencia a la plasticidad mixotrófica, presentan tolerancia moderada a la limitación de recursos y a pérdidas por sedimentación bajas a moderadas. Estas características favorecen su abundancia en ambientes turbios y con moderada concentración de nutrientes, presentes en los sistemas amazónicos y en la laguna Fúquene. Los flagelados unicelulares del grupo minimizan las pérdidas por sedimentación, facilitan la movilidad (transporte) y la incorporación efectiva de nutrientes que puede incrementar la tolerancia a su poca disponibilidad. Una dimensión lineal máxima relativamente alta y la presencia de flagelos pueden, además, proporcionar una evasión considerable a la herbivoría debida al pastoreo del zooplancton especializado (Reynolds, 1997; Kruk, et al., 2010). El grupo VII, compuesto por colonias mucilaginosas, es poco vulnerable a la sedimentación y a la herbivoría (Reynolds, 2007). Este grupo se encontró en los sistemas del Caribe y en el lago Tota. Sin embargo, mientras en el Caribe estuvo representado por colonias de gran tamaño y con aerótopos (Microcystis sp.), en el lago Tota lo estuvo principalmente por cenobios de menor tamaño y ausencia de rasgos especializados, como Crucigeniella sp. El predominio del grupo VII en los lagos caribeños se debe probablemente a la reducida transparencia y a que las altas temperaturas reducen la densidad del agua, lo que haría necesario poseer estructuras que permitan la permanencia en suspensión, como los aerótopos. Esto implica, además, contar con una fuente de nutrientes considerable, pues muchos de los organismos de este grupo son indicadores de eutrofia y no son tolerantes a las deficiencias de luz, por lo que poseen una baja razón de superficie:volumen. En consecuencia, deben compensar una mayor exposición a la dosis de luz requerida para aumentar su eficiencia fotoautotrófica, con rasgos especializados como el mucílago y los aerótopos. Por último, estas características se asocian a morfotipos sensibles a un bajo suplemento de recursos (Kruk, et al., 2010), pero su gran tamaño puede ayudar a evitar la herbivoría (Reynolds, 2007).
En cuanto a la adaptación del grupo VII, según Reynolds (en Descy, et al., 1994), la condición de eutrofia provoca que las formas oportunistas en los lagos someros y cinéticos sean las colonias grandes con rasgos funcionales para evitar la sedimentación, cuya principal adaptación morfológica es su baja relación volumen-superficie. En el lago Tota la presencia de este grupo se caracterizó principalmente por colonias de una talla moderada y sin rasgos especializados para la suspensión, lo que evidencia la disponibilidad de luz y, probablemente, la ausencia de presión fuerte hacia la herbivoría. Además del grupo VII, en el lago profundo y claro de montaña (Tota) también se encontraron los grupos IV y VI. El grupo IV corresponde a organismos de tamaño medio, sin rasgos especializados y con moderada tolerancia a la limitación de nutrientes y luz; presentan pérdida por sedimentación baja a moderada y, debido a su tamaño medio, son los más vulnerables a la herbivoría. El grupo VI incluye organismos no flagelados con exoesqueleto de sílice, por lo cual presentan una alta densidad y falta de movilidad, lo que repercute en elevadas pérdidas por sedimentación, así como una tolerancia moderada a la limitación de recursos y una tasa de sedimentación baja a moderada; su rango de tamaño y su calidad como alimento los hace altamente vulnerables a la herbivoría (Sterner & Elser, 2002; Kruk, et al., 2010). Por su parte, la presencia del grupo VI en la zona fótica del lago Tota probablemente se relaciona con la presencia de diatomeas de origen perifítico o del fitoplancton que pueden ser transferidas por las corrientes de la zona fótica desde la región litoral a la limnética; los organismos no flagelados y con exoesqueletos de sílice del grupo VI tienden a sedimentarse rápidamente debido a su alta densidad celular y a la falta de movilidad, sin embargo, las paredes silíceas les confieren ventajas frente a ciertos herbívoros (Hamm, et al., 2003; Kruk, et al., 2010). Las características descritas favorecen la abundancia de los grupos IV y VII, ya que, en síntesis, prosperan en un ambiente lumínico amplio y con moderada concentración de nutrientes, como ocurre en el lago Tota, un sistema profundo y claro de montaña, aspecto también discutido en Muñoz, et al. (2017).
Otro aspecto que reveló el desempeño ecológico fue la asociación entre la disponibilidad de luz y las proporciones morfométricas de los organismos mediante la relación inversa entre la profundidad fótica, la relación superficie:volumen y la presencia de aerótopos y mucílago y la profundidad fótica, rasgos categóricos que favorecen la flotabilidad disminuyendo las pérdidas por sedimentación o la exposición a prolongados períodos de oscuridad. La relación superficie-volumen fue positiva con respecto a la disponibilidad de nutrientes, ya que una superficie de exposición más extensa implica mayor área de interacción con el ambiente.
Conclusiones
Los resultados de las relaciones entre los grupos morfológicos y los factores ambientales indicaron que los grupos propuestos por la clasificación son útiles y objetivos como herramienta de estudio del ensamblaje fitoplanctónico, ya que explican la variación de la morfología en respuesta al ambiente. El análisis de correspondencias, que incluyó los seis sistemas, evidenció que la zona fótica, la profundidad máxima y la temperatura del agua fueron las variables más importantes en la distribución de los grupos, definiendo las siguientes tendencias:
los ambientes someros, turbios y cálidos (planicies y lagos de inundación del Caribe) fueron dominados por los grupos III y V, los cuales se caracterizan por formas filamentosas con alta relación superficie-volumen y presencia de aerótopos o heterocitos, así como flagelos. Estos grupos poseen rasgos morfológicos que favorecen la adquisición de recursos, disminuyen las pérdidas por sedimentación y la exposición a períodos prolongados sin luz.
En contraste, en el lago Tota, sistema profundo y de gran transparencia en alta montaña, dominaron los organismos pertenecientes a los grupos IV y VII con tallas medias en ambos. Dichos grupos predominaron en este ambiente porque las óptimas condiciones lumínicas y la disponibilidad moderada de nutrientes favorecen una morfología caracterizada por el volumen moderado y la ausencia de rasgos especializados en el fitoplancton.
Al observar ambientes de similar origen y posición altitudinal, se concluyó que los lagos de inundación y los sistemas de montaña se separaron en la distribución de los grupos y en las variables asociadas: los lagos de inundación del Caribe (ciénagas de Ayapel y el Bajo Sinú) se asociaron con la temperatura y las concentraciones de ortofosfatos y de amonio, en tanto que la laguna de Fúquene, situada en la montaña, y los lagos de inundación amazónicos se asociaron con una mayor concentración de clorofila a, sílice y precipitación.
Los dos sistemas de montaña se diferenciaron entre sí, ya que el lago Tota se relacionó con una mayor profundidad del disco de Secchi y con organismos pertenecientes a los grupos IV, VII y VI. Por su parte, la laguna Fúquene se caracterizó por la incidencia de una baja transparencia y la presencia de taxones correspondientes al grupo V, situación similar a los lagos de inundación. Esto puede deberse al carácter somero de Fúquene, que provoca resuspensión y alta turbidez.
El gradiente que separa los seis sistemas y responde a la variabilidad de los grupos está delimitado por el ambiente lumínico y la concentración de nutrientes. Los ambientes del Caribe se discriminaron por la concentración de nutrientes y la baja transparencia, características que afectan las relaciones altas y bajas entre superficie y volumen como corresponde al fitoplancton de los grupos II, III y VII, respectivamente. Es evidente, entonces, que el carácter del rasgo continuo de relación superficie-volumen y la presencia de aerótopos y de mucílago, que también caracteriza a estos grupos, reflejan estrategias morfológicas de desempeño ecológico que le permiten al fitoplancton optimizar los recursos en ambientes cálidos, turbios y con pocas variaciones en la concentración de nutrientes.
El gradiente que separa los ambientes de montaña está fuertemente caracterizado por el ambiente lumínico, lo cual promueve que la morfología de los organismos en el lago Tota esté representada por individuos de talla media y carentes de rasgos especializados, como los del grupo IV. Por su parte, el dominio de organismos flagelados del grupo V en la laguna Fúquene y en los lagos amazónicos evidencia también el papel de la morfología como una adaptación ecológica satisfactoria en un ambiente somero y turbio. Es importante considerar que el predominio de las euglenofíceas se debe también a su adaptación a sistemas muy ricos en materia orgánica (sapróbicos), como lo son los lagos amazónicos y la laguna de Fúquene (Pinilla, 2006).
Los resultados del estudio no entran en conflicto con otras clasificaciones ecológicas del ensamblaje del fitoplancton (Reynolds, 1988; Reynolds, et al., 2002; Salmaso & Padisák, 2007). Estas clasificaciones tienen la ventaja de ser más refinadas, pero requieren información sobre los rasgos que normalmente no son fáciles de obtener para todas las especies (Salmaso & Padisák, 2007; Mieleitner, et al., 2008). Estas herramientas pueden ser útiles a los ecólogos del fitoplancton y a los modeladores y encargados de controlar la calidad del agua para comprender y predecir la composición de las comunidades de fitoplancton según las condiciones de los ambientes acuáticos.