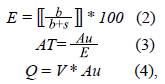Introducción
La variabilidad climática induce cambios sobre las características físicas y los ciclos biogeoquímicos de los sistemas acuáticos (De Senerpont Domis, et al., 2013), lo que afecta las tasas de crecimiento y abundancia, así como la composición de las comunidades biológicas (Kosten, 2010). Un efecto del clima y sus diferentes expresiones de variación es la modificación del tiempo de retención hidráulica (TRH). El TRH es un factor determinante en el desarrollo de los procesos energéticos y flujos de materia de los ecosistemas acuáticos, responsable de la regulación de los recursos asociados con el equilibrio dinámico entre la entrada y la salida del agua (Van der Kamp, et al., 2008). Dichos procesos se vinculan a diversos requerimientos biológicos y dan lugar a importantes interacciones ecológicas que, integradas con el medio externo, pueden determinar el comportamiento general de los ecosistemas acuáticos (Donato, et al., 1996; Heino, et al., 2015).
A diferencia de los lagos, la gran variabilidad en el nivel y el volumen de almacenamiento del agua en la mayoría de los embalses y reservorios de agua dulce influye de manera importante sobre el TRH y provoca cambios en la alternancia entre períodos de mezcla y estratificación debido a los movimientos verticales y horizontales del agua (Roldán-Pérez y Ramírez-Restrepo, 2008). Esta variabilidad ambiental ejerce una presión selectiva sobre las comunidades planctónicas que se refleja en cambios en la diversidad taxonómica y funcional para adaptarse espacial y temporalmente al entorno (Shimoda, et al., 2011; Naselli, 2014). El plancton está conformado por una fracción de especies reactivas, con poblaciones que expresan ciclos de vida cortos y altas tasas reproductivas, lo que permite considerarlo un buen modelo de evaluación de la respuesta de las entidades biológicas a los cambios en las condiciones del sistema en cortos períodos de tiempo (Adrian, et al., 2009).
La elección de un ambiente espacialmente pequeño y con mayor dinámica hidrológica como el reservorio La Chapa, sensible a la alta variación del TRH, permite evidenciar con mayor facilidad el efecto de procesos ecológicos de relevancia como la incorporación del calor, la estabilidad de la estratificación, la intensidad de la mezcla vertical, la zona-ción horizontal y el flujo de nutrientes en el metabolismo del sistema y la estructura de las comunidades biológicas (Aranguren-Riaño & Monroy-González, 2014).
Este tipo de investigación cobra relevancia por la grave amenaza que enfrentan los ecosistemas del mundo debido al cambio climático (Rosenzweig, 2007). En sistemas acuáticos se vislumbran alteraciones en la disponibilidad y la calidad de agua dulce y la pérdida progresiva de poblaciones (Jiménez-Cisneros, et al., 2014; Magrin, et al., 2014) debido a los cambios en el comportamiento de la temperatura y la precipitación, las alteraciones en los regímenes de flujo (escorrentía), el nivel del agua y el régimen de disturbio natural, las cuales modifican la estructura y el funcionamiento de los ecosistemas acuáticos (Jiménez-Cisneros, et al., 2014). Además, se espera que la frecuencia e intensidad de estos fenómenos aumente en regiones tropicales de Latinoamérica (Magrin, et al., 2014), con la consecuente incertidumbre en sus efectos.
El objetivo de este trabajo fue evaluar el efecto de distintas expresiones del TRH (menor y mayor a 30 días) relacionadas con las condiciones hidroclimáticas locales en las variables de estructura y función en un pequeño reservorio de la zona andina para comprender los procesos de ajuste de los organismos planctónicos frente a las diversas dinámicas de tensión en el hábitat. El análisis de la relación del TRH con el funcionamiento de los ecosistemas acuáticos empleando modelos e indicadores biológicos como el plancton es un aporte importante, dada la gran incertidumbre en torno a la capacidad de ajuste y adaptabilidad de los organismos en situaciones de cambio climático (Wilby, et al., 2010; Winder & Sommer, 2012).
Materiales y métodos
Area de estudio
La Chapa se considera un reservorio artificial sin presa y de alta variabilidad temporal, el cual es estratégico para el municipio de Santana por ser una de las principales fuentes de abastecimiento de agua en el sector rural y reserva para la zona urbana en períodos de escasez. Está localizado al noroccidente del departamento de Boyacá, en la subcuenca del río Suárez, sobre las coordenadas 6° 02' Norte - 73° 29' Oeste, a una altura de 1.650 m s.n.m. (Figura 1S, https://www.raccefyn.co/index.php/raccefyn/article/view/1022/2742) (Aranguren-Riaño & Monroy-González, 2014). El reservorio presenta un comportamiento polimíctico cálido asociado con los procesos de productividad. El área de estudio tiene una precipitación media mensual de 198,96 mm y un régimen con tendencia bimodal; la temperatura media anual es de 23 °C (Ministerio de Ambiente, Vivienda y Desarrollo Territorial, 2006).
Fase de campo
Se hicieron seis muestreos entre febrero y agosto del 2018 (12 de febrero, 1 de marzo, 10 de abril, 1 mayo, 19 de junio y 20 de agosto), que abarcaron momentos hidroclimáticos intensos (período de lluvias) y bajos (período seco), así como los períodos de transición entre unos y otros (Tabla 1). Las muestras biológicas y los datos fisicoquímicos se tomaron en tres zonas a lo largo del reservorio: cerca a la entrada de la quebrada La Chapa, en la zona limnética (mayor profundidad) y cerca de las salidas para el acueducto comunitario.
Tabla 1 Tiempo de retención hidráulica (TRH) en diferentes momentos hidrológicos en el reservorio La Chapa, Santana-Boyacá
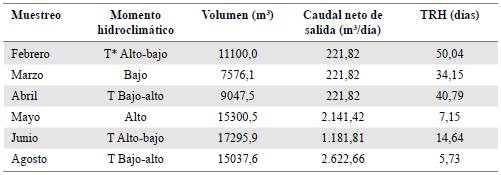
*Transición
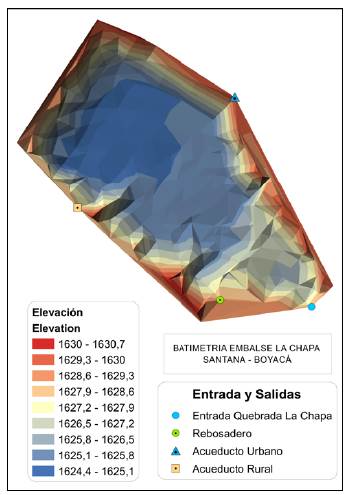
Para determinar el TRH, definido como la relación entre el volumen del agua retenido y el flujo o caudal de un sistema acuático (Rueda, et al., 2006), se obtuvo inicialmente el volumen a partir de la batimetría del reservorio, para lo cual se generó una nube de puntos distribuida de forma geométrica, intentando conformar trazados rectos y paralelos entre sí en forma de "malla" a partir de mediciones de profundidad y de coordenadas (Chapapría, et al., 1995). La información se procesó usando sistemas de información geográfica (SIG) para definir la forma y el volumen del reservorio correspondientes a cada altura de lámina de agua y, posteriormente, hacer la modelación del cambio de agua retenida (Figura 1).
Para analizar el comportamiento del caudal fue necesario considerar la entrada y las salidas, lo que hace parte del balance hídrico del reservorio. La entrada corresponde a la quebrada La Chapa, fuente abastecedora del reservorio, regulada por una rejilla encausada hacia el reservorio por una tubería de 6 pulgadas. Las salidas corresponden al rebosadero del reservorio, conformado por dos tubos de 6 y 12 pulgadas, y las salidas controladas del reservorio, la primera empleada para el abastecimiento del acueducto municipal en época de baja precipitación mediante bombeo en una tubería de 4 pulgadas, y la segunda para la extracción hacia el acueducto comunitario rural a través de dos tuberías de 1 pulgada.
En cada período evaluado se midieron los parámetros fisicoquímicos in situ: oxígeno disuelto (mg/L), conductividad eléctrica (μS/cm), pH (unidades), temperatura (°C), dureza (mg CaCO3) y transparencia medida con disco de Secchi (m) (APHA-AWWA-WEF, 1999). Se tomaron muestras compuestas de agua para la cuantificación de fosfatos y nitratos en laboratorio utilizando los métodos SM 4500 P - E y ASTM D 3867-04, respectivamente. Además, se seleccionaron dos momentos de relevancia metabólica (franja de las 14:00 h a las 16:00 h y franja de las 6:00 h a las 8:00 h) para construir los perfiles de temperatura y oxígeno en la zona central y profunda del sistema. Se registraron los datos cada 50 cm a lo largo de la columna de agua, con el propósito de conocer el comportamiento de los procesos de estratificación y mezcla del sistema.
En cuanto al plancton, se recolectaron muestras cualitativas mediante arrastres superficiales de fitoplancton (red con poro de 20 μm) y zooplancton (red con poro de 60 μm). Las muestras cuantitativas se tomaron con botella Shindler (capacidad: 10 L) dentro de los límites de la profundidad medida con disco de Secchi en cada período. Las muestras de fitoplancton se tomaron directamente del agua retenida en la botella y las de zooplancton se obtuvieron filtrando 30 L de agua a través de la red. Las muestras se preservaron con soluciones de Lugol y Transeau, respectivamente. Los procedimientos se ajustaron a los protocolos establecidos por Wetzel & Likens (1991).
Para determinar el nivel de productividad primaria en el reservorio La Chapa, se utilizaron botellas claras y oscuras en la zona limnética, con el fin de medir la relación entre producción y consumo de oxígeno durante un intervalo de tiempo. Para cada período evaluado se incubaron las botellas con sus respectivas réplicas en dos diferentes zonas de la columna de agua (profundidad medida con disco de Secchi y zona de compensación) durante 5 horas, tiempo que se determinó teniendo en cuenta que el rango óptimo de incubación es de 3 a 6 horas. Una vez retiradas las botellas, se determinó la concentración de oxígeno disuelto con el método Winkler. Para la determinación de la productividad primaria fitoplanctónica, se siguieron los protocolos presentados por Strickland & Parsons (1968), Wetzel & Likens (1991) y Ramírez (2000).
Fase de laboratorio
Para cada período evaluado se determinó el TRH teórico mediante la relación de volumen y caudal (Rueda, et al., 2006) según la ecuación 1:
R = V/Q (1), donde R es el TRH, V corresponde al volumen del reservorio (m3) y Q es la diferencia de caudal en el reservorio (m3/s).
Los métodos de medición del caudal para la entrada y cada una de las salidas fueron los siguientes.
En la entrada principal, toma de la quebrada La Chapa, se midieron las dimensiones de la rejilla y la velocidad de entrada mediante las ecuaciones 2, 3 y 4 (López-Cualla, 2003):
donde E (%): eficiencia, b (m): espaciamiento entre barras, s (m): diámetro de barra, AT (m 2 ): área total, Au(m 2 ): área útil, Q (m 3 /s): caudal, y V(m/s): velocidad.
En las salidas del rebosadero y el acueducto comunitario se midió el caudal directamente mediante el método volumétrico para cada muestreo.
En la salida por bombeo se determinó el volumen bombeado diariamente con base en los datos suministrados por el operador.
La identificación taxonómica de las poblaciones planctónicas se hizo hasta el nivel de género o especie con la ayuda de diferentes claves especializadas: para el fitoplancton, las de Tell (1980), Bourrelly (1981), Parra, et al. (1982; 1983), Starmach (1983), Sant'Anna (1984), Cox (1996), Castro & Bicudo (2007), y Bicudo & Menezes (2017), y para el zooplancton, las de Koste (1978), Gaviria & Aranguren-Riaño (2003), y Wallace, et al. (2006). Para los análisis cuantitativos se tuvieron en cuenta los protocolos referenciados en Wetzel & Likens (1991), De Paggi & Paggi (1995) y Ramírez (2000). El análisis de los rasgos morfológicos del fitoplancton se enfocó en la clasificación de los grupos funcionales basados en la morfología (GFBM) y la relación entre superficie y volumen de los taxones, según lo referenciado en Hillebrand, et al. (1999), Reynolds, et al. (2002), Sun & Liu (2003), y Kruk, et al. (2010), en tanto que los del zooplancton se analizaron teniendo en cuenta la variabilidad de las dimensiones corporales (largo y ancho) (Bottrell, et al., 1976; McCauley, 1984; Einsle, 1993) y algunas características biológicas como la duración del ciclo de vida, el tipo de alimentación y el hábitat (Pomerleau, et al., 2015).
Tratamiento de los datos
Los datos físicos y químicos se expresaron mediante los estadísticos de resumen de promedio aritmético, desviación estándar y coeficiente de variación (Zar, 1999) (Tabla 1S, https://www.raccefyn.co/index.php/raccefyn/article/view/1022/2746). Para las tendencias y relaciones de las variables fisicoquímicas en cada uno de los períodos hidroclimáticos evaluados, se empleó un análisis de componentes principales (ACP) (Ramírez, 1999). Mediante la prueba de Mann-Whitney se establecieron las diferencias en las medianas del biovolumen y la relación entre superficie y volumen del fitoplancton con respecto al TRH. Los análisis estadísticos se hicieron con en el programa PAST de acceso libre.
La diversidad funcional se estimó como una medida del espacio funcional ocupado por las especies según la expresión de los rasgos, considerando la riqueza funcional (FRic) y la divergencia funcional (FDiv) como descriptores (Villéger, et al., 2008). Los rasgos usados en el fitoplancton fueron el biovolumen celular, la relación entre superficie y volumen, la forma, la categoría de Kruk, y la categoría de Reynolds, y en el zooplancton fueron la longitud corporal, la alimentación, el ciclo de vida y el hábitat. Los descriptores de diversidad funcional se estimaron con el paquete FD en el programa RStudio (Laliberte, et al., 2014).
Para establecer la ordenación de los muéstreos en función de variables de relevancia ecológica como el TRH, la productividad primaria, la variación térmica superficie-fondo, y la riqueza taxonómica y funcional, se hizo un análisis de coordenadas principales (ACoP) basado en la distancia de Gower, la cual permite conservar la relación de distancia entre objetos en un sistema de coordenadas cartesianas (Legendre & Legendre, 2012).
Resultados
Tiempo de retención hidráulica (THR)
El TRH se clasificó según lo referenciado por Straskraba, et al. (1993): TRH<30 días, con mayores tasas de flujo y aumento de nutrientes en el sistema, y TRH>30 días, con disminución de nutrientes debido a la reducción de los flujos. Los períodos de febrero, marzo y abril presentaron un TRH>30 días, y mayo, junio y agosto un TRH<30 días. El TRH en el reservorio La Chapa presentó valores que oscilaron entre 5,73 y 50,04 días, siendo agosto y febrero los períodos de menor y mayor tiempo, respectivamente (Tabla 1).
Parámetros físicos y químicos
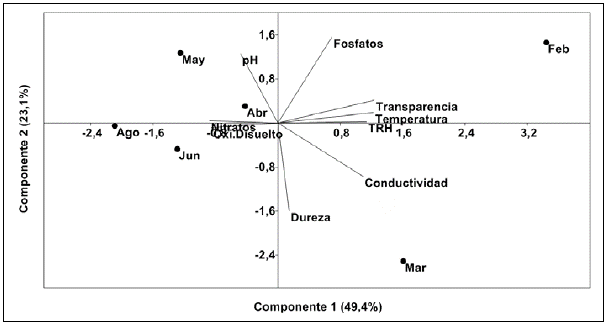
El análisis de componentes principales (ACP) (Figura 2) explicó el 72,5 % de la varianza de los datos: en el componente 1, el 49,4 % y en el componente 2, el 23,1%. Los parámetros con mayor correlación en el componente 1 fueron la transparencia (0,94) y la temperatura del agua (0,93), y en el componente 2, la dureza (-0,83) y los fosfatos (0,81). La ordenación permitió evidenciar que los períodos con un TRH<30 días se relacionaron con altos valores de oxígeno disuelto, nitratos y pH, pero con valores bajos de temperatura del agua y conductividad eléctrica, especialmente durante agosto. En contraste, los períodos con un TRH>30 días se relacionaron con una mayor temperatura y conductividad, pero con bajos valores de oxígeno disuelto en febrero y marzo. Las variables ambientales de mayor variación temporal fueron los fosfatos, los nitratos y la transparencia medida con disco de Secchi, con coeficientes de variación (CV) de 83, 60 y 33 %, respectivamente.
Estabilidad térmica y química
En general, los perfiles de temperatura evidenciaron un sistema polimíctico con mezcla en la noche. En cuanto al comportamiento del oxígeno disuelto, se evidenció una aparente estratificación química sostenida en los diferentes períodos, con reducción del contenido de oxígeno a partir de los 3 metros de profundidad (Figura 2S, https://www.raccefyn.co/index.php/raccefyn/article/view/1022/2743).
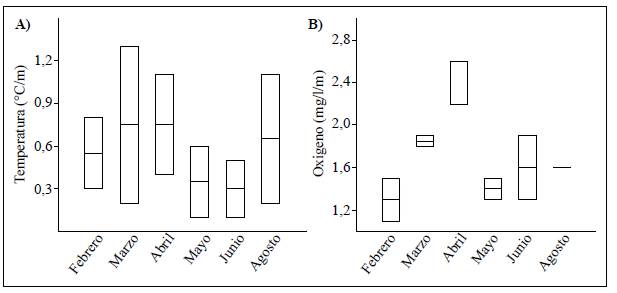
El cambio relativo de temperatura (Figura 3A) fue mayor durante los períodos con un TRH>30 días, siendo marzo el más importante, con 1,1 unidades de cambio de las 15:00 halas 6:30 h. En contraste, junio presentó el menor cambio relativo de temperatura, con 0,4 unidades en el TRH<30 días. El cambio relativo de oxígeno (Figura 3B) tuvo un comportamiento similar a la temperatura, pero febrero y abril presentaron el mayor cambio relativo de oxígeno durante el TRH>30 días, con 0,4 unidades de cambio de las 15:00 h a las 6:30 h. Durante el TRH<30 días se destacó agosto por no presentar cambio.
Comunidades planctónicas
Se identificaron 123 géneros de fitoplancton distribuidos en 56 familias, 33 órdenes, 15 clases y ocho divisiones. La clase Chlorophyceae fue dominante en todos los períodos evaluados, seguida de las clases Cyanophyceae, Trebouxiophyceae, Bacillariophyceae y Euglenophyceae. Se destacó la presencia de la clase Ulvophyceae en junio. Se observó que durante el TRH<30 días hubo una mayor riqueza de géneros comparada con el TRH>30 días, cuando fue menor (Figura 3S-A, https://www.raccefyn.co/index.php/raccefyn/article/view/1022/2744). De zooplancton se identificaron 15 taxones distribuidos en 11 familias y tres clases, sin embargo, solo tres especies se mantuvieron a lo largo del estudio. Al igual que el fitoplancton, la riqueza de géneros zooplanctónicos fue mayor en el TRH<30 días y menor durante el TRH>30 días (Figura 3S-B, https://www.raccefyn.co/index.php/raccefyn/article/view/1022/2744).
Las densidades más bajas en la comunidad fitoplanctónica se presentaron en los períodos con un TRH>30 días (Figura 4A), siendo el género Limnothrix sp. el de mayor densidad. ConTRH<30 días, el género Monoraphidium sp. dominó durante mayo y junio, y Cylindrospermopsis sp. en agosto. Se destacó la constancia de los géneros Limnothrix sp. y Monoraphidium sp. a lo largo de la investigación. El zooplancton (Figura 4B) también registró las densidades más bajas con los TRH>30 días; durante febrero y marzo dominaron los nauplios de Thermocyclops decipiens y en abril, Polyarthra sp. En todos los períodos con TRH<30 días, Polyarthra sp. aportó los valores más altos de densidad.
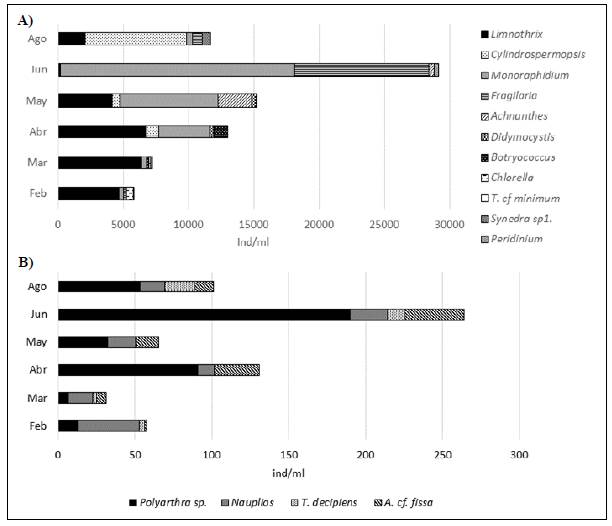
Figura 4 Densidad de los géneros dominantes del plancton en el reservorio La Chapa, Boyacá-Colombia. A. Fitoplancton. B. Zooplancton
En cuanto a la clasificación de grupos funcionales (Figura 4S, https://www.raccefyn. co/index.php/raccefyn/article/view/1022/2745), entre las especies fitoplanctónicas más abundantes se identificaron nueve de los grupos propuestos por Reynolds (2002). El codón XI (entornos poco profundos y grupos algales de la clase Chlorophyceae) se registró en todos los períodos con géneros como Chlorella sp., Monoraphidium sp. y Didymocystis sp., y el codón SI (ambientes turbios y especies Cyanoprocariontes) con representantes del género Limnotrhrix sp. El codón funcional J (ambientes profundos y enriquecidos), fue el único registrado en febrero, con representantes del género Tetraedron sp. Por su parte, el codón F (ambientes con aguas claras) se presentó en los períodos de marzo y abril, con un TRH>30, representado por el género Botryococcus sp. Durante los TRH<30 días, en mayo y junio se registró el codón R (ambientes no estratificados y profundos), con representantes del género Achnanthes sp. En junio se presentan estrategias de vida diferentes, ya que se encontró el grupo funcional de TRH cortos (codón R), reapareció el codón Lo, característico de ambientes profundos, con representantes del género Peridinium sp., y se registró nuevamente el grupo P, con representantes del género Fragilaria sp.
En la tabla 2S, https://www.raccefyn.co/index.php/raccefyn/article/view/1022/2747, se presentan los detalles de los atributos morfométricos los géneros más abundantes de fitoplancton con los valores promedio de los rasgos y la asignación a los grupos funcionales basados en la morfología (GFBM).
No se encontraron diferencias estadísticamente significativas en el biovolumen y la relación entre superficie y volumen del fitoplancton con respecto al TRH (Mann-Whitney: p=0,68; p>0,05). Sin embargo, se evidenciaron tendencias que relacionaban los TRH<30 días con el establecimiento de algas con elevada relación entre superficie y volumen y los TRH>30 días, algas con valores de relación entre superficie y volumen menores. El biovolumen tendió a aumentar con el TRH>30 días.
Con respecto a la morfometría del zooplancton, la longitud de Polyarthra sp. osciló entre 74 y 89 um y el ancho entre 55 y 61 um; enAnuraeopsis. cf. fissa la variación fue de 71 a 73 um en la longitud y 41 a 45 um en el ancho; por último, la longitud de T. decipiens osciló entre 1.009 y 1.091 um y el ancho entre 231 y 242 um. Al relacionar las medidas con el TRH, se evidenció que durante el TRH>30 días, T. decipiens y A. cf. fissa presentaron un menor tamaño comparado con el TRH<30 días. En cuanto a Polyarthra sp., la variación de las medidas no permitió establecer una tendencia frente a los TRH.
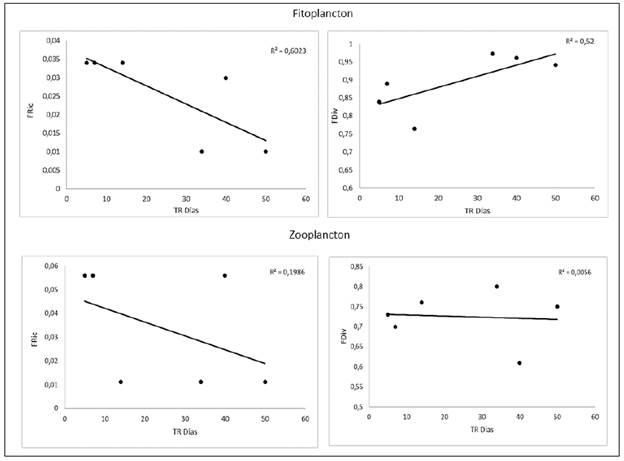
La diversidad funcional del fitoplancton y el zooplancton en relación con la expresión del TRH se presenta en la figura 5. En general, la riqueza funcional fue alta en los períodos con TRH<30 días, en contraste con lo observado en la divergencia funcional. Esta tendencia fue más relevante en el fitoplancton.
Metabolismo
En la tabla 3S, https://www.raccefyn.co/index.php/raccefyn/article/view/1022/2748, se evidencia cómo la productividad primaria bruta (PPB) durante el estudio fue menor en los períodos con TRH>30 días, lo que coincidió con la baja densidad fitoplanctónica en estos períodos. En los TRH<30 días, agosto registró la mayor PPB (182 mg C/m3/h) y se asoció con el TRH más bajo (5,73 días).
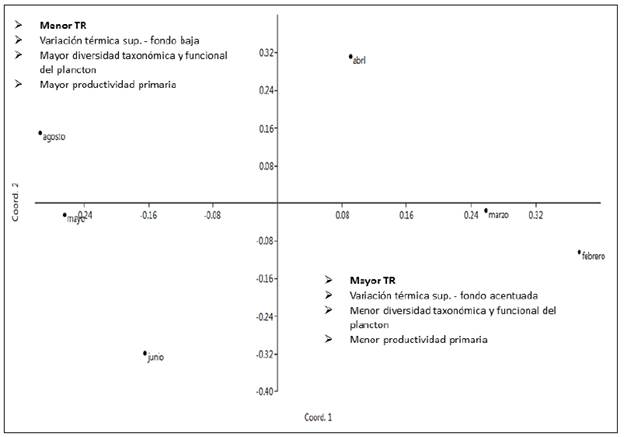
En el diagrama biplot de la figura 6 se observan las dos primeras coordenadas principales que explican el 85 % de la varianza (C1: 54 %, C2: 31 %). El TRH se confirmó como una variable importante en la ordenación y la expresión de las demás variables consideradas en el análisis, lo que es evidencia de su relevancia en el funcionamiento del reservorio.
Discusión
Los efectos ecosistémicos asociados con el cambio en el TRH fueron evidentes en el reservorio La Chapa durante el estudio, lo que se reflejó en las expresiones física, química y biológica, así como en la productividad primaria. En general, se identificaron dos momentos contrastantes asociados con el TRH: en aquellos con mayor TRH predominaron procesos de regulación interna asociados con un mayor contenido de luz y energía térmica, una baja concentración de nitratos y una acentuada reducción del oxígeno en profundidad. En este tiempo se evidenció una simplificación de las comunidades, con tendencia a una menor diversidad taxonómica y funcional. En los períodos con menor TRH, el ambiente fue más variable y, por lo tanto, más dependiente de condiciones alóctonas menos pre-decibles (Wetzel, 2001), con una expresión biológica más diversa en lo taxonómico y funcional, lo que se podría entender como el efecto positivo del disturbio en grado medio sobre la riqueza de taxones (Connell, 1978; Padisak, 1993).
Las condiciones físicas y químicas de las aguas en el reservorio durante los períodos con TRH>30 días favorecieron el establecimiento y la dominancia de la clase Cyanophyceae, representada por el género Limnotrhrix sp. Se ha reportado la tolerancia de Limnotrhrix sp. a un amplio rango de condiciones, por ejemplo, ambientes estables y con limitación de nutrientes (Rücker, et al., 1997; Rose, et al., 2018), sin embargo, en agosto, con el TRH más corto del estudio, se presentó una mayor dominancia del género Cilindrospermopsis sp., seguido de Limnotrhrix sp. Es importante resaltar que el GFBM VII (Botryococcus sp.) alcanzó en este estudio un gran biovolumen, especialmente durante los TRH>30 días. La presencia y dominancia de estas especies potencian la probabilidad de eventos de floraciones nocivas en el reservorio (Kruk, et al., 2010). Teniendo en cuenta las predicciones hechas en situaciones de cambio climático, se puede inferir que los períodos prolongados de sequía y los cambios en las condiciones abióticas del ecosistema acuático, como el aumento de la temperatura, pueden favorecer el establecimiento de algas nocivas como las cianobacterias, lo que representa una importante amenaza para el suministro del agua (Wagner & Adrian, 2009; Kosten, et al., 2012).
En cuanto a la comunidad zooplanctónica, los rotíferos presentaron la mayor densidad y riqueza, lo cual concuerda con los resultados de Aranguren-Riaño & Monroy-González (2014) en el mismo sistema, sin embargo, los taxones dominantes en el estudio de estos autores difiere con lo hallado en este, pues Polyarthra sp., los nauplios de T. decipiens y A. cf. fissa presentaron las densidades más altas, y se registró, además, la ausencia de los cladóceros Moina micrura y Bosmina longirostris reportados anteriormente. Esta inestabilidad de las comunidades planctónicas puede atribuirse a la gran variabilidad temporal del ecosistema que permite la presencia de especies constantes, ocasionales y efímeras (Aranguren-Riaño & Monroy-González, 2014). Un hábitat altamente fluctuante con un TRH<30 días favorece el establecimiento de organismos con ciclos de vida cortos que se adaptan a un amplio rango de condiciones ambientales, como los rotíferos (Esteves, et al., 2011; De Senerpont Domis, et al., 2013). Por otra parte, la disminución del tamaño corporal de T. decipiens y A. cf. fissa coincidió con el aumento en la temperatura del agua durante los TRH>30 días, así como con los resultados obtenidos para los copépodos por Havens, et al. (2015) y Rice, et al. (2015).
Es importante resaltar que las especies de zooplancton identificadas en este estudio no preferirían especies fitoplanctónicas de gran porte, lo que favorecería la preponderancia de las algas filamentosas (Reynolds, et al., 2014; Colina, et al., 2016). La eficiencia en la trasferencia de energía del fitoplancton al zooplancton declina con el aumento del TRH y, por lo tanto, se espera que las tasas de reproducción del zooplancton disminuyan (Straskraba, et al., 1993). En contraste, con un TRH<30 días el aumento en la diversidad y densidad de especies fitoplanctónicas de menor porte coincide con un aumento considerable de la densidad de las poblaciones zooplanctónicas, como se evidenció en el muestreo de junio.
La relación negativa de la riqueza funcional con el TRH, especialmente evidenciada en el fitoplancton, resalta la marcada y variada capacidad de respuesta que pueden expresar las algas ante disturbios de mayor frecuencia (Reynolds, et al., 2014). La mayor riqueza funcional en los momentos de bajo TRH se interpreta como un mayor espectro de rasgos en el espacio funcional cuando las condiciones son más variables (Villéger, et al., 2008). En el zooplancton esto no es tan evidente debido a que los ciclos de vida son más largos y complejos (Urban, 2004).
La PPB en este estudio puede considerarse moderada comparada con los valores obtenidos en diferentes ecosistemas acuáticos colombianos, lo que coincide con la PPB de otros embalses (Ramírez & Alcaráz, 2002; Montoya & Aguirre, 2010) y se relaciona con la circulación permanente de los sistemas polimícticos, pues en ambientes poco profundos, como el del reservorio La Chapa, predominan estratificaciones débiles durante el día y procesos de mezcla en la noche. Sin embargo, considerando que en sistemas acuáticos con temperaturas medias mayores a 20°C no es necesaria una amplia diferencia de temperatura en la columna de agua para generar estratos, se logró evidenciar cambios de temperatura entre superficie y fondo oscilaron entre 2 y 4 °C (Roldán-Pérez & Ramírez-Restrepo, 2008). El aumento de la PPB reportada con TRH<30 días podría estar vinculado con el aumento de flujos durante los momentos hidrológicos intensos, que permiten a los macronutrientes como el fósforo movilizarse dentro del sistema y estar biodisponibles para las algas planctónicas (Straskraba, et al., 1993; Carpenter, et al., 1998), lo que se comprobó en este estudio con el aumento de su riqueza y densidad durante estos períodos. En contraste, la alta retención de nutrientes en los sedimentos en lagos y embalses durante la época seca (Donald, et al., 2015) podría asociarse con la reducción de la PPB durante los TRH>30 días. Se puede inferir que las fluctuaciones temporales en la diversidad taxonómica y funcional de las comunidades planctónicas y la productividad primaria se ven fuertemente influenciados por factores abióticos como la hidrología, tal como lo señalan Feresin, et al. (2010), Rangel, et al. (2012) y Rangel, et al. (2016).
Conclusiones
Las respuestas de la comunidad planctónica a la variación del TRH durante el estudio se evidenciaron en el comportamiento de la diversidad taxonómica y funcional. La menor estabilidad del sistema durante los TRH bajos promovió la riqueza de especies y de rasgos funcionales, lo que sería respuesta a la incidencia positiva del disturbio en la diversidad en contraste con los resultados observados en los períodos con mayor TRH. Sobresalen las cianobacterias y los rotíferos como los grupos con mayor capacidad de ajuste a los cambios ambientales del sistema. Se concluye que el estudio del TRH y sus efectos es relevante para comprender el funcionamiento de los sistemas acuáticos, particularmente la complejidad de la organización de las comunidades planctónicas en ambientes como el reservorio La Chapa y constituye una herramienta útil en la gestión de los recursos hídricos.