Introducción
En los ecosistemas acuáticos la presencia de contaminantes orgánicos o inorgánicos modifican las características físicas y químicas del agua, lo cual puede afectar directamente la diversidad y distribución de las especies acuáticas (Roldán & Ramírez, 2008). La diversidad se ve influenciada por la adaptación de las diferentes especies al ecosistema y a los cambios que ocurran en él, ya sea que se deban a perturbaciones naturales o antrópicas, por lo que, para comprender los mecanismos de respuesta de las comunidades ante posibles alteraciones del ambiente, es imprescindible investigar los vínculos entre el ambiente y la diversidad (Rivera & Donato, 2008).
Al evaluar la calidad de los ecosistemas acuáticos es conveniente complementar el análisis de las variables físicas y químicas con estudios de la biota. En los últimos años se han venido implementando métodos de evaluación de la calidad del agua basados en la utilización de comunidades biológicas (García, et al., 2017). Estas comunidades u organismos se denominan organismos indicadores. Pinilla (2000) considera que un indicador biológico acuático es una especie cuya presencia y abundancia señalan algún proceso o estado del sistema en el cual habita.
El perifiton tiene características que lo convierten en un grupo ideal para el biomonitoreo de la calidad de las aguas tales como la imposibilidad de evadir la polución por encontrarse adherido a un sustrato generalmente fijo, lo que refleja los rasgos históricos del lugar y permite describir los patrones de distribución como respuesta a las condiciones ambientales (Biggs, 1998). Wetzel (2001) define el perifiton como una compleja comunidad de microbiota (bacterias, hongos, algas, protozoos y animales) y detritos orgánicos e inorgánicos adherida a un sustrato sumergido, natural o artificial. En la composición del perifiton la fracción conformada por algas y cianobacterias es la principal, por lo que se la conoce como fitoperifiton, ficoperifiton, fitobentos o algas y cianobacterias bentónicas.
Sin embargo, el estudio integral del perifiton se torna arduo y dispendioso, ya que es una comunidad con un agrupamiento complejo debido al alto número de organismos que la constituyen, a su variada arquitectura en mínimas superficies, a los diferentes sustratos colonizables y a su variación estacional, sumado todo ello a los cambios sucesionales relacionados con los ciclos de vida de sus integrantes (Montoya, et al., 2008).
Entre los estudios sobre fitoperifiton en Colombia se pueden mencionar los de Sala, et al. (1999), Martínez & Donato (2003), Díaz & Rivera (2004), Zapata & Donato (2005), Montoya & Ramírez (2007), Bustamante, et al. (2008), Sala & Ramírez (2008), Morales & Castro (2010), Pedraza & Donato (2011), y Andramunio (2013), pero sobre la región andino amazónica colombiana solo se cuenta con el trabajo de Ricaurte, et al. (2015), quienes hicieron un primer acercamiento a la comunidad algal en varios humedales de esta región.
En este contexto, el estudio analizó la distribución espacial de la diversidad y la bio-masa de la comunidad fitoperifítica, así como de los factores ambientales que la afectan, en diferentes tramos del gradiente altitudinal del río Hacha, principal ecosistema hídrico de la ciudad de Florencia, ya que sus aguas se utilizan para una variedad de actividades, entre los que se destacan el abastecimiento, la recreación y la recepción de las aguas residuales urbanas sin tratar de la mayor ciudad de la Amazonia colombiana (Peláez, et al., 2011). Los resultados aquí expuestos amplían el conocimiento sobre esta comunidad en los ecosistemas acuáticos de la región y constituye la línea de base para el desarrollo de futuros estudios sobre el fitoperifiton como potencial indicador de la calidad del agua en los sistemas lóticos andino amazónicos.
Materiales y métodos
Area de estudio
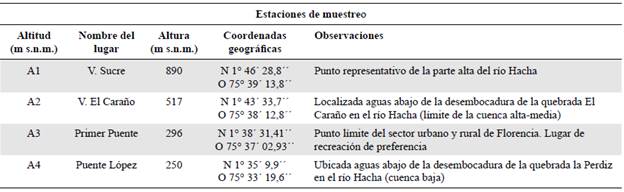
El estudio se hizo en el cauce del río Hacha, en el municipio de Florencia, departamento de Caquetá, Colombia (Figuras 1 y 2), cuya longitud aproximada es de 66,7 km y una cuenca de 430,51 km2, equivalente a 18,62 % del territorio del municipio. Las principales quebradas que vierten sus aguas al río Hacha son Paraíso, El Caraño, Las Doradas, El Dedo, La Yuca y La Perdiz, siendo esta última la principal receptora de las aguas residuales del casco urbano de la ciudad (Peláez, et al., 2006). Según la clasificación de Holdridge (1967), la cuenca del río Hacha se ubica en un clima de bosque húmedo tropical caracterizado por su alta pluviosidad, temperatura y humedad y un régimen pluviométrico monomodal. Asimismo, por su ubicación geográfica en el sector noroccidental de Florencia, la cuenca tiene su mayor área en la ladera de la cordillera Oriental y es menor la de la planicie amazónica (Corpoamazonia & Universidad de la Amazonia, 2006). Teniendo en cuenta su perfil topográfico y los usos del suelo en sus márgenes, se eligieron cuatro estaciones como sitios de muestreos (Tabla 1).
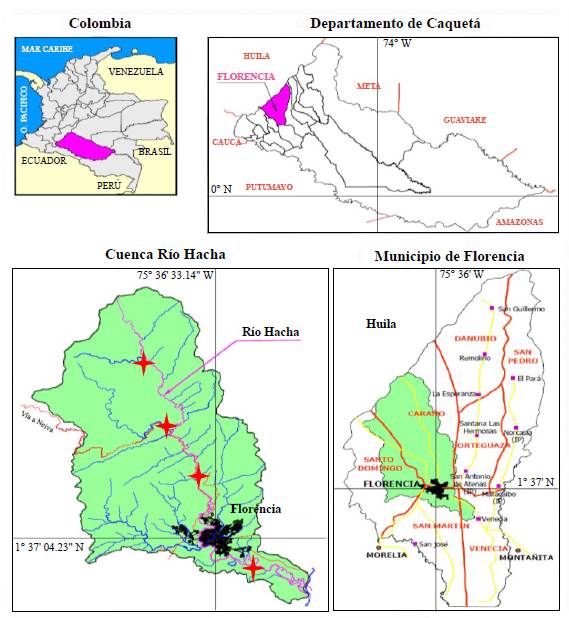
Figura 1 Localización geográfica de la cuenca del río Hacha en su paso por el municipio de Florencia Caquetá - Colombia (Corpoamazonia y Universidad de la Amazonia 2006). Se identifican las estaciones de muestreo con estrellas rojas.
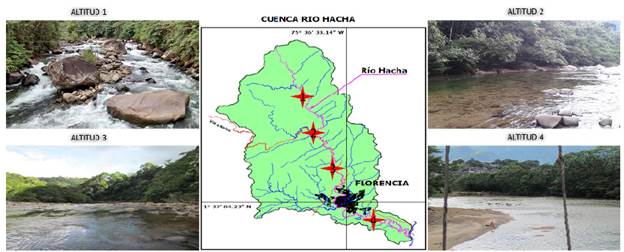
Figura 2 Localización geográfica de la cuenca del río Hacha en su paso por el municipio de Florencia (Corpoamazonia y Universidad de la Amazonia 2006). Se identifican las estaciones de muestreo con estrellas rojas e imágenes fotográficas.
Fase de campo
Durante el 2014 se realizaron cinco campañas de muestreos del perifíton adherido al sustrato rocoso en dos épocas con diferente nivel de precipitación: fin de la época de menor precipitación (de febrero a marzo) y fin de la estación de mayor precipitación (de septiembre a noviembre). Se fijó un área de 10 m de longitud por estación de muestreo, se seleccionaron al azar rocas en zonas de corriente y de cada una se tomó una muestra de 4 cm2 de área con ayuda de un cepillo de cerdas suaves; las muestras se preservaron en frascos plásticos de color ámbar de 250 ml de capacidad con solución Transeau en un volumen de 1:1.
Muestras adicionales del material perifítico (sin preservar) se almacenaron en botellas ámbar de polietileno, se refrigeraron y se mantuvieron en oscuridad hasta el momento de su procesamiento (Sabater, 1988) para medir la clorofila a y emplearlas para estimar la biomasa utilizando el método desarrollado por la International Organization for Standardization (ISO, código 10260). Los resultados con este método espectrofotométrico son muy coherentes con los modelos de regresión, en contraste con el método fluorométrico, y son de utilidad para describir patrones espaciales y temporales de la comunidad algal y cianobacterial (Rivera, et al., 2005).
El registro de las variables ambientales se hizo con base en los datos in situ de pH, conductividad, turbidez, temperatura del agua y oxígeno disuelto (OD) y la ayuda de medidores multiparámetro; se tomaron muestras para la determinación en laboratorio de la demanda biológica de oxígeno (DBO) y de nutrientes (ortofosfatos, nitrógeno amoniacal, nitratos).
Fase de laboratorio
La DBO y los nutrientes se analizaron siguiendo la metodología de Manrique & Peláez (2013), adaptada para sistemas andino amazónicos. Para la cuantificación de la comunidad del fitoperifiton se utilizó un microscopio óptico binocular (NIKON E-200) con métodos directos, una magnificación de 40 X y 100 X, y portaobjetos y cubreobjetos de 24 x 50 mm. Posteriormente, se agitó el contenido y se tomaron gotas de la muestra (0,05 ml aproximadamente). Se establecieron 30 campos de observación según la curva de acumulación de especies (Uehlinger, 1964). Se consideró como unidad de recuento la forma unicelular con filamentos ramificados largos o cortos, o sin ellos, y las formas pedunculadas.
La determinación de los taxones se hizo hasta el nivel de morfoespecie a través de las claves y descripciones de Bourrely (1970), Krammer & Lange-Bertalot (1991), Cox (1996), Komárek & Anagnostidis (1999), Ramírez (2000), Komárek & Anagnostidis (2005), y Bicudo & Menezes (2006).
Se usó la expresión de Ross (1979) para la cuantificación de organismos por mililitro, valor que se relacionó con el área de muestreo considerada para obtener la densidad de organismos por cm2. La abundancia relativa de la comunidad fitoperifítica por unidad de área se obtuvo a partir del número de individuos recolectados de cada género y su relación con el número total de individuos de la muestra y se utilizó para establecer la importancia y la proporción de cada género con respecto a la comunidad.
La biomasa se determinó mediante la concentración de clorofila a del fitoperifiton siguiendo las recomendaciones de Power (1984), Sabater (1988) y Gaxiola (2010) y utilizando filtros de fibra de vidrio Whatman® GF/C de 0,47 |im de diámetro. La clorofila a se extrajo con solución acuosa de acetona al 90 % durante 24 horas. Posteriormente, las absorbancias se obtuvieron con espectrofotómetro y longitudes de onda de 663, 664, 665 y 750 nm, y lecturas antes y después de acidificar con HCL. Como blanco se utilizó la misma acetona al 90 % usada en la extracción. Para calcular los valores de clorofila a se utilizó la fórmula propuesta por las American Public Health Association-American Water Works Association-Water Environment Federation (APHA-AWWA-WEF, 1989).
Análisis de datos
En cada uno de los muestreos se determinó el número de individuos por morfoespecies y la biomasa. Se hizo un análisis de varianza multivariado (prueba de Lambda-Wilks) para evaluar el efecto de las variables ambientales sobre la comunidad perifítica y se usaron matrices de biomasa, composición, abundancia y valores de los índices ecológicos de Shannon-Wiener (H'), así del índice de dominancia de Simpson (D) (Villareal, et al., 2004), cuyos valores se separaron a través de una prueba de Hotelling con 5 % de nivel de significación. Asimismo, con el fin de analizar el grado de asociación entre las variables evaluadas, se recurrió a dos análisis de correlación canónica: uno entre las variables ambientales y la variable de biomasa del itoperiiton, y otro entre las variables ambientales y las variables de composición y abundancia y los valores de los índices ecológicos.
También se hizo un análisis de componentes principales (ACP) para determinar las variables ambientales con más peso en la diferenciación de las variables biológicas en las cuatro altitudes y para cada época de muestreo y a partir de un gráico biplot, se analizó dicha relación. Por último, mediante un análisis de Procrustes generalizado se determinó el grado de consenso entre los datos de las variables biológicas y las variables físicas y químicas del agua. Las pruebas estadísticas se realizaron en el programa InfoStat, versión 2013 (Di Rienzo, et al., 2013).
Resultados
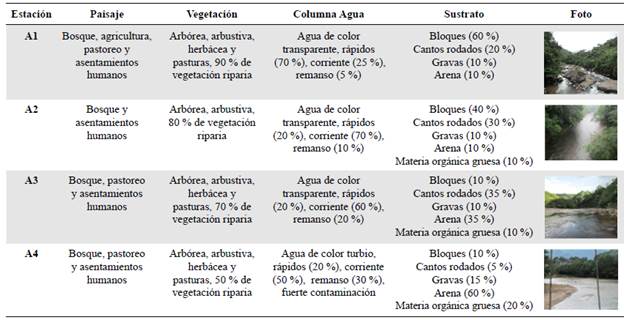
En la tabla 2 se detallan diferentes componentes que caracterizan cada una de las altitudes de estudio. En general, las altitudes A1, A2 y A3 presentan un alto grado de conservación de los bosques en sus riberas y el lecho del río dominado por sustratos duros que van cambiando a medida que se baja por el cauce del río Hacha. En la altitud A4 se observó una gran cantidad de fuentes contaminantes, principalmente vertimientos de aguas residuales domésticas urbanas, pero aún algo de vegetación riparia. Allí la conformación del lecho del río cambia signiicativamente pasando a predominar la arena y el fango (Peláez, et al., 2006).
Tabla 2 Descripción del paisaje en las altitudes (estaciones) de muestreo. Se describe la estructura del paisaje y la hidrogeomorfología del río en cada una de las altitudes.
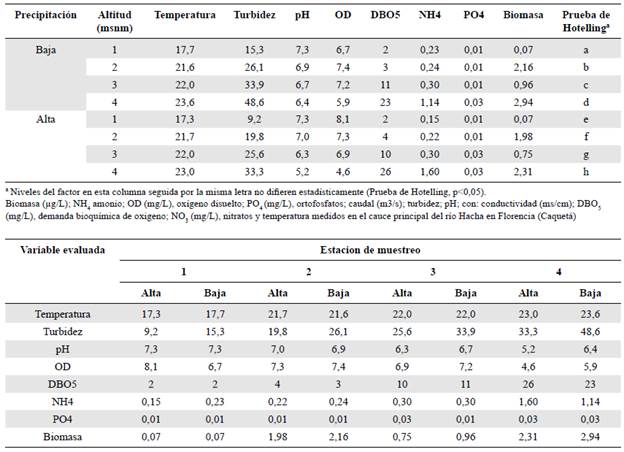
Los valores promedio de las principales características físicas y químicas del agua y de biomasa del fitoperifiton en cada una de las altitudes y épocas (alta y baja precipitación) en el cauce del río Hacha se presentan en la tabla 3. Todas la variables evaluadas difirieron estadísticamente (Lambda-Wilks, p<0,05) según el gradiente altitudinal y la época de precipitación. Se evidenció un gradiente creciente de turbidez, DBO, temperatura y amonio, así como valores decrecientes de oxígeno disuelto, a medida que se descendía hacia las menores altitudes en los dos períodos analizados. Desde el punto de vista temporal, se observaron mayores valores de biomasa en el punto de muestreo de Puente López en las dos épocas de muestreo.
Tabla 3 Medias del análisis de varianza multivariado de las principales características físicas, químicas y de biomasa del fitoperifiton medidas en la cuenca del río Hacha en Florencia (Caquetá) considerando las altitudes y las dos épocas de precipitación
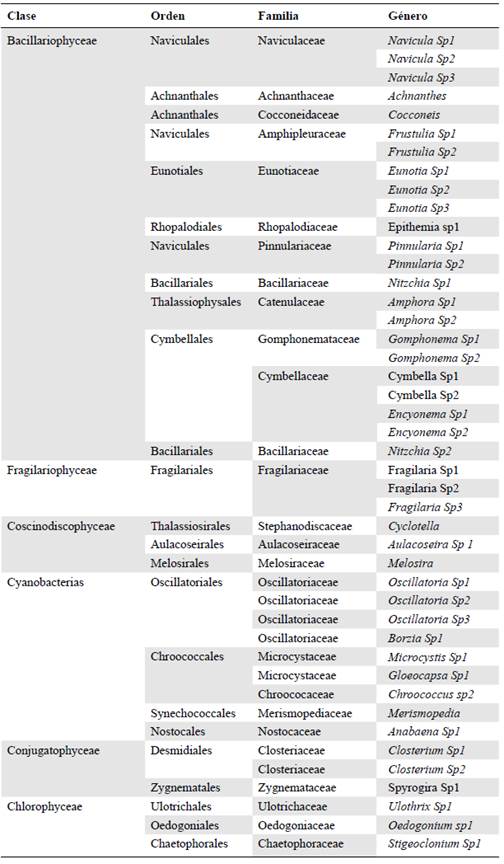
En cuanto a la composición de la comunidad fitoperifítica, se registraron 44 mor-foespecies agrupadas en 29 géneros, 26 familias, 19 órdenes y 6 clases (Tabla 4). De estas, la clase Bacillariophyceae fue la de mayor distribución altitudinal y registró el 52,3 % de las morfoespecies seguida de Cyanobacteria (20,4 %) y las clases Fragilariophyceae, Coscinodiscophyceae, Chlorophyceae y Conjugatophyceae, con un 6,8 % cada una. Las morfoespecies que presentaron mejor distribución y la mayor abundancia fueron Spyrogira Sp1 y Oscilatoria Sp1, (27 y 21 %, respectivamente) en todas las estaciones y épocas de muestreos. Asimismo, en la época de precipitación alta se presentaron los mayores valores de riqueza de la comunidad del fitoperifiton, siendo la estación A4 la de menor valor de riqueza y las estaciones A1 y A2 las de mayor diversidad.
Tabla 4 Composición de la comunidad fitoperifítica presente en el cauce principal del río Hacha, Florencia (Caquetá)
Según el análisis de correspondencia canónica (Tabla 5), entre la variable de biomasa fitoperifítica y las variables ambientales hubo una alta correlación significativa con respecto al gradiente altitudinal y la época de precipitación (r=0,99; p<0,001). Las variables de turbidez, temperatura y conductividad tuvieron mayor influencia positiva sobre la biomasa según las correlaciones de Pearson.
Tabla 5 Coeficientes de correlación múltiple de la biomasa fitoperifítica y las principales características físicas y químicas medidos en el río Hacha en Florencia (Caquetá). Pearson (r) (arriba en la diagonal) y valores de probabilidad (p) (abajo en la diagonal).
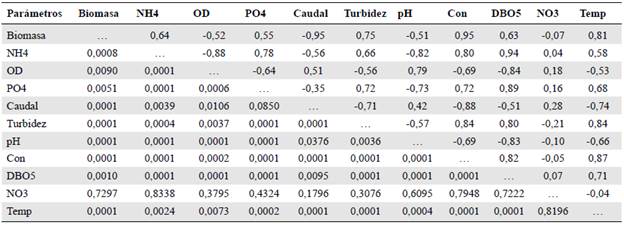
Biomasa (μg/L); NH4, amonio; od, oxígeno disuelto; po4, ortofosfatos; caudal; turbidez; ph; con, conductividad; dbo5, demanda biológica de oxígeno no3, nitratos y temperatura medidos en el cauce principal del río Hacha en Florencia (Caquetá). *p<0,05; significativo; **p<0,01, muy significativo; NS, no significativo
El análisis de correlación canónica entre las variables ambientales y las biológicas demostró que una alta correlación significativa con el gradiente altitudinal y la época de precipitación (r=0,95; p<0,01). Esta correlación se presentó principalmente en la época de alta precipitación, cuando en las altitudes A1 y A2 (estaciones de Sucre y Caraño, respectivamente) el índice de Shannon registró una relación significativa inversa con las variables del índice de Simpson, DBO5 y amonio (NH4), y de manera directa, con las variables de pH y oxígeno disuelto (OD). De igual forma, el índice de Simpson se vio influenciado inversa y muy significativamente por las variables pH y oxígeno disuelto (OD), y de manera positiva, con las variables de amonio (NH4), DBO5 y turbidez (Tabla 6).
Tabla 6 Coeficientes de correlación de Pearson para baja precipitación (arriba en la diagonal) y alta precipitación (abajo en la diagonal) de las principales características biológicas en la comunidad fitoperifítica y de las variables físicas y químicas medidas en el cauce del río Hacha, Florencia (Caquetá)
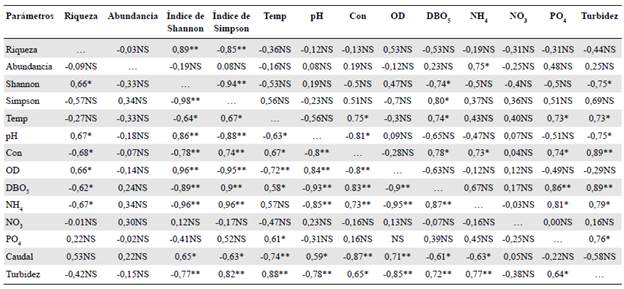
Riqueza; abundancia; riqueza, abundancia, índice de Shannon-Weaver, Índice de Simpson, temp, temperatura, ph, con, conductividad; dbo5, demanda biológica de oxígeno; no3, nitratos; nh4, amonio; po4, ortofosfatos y temperatura medidos en el cauce principal del río Hacha en Florencia (Caquetá). *p < 0.05; significativo; **p < 0.01, muy significativo; NS, no significativo.
Estos resultados se presentan gráficamente en detalle (Figura 3) con el análisis de componentes principales (ACP) en las cuatro altitudes y las dos épocas de muestreo, y explican más del 90 % de la variación de los datos en los dos primeros ejes. A partir del gráfico del biplot del ACP para las variables ambientales y biológicas del agua del río Hacha, se pudieron evidenciar dos grupos que se discriminaron con base en los descriptores de la altitud a la cual se recolectaron las muestras de agua.
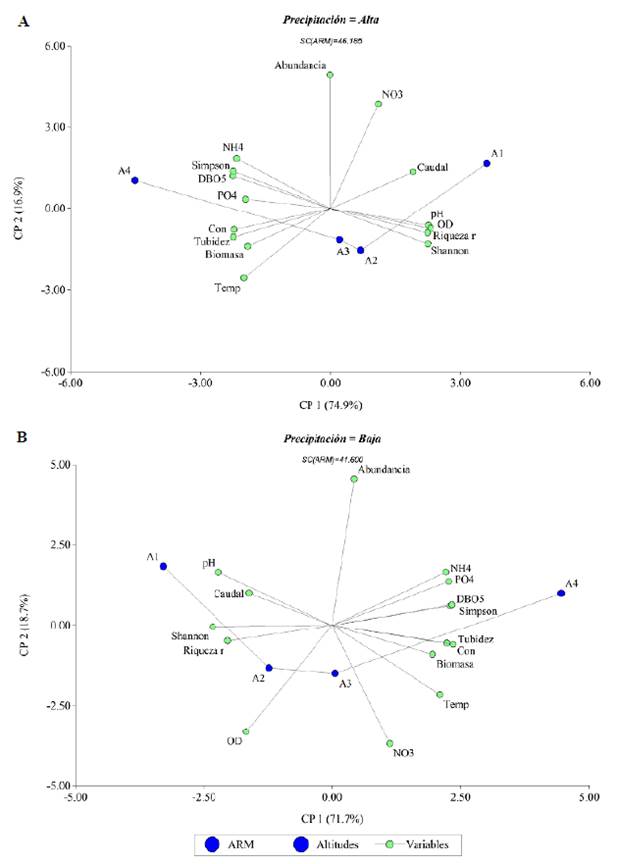
Figura 3 Ordenación de las altitudes en el espacio multidimensional de las variables físicas, químicas y biológicas. El "biplot" muestra la relación de las variables físicas, químicas y biológicas con las altitudes. A1 (Sucre); A2 (Caraño); A3 (Primer Puente); A4 (Puente López). A. Precipitación Alta. B. Precipitación Baja.
En la época de alta precipitación puede apreciarse que el primer componente (CP1) separó A4 (Puente López) del resto de las altitudes. En dicha altitud se asociaron negativamente las variables de conductividad, PO4, turbidez, DBO5, biomasa, Simpson, temperatura y NH4. Las altitudes A1 y A2 (Sucre y el Caraño, respectivamente) se asociaron con la variabilidad restante en este mismo componente en el extremo positivo.
En la época de baja precipitación puede verse que, en general, el primer componente (CP1) se asoció negativamente con las variables pH, Shannon y riqueza correlacionadas con la altitud A1 (Sucre). Con este mismo componente en el extremo positivo se asociaron las variables de turbidez, Simpson, DBO5, conductividad, biomasa, ortofosfatos y amonio, correlacionadas con la altitud A4 (Puente López). Los nitratos y el OD se relacionan con la altitud A3 (Primer Puente) y A2 (Caraño), respectivamente. La abundancia no presentó correlación en ninguna de las épocas, con excepción de los nitratos (NO3) en época de alta precipitación.
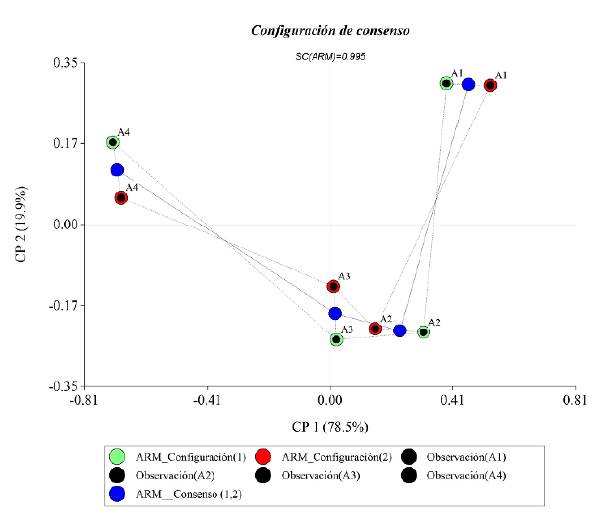
Por último, esto se corroboró el consenso de Procrustes de 96 % entre los descriptores biológicos, físicos y químicos y las altitudes de muestreo (Figura 4). Los valores indican que la variabilidad se explica a través de los ejes 1 y 2 de la descomposición de la matriz de consenso; las altitudes que tuvieron mayor consenso fueron A1 (0,601) y A4 (1,02), y la de menor consenso fue la altitud A3, con 0,09.
Discusión
El río Hacha es el principal ecosistema acuático del municipio de Florencia, ya que es la fuente principal de consumo de agua potable y de recreación de sus habitantes. Históricamente ha sufrido perturbaciones de origen antrópico, como la deforestación, la expansión ganadera y los vertimientos de aguas residuales (tramo que transcurre por la ciudad de Florencia), que han aumentado la carga de contaminantes en el cuerpo de agua (Peláez, et al., 2006, 2011). De acuerdo con Corpoamazonia y Universidad de la Amazonia (2005), para el año 2002 se estimaba en 52,25 % el área total de la cuenca con bosques naturales, con una tasa de deforestación anual de 3.578 ha/año, situación que menta monitorear el estado ecológico de este importante ecosistema acuático de la región.
El río Hacha presenta dos biomas, la zona andina, ubicada en la cuenca alta y media y, la zona de planicie amazónica en la cuenca baja. La zona andina es un área de cordillera con procesos de meteorización de rocas que se depositan en el cauce del río, disminuyendo su tamaño por erosión, fragmentación y cambios geomorfológicos, hasta llegar a materiales finos (arenas, limos y arcillas). Estos cambios geomorfológicos sucesivos en los ecosistemas lóticos se acompañan de otros en las características físicas y químicas de las aguas, las comunidades y la vegetación riparia (Allan & Castillo, 2007).
En el análisis del consenso de Procrustes entre los descriptores biológicos, ambientales y las altitudes de muestreo se puede observar que las condiciones en la altitud A1 se diferenciaron marcadamente de las de A4 (ya que cada altura está en un extremo del gráfico), en tanto que las altitudes A2 y A3 estuvieron próximas (características semejantes). Esto corrobora la misma discrepancia evidenciada mediante el ACP entre las altitudes, que en el comportamiento de las altitudes A1 a A4 estaría influenciada por el uso de la tierra, ya que en la altitud A1 se encuentra un área de explotación agropecuaria a pequeña escala con algunos asentamientos humanos, en tanto que la altitud A4 recibe las descargas de aguas residuales sin tratar de la ciudad de Florencia, condición que se refleja en los valores altos de conductividad, nitrógeno amoniacal, DBO5 y ortofosfatos y en la disminución de los valores de oxígeno disuelto y pH registrados en este tramo.
En la estación A4 confluyen tributarios como la quebrada La Perdiz (principal recolector de aguas residuales de la cuidad) y la quebrada El Dedo (Manrique & Peláez, 2010). El aumento de las concentraciones de nutrientes, conductividad y DBO es un indicio de la alteración de la masa del agua (Marín, 2006), al igual que la disminución del oxígeno disuelto y el pH (Volgaropoulos, et al., 1987), lo que puede acarrear una alteración del estado ecológico del río Hacha e influir en la dinámica de la comunidad de fitoperifiton (Roldán & Ramírez, 2008), lo que se manifiesta en la ausencia de organismos sensibles o la presencia de organismos tolerantes a la contaminación (Vivas, et al., 2002).
Los valores promedios de ortofosfatos en la A4 (0,03 mg.l-1) sugieren características eutróficas en las dos épocas de muestreo (Agencia de Protección Ambiental de los Estados Unidos de América (USEPA) en Ramírez & Viña, 1998). Los valores de riqueza se vieron afectados por la concentración de nutrientes y DBO. De hecho, los menores valores de riqueza se asociaron con la menor calidad del agua en A4, con una alta DBO y elevadas concentraciones de amonio, lo que se tradujo en los menores valores de riqueza y la ausencia de géneros como Aulocoseira Sp 1, Achnanthes Sp1, Melosira Sp1 y Stigeoclonium Sp1, abundantes en A1. En diversos estudios se ha demostrado que los ambientes acuáticos con tendencia a la eutrofización favorecen la dominancia de pocas especies (Morales & Salazar, 2012; Amaidén & Gari, 2011; Pizarro & Alemanni, 2005).
Esta información corrobora lo mencionado por López, et al. (2012), quienes aplicaron índices bióticos (macroinvertebrados) para evaluar la calidad de las aguas del río Hacha y encontraron en esta misma estación (A4) que el agua estaba moderadamente contaminada. Asimismo, en el estudio realizado por Peláez, et al. (2006) se caracterizó y cuantificó la carga contaminante transportada por este río registrando en la estación Puente López los valores más altos de DBO y de sólidos suspendidos totales (86 mg. L-1 y 610 mg. L-1) comparada con las estaciones el Caraño y Primer Puente, con 8 mg. L-1 y 6 mg.L-1, respectivamente, estaciones que también hicieron parte de este estudio.
En cuanto a la temperatura del agua, esta aumenta a medida que el río desciende, notándose una marcada diferencia en la altitud A1, de 919 m s.n.m. y las de las altitudes A2 de 517 m s.n.m, A3 de 296 m s.n.m. y A4, de 261 m s.n.m., además de la disminución gradual de la vegetación riparia a medida que el río transcurre aguas abajo y recibe una mayor intensidad lumínica con el consecuente aumento en su temperatura, condiciones que implicarían un incremento en la abundancia de la comunidad fitoperifítica (Pedraza & Donato, 2011). Por otra parte, en la altitud A4 se registraron los mayores valores de compuestos nitrogenados en comparación con las otras tres altitudes estudiadas, los cuales provienen de la descarga de las aguas residuales de Florencia (Manrique & Peláez, 2010).
En cuanto a la distribución de la comunidad fitoperifítica, esta estuvo dominada por la clase Bacillariophyceae en la época de mayor precipitación, la cual es común y abundante en ecosistemas lóticos debido a que pueden soportar cambios de temperaturas y altos niveles de contaminación (Ramírez & Plata, 2008). Por otra parte, las estaciones Sucre (A1) y El Caraño (A2) presentaron la mayor diversidad fitoperifítica de los muestreos realizados, lo que se explica por el gradiente altitudinal que, a medida que el río desciende sobre el curso del agua, tiene una mayor influencia antrópica que disminuye la calidad del agua del río Hacha (Peláez, et al., 2008).
El modelo de regresión utilizado indicó que el NH4 tuvo una influencia positiva sobre la abundancia y la biomasa. La incidencia de los nutrientes en la comunidad perifítica fue reportada por Montoya & Ramírez (2007), quienes resaltaron el efecto causado por el aumento de los nutrientes en la diversidad de algas y cianobacterias perifíticas. Asimismo, Ramírez & Plata (2008) resaltaron el efecto de la conductividad y el pH en la poca diversidad de diatomeas perifíticas; Pedraza & Donato (2011) y Gari & Corigliano (2004), por su parte, resaltan la influencia de la temperatura en la abundancia y la riqueza del perifiton, y Homer, et al. (1990) y Zoppi, et al. (2008) relacionaron los bajos niveles de nutrientes con la reducción significativa de la biomasa, la diversidad y la riqueza en un gradiente de profundidad del agua. Otros factores, además de los considerados en este estudio, probablemente afectaron la comunidad perifítica y podrían estar relacionados con la parte de la variación no explicada, entre ellos, factores ambientales abióticos como el sustrato (Sánchez, et al., 2005), el gradiente de profundidad del agua (Zoppi, et al., 2008; Sánchez, et al., 2005), la estacionalidad térmica (Gari & Corigliano, 2004), entre otros.
Conclusiones
Los análisis empleados en este estudio indicaron que la relación entre la comunidad fitoperifítica y las variables ambientales es evidente y cuantificable en el ecosistema del río Hacha. Las variables ambientales que determinaron de manera positiva la abundancia y la biomasa itoperifítica en el cauce principal del río fueron el nitrógeno amoniacal, la conductividad y la DBO5, las cuales influyeron de manera significativa en la distribución de la comunidad itoperifítica en cada una de las altitudes muestreadas.
Esta investigación continúa y los nuevos resultados sobre el papel de la comunidad itoperiitica como indicadora del ecosistema del río Hacha se abordarán en una publicación posterior. En este sentido, ya se está avanzando en la identiicación hasta el nivel de especie de las 44 morfoespecies obtenidas para relacionarlas con los factores ambientales, lo que permitiría a las autoridades ambientales implementar programas de monitoreo de este ecosistema, que, como ya se mencionó, es el principal recurso hídrico de la ciudad de Florencia.
Asimismo, se sugiere que en estudios posteriores se incluyan otras comunidades (interacciones biológicas), con el in de proporcionar una visión más completa de los factores que influyen en la estructura de la comunidad del fitoperifiton y plantear estrategias para la conservación de este ecosistema acuático.