Introducción
Los macroinvertebrados acuáticos son fundamentales en el funcionamiento de los ecosistemas fluviales, pues son un componente biológico clave de la red trófica acuática que interactúa como enlace entre las diferentes comunidades (bentónica, planctónica, nectónica, detrítica) (Tomanova, et al., 2006; Chará-Serna, et al., 2012; Roldán, 2016). Por lo general, los estudios sobre los macroinvertebrados acuáticos hacen especial referencia a los órdenes Ephemeroptera, Plecoptera y Trichoptera, pues además de su demostrado papel ecológico, se les considera bioindicadores de la calidad del agua por su gran sensibilidad frente a los diferentes tensores generados por la intervención antropogénica (Tamaris-Turizo & Turizo-Correa, 2004; Zúñiga, 2010; Alonso-EguíaLis, et al., 2014; Castillo-Sánchez, et al., 2018). Asimismo, estos organismos son sensibles a las variaciones físicas y químicas que se presentan en el ecosistema acuático, a la contaminación y al efecto inducido del cambio climático (Covich, et al., 2003; Pérez-Gómez & Bosque-Sendra, 2008; Zúñiga, 2010; Arango, et al., 2012; Ospina-Arias, et al., 2016). La gestión y el manejo inadecuados del recurso hídrico han reducido el número de especies claves para los ecosistemas dulciacuícolas (Chará-Serna, et al., 2009; Longo, et al, 2010; Roldán, 2016). Esta situación afecta de manera particular al orden Plecoptera, considerado altamente sensible a la contaminación acuática (Tomanova & Tedesco, 2007; Castillo-Sánchez, et al, 2018; Sierra-Labastidas, et al., 2017).
En el orden Plecoptera el género Anacroneuria es el taxón de mayor abundancia en el Neotrópico, y reviste gran importancia en los procesos de evaluación de corrientes de agua (Zúñiga, 2010; Bohórquez, et al., 2011) por su desempeño ecológico en la recirculación de nutrientes, como eslabón depredador en la composición de la red trófica y como bioindicador de la calidad de agua (Stewart & Stark, 2002). En Colombia más del 60 % de los registros del género Anacroneuria corresponden a la región andina, especialmente los departamentos de Valle del Cauca, Risaralda y Cauca, donde alcanza el 81,0 %, en tanto que en el Tolima y sus cuencas hidrográficas los estudios taxonómicos y ecológicos de plecópteros y del género Anacroneuria aún son incompletos. Menos del 10 % de las especies conocidas del género Anacroneuria en la región neotropical andina están asociadas con sus formas inmaduras (Barreto-Vargas, et al., 2005; Bohórquez, et al., 2011; Zúñiga, et al, 2013).
Dada la importancia del orden Plecoptera, en particular del género AnacroneuriaKlapálek (1909), en el presente estudio se planteó ampliar el conocimiento ecológico de este grupo en el país usando como modelo de estudio tres quebradas afluentes del río Combeima (Ibagué, Tolima, Colombia): Las Perlas, La Plata y Cay. Asimismo, se analizaron las relaciones entre su abundancia y distribución espacio-temporal con variables fisicoquímicas y microbiológicas. Este es un procedimiento tradicional en estudios comparativos en comunidades hidrobiológicas que se basa en sus formas inmaduras a nivel de familia y, en algunos casos, de género (Alonso-EguíaLis, et al., 2014). Los resultados del estudio permitirán complementar la información morfológica para mejorar la resolución taxonómica y ecológica de las formas inmaduras de los plecópteros en el departamento del Tolima. Servirán también como base de futuros estudios de bioindicación de la calidad de agua en el río Combeima y sus afluentes, así como de valoración de su biodiversidad y base para establecer estrategias de diagnóstico ambiental y de conservación (Zúñiga, et al., 2013).
Materiales y métodos
Area de estudio
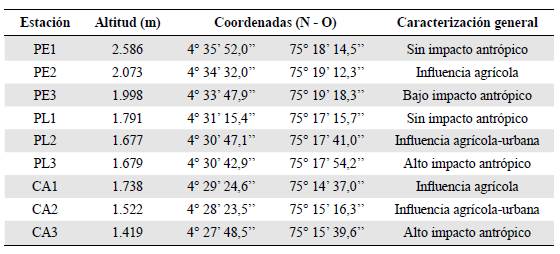
La cuenca del río Combeima cuenta con 27.421 ha y se encuentra en la vertiente oriental de la cordillera Central (04°19'30'' - 04°39'57'' N; 75°10'11" - 75°23'23'' O); hace parte de la cuenca mayor del río Coello (Leonel & Páez, 2000; Pérez & Bosque, 2008) y limita por el norte con el municipio de Anzoátegui, por el sur con las cuencas de los ríos Opía y Coello, por el oriente con el municipio de Anzoátegui y los ríos La China, Alvarado y Chipalo, y por el occidente con el río Coello. A esta cuenca tributan 18 microcuencas, entre las que sobresalen por su extensión Juntas o Las Perlas, La Plata, El Tejar, Cay y Corazón (CONPES, 2009). En cuanto a su superficie altitudinal, la cuenca varía desde los 5.225 m s.n.m. en su nacimiento en el nevado del Tolima hasta los 648 m s.n.m. en su desembocadura en el río Coello (CORTOLIMA, 2006). La precipitación media anual es de 1.816 mm3, con dos épocas de sequía y dos de lluvia (distribución bimodal): las primeras de diciembre a marzo y de julio a agosto, y las segundas de abril a junio y de septiembre a noviembre, y la temperatura media anual de 17 °C (CORTOLIMA, 2006). Según el análisis pluviométrico entre 1986 y 2000, el valor máximo de precipitación alcanzado fue de 2.250 mm3 en los sectores de Villa Restrepo y la quebrada Cay (CONPES, 2009). Las tres quebradas se seleccionaron con base en el área, el caudal, la longitud, el acceso, el rango altitudinal, y los impactos antropogénicos sobre estos cuerpos de agua, atributos según los cuales las quebradas Las Perlas (PE), La Plata (PL) y Cay (CA) son las de mayor relevancia para el estudio (CORTOLIMA, 2006; CONPES, 2009) (Figura 1S, https://www.raccefyn.co/mdex.php/raccefyn/article/view/951/2749).
Muestreo biológico
En cada microcuenca se establecieron tres áreas de trabajo: parte alta (1), media (2) y baja (3) (Tabla 1). Se hicieron seis muestreos (M1 - M6) durante un ciclo hidrológico: de agosto de 2016 a mayo de 2017, incluidos los periodos de transición a temporada de lluvias (M1: agosto, 2016; M4: febrero, 2017), lluvias intensas (M2: octubre, 2016; M5: abril, 2017) y transición a poca lluvia (M3: diciembre, 2016; M6: mayo, 2017), con el fin de tener información de periodos climáticos contrastantes según el registro hidrológico histórico (últimos 30 años) suministrado por el IDEAM para la cuenca del río Combeima y sus tributarios. En diferentes tramos de cada quebrada se hicieron recolecciones aleatorias de material biológico siguiendo las metodologías planteadas por Froehlich & Oliveira (1997) y Buss & Salles (2007), utilizando una red Surber (30x30 cm, 0.09 m2 y 250 Lim de poro de malla). El material recolectado se almacenó en frascos plásticos debidamente etiquetados y se fijó en solución de alcohol al 70 %.
Toma de muestras bacteriológicas y fisicoquímicas
Se evaluaron in situ las variables de temperatura del ambiente y del agua (°C) y de conductividad eléctrica (μS/cm) con un medidor multiparamétrico portátil (Schott Handylab multi12/Set). Se determinó asimismo la velocidad de la corriente, la profundidad y el caudal según la metodología propuesta por Sabater & Elosegi (2009). Se tomaron muestras de agua en cada estación de muestreo y se conservaron a menos de 10 °C con gel refrigerante en neveras portátiles para el posterior análisis de las variables fisicoquímicas, el pH (unidades de pH), el oxígeno disuelto (mgO2/L), el porcentaje de saturación de oxígeno (%SAT.O2), la turbidez (UNT), la alcalinidad total y la dureza (mgCaCO3/L), los cloruros (mg Cl/L), nitratos (mgNO3/L) y fosfatos (mg PO4/L), el fósforo total (mg P/L), los sólidos suspendidos y los totales (mg/L), la demanda biológica de oxígeno (DBO5) y la DQO (mgO2/L), así como los parámetros bacteriológicos de recuento de coliformes totales (RCT) (UFC/100mL) y de coliformes fecales (RCF) (UFC/100mL), en el Laboratorio de Servicios de Extensión en Análisis Químico (LASEREX) de la Universidad del Tolima (Ibagué, Colombia).
Determinación de organismos
Las ninfas se identificaron inicialmente a nivel de género en el Laboratorio de Zoología de la Universidad del Tolima con base en las claves y descripciones taxonómicas de Benedetto (1974), Zamora & Roessler (1995, 1997), Marques & Froehlich (1999), Hamada & Couceiro (2003), Zúñiga, et al. (2005), Froehlich (2009), Stark, et al. (2009, 2012) y Bohórquez, et al. (2011). Se hizo un análisis biométrico mediante morfometría tradicional en una muestra de 60 especímenes de una población total de 528 organismos del género Anacroneuria para diferenciar caracteres morfológicos relevantes en un rango de talla entre los 1,0 y los 1,9 cm de longitud. Los individuos con tallas entre 0,9 cm o menos y 2 cm o más (222) no fueron objeto del estudio debido al desarrollo temprano o por la baja densidad de la población de ninfas en sus últimos estadios, con lo cual se evitaron potenciales errores taxonómicos (McLellan & Zwick, 2007). En la medición de la longitud total del organismo (LT) se tuvo en cuenta la distancia desde el labro hasta el extremo distal del último segmento abdominal en su parte dorsal, el ancho de la región cefálica (AC) en su zona dorsal, la longitud de la región cefálica (LC) desde el labro hasta la sutura metópica, el ancho de la cápsula cefálica (AC) y el ancho ocelar (AO) entre los bordes internos de los ojos, la longitud (LP) y el ancho (AP) de la región del pronoto y la longitud de la región abdominal (LA) (Figura 1). Como complemento se consideraron los estudios de morfometría tradicional en ninfas del género Anacroneuria de Zamora & Roessler (1997), Dujardin, et al. (1998), Fenoglio, et al. (2007) y Oliveira, et al. (2007). Las ninfas se midieron en el programa Imagej-Fiji; una vez capturada la imagen en estereoscopio Optika SZM-LED 2 y cámara digital Optika 4083.B9, se calibraron con placa entomológica en una escala de 1 mm y se rectificaron con el paquete Optika Vision Lite.
Análisis de las variables morfológicas
El supuesto de normalidad de cada variable morfológica se analizó mediante el estadígrafo de Shapiro-Wilks y, si no se cumplía la homogeneidad de varianzas, se recurría a una comparación independiente con un ANO VA no paramétrico de Kruskal & Wallis (1952) para comprobar su significación estadística (α=0,05). Para determinar el conjunto de variables no correlacionadas, es decir, que explicaban la variación de los resultados de las pruebas morfométricas, se hizo un análisis de componente principales (ACP) con los datos transformados por ln x+1 al no cumplir los supuestos de normalidad y homocedasticidad. Estos análisis se realizaron con el programa R, versión 3.4.1 (Team, R. C, 2015).
Análisis de las variables bacteriológicas y fisicoquímicas y su relación ecológica
Para establecer las diferencias significativas de cada variable e independientemente por quebrada a nivel espacial y temporal, se utilizó un ANOVA no paramétrico de una vía (Kruskal-Wallis) si no se cumplían los supuestos incluso después de la transformación de los datos con logaritmo natural (ln x+1). Por otra parte, para identificar la relación multivariada de los factores fisicoquímicos y bacteriológicos en cada una de las quebradas de estudio, se utilizó un ACP con el fin de obtener "n" componentes para una mejor interpretación de la relación entre las variables. Mediante el análisis de correlación de Spearman se determinó la asociación entre las morfoespecies en estudio y las variables bacteriológicas y fisicoquímicas en cada microcuenca, con el fin de detectar algún tipo de respuesta que pudieran generar en la población de ninfas. Todos los análisis de los datos se realizaron con el programa R, versión 3.4.1 (Team, R. C, 2015).
Resultados y discusión
Morfametría de las ninfas
Las variables morfométricas (LT, LC, LP, LA, AC, AO, AP) presentaron diferencias significativas (Kruskal-Wallis: p<0,05) entre las ninfas analizadas. Por otra parte, el ACP reveló en el componente 1 (CP 1) el 86,53 % de la varianzay en el componente 2 (CP2), el 11,80 %, para un acumulado de la varianza total explicada en 98,33 %. El CP1 describía la variación de los morfotipos en relación con la magnitud de los coeficientes de las variables de ancho cefálico (AC=0,4047), longitud cefálica (LC=0,4029) y ancho ocelar (AO=0,4023), por lo que este componente se relacionó con la descripción morfológica de la cabeza, en tanto que el componente 2 (CP2) se relacionó con la variación de los morfotipos en función de la longitud del abdomen (LA=0,9198) sobre la longitud total del espécimen (Figura 2).
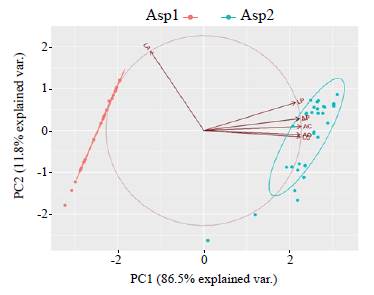
Figura 2 Biplot 1x2 del ACP de las variables morfométricas evaluadas en ninfas de Anacroneuria recolectadas en el sector de estudio (Las Perlas, La Plata y Cay).
Estos resultados evidencian que entre las variables LA, AC y AO hubo diferencias métricas en la muestra de ninfas seleccionadas; según Zamora & Roessler (1995, 1997) y Gamboa & Arrivillaga (2010), estas mediciones pueden considerarse como caracteres diagnósticos que ayudan a describir las especies en dos morfotipos, denominados en este estudio como Aspl y Asp2 (Anacroneuria spl y Anacroneuria sp2, respectivamente). El uso de herramientas morfométricas permite inferir mediante análisis comparativo la presencia de varios morfotipos, su relación ecomorfológica y sus historias de vida, el uso del recurso y las relaciones con el ambiente (Dujardin, et al, 1998). Sin embargo, ante la escasa información sobre la relación de las ninfas del orden Plecoptera con sus formas adultas (Stark, et al., 2009; Zúñiga, 2010; Castillo, et al., 2013; Castillo-Sánchez, et al., 2018), es necesario describir los caracteres diagnósticos de las ninfas que facilitan su diferenciación y su relación con las formas adultas mediante otras técnicas como la morfometría geométrica o la determinación a nivel bioquímico y molecular (Gamboa & Arrivillaga, 2010; Gamboa & Arrivillaga-Henríquez, 2019).
Diagnosis
El valor promedio de la longitud total (LT) en las ninfas de Asp1 fue de 1,3175 cm (± DE= 0,049). Su cuerpo era delgado y aplanado desde la sección del tórax y el abdomen. La longitud cefálica (LC) fue de 0,1257 cm (± DE= 0,005), el ancho de la cápsula cefálica (AC) de 0,2682 cm (± DE= 0,011) y el ancho ocelar (AO) de 0,1447cm (± DE= 0,011). En la cabeza se observó una mancha de color marrón desde el borde del clípeo hasta la parte media de la cápsula cefálica sin alcanzar los bordes externos. La longitud del pronoto (LP) era de 0,1602 cm (± DE= 0,014) y el ancho (AP) de 0,3004 cm (± DE= 0,014). El abdomen era largo, cilíndrico en su parte proximal y ligeramente aplanado en la parte distal, con una media longitudinal (LA) de 0,5539 cm (± DE: 0,021) (Figura 3 a, c).

Figura 3 Ninfas de Anacroneuria sp1 (Asp1) y Anacroneuria sp2 (Asp2) registradas en el área de estudio. a) cabeza de Asp1 (57x); b) cabeza de Asp2 (40x); c) región dorsal de Asp1 (12,5x); d) región dorsal de Asp2 (10x)
Por su parte, Asp2 presentó un valor promedio en la longitud total (LT) de 1,6542 cm (± DE= 0,06); comparativamente, el cuerpo era de forma más robusta y semicurva desde la sección del tórax hasta el abdomen que el de Asp1. La longitud cefálica (LC) era de 0,2188 cm (± DE= 0,018), el ancho de la cápsula cefálica (AC) de 0,4009 cm (± DE= 0,023) y el ancho ocelar (AO) de 0,2703 cm (± DE= 0,017). En la parte dorsal de la cabeza también se observaron tres depresiones que formaban entramados particulares, una en la región media de la cápsula cefálica y dos rodeando los ocelos. El pronoto presentaba una forma más elipsoidal que en Aspl, con una mayor curvatura en la región anterior y una leve depresión interna en posición distal-posterior y hacia la línea ecdisial, y rodeado por finos pelos. La longitud media (LP) era de 0,1927 cm (± DE= 0,012) y el ancho (AP) de 0,4028 cm (± DE= 0,025). El abdomen se presentaba corto en relación con el resto del cuerpo y de forma ancha y robusta, con una longitud (LA) de 0,5168 cm (± DE= 0,019) (Figura 3 b, d).
Con base en estos datos, se propone en este estudio que en futuras investigaciones con plecópteros en el río Combeima se reconozcan por lo menos dos poblaciones de ninfas de Anacroneuria, ya que no presentaron correspondencia en el crecimiento, entre la longitud del cuerpo y la longitud del abdomen, e incluso en las últimas etapas preimaginales hubo diferencias significativas (LA; p<0,05) entre las poblaciones de las dos morfoespecies propuestas, constituyéndose la longitud del abdomen en un caracter diagnóstico en el presente estudio. En contraposición con los estudios de Fenoglio, et al. (2007), se encontró en las ninfas grandes un abdomen más reducido y robusto que el de las pequeñas (Figura 3 b, d), lo que refleja una tendencia alométrica entre las dos morfoespecies. En este sentido, hay estudios morfométricos de insectos hemimetábolos (Klingenberg & Zimmermann, 1992) y ninfas de Anacroneuria (Gamboa, et al., 2009; Gamboa & Arrivillaga-Henríquez, 2010) en los que se relacionan aspectos ecológicos del tamaño de las ninfas y las partes del cuerpo, así como su sistemática filogenética y su biogeografía (Fenoglio & Morisi, 2001). Una diferenciación en la longitud del abdomen en relación con la longitud del cuerpo en las ninfas antes de la etapa preimaginal puede relacionarse con la demanda energética, el presupuesto energético o los requerimientos reproductivos en algunas especies (Fenoglio & Rosciszewska, 2003; Fenoglio, 2003). Según Gamboa, et al. (2009), la diferencia de tallas entre las ninfas de Anacroneuria promueve la selección de nichos tróficos que definen el tamaño de las presas ingeridas y la actividad diaria de alimentación.
Variables bacteriológicas y fisicoquímicas
Quebrada Las Perlas. En las estaciones PE1, PE2, PE3 las variables que reflejaron variación significativa en su rango (p<0,05) fueron la alcalinidad (valores entre 172 y 84mg/L), la conductividad eléctrica (557 y 297 μS/cm), los sólidos totales (542 y 198 mg/L) y el caudal (147,86 y 13,03 m3/s), siendo la estación PE2 la de los valores más altos y la PE1 la de los mínimos. Estas variables se ven influenciadas por los cambios en la precipitación en el sector, por las características topográficas del terreno en la PE2, y las variaciones en el caudal y la influencia de material alóctono ante los procesos erosivos que convergen en el lecho de la quebrada, como se ha descrito en otros sistemas acuáticos similares en los Andes colombianos (Roldán & Ramírez, 2008; Ospina-Arias, et al., 2016). Asimismo, en el análisis temporal de los muestreos (periodos climáticos) se determinaron las variables significativas (p<0,05) en su rango: dureza (623 y 104 mg/L), con el valor máximo registrado en febrero de 2017 y el mínimo en agosto de 2016; los nitratos con valores entre los 0,4 mg/L en abril de 2017 y 0,001 mg/L en febrero de 2017; el oxígeno disuelto con un valor máximo de 6,1 mg/L en mayo de 2017 y de 2,7 mg/L en octubre de 2016, y la DQO con un valor máximo de 59,3 mg/L en agosto de 2016 y de 1,0 mg/L en abril de 2017. Estas variables se vieron influenciadas por los cambios bimodales en las épocas de lluvia intensa y las de transición a lluvias, así como por la saturación de iones y los procesos de escorrentía y erosión (Roldán & Ramírez, 2008).
Quebrada La Plata. Las variables significativas (p<0,05) en las estaciones de muestreo fueron la temperatura, con valores entre los 25 °C en la PL3 y 12 °C en PL2; la alcalinidad, entre 79 mg/L en PL2 y 33,1 mg/L en PL1, y la conductividad eléctrica, entre 208 μS/crn en PL3 y 14 μS/cm en PL1, cuya variación podría deberse a factores como la topografía del terreno, la alta precipitación en el sector PL1 y el arrastre del material alóctono y autóctono por el lecho de la quebrada, lo que modifica las condiciones físicas y químicas a lo largo del cauce en PL2 y PL3 (Chará-Serna, et al., 2012; Ospina-Arias, et al., 2016 ). En los periodos de muestreo, las variables significativas (p<0,05) fueron el oxígeno disuelto, que fluctuó entre 6,21 mg/L en mayo de 2017 y 3,56 mg/L en diciembre de 2016; los nitratos, con 1,020 mg/L en abril de 2017 y 0,001 mg/L en agosto de 2016; los RCF, que fluctuaron entre 9, E+05 UFC/100mL en octubre de 2016 y 2, E+00 UFC/100mL en mayo de 2017. Las variables mostraron una asociación con las temporadas de lluvias y de sequía, las características del lecho del cauce, sus afluentes, el entorno y la escorrentía.
Quebrada Cay. Las variables significativas (p<0,05) fueron la temperatura, con valores entre 24 °C en CA3 y 12 °C en CA1; la conductividad eléctrica entre 250 μS/ cm en CA3 y 148 μS/cm en CA2; los cloruros, entre 7,7 mg/L en CA3 y 1,3 mg/L en CA1, y los fosfatos, entre 15,8 mg/L en CA2 y 0,1 mg/L en CA1. Estas variaciones se asociaron con la diferencia en los tramos altitudinales (1.738 a 1.419 m s.n.m.), con los asentamientos urbanos y la canalización de las aguas para el acueducto municipal de Ibagué (CORTOLIMA, 2006; Hernández & Ramírez, 2016). En cuanto a los periodos del muestreo, las variables significativas correspondieron al oxígeno disuelto, con valores entre los 6,13 mg/L en mayo de 2017 y los 2,53 mg/L en diciembre de 2016; los sólidos suspendidos, entre 53 mg/L en agosto de 2016 y 17 mg/L en abril de 2017; los nitratos, entre 2,43 mg/L en abril de 2017 y 0,00 mg/L en agosto de 2016 y los RCF con valores entre 1, E+05 UFC/100mL en octubre de 2016 y 7, 0E+00 UFC/mL en abril de 2017. Esta variación de los datos corresponde a periodos de transición a la temporada de pocas lluvias (diciembre-mayo), transición a lluvias (agosto) y periodos de lluvias intensas (octubre-abril), lo que se relaciona con la disminución y el aumento en el arrastre de materiales orgánicos que hacen parte de la microcuenca en los sectores CA2 y CA3 por influencia de la actividad antropogénica en el sector asociada con procesos de deforestación y erosión (Vásquez, et al., 2013; Hernández & Ramírez, 2016).
Análisis de componentes principales
Quebrada Las Perlas. Se determinaron tres componentes de las variables de estudio: el primero fue el de salinidad y cauce, conformado por las variables de cloruros, profundidad, área y caudal con correlaciones positivas, lo que indicaba que un aumento en el caudal involucra una mayor concentración de sales (cloruros), influenciado por el arrastre de minerales y de carga orgánica en época de alta precipitación, lo que interviene en la topografía del cauce y las condiciones ribereñas (Roldán & Ramírez, 2008). El segundo componente de dureza y alcalinidad se componía de las variables de dureza, pH, y alcalinidad, con correlaciones positivas que reflejan un aumento proporcional en la dureza del agua y en su basicidad. Un tercer componente de oxígeno disuelto y contaminación orgánica con correlaciones positivas en las variables de RCT y RCF y negativas en el oxígeno disuelto. Por lo tanto, un aumento de contaminación por material orgánico producto de las actividades antropogénicas (ganadería, agricultura) y el vertimiento de aguas residuales en el sector disminuye la concentración de oxígeno (Gutiérrez-Garaviz, et al., 2014). La varianza total explicada a partir de los tres componentes fue del 65,72 %, en la cual el CP1 aportó el 26,08 %, el CP2 el 23,75 % y el CP3 el 14,88 % (Figura 2S, https://www.raccefyn.co/index.php/raccefyn/article/view/951/2750).
Quebrada La Plata. El análisis definió tres componentes de la siguiente forma: el primer componente de RCT y nitratos hubo correlación negativa con el RCT, el ancho del lecho y los sólidos suspendidos y positiva con los nitratos. Según Roldán & Ramírez (2008) existen valores de nitratos muy bajos en los arroyos altoandinos, pero a medida que se desciende a los valles estos se incrementan debido a la actividad agrícola y el vertimiento de contaminantes domésticos y la erosión de los suelos provocada por el arrastre de sedimentos a causa de las lluvias. En el segundo componente de temperatura, DBO5 y fósforo mostró correlaciones positivas en las tres variables, lo que indicó que a medida que se incrementó la temperatura del agua al descender en las estaciones de estudio, también lo hicieron las cargas orgánicas en el lecho del cauce por la influencia del material alóctono (Gutiérrez-Garaviz, et al., 2014; Ospina-Arias, et al., 2016). Un tercer componente, ancho del lecho y DQO, conformado por las variables ancho con correlación negativa y positiva con la DQO y el oxígeno disuelto, lo que indica que la disminución en el ancho del cauce de la quebrada incrementa el contenido de materia orgánica y el consumo del oxígeno disuelto para su descomposición (Roldán & Ramírez, 2008). La varianza total explicada a partir de los tres componentes fue del 55,94 %, con un aporte del CP1 de 22,30 %, del CP2 de 17,32 % y del CP3 de 16,33 % (Figura 3S, https://www.raccefyn.co/index.php/raccefyn/article/view/951/2751).
Quebrada Cay. Se establecieron tres componentes. En el primero, compuesto por conductividad y ancho del lecho, se integraron las variables de conductividad eléctrica y cloruros con correlaciones positivas y negativa con el ancho del lecho. El incremento de la conductividad en el agua estuvo condicionado por la disminución del ancho y el área del cauce, la naturaleza geoquímica del terreno y las épocas de lluvia y sequía (Roldán & Ramírez, 2008). En el segundo componente el material disuelto y la profundidad del lecho las variables de sólidos suspendidos y fósforo tuvieron una correlación positiva, y la profundidad, negativa, en tanto que un tercer componente, los nitratos y la DQO, registró una correlación positiva con las variables de nitratos y oxígeno disuelto y negativa con la DQO. La DQO es un indicador analítico que mide la contaminación mediante el contenido de materia orgánica que afecta la concentración del oxígeno disuelto en el agua, entre otros factores (Roldán & Ramírez, 2008; Gutiérrez-Garaviz, et al., 2014). La varianza total explicada a partir de los tres componentes fue del 58,29 %: el CP1 aportó el 23,27 %, el CP2 el 20,28 % y el CP3 el 14,74 % (Figura 4S, https://www.raccefyn.co/index.php/raccefyn/article/view/951/2752). Según autores como Froehlich & Oliveira (1997), Bispo, et al. (2006) y Zúñiga (2010), en el Neotrópico los ríos de alta montaña mantienen una dinámica constante por el flujo de sus aguas al pasar de tramos de corriente rápida con una elevada carga de oxígeno y menor intervención antropogénica a zonas de bajo porcentaje de saturación de oxígeno y gran influencia de las actividades agrícolas y demás actividades humanas que generan cambios, a veces significativos, en sus microhábitats y en la dinámica de las poblaciones.
Correlación de Spearman para las tres microcuencas
Se evidenció que para la morfoespecie Asp1 en la quebrada Las Perlas se presentó una correlación negativa entre la densidad de su población y el fósforo (-0,5266). Asimismo, en el sector de la quebrada La Plata, hubo correlación con la conductividad eléctrica (-0,4726) y en la quebrada Cay con los nitratos (-0,4821). Para la morfoespecie Asp2, en la quebrada Las Perlas se encontró una relación negativa con la variable DQO (-0,5635) y relaciones positivas con las variables de pH (0,7080), temperatura (0,6750), nitratos (0,5569) y fósforo (0,5421). En las quebradas La Plata y Cay no se evidenció ninguna correlación significativa. En cuanto al gradiente altitudinal, al integrar los datos de las tres microcuencas (2.500 a 1.400 m s.n.m.) se evidenció una correlación negativa de Asp1 con las variables de temperatura (-0,3597), fosfatos (-0,3250), y nitratos (-0,4408) y positiva con las variables de área (0,3754) y caudal (0,3795). Por otra parte, Asp2 mostró relaciones negativas con la variable de temperatura (-0,3840) y RCF (-0,4789) y relaciones positivas con el pH (0,4862), la dureza (0,4709), la alcalinidad (0,3394), la conductividad eléctrica (0,3851), el oxígeno disuelto (0,3164) y los sólidos totales (0,3389). Los análisis permitieron deducir que Asp1 requiere de afluentes donde el caudal y el área sean de una condición ecológica relativamente estable y de baja carga orgánica, ya sea la producida por el arrastre de sedimentos o la escorrentía generada por las lluvias y los suelos erosionados o intervenidos por la actividad agrícola (Roldán & Ramírez, 2008; Sierra-Labastidas, et al., 2017). Por su parte, Asp2 presentó un mayor rango de respuesta ecológica que Asp1 en las microcuencas evaluadas y en un tramo altitudinal (2.500 a 1.400 m s.n.m.), y su densidad se vio afectada por factores como la contaminación orgánica proveniente de la actividad doméstica y agrícola y la carga de materia orgánica resultante de los procesos de erosión en el sector. Estas correlaciones corresponden a las características físicas y ambientales de las microcuencas que responden a sus condiciones topográficas de terrenos con evidente erosión, tramos con pendientes elevadas y zonas intervenidas por la agricultura y los asentamientos humanos, lo cual es característico de las quebradas de la región andina del país (Leonel & Páez, 2000; Roldán & Ramírez, 2008; Zúñiga, 2010; Vásquez, et al., 2013; Hernández & Ramírez, 2016). El presente estudio coincide con los trabajos de Bispo, et al. (2002) y Tomanova & Tedesco (2007) en cuanto al amplio margen de tolerancia de las ninfas de Anacroneuria frente a las características fisicoquímicas del agua y demás condiciones ambientales en la zona de estudio, pues toleran algún grado de contaminación orgánica, la deficiencia de oxígeno y grados variables de intervención antropogénica. Según varios autores (Baptista, et al., 2001; Bobot & Hamada, 2002; Tomanova & Tedesco, 2007; Zúñiga, 2010; Castillo-Sánchez, et al., 2018), y tal como se confirmó en este estudio, las ninfas de Anacroneuria se establecen tanto en zonas de rápidos de las quebradas como en lugares donde la corriente es baja con una velocidad del agua entre 0,01 y 0,97 m/s, y temperaturas entre los 7 y los 25 °C, así como en quebradas con variación en el porcentaje de saturación de oxígeno (35 a 83 %). También se determinó que con los rangos de conductividad eléctrica registrados (entre 1,5 y 557 μS/cm) y una amplitud del lecho entre 0,5 y 12 m, las ninfas de Anacroneuria se establecen y exhiben un amplio margen de tolerancia en las zonas altas del Neotrópico (siempre que haya disponibilidad de oxígeno disuelto según la información obtenida), respondiendo adecuadamente a corrientes con perturbación variable y demostrando su capacidad de supervivencia y respuesta ecológica para la adquisición de alimento (Tomanova & Tedesco, 2007).
Conclusiones
Se confirmó la composición de Plecoptera en las quebradas tributarias de la cuenca del río Combeima analizadas con la presencia únicamente de la familia Perlidae y el género Anacroneuria con dos morfoespecies y desde los 2.500 m hasta los 1.400 m s.n.m. Asimismo, se identificaron dos tipos de morfoespecies (Anacroneuria sp1, Asp1, y Anacroneuria sp2, Asp2) en el estadio ninfal mediante morfometría tradicional y el análisis de componentes principales (ACP) con caracteres morfológicos relevantes como la longitud del abdomen (LA), el ancho ocelar (AO) y el ancho cefálico (AC). Asimismo, el ACP de las variables bacteriológicas y fisicoquímicas permitió inferir que en las estaciones con algún grado de intervención antropogénica (PE2, P12, PL3, CA2 y CA3), se había restringido el ensamble de las morfoespecies de Anacroneuria. El análisis de correlación de Spearman determinó que Asp1 requiere de cuerpos de agua con menor intervención humana y baja carga orgánica de material alóctono o proveniente de la actividad agrícola, en tanto que Asp2 aparentemente tiene un mayor rango de respuesta ecológica frente a los cambios en las condiciones naturales del cuerpo de agua. Se confirmó que las ninfas del género Anacroneuria difieren en sus niveles de tolerancia ante las condiciones ambientales cambiantes y que en el Neotrópico estas especies pueden tolerar algún grado de contaminación orgánica, así como variaciones en el caudal y la temperatura del agua.