Introducción
Los quironómidos (Díptera: Chironomidae) representan una de las familias de invertebrados acuáticos más diversa (11 subfamilias, 22 tribus y aproximadamente 15.000 especies); tiene una amplia distribución a nivel global y constituye el grupo más abundante de insectos en los ecosistemas de agua dulce (Cranston, 1995; Ferrington, 2008). Los estados inmaduros de la familia cumplen un papel importante en los niveles de las cadenas tróficas, ya que se encuentran en prácticamente toda clase de hábitats acuáticos. Es un grupo de insectos holometábolo, con cuatro estadios larvales. Las larvas y pupas se pueden encontrar sobre cualquier tipo de sustrato (Ekrem, et al., 2007; Paggi, 2009). Sus especies son conocidas por ser oportunistas y rápidas colonizadoras que se adaptan rápidamente a condiciones fluctuantes. Pueden ser de vida libre, sedentarias, minadoras de plantas acuáticas, comensales o semiparásitas, y hasta parásitas (Ruse, 1995).
Por lo general, las larvas de Chironomidae pasan la mayor parte de su ciclo de vida en el sedimento de ríos y quebradas, donde se acumulan diferentes sustancias tóxicas, por lo que podrían ser candidatos ideales como bioindicadores de contaminación en estos ecosistemas (Warwick, 1985; Armitage, et al., 1995; Béchard, et al., 2008). Sin embargo, la difícil taxonomía del grupo y la necesidad de montar las cápsulas cefálicas para su identificación (Pinder, 1983; Ekrem, et al., 2010) ha limitado en ocasiones su utilización como tales en algunas regiones, lo que, además, ha llevado a que el grupo sea identificado a nivel de familia en la mayoría de los estudios ecológicos.
Los estudios taxonómicos sobre los Chironomidae en Suramérica han ido en aumento (Brundin, 1966; Roback & Coffman, 1983; Spies & Reiss, 1996; Paggi, 2009; Donato, et al., 2009; Siri & Paggi, 2010; Prat, et al., 2012;Siri, et al., 2014; Siri & Donato, 2015; Hamerlik, et al., 2019; Silva, et al., 2019), aunque, infortunadamente, no al mismo ritmo en Colombia. En este contexto, se destacan los siguientes trabajos: el catálogo de especies de Chironomidae para el neotrópico y México, en el que Spies & Reiss (1996) documentan 13 géneros de la familia en el país; las guías para la identificación genérica de larvas para las cinco subfamilias de Ruiz, et al. (2000a y 2000b) y Ospina, et al. (1999), y el artículo sobre los Chironomidae de Colombia de Mendes & Pinho (2016), quienes resumen los reportes encontrados en la literatura y registran cinco géneros para el departamento del Meta. Además, se podrían mencionar algunos trabajos con enfoque ecológico o faunístico que involucran el registro de géneros de la familia en diversos departamentos de Colombia: Magdalena (16), Tolima (16), Norte de Santander (13), Antioquia (9), Caldas (8), Chocó (4), Valle del Cauca (2), Cauca (1) y Cesar (1) (Nazarova, et al, 2004; Castellanos & Serrato, 2008; Posada-Garcia, et al., 2008; Meza, et al., 2012; Forero, et al., 2014; Zambrano, et al., 2015; Madera, et al., 2016; Oviedo & Reinoso, 2018; Mosquera & Sánchez, 2019). Lastimosamente, muchos de los estudios con Chironomidae en el país constituyen trabajos de grado que no han sido publicados y, por tal razón, no se consideran registros formales.
Entre las subfamilias más diversas de Chironomidae, se encuentra la Chironominae, la cual está representada mundialmente por tres tribus (Chironomini, Pseudochironomini, Tanytarsini) y 101 géneros descritos (Ashe, et al., 1987). En Suramérica la distribución del grupo está subestimada, pues apenas se han registrado 60 géneros, de los cuales solamente quince lo han sido en Colombia: Chironomus, Cladopelma, Dicrotendipes, Endotribelos, Género A, Goeldichironomus, Oukuriella, Parachironomus, Paracladopelma, Paratanytarsus, Polypedilum, Pseudochironomus, Rheotanytarsus, Tanytarsus y Xestochironomus (Spies & Reiss, 1996; Ruiz, et al., 2000; González, et al., 2012; Meza, et al., 2012).
Considerando el insipiente conocimiento de los Chironominae en diferentes regiones del país, entre ellas Caldas, con apenas tres géneros documentados, el propósito de este trabajo fue contribuir a la taxonomía de la subfamilia en el departamento mediante la elaboración de una clave taxonómica para los géneros, con su respectiva diagnosis y los nuevos registros.
Materiales y métodos
Obtención y revisión de especímenes
Se revisaron las larvas de Chironominae depositadas en la Colección Entomológica del Programa de Biología de la Universidad de Caldas (CEBUC). El material revisado proviene de 11 estaciones ubicadas en la cuenca del río Chinchiná en los municipios de Manizales y Villamaría (departamento de Caldas), entre los 1.720 y los 2776 m s.n.m. Las quebradas muestreadas en Villamaría, fueron la Toldafría (04°59'08"N; 75°26'43'O), la Romerales (04°59'22''N; 75°25'58''O), la California (04°59'5''N; 75°26'35'O), y la ubicada en la finca Don Fernando (05°01'36,9''N; 75°31'26,3'O). Los afluentes muestreados en Manizales fueron la quebrada Chuscales (05°02'45,2''N; 75°25'18,9''O), la quebrada El Establo (05° 01' 42,1''N; 75°31'10,9''O), la quebrada La Elvira - estación 1 (05°03'4,4''N; 75°24'33,1''O), la quebrada La Elvira - estación 2 (05°03'10,9''N; 75°24'33,6''O), la quebrada La Elvira - estación 3 (05°01'53''N; 75°24'43,8''O), la quebrada Cimitarra (05°04'32,0"N; 75°24' 0,60"O) y Río Blanco (05°03'51''N; 75°27'52''O).
Los especímenes se recolectaron con red tipo Surber en tres substratos (hojarasca, roca y sedimento) entre febrero y julio de 2014 en el marco del proyecto de "Evaluación del impacto minero, agrícola y ganadero mediante respuestas ecológicas y genéticas de macroinvertebrados acuáticos". Se hizo, además, una revisión bibliográfica de los artículos que documentan géneros de Chironominae en Caldas (González, et al., 2012; Meza, et al., 2012), con el fin de incluir todos los géneros previamente registrados en el departamento.
Para la determinación de los géneros se montaron las cápsulas cefálicas de las larvas siguiendo el protocolo de Pinder (1983) que propone la utilización de KOH al 10 % para aclarar las estructuras, proceso que luego se detiene con agua destilada y alcoholes de diferentes grados (70 y 90 %). Por último, se utiliza euparal o bálsamo de Canadá para preservar las estructuras en un montaje permanente.
Diagnosis y distribución
La información sobre las diagnosis de los géneros se corroboró con los datos obtenidos en los estudios sobre Chironomidae (Ruiz, et al., 2000a; Pinder & Reiss, 2008; Trivinho-Strixino, 2011). Los aspectos generales referentes a la morfología y la terminología de Chironomidae se pueden consultar en el glosario especializado de Saether (1980), en tanto que los datos de la distribución y las notas ecológicas pueden consultarse en Cranston (2010).
Clave taxonómica
La clave taxonómica se elaboró con base en la guía para la identificación genérica de larvas de quironómidos (Diptera: Chironomidae) de la sabana de Bogotá. II. Subfamilla Chironominae, de Ruiz, et al. (2000a) y la Clave para Larvas de Chironomidae, Guía de identificação, de Trivinho-Strixino (2011).
Las fotografías se tomaron con un estereomicroscopio Leica M205 con cámara acoplada y un microscopio Leica DM500.
Resultados y discusión
Se lograron identificar 278 individuos de Chironominae pertenecientes a los siguientes nueve géneros (Figuras 1-7): Chironomus Meigen (Figura 1A-D), Endotribelos Grodhaus (Figura 2A-D), Polypedilum Kieffer (Figura 2E), Género A (Figura 3A-E), Paracladopelma Harnisch (Figura 4A-D), Rheotanytarsus Thienemann & Bause (Figura 5A, B y C), Paratanytarsus Thienemann & Bause (Figura 5D y E), Riethia Kieffer (Figura 6A-E), y Tanytarsus Wulp (Figura 7A-F). El cuarto género mencionado corresponde morfológicamente a un morfotipo del complejo Harnischia, denominado Género A por Ruiz, et al. (2000 a) en la sabana de Bogotá.
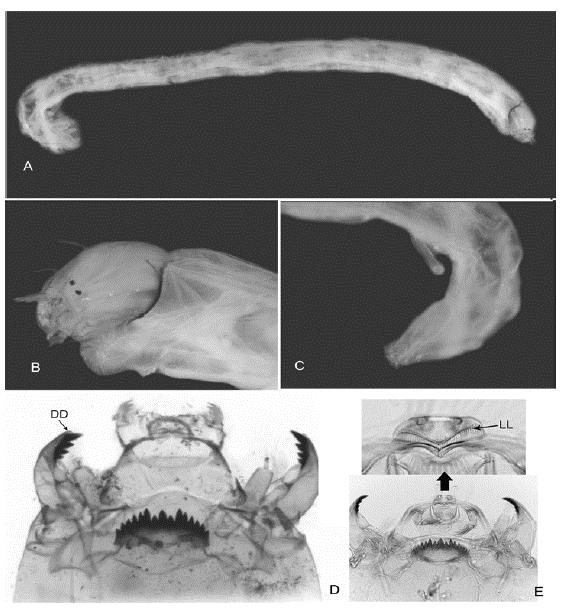
Figura 1 Chironomus: A. Cuerpo entero; B. Cabeza; C. Parte posterior abdominal; D. Cápsula cefálica. Diente dorsal de la mandíbula (DD); E. Acercamiento de la lamela labral (LL)
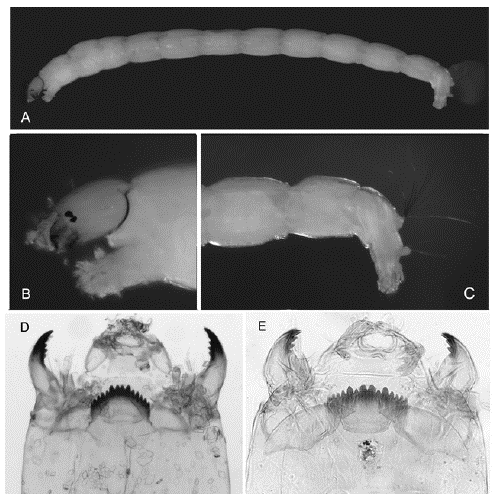
Figura 2 Endotribelos y Polypedilum: A. Cuerpo entero de Endotribelos; B. Cabeza de Endotribelos; C. Parte posterior del abdomen de Endotribelos; D. Cápsula cefálica de Endotribelos; E. Cápsula cefálica de Polypedilum
Varios autores consideran Chironominae como una de las subfamilias más abundantes y ricas en géneros en el Neotrópico (Spies & Reiss, 1996 y Trivinho-Strixino, 2011). Sin embargo, en Colombia los reportes de la subfamilia son escasos, con siete géneros reportados por Spies & Reiss (1996): Chironomus, Cladopelma Kieffer, Dicrotendipes Kieffer, Goeldichironomus Fittkau, Parachironomus Lenz, Oukuriella Epler y Tanytarsus, cuya ubicación exacta no se ha reportado. En la sabana de Bogotá están registrados 11 géneros: Chironomus, Dicrotendipes, Endotribelos, Parachironomus, Paracladopelma, Género A, Polypedilum, Xestochironomus Sublette & Wirth, Paratanytarsus Thienemann & Bause, Tanytarsus y Pseudochironomus Malloch (Ruiz, et al., 2000). En Caldas se habían reportado tres géneros previamente: Stenochironomus Kieffer, Rheotanytarsus y Polypedilum (Meza, et al., 2012 y Gonzáles, et al., 2012), sin embargo, al revisar los especímenes identificados en el trabajo de Meza, et al. (2012), los cuales se encuentran depositados en la colección CEBUC, se observó que hubo un error en la identificación del único individuo determinado como Stenochironomus, que en realidad correspondía a un género de otra subfamilia. Es importante destacar que Chironomus, Endotribelos, Género A, Paracladopelma, Paratanytarsus, Riethia y Tanytarsus corresponden a nuevos registros en Caldas.
Se presentan a continuación la clave taxonómica ilustrada y las diagnosis de los géneros reportados en este trabajo.
Clave para la determinación de los géneros de Chironominae registrados para Caldas (Basada en Ruiz, et al., 2000a):
1. Antena ubicada sobre una base alargada o pedestal (Figuras 5 B, C y 7 B), al menos tan alta como ancha. Antenas normalmente largas (Figuras 7 B y F), de más de la mitad de la longitud de la cabeza..............................................................................Tanytarsini 7
1'. Antena sésil, sin esta base. Antena no tan larga (Figuras 1 B, 2 B, 3 B, 4 B y 6 B) menos de la mitad de la longitud de la cabeza................................................................... 2
2. Placas ventromentales estrechas y alargadas, en forma de barra y casi unidas en la parte media (Figura 6 E)........................Tribu Pseudochironomini... Riethia (Figura 6)
2'. Placas ventromentales con formas variadas (ej. Figura 3 D), generalmente anchas y cortas, en forma de abanico, separadas en la parte media...............................................3
3. Las setas SI y II del labro son simples, generalmente en forma de lámina (Figura 3 E). Lamela labral usualmente ausente. Mandíbula siempre sin diente dorsal. En visión ventral es posible ver cómo el mentón tiene una parte clara central (Figuras 3 D y 4 D). .......................................................................................................Grupo Harnischia ... 4
3'. SI plumosa, palmeada, aserrada o pinnada. Lamela labral presente (Figura 1 E) y por lo general bien desarrollada. Mandíbula con diente dorsal presente (Figura 1 D) o ausente. Menton con dientes de coloración uniforme....................................................... 5
4. Antena con cinco segmentos, el segundo mucho más largo que el tercero. Mentón con diente central claro y doble acompañado de siete pares de dientes laterales oscuros. Premandíbula con seis dientes (Figura 4 D)..........................Paracladopelma (Figura 4)
4'. Antena con seis segmentos, el tercero más largo que el segundo. Mentón con diente central claro y dividido en cuatro, acompañado de seis pares de dientes laterales oscuros. Premandíbula con cinco dientes (Figura 3 D)...................................Género A (Figura 3)
5. Larvas con túbulos abdominales en el octavo segmento abdominal (Figuras 1 A y C). Mentón con diente central trífido, donde los dos dientes externos pueden estar fusionados o separados del central (Figura 1 D)..........................Chironomus (Figura 1)
5'. Larvas sin túbulos abdominales (Figuras 2 C). Mentón con número par de dientes (Figuras 2 D)..................................................................................................................... 6
6. Mentón con un par de dientes centrales más grandes o iguales que los primeros laterales (Figura 2 E)................................................................Polypedilum (Figura 2 E)
6'. Mentón con un par de dientes centrales más pequeños que los primeros dientes laterales o casi alcanzando a los laterales (Figura 2 D)........Endotribelos (Figura 2 A-D)
7. Pedicelos de los órganos de Lauterborn más largos que los segmentos terminales de la antena (Figura 7 F). Premandíbulas con 3-5 dientes, peine de la epifaringe formado por tres placas dentadas (Figura 7 E)............................................. Tanytarsus (Figura 7)
7'. Pedicelos de los órganos de Lauterborn cortos, premandíbulas bífidas..................8
8. Órganos de Lauterborn en pequeños pedicelos, los cuales son más cortos o iguales a los segmentos antenales tercero a quinto (Figura 5 C). Placas ventromentales con estrías gruesas, con apariencia de bloque (Figura 5 C). Peine de la epifaringe como un peine sencillo con múltiples dientes, o tripartito débilmente (Figura 5 C).......................................................................................................................Rheotanytarsus (Figura 5 A, B y C)
8'. Órganos de Lauterborn sésiles (Figura 5 E), si los pedicelos están presentes son más largos que los segmentos antenales tercero a quinto. Peine de la epifaringe como una placa con 3, 5 o 10 lóbulos o tres placas con numerosos dientes (ver detalles del peine de la epifaringe en la clave de Epler, 2014)...........................Paratanytarsus (Figura 5 D y E)
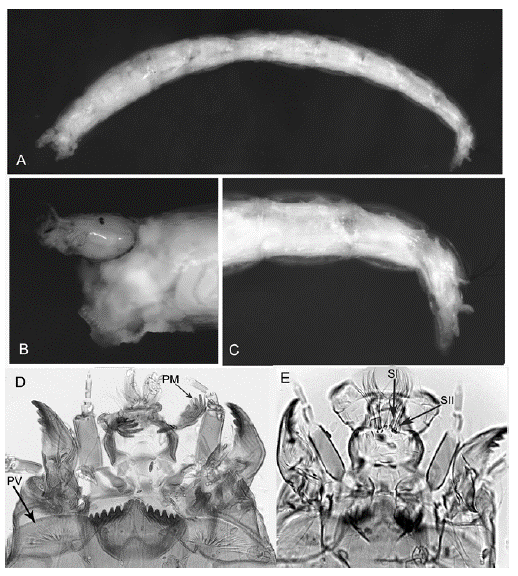
Figura 3 Género A: A. Cuerpo entero; B. Cabeza; C. Parte posterior del abdomen; D. Cápsula cefálica; E. Detalle de las setas I y II en la cápsula cefálica. PV: placa ventromental. PM: premandíbula
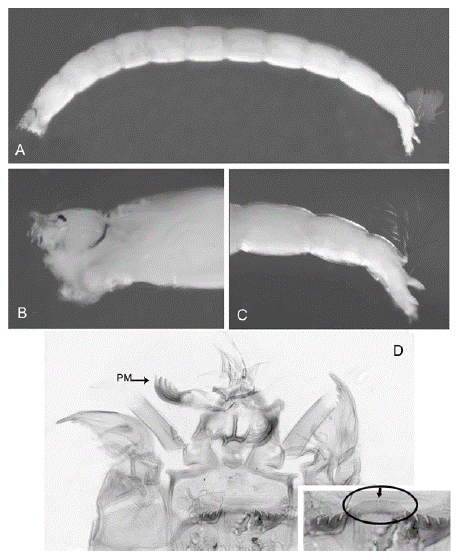
Figura 4 Paracladopelma: A. Cuerpo entero; B. Cabeza; C. Parte posterior del abdomen; D. Cápsula cefálica. La flecha indica el diente central claro y doble. PM: premandíbula
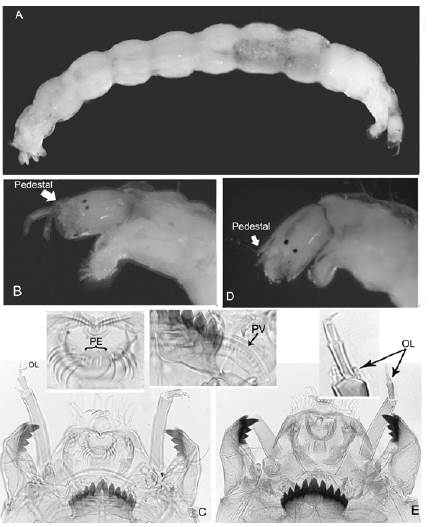
Figura 5 Paratanytarsus y Rheotanytarsus: A. Cuerpo entero de Rheotanytarsus; B. Cabeza de Rheotanytarsus; C. Cápsula cefálica de Rheotanytarsus (PE: peine de la epifaringe y PV: placa ventromental); D. Cabeza de Paratanytarsus; E. Cápsula cefálica de Paratanytarsus. OL: órganos de Lauterborn
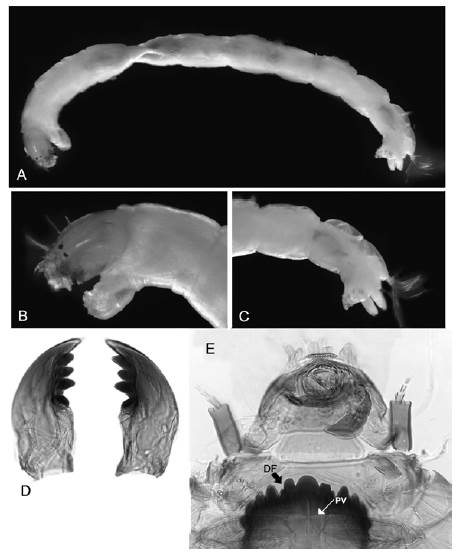
Figura 6 Riethia: A. Cuerpo entero; B. Cabeza; C. Parte posterior del abdomen; D. Mandíbulas; E. Cápsula cefálica. DF: diente fusionado, PV: placas ventromentales casi fusionadas
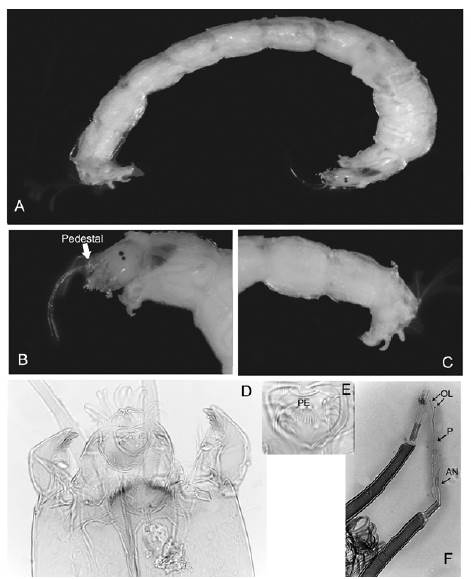
Figura 7 Tanytarsus: A. Cuerpo entero; B. Cabeza; C. Parte posterior del abdomen; D. Cápsula cefálica; E. Acercamiento del peine de la epifaringe; F. Antenas. OL: órganos de Lauterborn, P: pedicelo, AN: antena
Diagnosis de los géneros encontrados en la zona de estudio con su respectiva distribución y notas sobre su ecología
El símbolo (*) representa los registros nuevos documentados para Caldas en este trabajo.
Las larvas de la subfamilia Chironominae son generalmente rojizas, con tonos verdes y blancos. Su tamaño es variado, algunos géneros miden pocos milímetros (Stempellina) y otros llegan a centímetros (Chironomus). Se caracterizan por tener dos manchas oculares una encima de la otra siempre y, en la mayoría de los casos, bien diferenciadas. Su cápsula cefálica, mentón, placas ventromentales, procercos y parapodos son bien desarrollados. No tienen antenas retráctiles y sus mandíbulas son, en general, fuertes. Tienen 11 segmentos abdominales, y pueden tener túbulos laterales y ventrales, además de los túbulos anales. La mayoría de especies construyen tubos encima o dentro del sedimento que, generalmente, no son transportables; algunas viven dentro de tejidos vegetales y otras, como las del complejo Harnischia, son de vida libre. La mayoría son detritívoras, aunque algunas pueden ser depredadoras o herbívoras (Pinder & Reiss, 2008; Cranston, 2010; Trivinho-Strixino, 2011).
ChironomusMeigen, 1803* (Figura 1 A-D)
Diagnosis. Tamaño de la larva mediano a grande (7-20 mm de longitud). Cuerpo de color rojizo, generalmente con dos pares de túbulos ventrales en el octavo segmento (excepto Chironomus sp. 9 de Trivinho-Strixino, 2011), y, a veces, un par en el séptimo segmento abdominal. El mentón con diente central trífido, los dos dientes externos pueden estar fusionados o separados del central; seis dientes laterales. Antena con cinco segmentos, labro con la SI plumosa. Peine de la epifaringe constituido por una placa con 12 a 20 dientes. Premandíbula bífida o con siete dientes. Placas ventromentales en forma de abanico y separadas aproximadamente por un tercio del ancho del mentón. Mandíbula con diente dorsal pálido, diente apical oscuro y tres dientes internos también oscuros.
Comentarios. Las larvas del género se encuentran asociadas a sistemas lénticos y lóticos de baja velocidad, con sedimentos ricos en detritos orgánicos, y son tolerantes a ambientes pobres en oxígeno disuelto (Pinder & Reiss, 2008; Trivinho-Strixino, 2011). En el presente estudio se encontraron tres morfoespecies de este género asociadas con los sustratos de hojarasca, roca y sedimento.
Distribución. Es un género de distribución mundial; en el continente americano se encuentra registrado en Costa Rica, Puerto Rico, Chile, Argentina, Brasil, Colombia, Panamá, Islas Vírgenes, Guatemala, USA, México, Uruguay y St. Vincent.
EndotribelosGrodhaus, 1987* (Figura 2 A-D)
Diagnosis. Larva de coloración rojiza, de tamaño mediano (7-10 mm de longitud). Mentón y mandíbulas fuertemente esclerosadas. Mentón oscuro con número par de dientes (con excepción de E. hesperium), los dientes centrales son menores que los primeros laterales. Antena con cinco segmentos y hoja antenal más larga que el flagelo. Peine de la epifaringe formado por tres piezas dentadas. Cápsula cefálica con clípeo separado del apótoma frontal y un esclerito labral. Placas ventromentales generalmente fuertemente estriadas y en forma de abanico. Mandíbulas con dientes apicales, dorsales e internos (2, 3 o 4) oscuros. Túbulos anales cortos.
Comentarios. Fue establecido por Grodhaus en 1987 para la especie E. hesperium, cuyas larvas presentan un solo diente central; las demás especies descritas (14 en total) presentan dos dientes centrales. Sus larvas son comunes en cuerpos de agua asociados a bosques, donde viven en troncos, frutos y hojas, y también en macrofitas acuáticas de lagos y estanques, mostrando preferencia por el sustrato de hojarasca (Ruiz, et al., 2000a; Pinder & Reiss, 2008; Trivinho-Strixino, 2011; Trivinho-Strixino & Pepinelli, 2015).
Distribución. Se encuentra registrado en Guatemala, Costa Rica, Estados Unidos, México, Colombia y Brasil.
PolypedilumKieffer, 1912 (Figura 2 E)
Diagnosis. Tamaño mediano de la larva, entre 7 y 10 mm de longitud. Cuerpo de color desde rojizo con tonalidades verdes o naranjas hasta fuertemente rojo. Mentón con 14 a 16 dientes, todos oscuros, en general los centrales son más grandes que los primeros laterales, característica que separa a las larvas del grupo fallax, ya que en estas los dientes centrales son un poco menores que los primeros laterales. Antena con cinco segmentos (aunque en los individuos del subgénero Tripodura pueden parecer cuatro). Peine de la epifaringe constituido por tres placas separadas y dentadas. Premandíbula con tres dientes. Placas ventromentales ampliamente separadas, en forma de abanico y con estrías continuas. Mandíbula con un notorio diente dorsal oscuro, al igual que el diente apical, con tres dientes internos.
Comentarios. Hasta el momento se han reconocido ocho subgéneros, siendo los más comunes P. (Tripodura) y P. (Polypedilum). Sus larvas se encuentran en todo tipo de aguas (lénticas y lóticas), exceptuando en la alta montaña y el Ártico (Pinder & Reiss, 2008; Trivinho-Strixino, 2011). Su sustrato preferido es el sedimento, aunque algunas especies se pueden encontrar en rocas y minando plantas acuáticas (Pinder & Reiss, 2008).
Distribución. Su distribución es mundial, es uno de los géneros con mayor número de especies, y se ha registrado en todo el continente americano: Estados Unidos, Costa Rica, Guatemala, Panamá, Nicaragua, Argentina, Brasil, Bolivia, St. Vincent, Colombia y Perú (Vårdal, et al., 2002).
Género A (Ruiz, et al., 2000a)* (Figura 3 A-E)
Diagnosis. Larva de tamaño medio, de no más de 10 mm de longitud y coloración clara. Cabeza pequeña, ligeramente dirigida hacia atrás, como en Paracladopelma. Mentón con el diente central claro y dividido en cuatro, acompañado por seis pares de dientes laterales oscuros terminados en punta. Antena con seis segmentos, el tercero más largo que el segundo. Labrum con la SI simple y lamela ausente. Peine de la epifaringe triangular con cuatro divisiones. Premandíbula con seis dientes. Placas ventromentales anchas, alargadas y separadas medialmente por la mitad del ancho del mentón. Mandíbula sin diente dorsal y con tres dientes internos.
Comentarios. Fue descrito por primera vez por Ruiz, et al. (2000a). En este estudio, la mayoría de individuos se encontraron en el sustrato de sedimento, seguido por el de roca.
Distribución. Colombia. Prat, et al. (2012) reportan larvas similares en Ecuador y Perú.
ParacladopelmaHarnisch, 1923 * (Figura 4 A-D)
Diagnosis. Larva de tamaño mediano, de no más de 10 mm de longitud, patrón de coloración amarillo. Cabeza pequeña, un poco alargada y ligeramente dirigida hacia atrás. Mentón con el diente central doble, de color claro, acompañado por siete pares de dientes laterales. Antena con cinco segmentos, siendo el segundo más largo que el tercero. Labro con la SI simple y lamela ausente. Peine de la epifaringe triangular con tres divisiones. Premandíbula con cinco dientes. Placas ventromentales separadas por el ancho del mentón, notoriamente estriadas. Mandíbula sin diente dorsal y con tres dientes internos puntudos. Cuerpo con túbulos anales alargados, la mitad de la longitud de los parápodos posteriores.
Comentarios. Las larvas del género son estenotermas e intolerantes a la eutrofización. Habitan sustratos arenosos en lagos, arroyos y pequeños ríos y los sedimentos suaves de lagos profundos (Pinder & Reiss, 2008). En este estudio se encontró en la estación de referencia para el sector de Gallinazo.
Distribución. Tiene distribución holártica, y en el continente americano solo se ha registrado en Brasil, Colombia y Costa Rica.
RheotanytarsusThienemann & Bause, 1913 (Figura 5 A, B y C)
Diagnosis. Larvas pequeñas de no más de 5 mm de longitud. Mentón con 11 dientes (el central generalmente trífido). Antena con cinco segmentos, ubicada sobre un pedestal. Órganos de Lauterborn pequeños en el ápice de cortos pedicelos, que en general no sobrepasan el tercer segmento antenal. Peine de la epifaringe como un peine ancho simple, o incompletamente dividido en tres partes. Premándibulas bífidas con mechón de setas. Placas ventromentales ligeramente curvas que se tocan en la línea media. Mandíbula con un diente dorsal, apical, y 2 o 3 internos, todos oscuros.
Comentarios. Sus larvas son reobiontes, es decir, solo se encuentran en cuerpos corrientosos asociadas a sustratos diversos (rocas, troncos, macrófitas) (Pinder & Reiss, 2008; Trivinho-Strixino, 2011) donde construyen sus características casas, las cuales poseen proyecciones para atrapar las partículas de detritos en suspensión con que se alimentan (son filtradoras). Los individuos de esta morfoespecie se encontraron tanto en sustrato de hojarasca como de roca, en zonas de referencia y en otras con impacto agrícola.
Distribución. Se ha registrado en Estados Unidos, Chile, Argentina, Puerto Rico, Colombia y Perú.
ParatanytarsusThienemann & Bause, 1913* (Figura 5 D y E)
Diagnosis. Larvas medianas de no más de 7 mm de longitud. Mentón con 11 dientes (central generalmente simple, algunas veces con hendiduras laterales). Antena con cinco segmentos, ubicada sobre un pedestal. Segmento basal dos o tres veces más largo que el flagelo, siendo el segundo segmento más largo que el tercero. Órganos de Lauterborn sésiles, sin extenderse hasta el ápice de la antena. Peine de la epifaringe formado por una placa que puede tener 3, 5 o 10 lóbulos o tres placas dentadas. Premándibulas bífidas con diente interno grueso y mechón de setas. Placas ventromentales estrechas y alargadas, separadas por aproximadamente un tercio del diente central. Mandíbula con dientes dorsal, apical, y 2 o 3 internos, todos notorios y oscuros.
Comentarios. Es un género conocido por tolerar un amplio rango de condiciones, lo que le permite ocupar varios hábitats. Incluye especies partenogenéticas que pueden convertirse en plagas en los sistemas de agua potable. La mayoría de las especies de este género no se ha descrito en su estado larval, por lo que es difícil su identificación, lo que torna conveniente su asociación con el estado adulto (Pinder & Reiss, 2008; Trivinho-Strixino, 2011).
Distribución. Su distribución es mundial, con excepción de la Antártida. En Brasil se reportó una nueva especie, identificada por asociación con adultos, pues sus características son bastante diferentes a las establecidas (Pinder & Reiss, 2008; Cranston, 2010; Trivinho-Strixino, 2011).
RiethiaKieffer, 1917 * (Figura 6 A-E)
Diagnosis. Son larvas de tamaño mediano (6-9 mm), robustas. Mentón con diente central y seis pares laterales oscuros, el segundo diente lateral más corto que el primero y el tercero. Antena con cinco segmentos; el segmento basal es mayor que el flagelo antenal, y la lámina antenal es más corta que el flagelo antenal; órganos de Lauterborn en el ápice del segundo segmento antenal. Peine de la epifaringe dividido en tres placas simples. Apotoma frontal separado del clípeo. Placas ventromentales largas, ligeramente curvas y tocándose en la línea media. Mandíbula con diente apical pálido y tres dientes internos oscuros, seta subdental larga.
Comentarios. Fue establecido en 1917 por Kieffer para dos especies australianas basándose en los adultos. Sus larvas se encuentran en sistemas lénticos y lóticos, por lo general, en áreas sombreados con vegetación ribereña. Ocurren en hábitats caracterizados por altas cantidades de partículas finas de materia orgánica (Trivinho-Strixino, 2011).
Distribución. Colombia, Argentina, Chile, Australasia y Brasil. TanytarsusWulp, 1874 * (Figura 7 A-F)
Diagnosis. Larva de tamaño mediano, de no más de 9 mm de longitud. Mentón con diente central redondeado o trífido y más claro, acompañado de cinco pares de dientes laterales. Antena generalmente larga, con cinco segmentos, ubicada sobre un pedestal. Órganos de Lauterborn pequeños, situados sobre largos pedicelos. Peine de la epifaringe constituido por tres escamas dentadas separadas. Premandíbula con tres dientes. Placas ventromentales angostas y alargadas y casi tocándose en la línea media. Mandíbula con diente dorsal claro y tres dientes internos oscuros.
Comentarios. Las larvas del género se pueden encontrar en todo tipo de aguas, incluso los ecosistemas marinos y hay, por lo menos, una especie terrestre. La mayoría se encuentra asociada a sedimentos superficiales o macrófitas acuáticas (Pinder & Reiss, 2008; Trivinho-Strixino, 2011). La identificación de muchas especies solo es posible por la asociación con el macho adulto. La mayoría de los individuos de esta morfoespecie se ha encontrado en el sustrato de hojarasca y en las estaciones escogidas como referencia.
Distribución. Es un género de distribución mundial; en el continente americano se encuentra registrado en Argentina, Brasil, Perú, Costa Rica, Chile, Guatemala, Colombia, México y Venezuela.















